扩展功能
文章信息
- 田雨竹, 张慧, 董路, 张亚
- TIAN Yuzhu, ZHANG Hui, DONG Lu, ZHANG Ya
- 北京及周边地区猛禽血液寄生虫的感染率与多样性
- Prevalence and Lineage Diversity of Avian Blood Parasites in Raptors
- 四川动物, 2017, 36(3): 336-340
- Sichuan Journal of Zoology, 2017, 36(3): 336-340
- 10.11984/j.issn.1000-7083.20170003
-
文章历史
- 收稿日期: 2017-01-03
- 接受日期: 2017-02-22
2. 北京师范大学生命科学学院, 生物多样性与生态工程 教育部重点实验室, 北京 100875;
3. 北京市西城区青少年科学技术馆, 北京 100037
2. Ministry of Education Key Laboratory for Biodiversity Science and Ecological Engineering, College of Life Sciences, Beijing Normal University, Beijing 100875, China;
3. Youth Science and Technology Center of Beijing Xicheng District, Beijing 100037, China
鸟类的健康直接影响鸟类的生存,是与鸟类保护和生物多样性维持紧密联系的重要科学问题(Bókony et al., 2012)。对鸟类健康水平的评价,通常包括体征指标、生理水平和疾病情况3个层次,其中疾病是导致鸟类健康状况下降的最主要因素。禽疟疾是在野生鸟类中广泛流行的一种全球性传染病,由血孢子虫目Haemosporida的疟原虫属Plasmodium、血液变形虫属Haemoproteus和住白细胞原虫属Leucocytozoon等血液寄生虫引发,通过吸血昆虫快速传播,并在各鸟类类群中普遍发生(Valkiūnas,2004;Hellgren et al., 2009)。随着对这类疾病研究的深入,血液寄生虫对鸟类健康状况的影响愈加受到研究者的关注。已有研究表明,血液寄生虫在很多方面对感染个体的适合度造成明显影响,包括寿命、配偶选择、繁殖成功率等,从而对种群存续构成威胁(LaPointe et al., 2012;Asghar et al., 2015)。
猛禽包括鹰形目Accipitriformes、隼形目Falconiformes和鸮形目Strigiformes的鸟类(Hackett et al., 2008),其物种数多,分布广泛,大部分种类迁徙,在生态系统中起重要作用,是食物链顶端的动物(高玮,2002;König & Weik,2008)。对猛禽血液寄生虫感染状况的研究,有利于了解生态系统的健康水平。在我国,猛禽均为国家级重点保护野生动物,对其疫源疫病状况的调查有利于开展保护工作。
目前对猛禽血液寄生虫感染状况的研究集中在欧洲、北美和非洲(Ortego et al., 2007;Ishak et al., 2008;Krone et al., 2008)。在东亚,仅在我国台湾地区对3种猛禽的感染状况进行过初步研究(Hsu et al., 2015),对其他地区猛禽感染血液寄生虫的情况尚不了解。为此,本研究对北京及周边地区猛禽血液寄生虫的感染率和多样性进行了调查。
1 材料和方法研究样品由北京猛禽救助中心提供,在接收猛禽后的3 d内通过肱静脉采血,2014年和2015年采集到3目20种126只猛禽的血液样品。利用TIANamp血液组织细胞基因组提取试剂盒(天根生化科技有限公司,北京)提取血液样品DNA,溶解于TE缓冲液中,-20 ℃保存。
相比于传统的血涂片检测,分子检测具有更高的准确性和效率(周婕等,2016)。采用Hellgren等(2004)设计的巢式PCR引物,对鸟类疟原虫和血液变形虫细胞色素b(Cyt b)基因的479 bp片段进行扩增,扩增反应包括2轮,每轮PCR反应体系均为10 μL,其中上下游引物各0.2 μL(10 pM),DNA模板0.6 μL,ExTaq mix(TaKaRa,日本)5 μL,ddH2O 4 μL。
第一轮扩增引物为HaemNFI(5'-CATATATTAAGAGAAITATGGAG-3')和HaemNR3(5'-ATAGAAA-GATAAGAAATACCATTC-3')。反应程序为:94 ℃模板变性5 min;94 ℃变性30 s,50 ℃退火35 s,72 ℃延伸75 s(20个循环);72 ℃延伸7 min。第一轮扩增反应的产物取出1 μL作为第二轮扩增的模板,剩余产物4 ℃保存。
第二轮扩增引物为HAEMF(5'-ATGGTGCTTT-CGATATATGCATG-3')和HAEMR2(5'-GCATTATCTGGATGTGATAATGGT-3')。反应程序为:94 ℃模板变性5 min;94 ℃变性30 s,50 ℃退火35 s,72 ℃延伸75 s(35个循环);72 ℃延伸7 min。1.5%琼脂糖凝胶电泳对第二轮扩增产物进行检测。电泳检测为阳性的样品,以第一轮扩增产物为模板,配制40 μL反应体系进行第二轮扩增,产物经电泳检测后送北京六合华大基因科技有限公司使用3730XL(ABI,美国)测序。
用MEGA 6.0对Cyt b基因的双向测序结果进行拼接和对位。利用MalAvi数据库中的BLAST模块(http://mbio-serv2.mbioekol.lu.se/Malavi/blast.html)搜索与所测得寄生虫单倍型最相近的谱系支,并初步判定检测寄生虫的所属类群。计算猛禽血液寄生虫的总感染率和各类群间的感染率。利用SPSS 17.0对各种猛禽的感染率差异进行统计检验。
选取MalAvi数据库(Bensch et al., 2009)中可感染猛禽的4种血液寄生虫(GenBank登录号:AF495571、AF495576、DQ368381、KF192997),与本研究所测得的单倍型共同构建系统发育树。根据Outlaw和Ricklefs (2011)构建的血孢子虫目系统发育关系,选择猛禽中检测到的住白细胞原虫序列(Valkiunas,2004)作为系统发育树的外群。用BEAST 1.7.5 (Drummond & Rambaut,2007)构建系统发育树。用马尔可夫链蒙特卡洛方法(Markov Chain Monte Carlo,MCMC)独立运行2次,每次运行1×109代,每10万代保存一次树。在Tracer 1.5中检查2次运行的吻合程度,以避免MCMC起始树的不同对分析结果造成的偏向性,各参数的ESS达到200以上表明树的拓扑结构可信。运行完成后舍弃前1 000棵树(burnin=1 000),利用TreeAnotator 1.7.5计算各树的似然值,选出最大置信树,并计算各分支节点的后验概率。
2 结果 2.1 猛禽血液寄生虫的感染率本研究共采集2014—2015年来自北京、河北和内蒙古的3目20种126只猛禽血液样品。其中感染了血液寄生虫的猛禽3目5种10只(表 1),感染率从0(雕鸮Bubo bubo、红角鸮Otus scops、纵纹腹小鸮Athene noctua、苍鹰Accipiter gentilis、凤头蜂鹰Pernis ptilorhynchus和普通Buteo buteo)到66.67%(燕隼Falco subbuteo)不等(表 1)。
| 物种 | 样本量/只 | 感染个体数/只 | 感染率/% | |
| 隼形目 Falconiformes | 红脚隼Falco vespertinus | 2 | 0 | 0 |
| 红隼Falco tinnunculus | 46 | 3 | 6.52 | |
| 猎隼Falco cherrug | 2 | 0 | 0 | |
| 燕隼Falco subbuteo | 3 | 2 | 66.67 | |
| 游隼Falco peregrinus | 1 | 0 | 0 | |
| 小计 | 54 | 5 | 9.26 | |
| 鸮形目 Strigiformes | 雕鸮Bubo bubo | 12 | 0 | 0 |
| 红角鸮Otus scops | 9 | 0 | 0 | |
| 灰林鸮Strix aluco | 2 | 0 | 0 | |
| 领角鸮Otus bakkamoena | 2 | 0 | 0 | |
| 鹰鸮Ninox scutulata | 2 | 2 | 100 | |
| 长耳鸮Asio otus | 6 | 1 | 16.67 | |
| 纵纹腹小鸮Athene noctua | 8 | 0 | 0 | |
| 小计 | 41 | 3 | 7.32 | |
| 鹰形目 Accipitriformes | 苍鹰Accipiter gentilis | 9 | 0 | 0 |
| 凤头蜂鹰Pernis ptilorhynchus | 4 | 0 | 0 | |
| 黑耳鸢Milvus migrans lineatus | 1 | 0 | 0 | |
| 普通Buteo buteo | 6 | 0 | 0 | |
| 雀鹰Accipiter nisus | 7 | 2 | 28.57 | |
| 日本松雀鹰Accipiter gularis | 2 | 0 | 0 | |
| 秃鹫Aegypius monachus | 1 | 0 | 0 | |
| 玉带海雕Haliaeetus leucoryphus | 1 | 0 | 0 | |
| 小计 | 31 | 2 | 6.45 | |
| 总计 | 126 | 10 | 7.94 |
感染猛禽的血液寄生虫包括疟原虫的2个谱系支和血液变形虫的5个谱系支(表 2),其中血液变形虫在感染的5种猛禽中均被检测到,而疟原虫仅在2种猛禽中被检测到(图 1)。经与MalAvi数据库比对,本研究新发现的谱系支有3个(H2、H3和H4),均为血液变形虫。另外4个谱系支与MalAvi数据库中已有序列完全相同,但是H1(LK03) 和H6(ORW1) 为首次在鸮形目鸟类中发现,H1(LK03) 和H5(BUBIBI01) 为首次在亚洲的鸟类中被检测到。
| 寄生虫单倍型 | 寄生虫类群 | 宿主(感染个体数/只) | MalAvi数据库比对结果 | |
| 谱系支 | 相似度/% | |||
| H1 | 血液变形虫属 | 长耳鸮(1),红隼(2) | LK03 | 100 |
| H2 | 血液变形虫属 | 燕隼(1),红隼(1) | LK04 | 99 |
| H3 | 血液变形虫属 | 雀鹰(1) | LK04 | 99 |
| H4 | 血液变形虫属 | 鹰鸮(1) | CELEC01 | 99 |
| H5 | 血液变形虫属 | 燕隼(1) | BUBIBI01 | 100 |
| H6 | 疟原虫属 | 鹰鸮(1) | ORW1 | 100 |
| H7 | 疟原虫属 | 雀鹰(1) | BT7 | 100 |

|
| 图 1 2014—2015年北京及周边地区猛禽中疟原虫属与血液变形虫属的感染率 Fig. 1 The infection rates of blood parasites in raptors in Beijing and neighboring region in 2014 and 2015 |
| |
所检测到的7个寄生虫谱系支都不能鉴定到具体的形态学物种,但是H7(BT7) 与弯形疟原虫Plasmodium circumflexum的亲缘关系很近,可能为同一个物种,而新发现的3个谱系支(H2、H3和H4) 与H5(BUBIBI01) 形成一个单系群,与已知可感染猛禽的血液寄生虫物种亲缘关系都较远,可能为不同物种(图 2)。
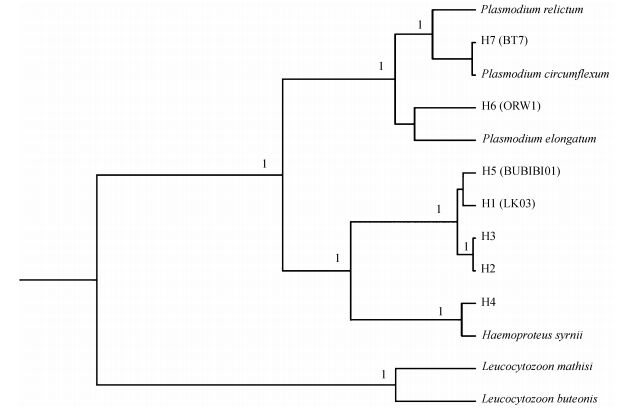
|
| 图 2 基于Cyt b序列构建的猛禽血液寄生虫贝叶斯树 Fig. 2 The Bayesian tree of blood parasites in raptors based on Cyt b sequences 节点上的数字为后验概率(<0.9的未标出);单倍型名称同表 2(括号中为MalAvi数据库已收录的相同谱系支名称)。 The number on the node were the posterior probability (only showed the posterior probability > 0.9); the haplotype names were corresponding to table 2 (name in bracket was the same with that recorded in MalAvi database). |
| |
通过对2014—2015年北京及周边地区126只猛禽的检测,首次报道了中国北方地区多种猛禽血液寄生虫的感染状况,发现其血液寄生虫的总感染率(7.94%)与台湾地区猛禽的感染率(7.24%)相似(Hsu et al., 2015),但明显低于欧洲猛禽的感染率(21.8%)(Krone et al., 2008)。Gutiérrez-López等(2015)发现,长距离迁徙的猛禽具有较低的血液寄生虫感染率,因此,东亚猛禽血液寄生虫较低的感染率,可能与本地区长距离迁徙的猛禽较多(高玮,2002)有关。此外,东亚地区与欧洲所流行的血液寄生虫种类不同(Zhang et al., 2014;Huang et al., 2015),也可能导致其对猛禽的感染力存在差异。相比北京地区雀形目Passeriformes鸟类24.8%的感染率(Huang et al., 2015),猛禽的感染率也较低,这可能与猛禽和雀形目鸟类对血液寄生虫免疫能力存在差异有关(Martínez-Abraín et al., 2004)。
在北京及周边地区,猛禽所感染的血液寄生虫种类可能与寄生虫的宿主专一性和猛禽的分布区有关。目前普遍认为,血液变形虫属以专性寄生为主,宿主种类较少;而疟原虫属以泛性寄生为主,宿主种类较多(Valkiūnas,2004)。本研究检测到的血液变形虫属谱系支中,H1(LK03)、H5(BUBIBI01) 以及与H2和H3两个新发现谱系支高度相似的LK04,已知宿主仅限于欧洲的黄爪隼Falco naumanni、艾氏隼Hieraaetus ayresii(Ortego et al., 2007;Krone et al., 2008;Gutiérrez-López et al., 2015)和台湾地区的红隼(Hsu et al,2015),本研究检测的隼类也仅感染以上谱系支,证实了这些寄生虫对于隼形目鸟类具有较强的宿主专一性。但同时也在长耳鸮Asio otus和雀鹰Accipiter nisus中各检测到一例感染个体,从而拓展了对其宿主类群的认识。
对于谱系支CELEC01,此前仅在分布于非洲的佛法僧目Coraciiformes和雀形目鸟类中检测到,本研究在鹰鸮Ninox scutulata中发现该谱系支是对其分布区及宿主类群的新认识。结合鹰鸮属Ninox主要分布区位于亚洲南部和非洲(König & Weik,2008),以及Gutiérrez-López等(2015)发现猛禽常在越冬地感染血液寄生虫的特点,推测此鹰鸮个体可能是自我国华北地区的繁殖地迁徙至东南亚地区越冬时感染了该寄生虫。
疟原虫属中检测到的2个谱系支可感染的宿主物种都多于血液变形虫属。ORW1在MalAvi数据库中记录到的宿主已达4目16种,而BT7的宿主多达4目38种,呈明显泛性寄生特点。但是这2种寄生虫的主要分布区不同。ORW1主要见于东洋界和大洋洲鸟类(Ishtiaq et al., 2007;Clark et al., 2015);而BT7主要见于古北界和新北界鸟类(Krone et al., 2008;Oakgrove et al., 2014),也是北京地区雀形目鸟类中主要流行的血液寄生虫(Huang et al., 2015)。由此推测,本研究中感染ORW1的鹰鸮同样有可能是在越冬地染病,而检测到BT7的雀鹰很可能是在北方的繁殖地或迁徙中停留地受到感染。
大多数猛禽具有长距离迁徙的特点,如果猛禽在生活史不同阶段都可以感染血液寄生虫,将有可能导致不同地区的血液寄生虫借助猛禽的迁徙进行长距离扩散,从而导致疾病的传播。因此,在不同地点和不同时期开展猛禽血液寄生虫感染状况的监测,一方面有助于对猛禽的健康状况进行更为全面的评估,从而科学有效地开展猛禽的保护与救助工作;另一方面,将有助于深入认识鸟类迁徙对疾病传播风险的影响,从而为动物疫源疫病的预警和防控提供科学支撑。
致谢: 感谢北京猛禽救助中心为本研究提供的样品,以及戴畅、张帅和周蕾在采样过程中提供的帮助。感谢周婕和刘博野在实验和数据分析中给予的建议。| 高玮. 2002. 中国隼形目鸟类生态学[M]. 北京: 科学出版社. |
| 周婕, 夏灿玮, 臧春鑫, 等. 2016. 鸟类血液寄生虫研究方法的发展与比较[J]. 生态学杂志, 35(8): 2244–2250. |
| Asghar M, Hasselquist D, Hansson B, et al. 2015. Hidden costs of infection:chronic malaria accelerates telomere degradation and senescence in wild birds[J]. Science, 347(6220): 436–438. DOI:10.1126/science.1261121 |
| Bensch S, Hellgren O, Péreztris J. 2009. MalAvi:a public database of malaria parasites and related haemosporidians in avian hosts based on mitochondrial cytochrome b lineages[J]. Molecular Ecology Resources, 9(5): 1353–1358. DOI:10.1111/men.2009.9.issue-5 |
| Bókony V, Seress G, Nagy S, et al. 2012. Multiple indices of body condition reveal no negative effect of urbanization in adult house sparrows[J]. Landscape & Urban Planning, 104(1): 75–84. |
| Clark NJ, Olsson-Pons S, Ishtiaq F, et al. 2015. Specialist enemies, generalist weapons and the potential spread of exotic pathogens:malaria parasites in a highly invasive bird[J]. International Journal for Parasitology, 45(14): 891–899. DOI:10.1016/j.ijpara.2015.08.008 |
| Drummond AJ, Rambaut A. 2007. BEAST:Bayesian evolutionary analysis by sampling trees[J]. BMC Evolutionary Biology, 7(1): 214. DOI:10.1186/1471-2148-7-214 |
| Gutiérrez-López R, Gangoso L, Martínez-de la Puente J, et al. 2015. Low prevalence of blood parasites in a long-distance migratory raptor:the importance of host habitat[J]. Parasites & Vectors, 8(1): 189. |
| Hackett SJ, Kimball RT, Reddy S, et al. 2008. A phylogenomic study of birds reveals their evolutionary history[J]. Science, 320(5884): 1763–1768. DOI:10.1126/science.1157704 |
| Hellgren O, Péreztris J, Bensch S. 2009. A jack-of-all-trades and still a master of some:prevalence and host range in avian malaria and related blood parasites[J]. Ecology, 90(10): 2840–2849. DOI:10.1890/08-1059.1 |
| Hellgren O, Waldenström J, Bensch S. 2004. A new PCR assay for simultaneous studies of Leucocytozoon, Plasmodium, and Haemoproteus from avian blood[J]. Journal of Parasitology, 90(4): 797–802. DOI:10.1645/GE-184R1 |
| Hsu YC, Cheng SJ, Hsu CC. 2015. Prevalence of blood parasites in three migratory raptor species from Taiwan[J]. Journal of Raptor Research, 49(2): 227–230. DOI:10.3356/0892-1016-49.2.227 |
| Huang X, Dong L, Zhang C, et al. 2015. Genetic diversity, temporal dynamics, and host specificity in blood parasites of passerines in north China[J]. Parasitology Research, 114(12): 4513–4520. DOI:10.1007/s00436-015-4695-5 |
| Ishak HD, Dumbacher JP, Anderson NL, et al. 2008. Blood parasites in owls with conservation implications for the spotted owl (Strix occidentalis)[J]. PLoS ONE, 3(5): e2304. DOI:10.1371/journal.pone.0002304 |
| Ishtiaq F, Gering E, Rappole JH, et al. 2007. Prevalence and diversity of avian hematozoan parasites in Asia:a regional survey[J]. Journal of Wildlife Diseases, 43(3): 382–398. DOI:10.7589/0090-3558-43.3.382 |
| König L, Weik F. 2008. Owls of the world 2nd edition[M]. London: Christopher Helm. |
| Krone O, Waldenstroem J, Valkiunas G, et al. 2008. Haemosporidian blood parasites in European birds of prey and owls[J]. Journal of Parasitology, 94(3): 709–715. DOI:10.1645/GE-1357.1 |
| LaPointe DA, Atkinson CT, Samuel MD. 2012. Ecology and conservation biology of avian malaria[J]. Annals of the New York Academy of Sciences, 1249(1): 211–226. DOI:10.1111/j.1749-6632.2011.06431.x |
| Martínez-Abraín A, Oro D, Esparza B. 2004. Lack of blood parasites in bird species:does absence of blood parasite vectors explain it all?[J]. Ardeola Revista Ibeérica De Ornitología, 51(1): 225–232. |
| Oakgrove KS, Harrigan RJ, Loiseau C, et al. 2014. Distribution, diversity and drivers of blood-borne parasite co-infections in Alaskan bird populations[J]. International Journal for Parasitology, 44(10): 717–727. DOI:10.1016/j.ijpara.2014.04.011 |
| Ortego J, Calabuig G, Cordero PJ, et al. 2007. Genetic characterization of avian malaria (Protozoa) in the endangered lesser kestrel, Falco naumanni[J]. Parasitology Research, 101(4): 1153–1156. DOI:10.1007/s00436-007-0575-y |
| Outlaw DC, Ricklefs RE. 2011. From the cover:rerooting the evolutionary tree of malaria parasites[J]. Proceedings of the National Academy of Sciences of the United States of America, 108(32): 13183–13187. DOI:10.1073/pnas.1109153108 |
| Valkiūnas G. 2004. Avian malaria parasites and other haemosporidia[M]. Boca Raton: CRC Press. |
| Zhang Y, Wu Y, Zhang Q, et al. 2014. Prevalence patterns of avian Plasmodium and Haemoproteus parasites and the influence of host relative abundance in southern China[J]. PLoS ONE, 9(9): e99501. DOI:10.1371/journal.pone.0099501 |
 2017, Vol. 36
2017, Vol. 36




