扩展功能
文章信息
- 任亮, 付伟, 金素钰, 黄林, 李彩霞, 郑玉才
- REN Liang, FU Wei, JIN Suyu, HUANG Lin, LI Caixia, ZHENG Yucai
- 牦牛和雄性不育犏牛睾丸PPP2CA、PME-1基因mRNA水平的比较
- Comparison of mRNA Levels of PPP2CA and PME-1 Genes in the Testes of Yaks and Sterile Cattle-yaks
- 四川动物, 2017, 36(3): 306-310
- Sichuan Journal of Zoology, 2017, 36(3): 306-310
- 10.11984/j.issn.1000-7083.20160337
-
文章历史
- 收稿日期: 2016-11-30
- 接受日期: 2017-02-23
2. 四川省广元市剑阁县动物疫病预防控制中心, 四川广元 628300
2. Jiange Animal Disease Control and Prevention Centre, Guangyuan, Sichuan Province 628300, China
蛋白磷酸酶2A(PP2A)是细胞中主要的一种丝氨酸/苏氨酸蛋白磷酸酶,由核心二聚体即催化亚基和结构亚基,以及可变的调节亚基组成,其中催化亚基包括α和β两种变异体(Kiely & Kiely,2015)。PP2A在依赖于磷酸化的信号转导通路中占中心地位,因此,与细胞的很多重要生物学过程相关,例如肿瘤抑制、阿兹海默氏症等,是潜在的治疗靶点(Rudrabhatla & Pant,2011;Perrotti & Neviani,2013;Kiely & Kiely,2015),并在细胞周期调控方面发挥重要作用(Yasutis & Kozminski,2013;Wlodarchak & Xing,2016)。
PP2A的活性受多种因素调控(Wlodarchak & Xing,2016),其中蛋白磷酸甲酯酶-1(PME-1) 是PP2A的蛋白质抑制剂,能通过催化PP2A催化亚基羧基端的去甲基化而抑制PP2A活性(Ogris et al., 1999)。但也有报道PME-1能减少PP2A的降解(Yabe et al., 2015)。PME-1与细胞的生长、分化调控有关,有报道显示其可通过影响有丝分裂中纺锤体大小而影响细胞的正常分裂(Xia et al., 2015)。
犏牛是牦牛Bos grunniens与普通牛B. taurus的种间杂交后代,在产乳和产肉性能等方面比牦牛有明显优势,但在杂交三代内表现为雄性不育(金帅等,2013),而雌性杂交后代生殖机能正常。目前,犏牛雄性不育的分子机理尚未被阐明。本课题组在研究睾丸蛋白质组学时发现,牦牛睾丸中PME-1水平约为犏牛睾丸的8倍(Fu et al., 2015),推测犏牛不育或与PP2A的表达有关。近年来,蛋白磷酸酶在细胞周期调控中的作用受到重视,由于PP2A催化亚基α基因(PPP2CA)在细胞中的表达远高于β亚基(Khew-Goodall et al., 1991),本研究克隆了牦牛PPP2CA和PME-1基因的cDNA序列,并利用荧光定量PCR检测二者在牦牛和犏牛睾丸中的mRNA水平,为进一步在分子水平上阐明犏牛雄性不育的机制提供数据。
1 材料与方法 1.1 样品的采集于2014年秋季在成都市青白江区一屠宰场采集健康的麦洼牦牛和犏牛(普通牛与母麦洼牦牛的杂交F1代)的睾丸组织,包括成年牦牛13头和犏牛7头,在屠宰后立刻将其睾丸置于干冰中带回实验室,-80 ℃保存备用。
1.2 主要试剂和仪器cDNA反转录试剂盒(美国Thermo Scientific公司);Trizol Reagent(美国Ambion公司);QuantiFast SYBR Green PCR Kit(德国Qiagen公司);Cycle-pure Kit(美国OMEGA公司);pMD 19-T Vector(日本TaKaRa公司);Super Taq DNA Polymerase(美国GeneCopoeia公司);DL2000 Marker、DH5α感受态细胞(北京天根生化科技有限公司)。
Z323K高速冷冻离心机(德国Hermle公司);OMNI-GLH电动匀浆器(美国OMNI公司);C1000 Thermal Cycler梯度PCR仪、C1000 Touch Thermal Cycler荧光定量PCR仪、Versa Doc 1000凝胶成像系统(美国Bio-Rad公司产品)。
1.3 睾丸组织总RNA的提取及反转录采用Trizol法提取牦牛和犏牛睾丸组织的总RNA,提取步骤参见RNA提取试剂的说明书。紫外分光光度法测定核酸浓度和质量后,利用反转录试剂盒以2 μg总RNA为模板,随机引物进行反转录,得到cDNA第一链。
1.4 引物设计与PCR扩增参照GenBank中普通牛PPP2CA(登录号:BC147979.1) 和PME-1 (登录号:BT021563.1) 序列,用Primer Premier 5.0分别设计PCR引物(表 1),送上海生工生物工程有限公司合成。
| 目的基因 Target gene |
引物序列(5'-3') Primer sequence |
产物长度 Fragmentsize/bp |
| PME-1 | F: ACTTAGCGTGGGACGAA R: AACTCACTGGACCAGAGCA |
1 263 |
| PPP2CA | F: GCCAGTACCCTCACAAA R: TGCTCTTCCCATATCCA |
1 109 |
| PME-1(qPCR) | F: TGGTTCCGAGGCTTATCCAATCTC R: GGCAACAGCTTCAGCTACCTTGTC |
192 |
| PPP2CA(qPCR) | F: CCTCATGAGGGTCCAATGTGTGAC R: CATTTCGGTCATGGCACCAGTTATA |
199 |
| GAPDH | F: CGACTTCAACAGCGACACTCA R: GGTCCAGGGACCTTACTCCTT |
169 |
| 18s RNA | F: CTGAGAAACGGCTACCACATC R: CAGACTTGCCCTCCAATGG |
168 |
以牦牛睾丸反转录cDNA为模板,进行PCR扩增,反应体系为:Buffer 2.5 μL,DNA聚合酶0.2 μL,dNTP 0.5 μL,模板1 μL,上、下游引物各1 μL,加超纯水至25 μL。PCR程序:95 ℃预变性3 min;95 ℃变性30 s,56 ℃退火30 s,72 ℃延伸60 s,共35个循环;72 ℃ 5 min,4 ℃保存。PCR产物用1.5%琼脂糖凝胶电泳检测。
1.5 基因的克隆测序及序列分析上述PCR产物经纯化后用pMD 19-T Vector与DH5α感受态细胞进行连接转化,将转化后的感受态细胞均匀涂在含氨苄青霉素的LB培养基上,37 ℃过夜培养后,挑单菌落若干,用菌液PCR(反应体系和程序同1.4) 鉴定阳性克隆。每个基因选取5个阳性克隆菌液送上海生工生物工程有限公司进行双向测序,最后用DNAMAN 5.0分析测序结果。
1.6 睾丸组织PPP2CA和PME-1基因的定量分析以本研究从牦牛睾丸中克隆获得的PPP2CA和PME-1基因序列,以及以普通牛GAPDH(登录号:NM001034034)、18s RNA(登录号:NR036642) 序列为模板,用Primer Premier 5.0设计2个目的基因和2个内参基因的定量PCR引物(表 1)。
以反转录获得的睾丸cDNA为模板,采用实时荧光定量PCR方法检测PPP2CA和PME-1基因在牦牛与犏牛睾丸中的相对表达量。PCR反应体系为25 μL,包括2×QuantiFast SYBR Green PCR Master Mix 12.5 μL,RNase-free water 9.5 μL,上、下游引物各1 μL,模板1 μL;反应程序:95 ℃预变性5 min;95 ℃变性15 s,56 ℃退火30 s(PPP2CA),65 ℃退火20 s (PME-1),72 ℃延伸15 s,共40个循环,65~95 ℃制作熔解曲线。
1.7 数据统计数据用平均值±标准误表示。以GAPDH和18s RNA为内参基因,用2-△△Ct法计算PPP2CA和PME-1基因在睾丸中的相对表达水平(Livak & Schmittgen,2001)。在SPSS 18.0中用t检验比较牦牛和犏牛睾丸中PPP2CA和PME-1基因mRNA水平表达的差异。
2 结果 2.1 牦牛PPP2CA和PME-1基因的克隆测序本研究从牦牛睾丸中扩增得到与预期片段长度相符、特异性高的产物(图 1)。PCR产物经连接、转化、菌液PCR检测等步骤,获得了相应基因的阳性克隆菌液,进一步测序证实,获得的牦牛PPP2CA和PME-1基因的长度分别为1 109 bp和1 263 bp。
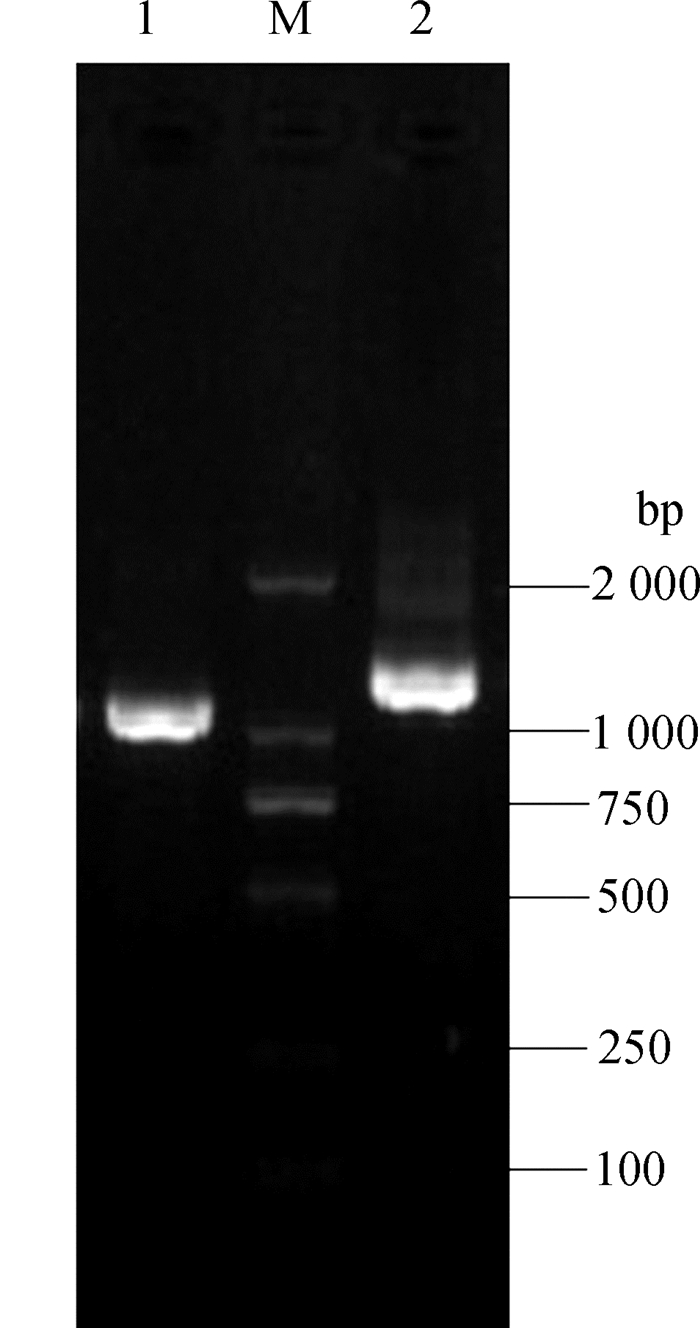
|
| 图 1 牦牛PPP2CA和PME-1基因的PCR扩增结果 Fig. 1 Amplification of PPP2CA and PME-1 genes of yak M. DL2000 Marker;1、2泳道分别为PPP2CA、PME-1基因qPCR产物。 M. DL2000 Marker; Lanes 1 and 2 were qPCR products of PPP2CA and PME-1, respectively. |
| |
分析表明,牦牛PPP2CA基因编码区长度为930 bp(登录号:KP223677),与普通牛序列(登录号:BC147979) 长度相同,但存在2个碱基差异(第252位碱基牦牛为T,普通牛为C;第570位碱基牦牛为C,普通牛为T),相似性为99.78%。牦牛PPP2CA基因推导的氨基酸序列有309个氨基酸残基,与普通牛PPP2CA氨基酸序列一致,理论分子量为35.593 kD,预测的等电点为5.307。
实验获得的牦牛PME-1基因(登录号:KP223676) 编码区与普通牛序列(登录号:BT021563) 长度均为1 143 bp,但存在3个碱基差异(普通牛-牦牛:T243C、A457G、A744G),相似性为99.74%。由牦牛PME-1基因推导的氨基酸序列有380个氨基酸残基,与由普通牛PME-1基因推导的相差1个氨基酸(第153位:牦牛为缬氨酸,普通牛为异亮氨酸)。理论分子量为41.695 kD,预测的等电点与普通牛相同,均为5.804。
2.2 牦牛和犏牛睾丸中PPP2CA和PME-1基因mRNA水平的比较本研究对牦牛和犏牛睾丸中PPP2CA和PME-1基因mRNA水平进行了定量PCR检测,获得的扩增效率(E>95%)、标准曲线(R2>0.998) 和熔解曲线(图 2)均达到准确定量的标准。结果如图 3所示,犏牛睾丸中PPP2CA与PME-1基因的mRNA水平均极显著低于牦牛(P<0.01),其中PME-1基因mRNA水平差异在3倍以上。
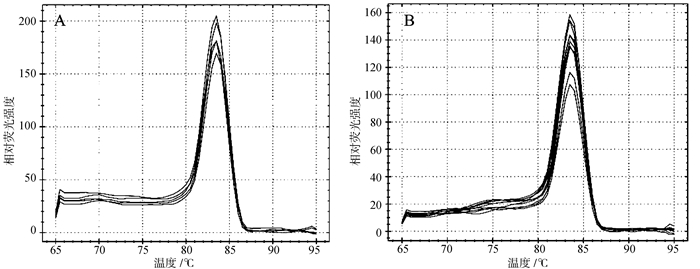
|
| 图 2 PPP2CA基因(A)和PME-1基因(B)的熔解曲线 Fig. 2 Melt curve of PPP2CA (A) and PME-1 (B) genes |
| |
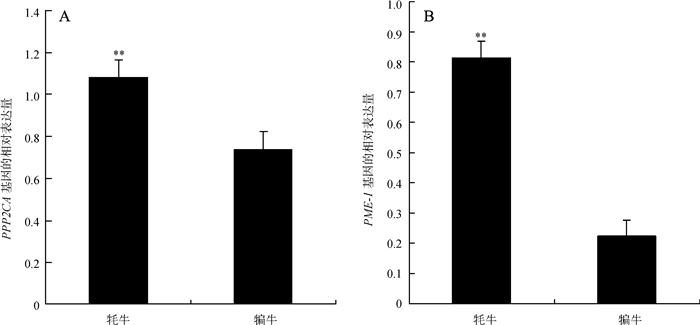
|
| 图 3 牦牛和犏牛睾丸中PPP2CA基因(A)和PME-1基因(B)的mRNA水平 Fig. 3 mRNA levels of PPP2CA (A) and PME-1 (B) genes in the testes of yaks and cattle-yaks * * P<0.01. |
| |
有关犏牛雄性不育的分子机制近年来有不少报道,但仍无定论。牦牛和犏牛睾丸组织在细胞组成方面有显著差异(Lou et al., 2014),很多基因在犏牛睾丸中表达显著下调(屈旭光等,2008;金帅等,2013;Lou et al., 2014;雷杰雯等,2016)。这些基因中既有与细胞减数分裂直接相关的,也有参与信号转导的,但基因表达与犏牛雄性不育的因果关系尚不清楚。
本研究从牦牛睾丸中克隆了PPP2CA和PME-1基因的cDNA序列。通过与普通牛相应基因的序列比对发现,这2个基因在进化上保守,这与过去的报道一致(Ogris et al., 1999)。由牦牛PME-1基因推导的氨基酸序列与普通牛相比仅有1个性质相近的氨基酸差异(缬氨酸替代异亮氨酸),推测PME-1基因的功能不会有明显变化。
定量PCR检测证实犏牛睾丸中PME-1基因的mRNA水平显著低于牦牛,这与蛋白水平的分析结果一致(Fu et al., 2015)。PME-1基因能通过催化PPP2CA羧基端的去甲基化而抑制PP2A活性(Ogris et al., 1999),但本研究中犏牛睾丸组织中PPP2CA基因mRNA水平仍显著低于牦牛,并未随PME-1基因mRNA水平下降而提高,提示PPP2CA基因表达的调控机制可能十分复杂。分析其原因,一方面有报道PME-1基因能减少PP2A的降解(Yabe et al., 2015);另有研究表明,破坏PME-1基因表达的小鼠组织中,PP2A的催化活性大幅度下降(Ortega-Gutiérrez et al., 2008)。这些结果可能提示适当的PME-1基因表达对PP2A功能的必要性。PPP2CA基因在犏牛睾丸中表达水平的下降以及PME-1基因的异常低表达,可能会显著影响PP2A活性。犏牛睾丸中PME-1基因mRNA和蛋白质水平的显著降低,很有可能影响睾丸正常的精子发生过程。由于PP2A在依赖于磷酸化的信号转导通路中占有非常重要的地位(Wlodarchak & Xing,2016),其活性改变会引起广泛的信号通路变化。过去的研究也表明,犏牛睾丸MAPK信号转导通路中的ERK1、ERK2基因的mRNA水平均显著下降(雷杰雯等,2016)。有报道称PP2A会影响多个信号通路,如Wnt通路、mTOR通路、MAPK通路等(Wlodarchak & Xing,2016),并与细胞的有丝分裂有关(Hunt,2013)。结合本研究和过去对一些信号通路的研究结果(雷杰雯等,2016),认为犏牛睾丸中可能存在广泛的信号转导通路异常。另外,抑制PP2A可能会导致细胞凋亡的增加(Kiely & Kiely,2015),尽管对此有不同的研究结果,确实有研究观察到犏牛睾丸细胞凋亡的增加(Lou et al., 2014),这与本研究中犏牛睾丸中PPP2CA基因mRNA水平显著下降吻合。
| 金帅, 郭宪, 包鹏甲, 等. 2013. 牦牛和犏牛Dmrt7基因序列分析及其在睾丸组织中的表达水平[J]. 中国农业科学, 46(5): 1036–1043. |
| 雷杰雯, 黄林, 金素钰, 等. 2016. 牦牛和雄性不育犏牛睾丸ERK1、ERK2、P38基因mRNA水平的比较[J]. 四川动物, 35(5): 660–665. |
| 屈旭光, 李齐发, 刘振山, 等. 2008. 牦牛、犏牛睾丸组织中SYCP3基因mRNA表达水平研究[J]. 畜牧兽医学报, 39(8): 1132–1136. |
| Fu W, Li CX, Liu WJ, et al. 2015. Identification of differentially expressed proteins in the testes of normal yaks and sterile hybrids by two-dimensional electrophoresis and mass spectrometry[J]. Indian Journal of Animal Sciences, 85(11): 1181–1186. |
| Hunt T. 2013. On the regulation of protein phosphatase 2A and its role in controlling entry into and exit from mitosis[J]. Advances in Biological Regulation, 53(2): 173–178. DOI:10.1016/j.jbior.2013.04.001 |
| Khew-Goodall Y, Mayer RE, Maurer F, et al. 1991. Structure and transcriptional regulation of protein phosphatase 2A catalytic subunit genes[J]. Biochemistry, 30(1): 89–97. DOI:10.1021/bi00215a014 |
| Kiely M, Kiely PA. 2015. PP2A:the wolf in sheep's clothing?[J]. Cancers (Basel), 7(2): 648–669. DOI:10.3390/cancers7020648 |
| Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2(-Delta Delta C(T)) method[J]. Methods, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| Lou YN, Liu WJ, Wang CL, et al. 2014. Histological evaluation and Prdm9 expression level in the testis of sterile male cattle-yaks[J]. Livestock Science, 160(2): 208–213. |
| Ogris E, Du X, Nelson KC, et al. 1999. A protein phosphatase methylesterase (PME-1) is one of several novel proteins stably associating with two inactive mutants of protein phosphatase 2A[J]. Journal of Biological Chemistry, 274(20): 14382–14391. DOI:10.1074/jbc.274.20.14382 |
| Ortega-Gutiérrez S, Leung D, Ficarro S, et al. 2008. Targeted disruption of the PME-1 gene causes loss of demethylated PP2A and perinatal lethality in mice[J]. PLoS ONE, 3(7): e2486. DOI:10.1371/journal.pone.0002486 |
| Perrotti D, Neviani P. 2013. Protein phosphatase 2A:a target for anticancer therapy[J]. Lancet Oncology, 14(6): e229–e238. DOI:10.1016/S1470-2045(12)70558-2 |
| Rudrabhatla P, Pant HC. 2011. Role of protein phosphatase 2A in Alzheimer's disease[J]. Current Alzheimer Research, 8(6): 623–632. DOI:10.2174/156720511796717168 |
| Wlodarchak N, Xing Y. 2016. PP2A as a master regulator of the cell cycle[J]. Critical Reviews in Biochemistry & Molecular Biology, 51(3): 162–184. |
| Xia X, Gholkar A, Senese S, et al. 2015. A LCMT1-PME-1 methylation equilibrium controls mitotic spindle size[J]. Cell Cycle, 14(12): 1938–1947. DOI:10.1080/15384101.2015.1026487 |
| Yabe R, Miura A, Usui T, et al. 2015. Protein phosphatase methyl-esterase PME-1 protects protein phosphatase 2A from ubiquitin/proteasome degradation[J]. PLoS ONE, 10(12): e0145226. DOI:10.1371/journal.pone.0145226 |
| Yasutis KM, Kozminski KG. 2013. Cell cycle checkpoint regulators reach a zillion[J]. Cell Cycle, 12(10): 1501–1509. DOI:10.4161/cc.24637 |
 2017, Vol. 36
2017, Vol. 36




