扩展功能
文章信息
- 梁涛, 时磊
- LIANG Tao, SHI Lei
- 旱地沙蜥三个地理种群形态变异与两性异形——Bergmann法则、Allen法则和Rensch法则的检验
- Sexual Dimorphism and Morphological Variation of Three Populations of Phrynocephalus helioscopus: Test of Bergmann's Rule, Allen's Rule and Rensch's Rule
- 四川动物, 2017, 36(3): 249-257
- Sichuan Journal of Zoology, 2017, 36(3): 249-257
- 10.11984/j.issn.1000-7083.20160314
-
文章历史
- 收稿日期: 2016-11-15
- 接受日期: 2017-02-22
自然选择和性选择是驱使形态变异的两大因素(Ceballos & Iverson, 2014)。两性异形在动物界中普遍存在, 具体表现在体型、局部形态特征和体色等方面(Darwin, 1871;Anderson, 1994;廖灏泓等, 2013)。两性异形的进化方向各异, 以体型为例, 在一些种群中雌性较大, 而另一些种群中雄性较大(Dale et al., 2007;West, 2009)。形态变异遵循一定的地理模式(Mayr, 1956), 如Bergmann法则(Bergmann, 1847)、Allen法则(Allen, 1877)和Rensch法则(Rensch, 1950)。Bergmann法则指出, 生活在寒冷地区的动物比生活在温暖地区的动物拥有更大的体型(Bergmann, 1847;Ashton, 2004), 该法则最早适用于恒温动物, 而变温动物中的部分类群遵循相同(Ray, 1960;Blanckenhorn & Demont, 2004)或相反的规律(Park, 1949;Mousseau, 1997)。Allen法则是指寒冷地区动物的暴露附器, 如四肢、尾、耳等, 比温暖地区动物的小(Allen, 1877);在较热的环境中较大的附器有助于散热(Tattersall et al., 2009), 而在较冷的环境中较小的附器有助于维持热量(Scholander, 1955;Mayr, 1956)。Allen法则最初被视为Bergmann法则的补充, 研究对象也是恒温动物, 近年来Allen法则在变温动物中也有报道, 变温动物通过将身体暴露在热源中提高体温, 同时以较小的体表面积来尽可能减少热量的消耗而增加获得热量的速度(Alho et al., 2011);但也有一些爬行类表现出反Allen法则现象(Jin & Liao, 2015)。Rensch法则是一个关于异速增长的法则, 主要表现为当雄性大于雌性时, 体型的两性异形程度随着体型的增大而增大, 反之, 当雌性个体较大时, 两性异形程度随体型的增大而减小(Rensch, 1950)。变温动物中, 龟类已被证实遵循Rensch法则(Stephens & Wiens, 2009), 但在某些无尾目Anura动物中, 两性之间的异速增长没有显著差异(Liao, 2013);在某些雌性体型较大的种类中, 存在反Rensch法则的现象(Webb & Freckleton, 2007);甚至一些雌性体型较大的物种不遵循Rensch法则(Colleoni et al., 2014)。
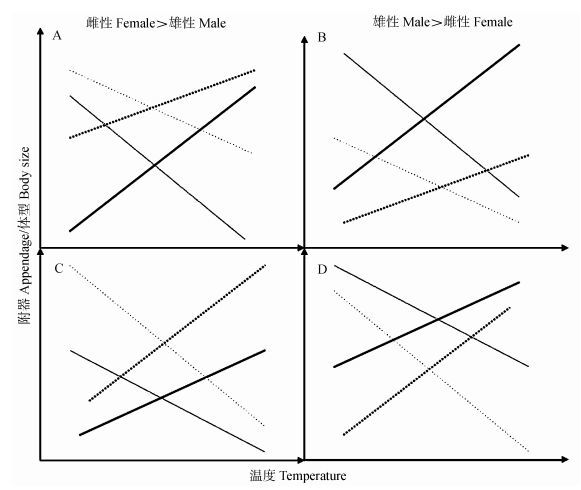
不管是否遵循Bergmann法则或Allen法则, 都是反映环境温度与身体暴露表面积之间关系的一种法则, 动物的体型越大, 则比表面积(表面积/体积)越小, 当附器(四肢、尾、耳等)变小时, 比表面积就会进一步缩小(Ray, 1960)。因此, 本研究提出了关于动物体型遵循Bergmann法则以及Allen法则或者违背它们的4种假想图, 以试图探究研究对象是否遵循这2个法则的具体表现(图 1), 并且依据温度因子来探究环境因素和Bergmann法则以及Allen法则的关系。
|
| 图 1 不同性别附器和体型的可能性组合 Fig. 1 The possible combinations of sex appendage and body size 实线:雄性, 虚线:雌性;Bergmann法则, 体型随着温度的升高逐渐变小(灰色), 反Bergmann法则, 体型随着温度的升高逐渐增大(黑色);Allen法则, 附器随着温度的增加而变大(黑色), 反Allen法则, 附器随着温度的增加而变小(灰色);雌性体型大于雄性(A, C), 雄性体型大于雌性(B, D);雄性变化快(A, B), 雌性变化快(C, D)。 Solid lines: males, dashed lines: females; body size clines with sexual size dimorphism of Bergmann's rule (gray and decreasing with temperature) and converse Bergmann's rule (black and increasing with temperature), or Allen's rule (black and increasing with temperature) and converse Allen's rule (gray and decreasing with temperature); females larger (A, C), males larger (B, D); the male cline is steeper (A, B) and the female cline is steeper (C, D). |
| |
自然界中动物体型和其他形态指标表现出一定的地理梯度变异模式(Lomolino, 2005), 并且形态特征与环境变量(如温度和降水)之间呈共变趋势(Millien et al., 2006)。国内已有研究报道分别采自新疆北屯市(梁涛等, 2015)和塔城地区(徐峰等, 2015)的旱地沙蜥Phrynocephalus helioscopus 2个地理种群的两性异形有显著差异。在上述研究基础上, 本研究增加了伊宁市种群的数据, 通过分析旱地沙蜥3个地理种群两性异形的差异, 进一步探究不同地区旱地沙蜥的生存选择压力对形态指标的影响。此外, 目前关于Rensch法则的研究仅限于比较体型的两性差异, 本研究在对3个地区的旱地沙蜥形态地理变异的研究中, 将Rensch法则扩展到四肢及尾部的差异, 并与Allen法则结合进行考虑, 以期检验以下几个问题:旱地沙蜥3个地理种群在体型和其他形态学指标(四肢和尾部)之间是否存在地理变异?若存在, 那么旱地沙蜥3个地理种群在体型、四肢和尾部的大小上是否遵循Bergmann法则、Allen法则和Rensch法则?当Rensch法则与Bergmann法则同时作用于旱地沙蜥不同地理种群时, 其地理变异呈现怎样的变化趋势?
1 材料和方法 1.1 材料来源与测量分组旱地沙蜥标本于2013年5月—2014年5月分别采自新疆维吾尔自治区北屯市(87°15′11.57″~87°15′48.89″E, 47°26′15.93″~47°26′47.03″N)、塔城(83°35′46.02″~ 83°35′49.21″E, 45°57′15.88″~45°57′19.07″N)和伊宁市(80°47′06.37″~80°47′27.53″E, 43°40′54.34″~43°40′57.77″N)3个地区(北屯n=136, 塔城n=129, 伊宁n=132)。记录每条蜥蜴的性别, 用数显游标卡尺(±0.01 mm)测量体型(头体长, snout-vent length, SVL;吻端至泄殖腔孔前缘间距)、尾长(tail length, TL;泄殖孔至尾端部的距离)、前肢长(fore limb length, FLL;前肢基部到最长指端的长度)、后肢长(hind limb length, HLL;后肢基部到最长趾端的长度)等数据(赵尔宓等, 1999)。分别以各自地区的最小怀卵个体的体型为标准(北屯:40.95 mm, 塔城:42.14 mm, 伊宁:43.22 mm), 分为雄性成体、雌性成体组和雄性亚成体、雌性亚成体组。用于检验Bergmann法则、Allen法则的气候资料来源于中国气象局政府门户网站(http://cmdp.ncc.cma.gov.cn/cn/index.htm)。
1.2 数据处理用Excel 2003整理数据, SPSS 19.0进行统计分析。首先对变量进行Kolmogorov-Smirnov正态性检验以及Levene's方差同质性检验, 由于所有指标均符合正态分布和方差同质性, 3个地理种群雌雄个体间的体型差异采用t检验, 描述性统计值用平均值±标准误表示, 雌雄个体尾长、前肢长和后肢长的差异以体型作为协变量进行单因素协方差分析(ANCOVA), 显著性水平均设置为α=0.05。对于Bergmann法则, 将各地区旱地沙蜥个体的体型与对应的年均温度进行回归分析;对于Allen法则, 以前肢长和后肢长以及尾长对年均温度进行回归分析(金园庭等, 2006);对于Rensch法则, 用模型Ⅱ回归(压轴回归分析法, reduced major axis regression, RMA;Sokal & Rohlf, 1994)来检验, 一般而言, 通过RMA斜率大小来判定是否遵循Rensch法则, 当斜率>1时遵循Rensch法则, <1时相反(Fairbairn, 1997), 种群间的前肢长、后肢长以及尾部指标经lg转化。
2 结果 2.1 3个地理种群间的两性差异旱地沙蜥种群头体长, 伊宁市雌性成体显著大于雄性(t=2.143, df=83.644, P<0.05), 雄性亚成体略大于雌性, 但差异无统计学意义(t=-0.013, df=27.979, P>0.05);塔城地区雌性成体和亚成体略大于雄性, 但差异均无统计学意义(t=0.915, df=41.860, P>0.05;t=0.321, df=66.633, P>0.05);北屯市雌性成体显著大于雄性(t=2.51, df=110.327, P<0.05), 而雄性亚成体显著大于雌性(t=-2.15, df=52.180, P<0.05)(表 1)。
| 种群 Population | 性状 Trait | 雌性成体 Adult females | 雄性成体 Adult males | P | 雌性亚成体 Juvenile females | 雄性亚成体 Juvenile males | P |
| 伊宁 Yining | 头体长SVL/mm | 49.20±0.52 | 47.86±0.34 | 0.035 | 37.20±1.02 | 37.22±1.52 | 0.090 |
| 尾长TL/mm | 49.65±0.48 | 54.18±0.54 | 0.000 | 41.92±1.01 | 42.84±1.89 | 0.464 | |
| 前肢长FLL/mm | 27.01±0.25 | 26.42±0.23 | 0.017 | 21.15±0.58 | 22.01±0.89 | 0.162 | |
| 后肢长HLL/mm | 39.79±0.36 | 41.67±0.30 | 0.000 | 33.06±0.74 | 34.74±1.36 | 0.061 | |
| 塔城 Tacheng | 头体长SVL/mm | 49.62±0.79 | 48.79±0.45 | 0.365 | 35.75±0.70 | 35.45±0.64 | 0.749 |
| 尾长TL/mm | 47.45±0.84 | 54.48±0.88 | 0.000 | 36.71±0.79 | 36.34±0.80 | 0.933 | |
| 前肢长FLL/mm | 26.88±0.49 | 26.71±0.30 | 0.855 | 20.79±0.34 | 21.10±0.37 | 0.031 | |
| 后肢长HLL/mm | 38.97±0.50 | 40.19±0.42 | 0.001 | 30.11±0.55 | 29.71±0.61 | 0.682 | |
| 北屯 Beitun | 头体长SVL/mm | 46.10±0.28 | 45.13±0.25 | 0.014 | 29.02±0.56 | 31.21±0.64 | 0.036 |
| 尾长TL/mm | 44.71±0.38 | 49.88±0.40 | 0.000 | 30.44±0.59 | 32.07±1.14 | 0.963 | |
| 前肢长FLL/mm | 24.42±0.20 | 24.25±0.21 | 0.576 | 17.28±0.37 | 18.04±0.36 | 0.206 | |
| 后肢长HLL/mm | 35.75±0.17 | 38.01±0.18 | 0.000 | 24.85±0.40 | 26.58±0.65 | 0.171 |
伊宁市雄性成体尾长、后肢长极显著大于雌性(尾长:F1, 97=163.097, P<0.01;后肢长:F1, 97=185.047, P<0.01), 雌性成体前肢长显著大于雄性(F1, 96=2.320, P<0.05);塔城地区雄性成体尾长、后肢长极显著大于雌性(尾长:F1, 58=54.084, P<0.01;后肢长:F1, 58=12.828, P<0.01), 雌性前肢长略大于雄性, 但差异无统计学意义(F1, 57=0.034, P>0.05);北屯市雄性成体尾长和后肢长极显著大于雌性(尾长:F1, 110=121.757, P<0.01;后肢长:F1, 110=108.092, P<0.01), 雌性前肢长略大于雄性, 但差异无统计学意义(F1, 101=0.001, P>0.05)(表 1)。
伊宁市雄性亚成体的尾长、前肢长与后肢长略大于雌性, 但差异均无统计学意义(尾长:F1, 32=0.551, P>0.05;前肢长:F1, 32=2.051, P>0.05;后肢长:F1, 32=3.788, P>0.05);塔城地区雄性亚成体前肢长显著大于雌性(F1, 68=4.873, P<0.05), 雌性的后肢长与尾长略大于雄性, 但差异无统计学意义(后肢长:F1, 68=0.170, P>0.05;尾长:F1, 68=0.007, P>0.05);北屯市雄性亚成体尾长、前肢长和后肢长略大于雌性, 但差异均无统计学意义(尾长:F1, 52=2.811, P>0.05;前肢长:F1, 52=1.057, P>0.05;后肢长:F1, 52=0.276, P>0.05)(表 1)。
2.2 Bergmann法则旱地沙蜥的体型呈反Bergmann法则的现象, 即亚成体与成体的雌、雄个体体型随着温度的递增而逐渐变大(图 2:a, A)。

|
| 图 2 旱地沙蜥3个地理种群成体、亚成体头体长(A, a)、前肢长(B, b)、后肢长(C, c)、尾长(D, d)与平均温度的回归 Fig. 2 Regression of snout-vent length (A, a), fore limb length (B, b), hind limb length (C, c) and tail length (D, d) of adults and juveniles with mean annual temperature in 3 populations of Phrynocephalus helioscopus |
| |
旱地沙蜥亚成体的前肢长(图 2:b)、后肢长(图 2:c)以及尾长(图 2:d)均表现为雄性大于雌性;成体中, 尾长(图 2:D)和后肢长(图 2:C)表现为雄性大于雌性, 而雌性前肢长(图 2:B)较大, 且3个指标均是雄性斜率较小。前肢长、后肢长以及尾长随着温度升高而变大, 故旱地沙蜥成体与亚成体的前肢长、后肢长和尾长均遵循Allen法则。
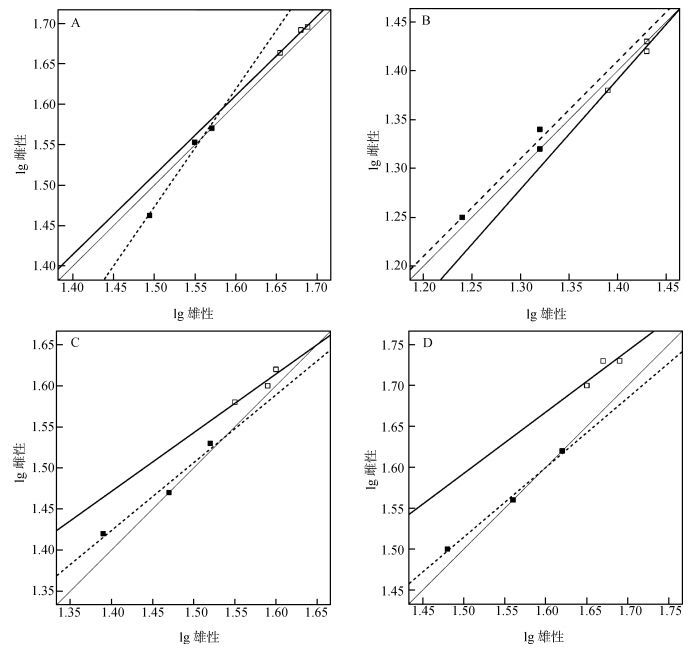
2.4 Rensch法则由图 3可以看出, 亚成体的前肢长、后肢长、尾长和体型均不遵循Rensch法则(前肢长:F1, 2=0.000, P>0.05;后肢长:F1, 2=2.541, P>0.05;尾长:F1, 2=8.919, P>0.05;体型:F1, 2=1.160, P>0.05);成体的前肢长、后肢长、尾长和体型均不遵循Rensch法则(前肢长:F1, 2=0.666, P>0.05;后肢长:F1, 2=2.665, P>0.05;尾长:F1, 2=0.666, P>0.05;体型:F1, 2=0.009, P>0.05)。
|
| 图 3 旱地沙蜥3个地理种群雌雄个体间的头体长(A)、前肢长(B)、后肢长(C)、尾长(D)的回归 Fig. 3 Regression of snout-vent length (A), fore limb length (B), hind limb length (C) and tail length (D) between males and females in 3 populations of Phrynocephalus helioscopus 亚成体:空心正方形, 虚线;成体:实心正方形, 实线;等角轴线:灰线。 Sub-adult: hollow squares, dashed line; adult: solid squares, solid line; isometric axis: grey line. |
| |
有鳞目Squamata动物是否遵循Bergmann法则尚无统一意见。变温动物中, 寒冷地区的个体拥有较小的体型, 可使动物快速获得活动所需热量, 较小的个体可以更精巧控制体温(Stevenson, 1986), 这样的体温调节能力与有鳞目动物的消化和个体生长发育息息相关(Shine & Madsen, 1996)。动物个体生长和季节长短有密切关系(Adolph & Poter, 1996;Blanckenhorn & Demont, 2004), 季节长短会影响可获得的食物和能量, 从而影响体型大小(Nagy, 2005)。爬行动物普遍为终身生长, 寒冷地区比温暖地区有更长的严寒期, 这样的低温与较短的生长季节在一定程度上对寒冷地区的植物以及昆虫造成了一定影响, 比如限制植食性昆虫的生长、发育和繁殖(金园庭等, 2006), 导致爬行动物摄食活动的时间相对温暖地区短, 以及可利用的食物资源比温暖地区少, 从而限制了个体的活动、食物及生长。高纬度地区意味着较短的生长时间, 更长的冬眠时间, 这样使得个体偏小。然而分布在高寒地区卵胎生的青海沙蜥P. vlangalii体型比海拔较低、较温暖地区的近缘种大(金园庭等, 2006), 卵胎生物种胚胎发育过程所需的热量要从母体获得(赵肯堂, 2003), 这就使得较大体型可以有更充足的热量维持母体以及个体所需, 而旱地沙蜥为卵生种, 通过环境热量来孵化卵, 这就使得个体不需要进化出如卵胎生物种那么大的体型。旱地沙蜥的体型变化规律是雌性以及雄性的体型随着温度的升高均变大, 即高纬度地区的个体体型偏小, 呈反Bergmann的现象。寒冷地区旱地沙蜥较小的个体有助于它们快速从环境中获得热量, 此外, 低温环境的食物资源受到限制以及较短的生长季, 也是导致寒冷地区个体体型较小的原因。同时, 较小的体型往往有着较短的成熟期, 对于雄性个体而言缩短成熟期可以更早参加繁殖(陈旭等, 2013;胡舒展等, 2015)。
3.2 Allen法则Allen法则与温度和体温调节有关(Allen, 1877)。然而, 相比Bergmann法则, Allen法则很少受到关注。已被证实遵循Allen法则的恒温动物种类有限(Cartar & Morrison, 2005;Yom-Tov et al., 2006)。事实上, 一些学者甚至认为在恒温动物中, Allen法则是个例外, 并不是法则, 因为身体突出部分可能受到比体温调节更强烈的选择性压力(Stevenson, 1986)。变温动物的体温受环境影响, 在低温环境下通常难以维持一个高于环境温度的体温(金园庭等, 2006)。体表面积相对较小的变温动物个体升温和降温速度慢, 这是适应“热异构环境”的表现(Alho et al., 2011)。身体附器变小, 有利于减少暴露部分的表面积, 达到维持相对恒定体温的目的。旱地沙蜥遵循Allen法则的机制是为了维持体温, 而较小的附器可以在寒冷环境中减少与空气的接触面积而减少热量消耗。此外动物个体的附器也受体型影响, 旱地沙蜥3个地理种群体型呈反Bergmann规律, 寒冷地区种群的体型也会制约附器的生长。
3.3 Rensch法则目前, 关于两性异速生长的假说主要有3个:1) 进化约束假说(evolutionary constraints hypothesis;Webster, 1992;Fairbairn, 1997)认为, 两性异形是两性个体对体型相似的选择压力响应不同的一个副产品;2) 自然选择假说(natural selection hypothesis;Webster, 1992;Fairbairn, 1997)认为, 诸如两性间的资源竞争和/或繁殖力选择也可以产生两性异速生长;3) 性选择假说(sexual selection hypothesis;Webster, 1992;Abouheif & Fairbairn, 1997;Fairbairn, 1997)预测, 性选择对某一性别的作用更强, 同时另一性别产生一个相关的但较弱的进化改变。在一般情况下雄性体型经历更强的性选择, 然后表现出正异速生长从而遵循Rensch法则。与此相反, 性选择对雌性体型影响更大的类群则表现负异速生长(反Rensch法则)。多因素分析表明, 性选择强度是关于异速生长最好的预测因子(Dale et al., 2007)。
动物体型变化是否遵循Rensch法则需要量化异速生长(Abouheif & Fairbairn, 1997;Fairbairn, 1997)。将雄性和雌性量度指标进行对数转换, Y轴为RMA斜率, 可以提供异速生长的量度。斜率>1表明正异速生长, 即遵循Rensch法则(Bonduriansky, 2007)。旱地沙蜥3个地理种群的头体长、前肢长、后肢长和尾长均不遵循Rensch法则。旱地沙蜥后肢长和尾长不遵循Rensch法则可以用性选择解释。可以推测, 雌性经历的生长和繁殖之间的权衡更强。
3.4 两性异形 3.4.1 体型的两性异形自然界中, 雌雄两性个体用于生长和繁殖的资源分配方式的差异导致两性在个体大小和局部特征上产生分化(徐大德等, 2014)。两栖爬行动物体型的两性异形可以分为3种类型:1) 不存在两性异形;2) 存在两性异形, 雌性大于雄性;3) 存在两性异形, 雄性大于雌性。旱地沙蜥3个地理种群中, 伊宁市和北屯市的体型均属于第2种类型, 雌性具有较大的体型, 一般认为是受繁殖力选择影响, 以便提高整个种群的繁殖投入(林植华等, 2007)。塔城地区属于第1种类型, 与徐峰等(2015)的研究结果一致, 造成这种结果的原因可能是两性都偏好较大的体型, 最终导致两性体型差异较小(García-Navas et al., 2016)。
3.4.2 附肢的两性异形一般认为, 蜥蜴的附肢大小影响运动能力(Losos, 1990;Christian & Garland, 1996;Gifford et al., 2008)、交配能力以及争斗能力(Lappin & Swinney, 1999)。由于蜥蜴的交配涉及追逐等一系列过程(杜卫国, 姚智娟, 2007), 雄性具有较长的附肢会拥有较大的优势。旱地沙蜥3个地理种群雄性成体均具有显著较长的后肢, 这可能是受性选择的压力驱使以增加雄性个体的适合度。旱地沙蜥在接近性成熟时, 后肢长存在异速增长的现象, 而后肢是旱地沙蜥运动的主要动力来源(梁涛等, 2015), 表明旱地沙蜥在接近性成熟阶段, 会优先发展后肢, 以提高自身的生存适合度(交配、捕食等)。而关于雌性前肢较长的原因尚待进一步研究。室内观察发现雌性沙蜥排卵前有刨洞现象, 雌性是否因为受繁殖期间挖洞驱使而进化出较长的前肢有待野外条件下进一步探究。
3.4.3 尾部的两性异形爬行动物的尾部具有较多的功能, 可以参与运动(Arnold & Bennett, 1988)、保卫领域以及交配(Martin & Salvador, 1993;Salvador et al., 1995)、控制平衡(Fox & McCoy, 2000)、储存脂肪和保存能量(林炽贤等, 2005)等。此外, 雄性具有较大的尾部亦与含半阴茎有关(林植华, 2004), 旱地沙蜥3个地理种群的雄性尾长均显著大于雌性, 表现出与北屯种群一致的结果(梁涛等, 2015), 因此本研究结果进一步支持尾长受性选择影响的假说。
根据野外观察, 旱地沙蜥生活环境较贫瘠, 植被稀疏, 食物资源匮乏, 面临较多的生存选择, 使种群生长在性选择与繁殖力选择之间做出权衡。尽管北屯市旱地沙蜥种群两性异形的形成受性选择影响较强(梁涛等, 2015), 从繁殖力选择的角度看, 雌性为了保证种群延续, 需要尽可能地增加繁殖投入, 故在接近性成熟的过程中或者性成熟后减缓附器的生长速度, 从而增加它们的体型, 使得整体朝保持种群顺利繁衍的方向进化, 这也就解释了旱地沙蜥的雌性体型较大, 而雄性体型较小却具有较大的后肢长和尾长的现象。3个地区种群表现同样的规律, 我们认为这是受性选择和繁殖力选择共同作用的结果。
4 结论形态地理变异与温度之间的关系一般受基因和自然选择的影响, 蜥蜴在不同的环境中生长而演变出不同的表型(Jaffe et al., 2016)。3个地理种群之间基因的差异有待进一步研究, 然而, 3个地理种群在体型和附器呈现一致的规律——随着温度的升高而变小, 且雌雄之间的斜率无差异, 表现为形态指标同速降低, 表明温度对旱地沙蜥形态的影响不因性别而异。因此, 旱地沙蜥3个地理种群后肢长、尾长、前肢长、体型表现为不遵循Rensch法则, 我们认为繁殖力选择假说和性选择假说是旱地沙蜥形成这种现象的内在机制。3个地区温度存在差异, 并且3个地理种群个体的体型以及附器(尾巴、四肢)随温度的降低而逐步变小, 较热地区较大的体型及附器可以增强散热能力, 反之, 较小的体型和附器可以在寒冷地区减少散热, 正是因为受这样自然选择的因素驱使, 3个地区的变化规律表现出弥散性(不定向性)。由于3个地理种群在后肢长、前肢长、尾长、体型上表现出一致的变化规律, 表明繁殖力和性选择具有定向性。尽管如此, 寒冷地区旱地沙蜥的体型以及附器也没有比温暖地区的大, 表明这样定向性的繁殖力和性选择弱于自然选择。总之, 旱地沙蜥3个地理种群的两性异形同时受自然选择、性选择和繁殖力选择的影响, 其中受弥散性自然选择的压力比定向性的繁殖力选择和性选择的作用更强。
| 陈旭, 张方, 陈潘, 等. 2013. 凹耳蛙的两性异形[J]. 四川动物, 32(1): 73–77. |
| 杜卫国, 姚智娟. 2007. 北草蜥的交配行为[J]. 动物学杂志, 42(6): 7–12. |
| 胡舒展, 路迪, 赵联军, 等. 2015. 华西蟾蜍年龄结构、体长和生长率的研究[J]. 四川动物, 34(1): 41–46. |
| 金园庭, 田仁荣, 刘迺发. 2006. 四种沙蜥的形态地理变异:Bergmann和Allen规律的检验[J]. 动物学报, 52(5): 838–845. |
| 梁涛, 吕士鹏, 武开乐, 等. 2015. 旱地沙蜥的两性异形和雌性繁殖投入[J]. 生态学杂志, 25(6): 1602–1606. |
| 廖灏泓, 徐峰, 杨维康. 2013. 新疆沙虎的两性异形[J]. 四川动物, 32(6): 808–813. |
| 林炽贤, 杜宇, 邱清波, 等. 2005. 多线南蜥贮能部位的能量贮存与动用[C]//周开亚, 计翔. 两栖爬行动物学研究(第10辑). 长春: 吉林人民出版社: 232-238. |
| 林植华, 雷焕宗, 陈利丽, 等. 2007. 棒花鱼形态特征的两性异形和雌性个体生育力[J]. 四川动物, 26(4): 910–913. |
| 林植华. 2004. 丽纹攀蜥头体大小的两性异形和繁殖期的生长[J]. 四川动物, 23(3): 277–280. |
| 徐大德, 罗斯特, 刘文华, 等. 2014. 肇庆南草蜥形态、食性及运动表现的两性差异[J]. 四川动物, 33(6): 808–814. |
| 徐峰, 廖灏泓, 杨维康. 2015. 旱地沙蜥的两性异形[J]. 四川动物, 34(6): 859–862. |
| 赵尔宓, 赵肯堂, 周开亚, 等. 1999. 中国动物志爬行纲第二卷(有鳞目:蜥蜴亚目)[M]. 北京: 科学出版社. |
| 赵肯堂. 2003. 中国的"胎生"蜥蜴[J]. 大自然, 6(23): 48–49. |
| Abouheif E, Fairbairn DJ. 1997. A comparative analysis of allometry for sexual size dimorphism:assessing Rensch's rule[J]. The American Naturalist, 149(3): 540–562. DOI:10.1086/286004 |
| Adolph SC, Porter WP. 1996. Growth, seasonality, and lizard life histories:age and size at maturity[J]. Oikos, 77(2): 267–268. DOI:10.2307/3546065 |
| Alho JS, Herczeg G, Laugen A, et al. 2011. Allen's rule revisited:quantitative genetics of extremity length in the common frog along a latitudinal gradient[J]. Journal of Evolutionary Biology, 4(1): 59–70. |
| Allen JA. 1877. The influence of physical conditions in the genesis of species[J]. Radical Review, 1: 108–140. |
| Anderson M. 1994. Sexual selection[M]. New Jersey: Princeton University Press. |
| Arnold SJ, Bennett AF. 1988. Behavioural variation in natural populations.Ⅴ. Morphological correlates of locomotion in the garter snake (Thamnophis radix)[J]. Biological Journal of the Linnean Society, 34(2): 175–190. DOI:10.1111/bij.1988.34.issue-2 |
| Ashton KG. 2004. Sensitivity of intra specific latitudinal clinic of body size for tetrapods to sampling, latitude and longitude?[J]. Integrative & Comparative Biology, 44(6): 403–412. |
| Bergmann C. 1847. Über die Verhä ltnisse der Wärmeökonomie der Thiere zuihrer Grösse[J]. G ttinger Studien, 1: 595–708. |
| Blanckenhorn WU, Demont M. 2004. Bergmann and converse Bergmann latitudinal clines in arthropods:two ends of a continuum?[J]. Integrative & Comparative Biology, 44(6): 413–424. |
| Bonduriansky R. 2007. Sexual selection and allometry:a critical reappraisal of the evidence and ideas[J]. Evolution, 61(4): 838–849. DOI:10.1111/evo.2007.61.issue-4 |
| Cartar RV, Morrison RIG. 2005. Metabolic correlates of leg length in breeding arctic shorebirds:the cost of getting high[J]. Journal of Biogeography, 32(3): 377–382. DOI:10.1111/jbi.2005.32.issue-3 |
| Ceballos CP, Iverson JB. 2014. Patterns of sexual size dimorphism in Chelonia:revisiting Kinosternidae[J]. Biological Journal of the Linnean Society, 111(4): 806–809. DOI:10.1111/bij.2014.111.issue-4 |
| Christian A, Garland JRT. 1996. Scaling of limb proportions in monitor lizards (Squamate, Varanidae)[J]. Journal of Herpetology, 30(2): 219–230. DOI:10.2307/1565513 |
| Colleoni E, Denoël M, Padoa-Schioppa E, et al. 2014. Rensch's rule and sexual dimorphism in salamanders:patterns and potential processes[J]. Journal of Zoology, 293(143): 143–151. |
| Dale J, Dunn PO, Figuerola J, et al. 2007. Sexual selection explains Rensch's rule of allometry for sexual size dimorphism[J]. Proceedings of the Royal Society B Biological Sciences, 274(1628): 2971–2979. DOI:10.1098/rspb.2007.1043 |
| Darwin C. 1871. The descent of man and selection in relation to sex[M]. London: John Murray. |
| Fairbairn DJ. 1997. Allometry for sexual size dimorphism:pattern and process in the coevolution of body size in males and females[J]. Annual Review of Ecology and Systematics, 28(4): 659–687. |
| Fox SF, McCoy JK. 2000. The effects of tail loss on survival, growth, reproduction, and sex ratio of offspring in the lizard Uta stansburiana in the field[J]. Oecologia, 122(3): 327–334. DOI:10.1007/s004420050038 |
| García-Navas V, Bonnet T, Bonal R, et al. 2016. The role of fecundity and sexual selection in the evolution of size and sexual size dimorphism in New World and Old World voles (Rodentia:Arvicolinae)[J]. Oikos, 125(9): 1250–1260. DOI:10.1111/oik.2016.v125.i9 |
| Gifford ME, Herrel A, Mahler DL. 2008. The evolution of sprinting performance among populations of Leiocephalus lizards from the Dominican Republic[J]. Biological Journal of Linnean Society, 93(3): 445–456. DOI:10.1111/j.1095-8312.2007.00909.x |
| Jaffe AL, Campbell-Staton SC, Losos JB. 2016. Geographical variation in morphology and its environmental correlates in a widespread North American lizard, Anolis carolinensis (Squamata:Dactyloidae)[J]. Biological Journal of the Linnean Society, 117(4): 760–774. DOI:10.1111/bij.12711 |
| Jin YT, Liao PH. 2015. An elevational trend of body size variation in a cold-climate agamid lizard, Phrynocephalus theobaldi[J]. Current Zoology, 61(3): 444–453. DOI:10.1093/czoolo/61.3.444 |
| Lappin AK, Swinney EJ. 1999. Sexual dimorphism as it relates to natural history of leopard lizards (Crotaphytidae:Gambelia)[J]. Copeia(3): 649–660. |
| Liao WB. 2013. Evolution of sexual size dimorphism in a frog obeys the inverse of Rensch's rule[J]. Evolutionary Biology, 40(2): 293–299. DOI:10.1007/s11692-012-9212-5 |
| Lomolino MV. 2005. Body size evolution in insular vertebrates:generality of the island rule[J]. Journal of Biogeography, 32(10): 1683–1699. DOI:10.1111/jbi.2005.32.issue-10 |
| Losos JB. 1990. Ecomorphology, performance capability, and scaling of west Indian Anolis lizards:an evolutionary analysis[J]. Ecological Monographs, 60(3): 369–388. DOI:10.2307/1943062 |
| Martin J, Salvador A. 1993. Tail loss reduces mating success in the Iberian rock-lizard, Lacerta monticola[J]. Behavioral Ecology & Sociobiology, 32(3): 185–189. |
| Mayr E. 1956. Geographical character gradients and climatic adaptation[J]. Evolution, 10(1): 105–108. DOI:10.2307/2406103 |
| Millien V, Lyons SK, Olson L, et al. 2006. Ecotypic variation in the context of global climate change:revisiting the rules[J]. Ecology Letters, 9(7): 853–869. DOI:10.1111/ele.2006.9.issue-7 |
| Mousseau TA. 1997. Ectotherms follow the converse Bergmann's rule[J]. Evolution, 51: 630–632. DOI:10.2307/2411138 |
| Nagy KA. 2005. Field metabalic rate and body size[J]. Journal of Experimental Biology, 208(9): 1621–1625. DOI:10.1242/jeb.01553 |
| Park O. 1949. Application of the converse Bergmann principle to the carabid beetle, Dicaelus purpuratus[J]. Physiological Zoology, 22(4): 359–372. DOI:10.1086/physzool.22.4.30152061 |
| Ray C. 1960. The application of Bergmann's and Allen's rule to the poikilotherms[J]. Journal of Morphology, 106(1): 85–109. DOI:10.1002/(ISSN)1097-4687 |
| Rensch B. 1950. Die Abhängigkeit der relativen sexual differenz von der Körpergrösse[J]. Bonner Zoologische Beiträge, 1: 58–69. |
| Salvador A, Martin AJ, Lopez P. 1995. Tail loss reduces home range size and access to females in male lizards, Psammodromus algirus[J]. Behaviour Ecology, 6(4): 382–387. DOI:10.1093/beheco/6.4.382 |
| Scholander PF. 1955. Evolution of climatic adaptation in homeotherms[J]. Evolution, 9(1): 15–26. DOI:10.2307/2405354 |
| Shine R, Madsen T. 1996. Seasonal migration of predators and prey-a study of pythons and rats in tropical Australia[J]. Ecology, 77(1): 149–156. DOI:10.2307/2265663 |
| Sokal RR, Rohlf FJ. 1994. Biometry:the principles and practice of statistics in biological research[M]. Oxford: W.H. Freeman. |
| Stephens PR, Wiens JJ. 2009. Evolution of sexual size dimorphisms in emydid turtles:ecological dimorphism, Rensch's rule, and sympatric divergence[J]. Evolution, 63(4): 910–925. DOI:10.1111/evo.2009.63.issue-4 |
| Stevenson RD. 1986. Allen's rule in north American rabbits (Sylvilagus) and hares (Lepus) is an exception, not a rule[J]. Journal of Mammalogy, 67(2): 312–316. DOI:10.2307/1380884 |
| Tattersall GJ, Andrade DV, Abe AS. 2009. Heat exchange from the toucan bill reveals a controllable vascular thermal radiator[J]. Science, 325(5939): 468–470. DOI:10.1126/science.1175553 |
| Webb TJ, Freckleton RP. 2007. Only half right:species with female-biased sexual size dimorphism consistently break Rensch's rule[J]. PLoS ONE, 2(9): 897. DOI:10.1371/journal.pone.0000897 |
| Webster MS. 1992. Sexual dimorphism, mating system and body size in New-World blackbirds (Icterinae)[J]. Evolution, 46(6): 1621–1641. DOI:10.2307/2410020 |
| West S. 2009. Sex allocation[M]. New Jersey: Princeton University Press. |
| Yom-Tov Y, Yom-Tov S, Wright J, et al. 2006. Recent changes in body weight and wing length among some British passerine birds[J]. Oikos, 112(1): 91–101. DOI:10.1111/oik.2006.112.issue-1 |
 2017, Vol. 36
2017, Vol. 36




