扩展功能
文章信息
- 台雪姣, 郭兴荣, 罗超, 单勐也, 刘欣, 阮绪芝
- TAI Xuejiao, GUO Xingrong, LUO Chao, SHAN Mengye, LIU Xin, RUAN Xuzhi
- 小鼠颌下采血法改良
- Improved Experimental Techniques of Blood Collection from the Submandibular Vein Plexus in Mice
- 四川动物, 2017, 36(2): 211-214
- Sichuan Journal of Zoology, 2017, 36(2): 211-214
- 10.11984/j.issn.1000-7083.20160201
-
文章历史
- 收稿日期: 2016-07-28
- 接受日期: 2016-11-18
2. 湖北医药学院附属太和医院胚胎干细胞湖北省重点实验室, 湖北十堰 442000
2. Hubei Key Laboratory of Embryonic Stem Cell Research, Taihe Hospital, the Affiliated Hospitals of Hubei University of Medicine, Shiyan, Hubei Province 442000, China
小鼠由于自身基因序列与人类高度相似而成为医学科研及临床实验中最常用的模型动物,特别是在生理学、药理学、药物代谢动力学等研究中,经常要采集其血液进行常规质量检测、细胞学实验或生理、生化分析,能够顺利采集小鼠血液样本是实验成功必不可少的一步。目前小鼠的采血方法较多,但各有利弊。心脏穿刺操作难度大,易导致小鼠死亡 (吴晓晴,郝晨霞,2004);断头取血不可重复,且血液常被毛发、组织液等污染 (苏丽娜等,2010);眼眶后动脉、股动脉、静脉、颈动脉、腹主动脉等穿刺取血法,需先进行麻醉,操作复杂,对小鼠的损伤较大,且采血的次数有限 (宗阿南等,2008);断尾取血操作简单,却耗时长、取血少 (崔洁等,2013)。Vahl等 (2005)、吴剑平等 (2010)的研究表明,常规实验操作,特别是采血操作,都会使实验动物产生应激反应,使大鼠促肾上腺皮质激素及皮质醇等相应生理生化指标发生改变,因此,实验操作应尽量减少对实验动物的刺激。颌下采血法是当今最快速、简单、人性化的小鼠采血方法,在保证实验血样顺利采集的基础上将对小鼠的伤害减小到最小 (Golde et al., 2005)。但该方法尚未被广泛应用,文献报道很少。我们在动物实验过程中,实践了上述各种采血方法,结合自身经验对颌下采血法进行了关键技术改良。本文介绍了一种可广泛推广的简便、安全、快速、高效、采血量多的改良小鼠颌下采血方法。
1 材料和方法 1.1 材料 1.1.1 实验动物SPF级ICR雄性小鼠20只,体质量18~22 g,由湖北医药学院SPF级动物实验中心提供[实验动物生产许可证号:SCXK (鄂)2011-0008;实验动物使用许可证号:SYXK (鄂)2011-0031]。
1.1.2 实验器材20 μL微量毛细吸管 (批号:140208,姜堰市健华医疗器械有限公司)、常规1.5 mL灭菌离心管、酒精棉球、灭菌干棉球、肝素等。
1.2 方法改良颌下采血法步骤如下:
确定采血进针点:用5%水合氯醛溶液按照0.1 mL/10 g麻醉小鼠,整体观察头面部,可见下颌处左右各有1处明显少毛或无毛的位点,取名为下颌斑点 (图 1:a,b)。进行颌面部血管解剖,解剖可见颈外静脉在颌面部表浅部位主要分为2支 (图 1:c):一支上行到眼部,一支下行沿咬肌下缘走行 (图 1:d,e),走行区经过下颌斑点,该处血管位置表浅,且体表投影位置明确、易于识别,即为实验采血点。
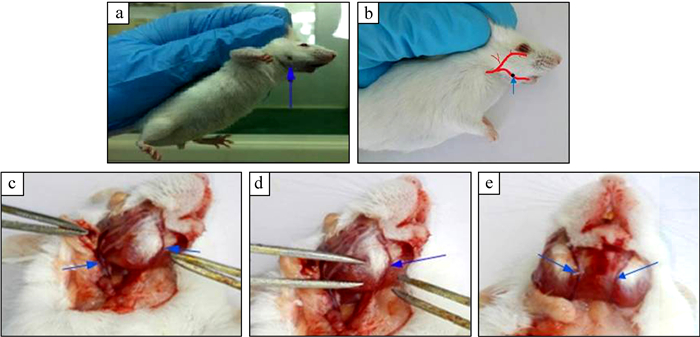
|
| 图 1 改良小鼠颌下采血进针点——下颌斑点 Fig. 1 The improved entry point position:mandibular freckle a.小鼠下颌采血进针斑点体表位置,b.小鼠下颌血管走行与进针斑点位置,c.小鼠下颌内部血管走行,d.小鼠单侧颌下血管,e.小鼠双侧颌下血管走行。 a. mouse mandibular freckle position on the surface, b. mouse mandibular blood vessel and the mandibular freckle, c. mouse mandibular vascular line, d. unilateral mandibular vascular of mouse, e. bilateral mandibular blood vessels of mouse. |
| |
改良采血针:选用简单易获得的20 μL微量毛细吸管代替金属采血针,使用前高压灭菌消毒,将微量毛细吸管一端折去,使断面平整,保留6 cm (图 2:a)。
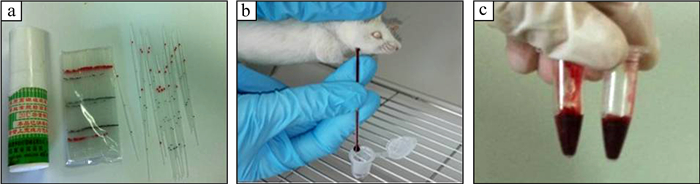
|
| 图 2 小鼠颌下采血针——微量毛细吸管 Fig. 2 The improved blood taking needle:microcapillary pipet a. 20 μL微量毛细吸管,b.微量毛细吸管采血,c.采集到的血量。 a. 20 μL microcapillary pipet, b. blood collected from mouse submandibular point, c. blood volume. |
| |
捉持法固定:以右手提鼠尾,将小鼠放于粗糙面上,将鼠尾轻向后拉,以左手拇指、食指捏双耳、头部皮肤,无名指、小指及掌心夹住背部皮肤和鼠尾,避免小鼠头部摆动 (图 1:a)。
颌下采血:左手捉持固定小鼠,将其倒立数秒使头面部血管充盈,在小鼠头面下颌部找到下颌斑点 (图 1:a),右手用酒精棉球擦拭采血部位消毒后,拇指、食指、中指持微量毛细吸管于血管体表投影点垂直颌面部旋转迅速刺入皮下,血液即流出 (图 2:b)。采血结束,立即用灭菌干棉球压迫止血。
将血液收集于1.5 mL灭菌离心管内,编号备用 (图 2:c)。采血结束后,小鼠正常培养观察10 d,观察其进水、饮食、行为活动、感染、死亡等情况。
2 结果采用改良颌下采血法对20只小鼠进行采血操作,每只小鼠采血量为0.5~0.7 mL。所取血液基本无溶血发生,离心后上层血清澄清透明。
单人操作采血20次,每次在40~60 s内即可完成对1只小鼠的采血过程,每2只间隔休息1 min,单人40 min内可完成20只小鼠采血工作,采血成功率达100%,为后期检测工作的顺利进行奠定了良好基础。采血数据结果统计见表 1。
| 样本数 Number of samples |
体质量 Body mass/g |
采血量 Blood volume/mL |
采血时间 Sampling time/s |
| 20 | 20.22±1.16 | 0.54±0.08 | 43.60±8.32 |
采血过程中,1只小鼠采血成功但采血后死亡。其余小鼠未发生伤残、死亡等情况。采血后常规条件下培养观察10 d,小鼠进水、饮食正常,毛发光滑,无行为活动异常、无感染、无死亡。
3 讨论颌下采血法是目前最简易、最快捷、损伤小的采血方法,符合3R原则和动物福利。与传统采血法结果 (张帅帅等,2016) 比较见表 2。
| 采血方法 Blood sampling method |
颌下静脉 Submandibularvein |
眼眶 Retro-orbital |
剪尾 Tail clip |
摘眼 Eye extraction |
断头 Decollation |
心脏 Cardiac puncture |
腋动脉 Axillary artery |
大隐静脉 Saphenous vein |
| 适用范围 | 重复多量采血 | 重复少量采血 | 重复少量采血 | 单次多量采血 | 单次多量采血 | 重复多量采血 | 单次多量采血 | 重复少量采血 |
| 采血量/mL | 0.30~0.60 | 0.20~0.30 | 0.02~0.20 | 0.20~0.60 | 0.70~1.10 | 0.50~0.60 | 0.30~0.50 | 0.03~0.20 |
| 溶血 | 少见 | 少见 | 少见 | 常见 | 常见 | 少见 | 少见 | 少见 |
| 麻醉 | 否 | 否 | 否 | 是 | 是 | 是 | 是 | 否 |
| 血液污染 | 少 | 少 | 少 | 少 | 常见 | 无 | 少 | 少 |
| 操作难易度 | 易 | 中 | 易 | 中 | 易 | 难 | 难 | 中 |
| 耗时/min | 0.50~1.00 | 1.00~1.50 | 2.00~4.00 | 0.80~1.20 | 1.00~1.50 | 1.00~3.00 | 2.00~3.00 | 1.00~2.00 |
颌下采血法不仅不会给小鼠造成大的伤害,而且可反复采血,操作方便,采血后小鼠恢复快。但在操作过程中有几点不足:第一,采血位置定位模糊。余琛琳等 (2008)描述“下颌骨后方咬肌边缘”;张帅帅等 (2016)介绍“鼠的下唇、眼、耳根下缘可组成近似等腰三角形,在下唇与耳根下缘所组成的底边中心偏耳根的位置处,有约2 mm2的软组织”。这些定位描述对于未接触过动物实验或无解剖学基础的人而言增加了难度。第二,各类文献中报道的颌下采血工具都是静脉专用采血针或注射器针头,刺破皮肤后使血液滴入收集管,但血液在接触到皮肤毛发后极易被污染。郝婉君等 (2009)通过对比摘眼、断尾、心脏、颌下采血法后,认为“采血量要求高,且不要求重复使用,可以采用心脏采血或摘眼取血;而对采血量要求不高的最好选择颌下静脉采血”。通过改进,我们用类似小鼠眶后静脉丛采血的微量毛细吸管进行采血,将血液由体内直接导入收集管中,避免了血样被污染,采血量要求高的实验也可选择此法;且下颌斑点的明确定位大大提高了实验的成功率和可重复性,使初学者也能快速准确地找到采血点进行采血。
针对上述问题,我们对小鼠颌下采血法进行了改良,改良后主要有以下几个方面的优点:(1) 采血所需实验器械简易、普遍;(2) 采血点明确,简单易识别,特别适合初学者;(3) 对小鼠损伤小,采血所需时间很短,尤其是操作熟练的实验人员,可很好地把握采血位置和深度,将损伤降至最低;(4) 血液采集量较大,成年小鼠单次采血量平均可达0.5 mL;(5) 使用微量毛细吸管采血,有利于避免局部皮肤、毛发及组织液的污染,不易发生溶血;(6) 可多次重复采集血液样本,满足对血样的不同需求。该方法简易实用,既减少医学工作者采集血液的难题,又减轻实验动物的痛苦,是一种快速、简单、人性化的小鼠采血方法。
为了更好地运用颌下采血法,以下几点值得注意:(1) 小鼠头部固定是采血成功的关键,左手抓住头部皮肤使其紧绷,更易于采血针的刺入,固定住头部后可将小鼠短暂倒立10 s使头部血管充盈;(2) 切忌将颈部皮肤抓持过紧,造成小鼠窒息死亡;(3) 找准进针点,垂直面部进针,一般刺破皮肤进针1~3 mm即可出血,触及颌骨应停止进针;(4) 采血过程中使小鼠倒立可增加采血量;(5) 采血遵循无菌原则;(6) 采血前禁食不禁水12~24 h,或于当天采血前0.5~1 h内用1 mL水灌胃,增加血容量,能减少采血造成的死亡。
| 崔洁, 朱玲玉, 陈兴智, 等. 2013. 一种自制的小鼠断尾采血简易装置[J]. 蚌埠医学院学报, 38(8): 1050–1051. |
| 郝婉君, 杨海岳, 王学强. 2009. 小鼠不同采血方法采血效果的比较[C]. 南宁: 第九届中南地区实验动物科技交流会论文集. |
| 苏丽娜, 郭剑伟, 饶光玲. 2010. 小鼠尾静脉注射与断头取血实验技术的改进[J]. 大理学院学报, 6: 25–27. |
| 吴剑平, 杨斐, 胡樱. 2010. 常规实验操作对Wistar大鼠的影响[J]. 中国实验动物学报, 18(4): 312–317. |
| 吴晓晴, 郝晨霞. 2004. 160只小鼠心脏采血的操作体会[J]. 实验动物科学, 21(1): 53–54. |
| 余琛琳, 赵乐, 汤球, 等. 2008. 一项小鼠采血新技术——颌下静脉丛采血法[J]. 中国比较医学杂志, 18(12): 53–54. |
| 张帅帅, 李天寿, 藏美蓉, 等. 2016. 鼠面颊采血方法探究[J]. 中华医学杂志(8): 655–657. |
| 宗阿南, 邹悦, 任萍萍. 2008. 实验动物质量检测中不同采血方法的比较[J]. 中国比较医学杂志, 18(2): 74–75. |
| Golde WT, Gollobin P, Rodriguez LL. 2005. A rapid, simple, and humane method for submandibular bleeding of mice using a lancet[J]. Lab Animal, 34(9): 39–43. DOI:10.1038/laban1005-39 |
| Vahl TP, Ulrich-Lai YM, Ostrander MM, et al. 2005. Comparative analysis of ACTH and corticosterone sampling methods in rats[J]. Ajp Endocrinology & Metabolism, 289(5): E823–E828. |
 2017, Vol. 36
2017, Vol. 36




