扩展功能
文章信息
- 隋世燕, 葛亚男, 徐取尉, 苏晶晶
- SUI Shiyan, GE Yanan, XU Quwei, SU Jingjing
- 美洲大蠊醇提物对大鼠抗氧化应激的影响
- Influence of Periplaneta americana Extract on Antioxidant Stress in Rats
- 四川动物, 2017, 36(2): 198-202
- Sichuan Journal of Zoology, 2017, 36(2): 198-202
- 10.11984/j.issn.1000-7083.20160279
-
文章历史
- 收稿日期: 2016-10-14
- 接受日期: 2016-12-15
氧化应激是在机体内环境稳态时,体内生成的活性氧超过机体的抗氧化防御能力时对细胞组织造成损害的病理性生物化学反应。氧化应激的本质在于反应性的氧化物与生物抗氧化剂间平衡的破坏,从而造成活性氧 (reactive oxygen species,ROS) 浓度升高。生理水平的ROS有助于卵子发生和卵泡形成,但是过量ROS对女性生殖健康则有许多不利的影响 (Aitken & Koppers,2011),可以破坏细胞的DNA、脂类和蛋白质,引起细胞基因、结构及功能受损,甚至导致细胞死亡 (Bausenwein et al., 2010)。很多研究已经证实,卵泡内含有内源性抗氧化物酶,如超氧化物歧化酶 (SOD)、过氧化氢酶 (CAT)、谷胱甘肽过氧化物酶 (GSH-PX) 等,与非酶类抗氧化物共同对抗氧化损伤以降低卵泡中的ROS水平 (Agarwal et al., 2005;Goud et al., 2008);但当卵母细胞中的氧化应激产物超过机体抗氧化能力时,就会引起多种卵巢相关疾病,如内分泌紊乱、卵泡闭锁、卵巢早衰等,严重危害人类和动物的生殖健康 (Agarwal et al., 2003, 2005;Rizzo et al., 2012)。在人类辅助的生殖领域,氧化应激可引起体外胚胎老化、发育受阻、凋亡和碎片等 (Sikka,2001;Agarwal et al., 2005;Riva et al., 2007)。因此,减少卵巢氧化应激的发生,对提高卵母细胞质量、促进胚胎的发育有积极作用。
机体中常见的氧化应激标志物有以一氧化氮 (NO) 和丙二醛 (MDA) 为代表的脂质氧化产物 (Wathes et al., 2007),它们能反映生物体内脂质过氧化反应的程度。利用机体内源的抗氧化体系在细胞内部协同对抗自由基,最终有效消除细胞内过量的自由基。若想有效降低自由基对人体的危害,不仅要依靠内源性防御体系,还要利用外源性自由基清除剂,使自由基在侵入机体之前就被阻断,避免机体遭受氧化损害 (Bagchi et al., 1997)。
美洲大蠊Periplaneta americana属于蜚蠊科Blattidae大蠊属Periplaneta,原产于南美洲,食性广泛,喜食糖和淀粉,污染食物、传播病菌和寄生虫,是世界性卫生害虫,其分泌物和粪便还含有致癌物质,但其药理作用却日益造福人类,其具有抗肝炎、抗肿瘤、抗菌、抗人类免疫缺陷病毒、增强机体免疫力、消炎镇痛、促进血管增生和组织修复等作用 (戴云等,2005;何正春等,2009)。研究发现,美洲大蠊提取物在体外具有一定的抗氧化能力 (焦春香等,2011),但是,其在体内的抗氧化效果却未见报道。
因此,本研究以成年SD大鼠为研究对象,观察以美洲大蠊醇提物干预后其血清NO、GSH-PX、CAT、SOD和MDA等氧化或抗氧化应激指标的变化,并且测定了大鼠卵巢中抗氧化相关基因GSH-PX、CAT和SOD的表达,以探讨美洲大蠊醇提物对大鼠机体和卵巢的抗氧化能力,从而为研究美洲大蠊醇提物对动物繁殖功能的影响奠定基础。
1 材料 1.1 实验对象 1.1.1 实验动物17只成年SD雌性大鼠,体质量230~250 g,购自第三军医大学实验动物中心,实验动物生产许可证号:SCXK (渝)2007-017,实验动物使用许可证号:SCXX (滇)2005-0010。
1.1.2 美洲大蠊醇提物的制取成年美洲大蠊 (由大理大学昆虫生物医药研究院赠送) 处死后,晾干,将虫体粉碎,用15倍量的95%乙醇进行冷浸提取3次,然后去除脂肪,沉淀物放入-40 ℃保存备用。
1.1.3 实验处理大鼠先进行7 d的自由采食饲养,以调节生理周期,使其适应环境。按体质量随机分为3组,对照组5只灌胃生理盐水;低剂量组6只灌胃低剂量的美洲大蠊醇提物 (0.03 g·mL-1);高剂量组6只灌胃高剂量的美洲大蠊醇提物 (0.09 g·mL-1);根据甘平等 (2011)的方法,3组大鼠灌胃的剂量均为每千克体质量9 mL。所有大鼠均自由饮水和采食。
1.2 主要试剂和仪器 1.2.1 主要试剂NO试剂盒、CAT试剂盒、MDA试剂盒、GSH-PX试剂盒、SOD试剂盒均购自南京建成生物工程研究所;Trizol试剂盒购自上海Life Technologies生物技术有限公司;DNA酶购自TaKaRa公司;反转录酶购自Promega公司;dNTP和RNA酶抑制剂购自南京生兴生物工程有限公司;含SYBR GREEN的DNA聚合酶购自TaKaRa公司。10%水合氯醛。反转录引物、内参引物和基因表达引物由上海捷瑞生物技术有限公司合成。
1.2.2 主要仪器可见分光光度计,上海棱光技术有限公司;NanoDrop分光光度计 (ND-1000),美国Thermo公司;普通PCR仪 (Gene Amp PCR system 9600),美国Perkins Elmer公司;实时荧光定量PCR仪 (Mx3000P),美国Stratagene公司。
2 方法 2.1 动物模型建立大鼠自由取食喂养7 d后灌胃,每2天1次。
2.2 样本采集大鼠喂养30 d后开始采样,用10%水合氯醛 (每千克体质量2 mL) 对大鼠进行腹腔注射,待麻醉后剖开腹腔,腹主动脉采血,将血注入含有EDTA-Na的抗凝管里,将卵巢放入EP管中,置于-70 ℃保存。血液4000 r·min-1离心10 min,取上清。
2.3 血清中各氧化和抗氧化应激指标测定根据说明书进行NO、GSH-PX、CAT、SOD、MDA指标的测定。
2.4 基因表达测定方法 2.4.1 RNA提取及质量控制根据说明书,使用Trizol试剂盒提取卵巢总RNA,DNA酶处理后用NanoDrop分光光度计测定总RNA的浓度,测得的值应在2 000 ng·μL-1内,若超过则稀释后重测,OD260/280=1.8~2.2。最后取5 μg RNA稀释到500 ng·μL-1,每管4 μL,共分装2套,用于RNA反转录。
2.4.2 反转录反应总体积25 μL。第一步,2 μg总RNA,10 mmol·L-1 dNTP,2.5 μmol·L-1随机引物,加DEPC水至10 μL,在普通PCR仪上70 ℃变性5 min后,立即置于冰上冷却;第二步,加5 μL5×RT buffer,0.2 μL 1 000 U RNA酶抑制剂,0.1 μL 10 000 U反转录酶 (M-MLV),DEPC水补齐至25 μL,在普通PCR仪上37 ℃反应1 h,95 ℃活化5 min。反转录产物短期内使用可置于4 ℃,长期保存需置于-20 ℃。
2.4.3 引物设计内参基因GAPDH和目的基因的引物根据GenBank上猪的相关cDNA序列,采用Primer premier 5.0进行设计,由上海捷瑞生物工程有限公司合成 (表 1)。
| 目的基因 Target gene |
PCR产物 PCR pro-duct/bp |
引物序列 Primer sequences (5'-3') |
基因序列号 GenBank ID |
| CAT | 213 | F:ACCTGTGAACTGTCCCTACCG R:CGCACCTGAGTGACGTTGTCT |
NM_012520 |
| SOD | 163 | F:GTGGTGGAGAACCCAAAGGA R:GCGGCAATCTGTAAGCGAC |
NM_017051 |
| GSH-PX | 221 | F:GTGCGAGGTGAATGGTGAGA R:TGTCGATGGTGCGAAAGC |
NM_030826 |
| GAPDH | 142 | F:GGCAAGTTCAACGGCACAG R:CGCCAGTAGACTCCACGACAT |
NM_017008 |
将cDNA原液稀释至10%,使用实时荧光定量PCR仪检测目的基因的mRNA表达,其体系为:cDNA 2 μL,1 μmol·L-1目的或内参基因引物2 μL,高压ddH2O 6 μL,含SYBR Green的DNA聚合酶10 μL,共20 μL。PCR反应条件为:95 ℃预变性3 min;95 ℃变性30 s,64 ℃退火20 s,72 ℃延伸20 s,40个循环。
统计方法使用2-ΔΔCt法 (Livak & Schmittgen,2001)。计算公式如下:△△Ct=(CtTarget-CtGAPDH)x-(CtTarget-CtGAPDH)control。
其中,以对照组的目的基因CtTarget和内参基因CtGAPDH差值的平均值为对照进行计算,x表示任意一个样本,通过上述公式计算出每一个样本目的基因的表达,即通过GAPDH校正后相对于对照组的目的基因表达的倍数。
2.5 数据统计与分析所有数据用平均值±标准误 (Mean±SE) 表示,统计分析采用SPSS 17.0中的单因素方差分析 (One-Way ANOVA),P<0.05表示差异有统计学意义。
3 结果 3.1 美洲大蠊醇提物对血清中各氧化和抗氧化应激指标的影响 3.1.1 对NO、GSH-PX和CAT含量的影响与对照组相比,低剂量组 (P=0.085) 和高剂量组 (P=0.091) 均使大鼠血清中NO含量有减少的趋势。与对照组相比,高剂量和低剂量的美洲大蠊醇提物均没有显著影响大鼠血清中的GSH-PX和CAT含量 (P>0.05)。
3.1.2 对SOD含量的影响与对照组相比,高剂量和低剂量的美洲大蠊醇提物均显著增加了大鼠血清中的SOD含量 (P<0.05)(图 1)。

|
| 图 1 雌性SD大鼠血清中SOD含量的测定 Fig. 1 Levels of serum SOD in female SD rats * P<0.05;下同the same below. |
| |
与对照组相比,低剂量的美洲大蠊醇提物没有显著影响大鼠血清中的MDA含量,但高剂量能够显著降低大鼠血清中的MDA含量 (P<0.05)(图 2)。

|
| 图 2 雌性SD大鼠血清中MDA含量的测定 Fig. 2 Levels of serum MDA in female SD rats |
| |
与对照组相比,高剂量与低剂量的美洲大蠊醇提物均没有显著影响大鼠卵巢GSH-PX和CAT基因的表达 (P>0.05)。
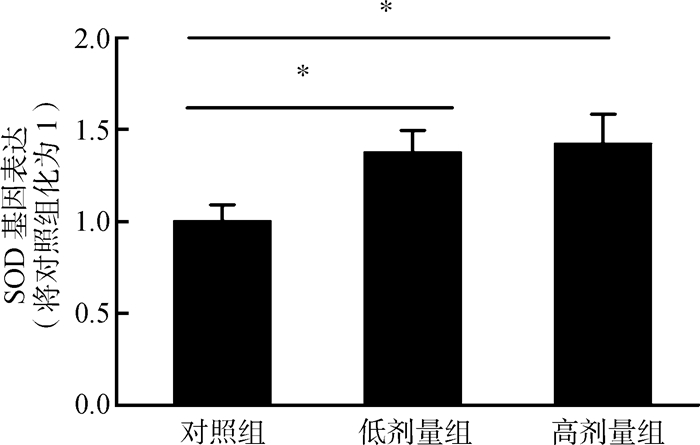
3.2.2 对SOD基因表达的影响由图 3可知,与对照组相比,高剂量和低剂量的美洲大蠊醇提物均显著增加了雌性大鼠卵巢中SOD基因的表达 (P<0.05)。
|
| 图 3 雌性SD大鼠卵巢组织中SOD基因的表达 Fig. 3 The expression of SOD gene in the ovary tissue of female SD rats |
| |
本实验结果显示,不同剂量的美洲大蠊醇提物能够降低大鼠血清中氧化应激指标NO及MDA的含量,并且能够增加大鼠血清中SOD的含量及其基因表达,说明美洲大蠊醇提物对大鼠机体和卵巢具有一定的抗氧化应激功能。
为保护机体免受过氧化损伤,细胞形成一套复杂的抗氧化酶防御系统,主要包括SOD、CAT、GSH-PX等,其中SOD将超氧阴离子 (O2-) 转换为过氧化氢 (H2O2),GSH-PX和CAT再将H2O2转化为水,从而使有毒性的O2-和H2O2均被转化为无害的水分子 (Husain et al., 2001)。CAT除了可调节体内H2O2水平,还可充当一些巯基蛋白质的保护剂;GSH在谷胱甘肽过氧化物酶的催化下,实现还原型谷胱甘肽与氧化型谷胱甘肽的转变,还原氧化型物质,解除其毒性 (吴军等,2007)。过多的自由基通过攻击生物膜中的多不饱和脂肪酸,引发脂质过氧化作用 (Oyawoye et al., 2003;Ashok et al., 2006),导致大鼠血清中脂质过氧化物MDA含量增加,造成组织细胞膜毒性反应,影响正常组织形态和功能的完整性 (Oyawoye et al., 2003)。
美洲大蠊醇提物使大鼠血清中MDA及NO的含量减少,显示了体内抗氧化酶防御系统能力的增强,使机体清除自由基的能力加强,从而使过多的自由基攻击生物膜中多不饱和脂肪酸而产生的MDA的含量也得到了控制,细胞膜不再受到过多自由基的侵袭,保证了其正常的组织形态和完整的功能,说明美洲大蠊醇提物具有增强抗氧化能力的功能。增强对NO及MDA的抑制作用,提高SOD的含量和基因表达,可能是美洲大蠊醇提物对机体抗氧化功能的保护机理所在。这与邹俊波等 (2016)的研究相似,美洲大蠊醇提物能够显著降低乙醇致急性胃溃疡小鼠胃黏膜组织内MDA和NO的水平,提高CAT、SOD和GSH-PX的活性,进而预防急性胃溃疡。
| 戴云, 曾茗, 项朋志. 2005. 蜚蠊的药用价值[J]. 中药材, 28(9): 848–850. |
| 甘平, 张旭强, 何旭, 等. 2011. 美洲大蠊醇提物对小鼠急性肝损伤的保护作用[J]. 现代药物与临床, 26(2): 123–128. |
| 何正春, 胡明辉, 王晓雨, 等. 2009. 美洲大蠊提取物对3株人及小鼠白血病细胞的细胞毒性研究[J]. 云南中医中药杂志, 30(5): 56–57. |
| 焦春香, 张成桂, 刘光明, 等. 2011. 美洲大蠊提取物中抗衰老活性部位抗氧化活性的初步分析[J]. 时珍国医国药, 22(6): 1389–1391. |
| 吴军, 赵凤鸣, 王明艳, 等. 2007. 四君子汤对环磷酰胺造模小鼠血清中SOD、GSH、CAT和MDA水平的影响[J]. 辽宁中医杂志, 34(8): 1168–1169. |
| 邹俊波, 桑文涛, 王芳, 等. 2016. 美洲大蠊提取物对乙醇致小鼠急性胃溃疡的预防作用[J]. 中成药, 38(11): 2325–2331. |
| Agarwal A, Gupta S, Sharma RK. 2005. Role of oxidative stress in female reproduction[J]. Reproductive Biology and Endocrinology, 3(28): 1–21. |
| Agarwal A, Gupta S, Sikka S. 2006. The role of free radicals and antioxidants in reproduction[J]. Current Opinion in Obstetrics and Gynecology, 18(3): 325–332. DOI:10.1097/01.gco.0000193003.58158.4e |
| Agarwal A, Saleh RA, Bedaiwy MA. 2003. Role of reactive oxygen species in the pathophysiology of human reproduction[J]. Fertility and Sterility, 79(4): 829–843. DOI:10.1016/S0015-0282(02)04948-8 |
| Aitken RJ, Koppers AJ. 2011. Apoptosis and DNA damage in human spermatozoa[J]. Asian Journal of Andrology, 13(1): 36–42. DOI:10.1038/aja.2010.68 |
| Bagchi D, Garg A, Krohn RL, et al. 1997. Oxygen free radical scavenging abilities of vitamins C and E and a grape seed proanthocyanidin extract in vitro[J]. Research Communications in Molecular Pathology and Pharmacology, 95(2): 179–189. |
| Bausenwein J, Serke H, Eberle K, et al. 2010. Elevated levels of oxidized low-density lipoprotein and of catalase activity in follicular fluid of obese women[J]. Molecular Human Reproduction, 16(2): 117–124. DOI:10.1093/molehr/gap078 |
| Goud AP, Goud PT, Diamond MP, et al. 2008. Reactive oxygen species and oocyte aging:role of superoxide, hydrogen peroxide, and hypochlorous acid[J]. Free Radical Biology and Medicine, 44(7): 1295–1304. DOI:10.1016/j.freeradbiomed.2007.11.014 |
| Husain K, Whitworth C, Somani SM, et al. 2001. Carboplatin-induced oxidative stress in rat cochlea[J]. Hearing Research, 159(1-2): 14–22. DOI:10.1016/S0378-5955(01)00306-9 |
| Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| Oyawoye O, Abdel Gadir A, Garner A, et al. 2003. Antioxidants and reactive oxygen species in follicular fluid of women undergoing IVF:relationship to outcome[J]. Human Reproduction, 18(11): 2270–2274. DOI:10.1093/humrep/deg450 |
| Riva C, Binelli A, Cogni D, et al. 2007. Evaluation of DNA damage induced by decabromodiphenyl ether (BDE-209) in hemocytes of dreissena polymorpha using the comet and micronucleus assays[J]. Environmental and Molecular Mutagenesis, 48(9): 735–743. DOI:10.1002/(ISSN)1098-2280 |
| Rizzo A, Roscino MT, Binetti F, et al. 2012. Roles of reactive oxygen species in female reproduction[J]. Reproduction in Domestic Animals, 47(2): 344–352. DOI:10.1111/rda.2012.47.issue-2 |
| Sikka SC. 2001. Relative impact of oxidative stress on male reproductive function[J]. Current Medicinal Chemistry, 8(7): 851–862. DOI:10.2174/0929867013373039 |
| Wathes DC, Abayasekara DR, Aitken RJ. 2007. Polyunsaturated fatty acids in male and female reproduction[J]. Biology of Reproduction, 77(2): 190–201. DOI:10.1095/biolreprod.107.060558 |
 2017, Vol. 36
2017, Vol. 36



