扩展功能
文章信息
- 侯东敏, 章迪, 余婷婷, 王政昆, 高文荣, 朱万龙
- HOU Dongmin, ZHANG Di, YU Tingting, WANG Zhengkun, GAO Wenrong, ZHU Wanlong
- 冷驯化对中缅树鼩PPARα、COXⅡ及PGC-1α基因表达量的影响
- Effect of Cold Exposure on the Expressions of PPARα, COXⅡ and PGC-1α in Tupaia belangeri
- 四川动物, 2017, 36(1): 34-38
- Sichuan Journal of Zoology, 2017, 36(1): 34-38
- 10.11984/j.issn.1000-7083.20160232
-
文章历史
- 收稿日期: 2016-08-31
- 接受日期: 2016-11-18
2. 云南经济管理学院, 昆明 650106
2. Yunnan College of Business Management, Kunming 650106, China
动物在野外生存面临许多环境因子的胁迫,尤其是在冬季,如环境温度较低和食物资源较差(Voltura & Wunder,1998)。当环境温度较低时,小型哺乳动物会表现出生理、行为等方面的适应性特征变化(Feder & Block,1991),而这往往会影响其野外的生存策略(朱万龙等,2008)。生理上,小型哺乳动物通常会在低温环境下增加产热能力,其主要的适应性产热(非颤抖性产热)发生器官是褐色脂肪组织(brown adipose tissue,BAT)。已有研究表明:低温条件下小型哺乳动物的白色脂肪组织(white adipose tissue,WAT)可以褐变,进而向BAT转化(Cypess et al., 2009;van Marken Lichtenbelt et al., 2009;Enerback,2010;Birerdinc et al., 2013),从而提高其产热能力。其中几种重要的脂肪转化因子起着重要的作用,如COXⅡ和PGC-1α能诱导WAT中BAT细胞的形成(Gesta et al., 2007;Madsen et al., 2010;Vegiopoulos et al., 2010),PPARα能诱导原代BAT细胞和BAT中解偶联蛋白1(uncoupling protein 1,UCP1)的表达(Feder & Block,1991)。这3种转录因子在冷驯化条件下表达量上调,可以使WAT褐变向BAT转化,从而增加动物的产热能力(Birerdinc et al., 2013)。
中缅树鼩Tupaia belangeri主要栖息在热带、亚热带地区,为东洋界特有的小型哺乳动物。研究表明树鼩科Tupaiidae动物由南向北扩散,即支持“岛屿起源”假说(Olson et al., 2005),而本研究组之前的研究也支持这一假说(王政昆等, 1994, 1995, 1999;张武先等,2002)。目前,实验动物的研发趋向动物体型小型化发展,树鼩因体型较小(一般为80~150 g)、进化地位和灵长类相似、人工繁殖和饲养成本较低,近年来已被广泛用作生物、医学等科学研究的实验动物(Kawamichi & Kawamichi,1979)。本研究组先前的研究结果指出,中缅树鼩在冷驯化条件下的产热、BAT质量和UCP1含量显著增加(王政昆等,1995),那么在该环境下中缅树鼩的WAT是否会向BAT转化,导致BAT质量和UCP1含量增加,从而增加其产热能力?本研究在此假设的基础上,在冷驯化条件下测定中缅树鼩的脂肪组织质量,脂肪转录因子PPARα、COX Ⅱ及PGC-1α基因表达量,来验证低温条件下中缅树鼩的WAT是否会褐变,进而向BAT转化。
1 材料与方法 1.1 动物来源中缅树鼩捕自云南省昆明市禄劝县的灌丛中,于云南师范大学生命科学学院动物饲养房(昆明)单笼室温饲养(温度25 ℃±1 ℃,光照12L:12D)。饲料为标准的雏鸡饲料(昆明生产的产蛋雏鸡饲料),熟喂,自由饮水。实验动物均为成年非繁殖期个体。
1.2 动物处理预适应1周后进行正式实验,随机分成2组:对照组和冷驯化组(每组各10只),实验前,2组动物体质量差异无统计学意义。冷驯化组在温度5 ℃±1 ℃,光照12L:12D环境中驯化28 d;对照组在温度25 ℃±1 ℃,光照12L:12D环境中驯化28 d。驯化期间动物可以自由取食和饮水。2组动物于28 d后断颈处死,称量其大网膜WAT和肩胛骨间BAT质量,取出皮下WAT于-80 ℃保存,用于相关脂肪转录因子基因表达量的测定。
1.3 表达量测定 1.3.1 RNA提取及纯度鉴定皮下脂肪组织总RNA的提取与纯化根据RNApure高纯总RNA快速抽提试剂盒(BioTeke Co.)提供的方法进行。通过琼脂糖凝胶电泳进行RNA纯度和完整性检验。提取的总RNA置于-80 ℃保存。
1.3.2 cDNA第一链合成第一链的合成以皮下脂肪组织总RNA为模板,根据FastQuant RT Kit (With gDNase)试剂盒提供的方法进行。基因组DNA的去除体系包括:2 μL 5×gDNA Buffer,4 μL总RNA,4 μL Rnase-Free ddH2O,配制体积10 μL,混匀。离心,42 ℃孵育3 min。然后置于冰上。反转录反应体系包括:2 μL 10×Fast RT Buffer,1 μL RT Enzyme Mix,2 μL FQ-RT Primer Mix,5 μL Rnase-Free ddH2O,配制体积10 μL。将反转录反应中的Mix加到gDNA去除步骤的反应液中,充分混匀。42 ℃孵育15 min,95 ℃孵育3 min之后放于冰上,得到的cDNA低温保存。
1.3.3 PPARα、COXⅡ及PGC-1α基因cDNA序列的扩增根据已知脊椎动物PPARα、COXⅡ及PGC-1α基因氨基酸保守序列设计引物(表 1)(章迪等,2014)。以上述cDNA第一链为模板进行RT-PCR,扩增条件均为:95 ℃变性4 min;95 ℃ 30 s,54~56 ℃ 1 min,72 ℃ 40 s,37个循环;72 ℃延伸10 min。扩增体系为50 μL:1 μL模板(10 ng·μL-1),1 μL上游引物(10 pmol·μL-1),1 μL下游引物(10 pmol·μL-1),4 μL dNTP (10 mmol·L-1,pH8.0),1 μL Taq酶(4 U·μL-1),5 μL 10×PCR Buffer (Mg2+),37 μL ddH2O。扩增产物效果见图 1。
| 引物Primer | 序列Sequence 5’-3’ |
| PPARαF | GCTCCGATGGGTCTGTTAT |
| PPARαR | GGTGAGGATTTCCGCTTT |
| COXⅡF | CATGAAGTTTGATCCAGAGCTG |
| COXⅡR | CTGAATGACTCAACAAACTGGG |
| PGC-1αF | GTGTCACCACCCAAATCCTTA |
| PGC-1αR | ATTCTTCCCTCTTCAGCCTCT |
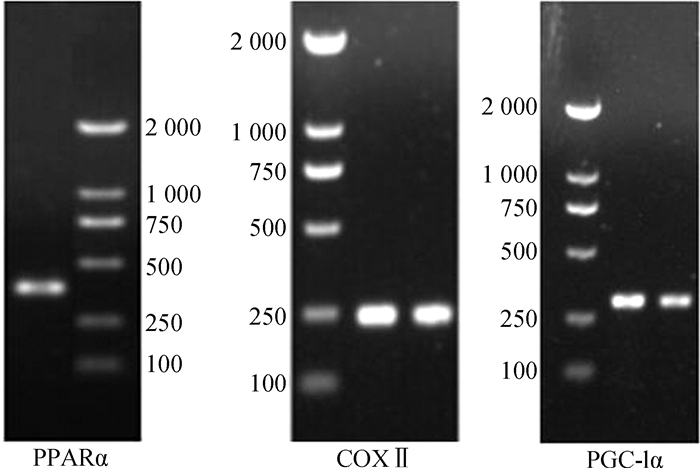
|
| 图 1 中缅树鼩PPARα、COXⅡ、PGC-1α的PCR扩增电泳图 Fig. 1 PCR electrophoresis of PPARα, COXⅡ and PGC-1α in Tupaia belangeri |
| |
模板cDNA用ABI-7000TM实时荧光PCR仪进行扩增,同时检测荧光信号。FQ-PCR反应体系依照SYBR Green Realmaster Mix试剂盒说明进行配制。反应体系为20 μL:9 μL SYBR Green Realmaster Mix,0.5 μL F引物(12.5 μmol·L-1),0.5 μL R引物(12.5 μmol·L-1),0.5 μL cDNA模板,9.5 μL RNase ddH2O。扩增条件为第一步94 ℃ 2 min,第二步94 ℃ 15 s,第三步60 ℃ 35 s,第二步到第三步重复37个循环。1个基因的每个样本均进行3次实时荧光定量平行重复,采用的数据为3次平行测定结果的平均值(朱万龙等,2014)。内参基因引物F:5’-GAGAGGGAAATCGTGCGTGAC-3’;引物R:5’-CATCTGCTGGAAGGTGGACA-3’。
1.3.5 2-ΔΔCT相对定量法目的基因的转录表达水平采用2-ΔΔCT相对定量法进行计算,用内参基因作均一化处理,ΔΔCT=(CT目的基因-CT内参基因)处理组-(CT目的基因-CT内参基因)对照组,2-ΔΔCT可反映出用内参基因均一化处理后,该样本目的基因的初始模板量相对于对照样本的表达倍数(差异)(Livak & Schmittgen,2001;Crott et al., 2007;Ornatowska et al., 2007)。对于对照组样本,ΔΔCT=0,2-ΔΔCT=1。而对于冷驯化组样本,若2-ΔΔCT>,说明该基因表达上调;若2-ΔΔCT<1,说明该基因表达下调。
1.4 统计分析实验数据的统计分析采用SPSS 16.0处理。采用独立样本t检验对不同组中WAT、BAT质量和相关脂肪转化因子表达量的差异进行处理。结果以平均值±标准误(Mean±SE)表示,其中P<0.05表示差异有统计学意义,P<0.01表示差异有高度统计学意义。
2 结果实验前,对照组和冷驯化组中缅树鼩的体质量分别为103.56 g±2.32 g和102.89 g±3.02 g,2组体质量差异无统计学意义(P>0.05)。冷驯化28 d后,2组脂肪组织质量差异有高度统计学意义(BAT:t=-6.92,P<0.01,图 2;WAT:t=-5.56,P<0.01,图 3),冷驯化组显著高于对照组,其中BAT质量为冷驯化组较对照组升高了85.71%,WAT质量则增加了14.14%。

|
| 图 2 冷驯化对中缅树鼩褐色脂肪组织质量的影响 Fig. 2 Effect of cold acclimation on brown adipose tissue mass in Tupaia belangeri ** P<0.01;下同The same below. |
| |
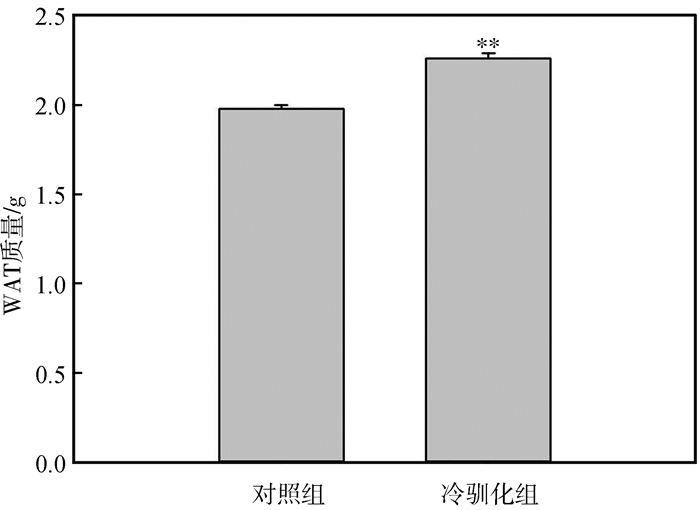
|
| 图 3 冷驯化对中缅树鼩白色脂肪组织质量的影响 Fig. 3 Effect of cold acclimation on white adipose tissue mass in Tupaia belangeri |
| |
冷驯化28 d后,中缅树鼩PPARα、COXⅡ和PGC-1α基因表达量显著高于对照组(PPARα:t=-6.36,P<0.01,图 4:A;COXⅡ:t=-7.44,P<0.01,图 4:B;PGC-1α:t=-2.87,P<0.01,图 4:C),其中冷驯化组PPARα、COXⅡ和PGC-1α基因表达量分别是对照组的7.68倍、5.65倍和9.98倍。
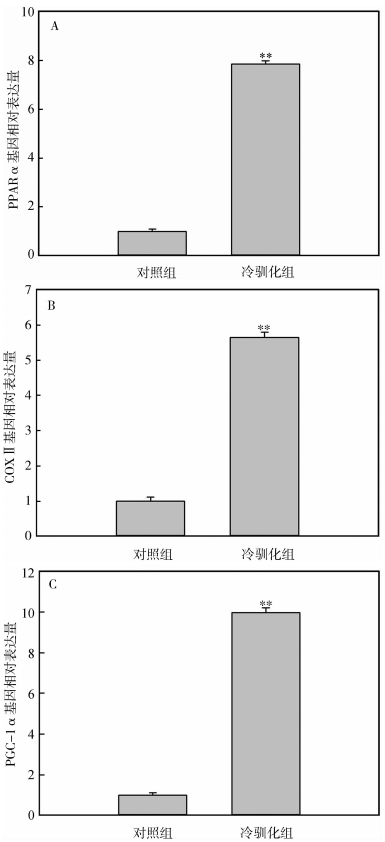
|
| 图 4 冷驯化对中缅树鼩PPARα(A)、COXⅡ(B)和PGC-1α(C)基因表达量的影响 Fig. 4 Effect of cold acclimation on PPARα (A), COXⅡ (B) and PGC-1α (C) expressions in Tupaia belangeri |
| |
栖息环境不同,小型哺乳动物在低温条件下的体质量变化模式也不同,有些动物体质量变化不明显,如小林姬鼠Apodemus sylvaticus(Klaus et al., 1988)和非洲刺毛鼠Acomys cahirinus(Khokhlova et al., 2001),而有些动物体质量增加,如环颈旅鼠Dicrostonyx groenlandicus和金黄仓鼠Mesocricetus auratus(Nagy & Negus,1993)。在本研究中,冷驯化组中缅树鼩大网膜WAT质量显著增加,和本研究组之前研究结果中中缅树鼩的体质量变化趋势一致,说明在冷驯化过程中,中缅树鼩体质量的增加可能和体内WAT质量的增加有关,当然,WAT的增加也和动物在该驯化条件下食物充足、不受限制有关(王政昆等,1995)。动物在低温条件下,一般会增加其产热能力来维持生存(Hayes & Chappell,1986)。本研究中,中缅树鼩在冷驯化条件下,BAT质量较对照组显著增加,说明中缅树鼩在该条件下增加BAT质量,从而增加UCP1的含量,最终增加非颤抖性产热来应对低温胁迫,这和本研究组先前的研究结果一致(Zhu et al., 2012)。BAT的质量增加可能是中缅树鼩自身在冷驯化条件下的BAT增生,还有可能是WAT褐变向BAT的转化而来。
脂肪转化因子PPARα、COXⅡ及PGC-1α在WAT向BAT的转变中具有重要作用(Madsen et al., 2010)。PPARα表达量的上调能诱导原代BAT细胞增生和UCP1的高表达(Barbera et al., 2001;Tong et al., 2005)。COXⅡ对于WAT中诱导形成BAT细胞是必需的,有研究表明WAT中诱导出现的BAT细胞中UCP1的表达依赖于COXⅡ(Madsen et al., 2010)。PGC-1α表达过高会使小鼠Mus musculus的WAT中具有UCP1阳性表达的BAT细胞增加(Puigserver et al., 1998)。本研究中,冷驯化28 d后,PPARα mRNA、COXⅡ mRNA及PGC-1α mRNA的基因表达量显著增加,这可能诱导了中缅树鼩WAT中BAT细胞的形成,或者使脂肪组织中UCP1含量增加,从而增加其在冷环境中的产热能力。
总之,中缅树鼩在冷驯化条件下通过增加脂肪转录因子的基因表达量,可能使得WAT细胞褐变增加UCP1表达量,促进了BAT细胞的分化和代谢,弥补中缅树鼩在冷环境中适应性产热的不足,以抵抗低温环境。
| 王政昆, 李庆芬, 孙儒泳. 1995. 中缅树鼩的非颤抖性产热及细胞呼吸特征[J]. 动物学研究, 16(3): 408–414. |
| 王政昆, 李庆芬, 孙儒泳. 1999. 光周期和温度对中缅树鼩产热能力的影响[J]. 动物学报, 45(3): 287–293. |
| 王政昆, 孙儒泳, 李庆芬. 1994. 中缅树鼩静止代谢率的研究[J]. 北京师范大学学报(自然科学版), 30(3): 408–414. |
| 张武先, 王政昆, 徐伟江. 2002. 冷驯化对中缅树鼩能量代谢的影响[J]. 兽类学报, 22(2): 123–129. |
| 章迪, 张浩, 朱万龙. 2014. 中缅树鼩PRDM16、BMP7、PPARα、COXⅡ及PGC-1α基因的扩增研究[J]. 生物过程, 4(3): 52–60. |
| 朱万龙, 蔡金红, 张麟, 等. 2014. 中缅树鼩体质量、血清瘦素和下丘脑神经肽表达量的季节性变化[J]. 生物学杂志, 31(3): 33–37. |
| 朱万龙, 王海, 贾婷, 等. 2008. 冷驯化对大绒鼠和高山姬鼠肝脏线粒体呼吸的影响[J]. 四川动物, 27(3): 371–377. |
| Barbera MJ, Schluter A, Pedraza N, et al. 2001. Peroxisome proliferator-activated receptor alpha activates transcription of the brown fat uncoupling protein-1 gene:a link between regulation of the thermogenic and lipid oxidation pathways in the brown fat cell[J]. Journal of Biological Chemistry, 276(2): 1486–1493. DOI:10.1074/jbc.M006246200 |
| Birerdinc A, Jarrar M, Stotish T, et al. 2013. Manipulating molecular switches in brown adipocytes and their precursors:a therapeutic potential[J]. Progress in Lipid Research, 52(1): 51–61. DOI:10.1016/j.plipres.2012.08.001 |
| Crott JW, Liu Z, Choi SW, et al. 2007. Folate depletion in human lymphocytes up-regulates p53 expression despite marked induction of strand breaks in exons 5-8 of the gene[J]. Mutation Research, 626(1-2): 171–179. DOI:10.1016/j.mrgentox.2006.10.001 |
| Cypess AM, Lehman S, Williams G, et al. 2009. Identification and importance of brown adipose tissue in adult humans[J]. The New England Journal of Medicine, 360(15): 1509–1517. DOI:10.1056/NEJMoa0810780 |
| Enerback S. 2010. Human brown adipose tissue[J]. Cell Metabolism, 11(4): 248–252. DOI:10.1016/j.cmet.2010.03.008 |
| Feder ME, Block BA. 1991. On the future of animal physiological ecology[J]. Functional Ecology, 5(2): 135–144. |
| Gesta S, Tseng YH, Kahn CR. 2007. Developmental origin of fat:tracking obesity to its source[J]. Cell, 131(2): 242–256. DOI:10.1016/j.cell.2007.10.004 |
| Hayes JP, Chappell MA. 1986. Effects of cold acclimation on maximum oxygen consumption during cold exposure and treadmill exercise in deer mice Peromyscus maniculatus[J]. Physiological Zoology, 59(4): 453–459. |
| Kawamichi T, Kawamichi M. 1979. Spatial organization and territory of three shrews (Tupaia glis)[J]. Animal Behavior, 27(2): 381–393. |
| Khokhlova I, Krasnov BR, Shenbrot GI, et al. 2001. Body mass and environment:a study in Negev rodents[J]. Israel Journal Zoology, 47(1): 1–13. |
| Klaus S, Heldmaier G, Ricquier D. 1988. Seasonal acclimation of bank voles and thermogenic properties of brown adipose tissue mitochondria[J]. Journal of Comparative Physiology B, 158(2): 157–164. DOI:10.1007/BF01075829 |
| Livak KJ, Schmittgen TD. 2001. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method[J]. Methods, 25(4): 402–408. DOI:10.1006/meth.2001.1262 |
| Madsen L, Pedersen LM, Lillefosse HH, et al. 2010. UCP1 induction during recruitment of brown adipocytes in white adipose tissue is dependent on cyclooxygenase activity[J]. PLoS ONE, 5(6): e11391. DOI:10.1371/journal.pone.0011391 |
| Nagy TR, Negus NC. 1993. Energy acquisition and allocation in male collared lemmings Dicrostonyx groenlandicus:effects of photoperiod, temperature, and diet quality[J]. Physiological Zoology, 66(4): 537–560. DOI:10.1086/physzool.66.4.30163807 |
| Olson LE, Sargis EJ, Martin RD. 2005. Intraordinal phylogenetics of tree shrews (Mammalia:Scandentia) based on evidence from the mitochondrial 12S rRNA gene[J]. Molecular Phylogenetics and Evolution, 35(3): 656–673. DOI:10.1016/j.ympev.2005.01.005 |
| Ornatowska M, Azim AC, Wang X, et al. 2007. Functional genomics of silencing TREM-1 on TLR4 signaling in macrophages[J]. American Journal of Physiology-Lung Cellular and Molecular Physiology, 37(6): L1377–L1384. |
| Puigserver P, Wu Z, Park CW, et al. 1998. A cold-inducible coactivator of nuclear receptors linked to adaptive thermogenesis[J]. Cell, 92(6): 829–839. DOI:10.1016/S0092-8674(00)81410-5 |
| Tong Y, Hara A, Komatsu M, et al. 2005. Suppression of expression of muscle-associated proteins by pparalpha in brown adipose tissue[J]. Biochemical and Biophysical Research Communication, 336(1): 76–83. DOI:10.1016/j.bbrc.2005.08.041 |
| van Marken Lichtenbelt WD, Vanhommerig JW, Smulders NM, et al. 2009. Cold-activated brown adipose tissue in healthy men[J]. The New England Journal of Medicine, 360(15): 1500–1508. DOI:10.1056/NEJMoa0808718 |
| Vegiopoulos A, Muller-Decker K, Strzoda D, et al. 2010. Cyclooxygenase-2 controls energy homeostasis in mice by de novo recruitment of brown adipocytes[J]. Science, 328(5982): 1158–1161. DOI:10.1126/science.1186034 |
| Voltura MB, Wunder BA. 1998. Effects of ambient temperature, diet quality, and food restriction on body composition dynamics of the prairie vole, Microtus ochrogaster[J]. Physiological Zoology, 71(3): 321–328. DOI:10.1086/515929 |
| Zhu WL, Jia T, Huang CM, et al. 2012. Changes of energy metabolism, thermogenesis and body mass in the tree shrew (Tupaia belangeri chinensis) during cold exposure[J]. Italian Journal of Zoology, 79(2): 175–181. DOI:10.1080/11250003.2011.650227 |
 2017, Vol. 36
2017, Vol. 36




