扩展功能
文章信息
- 党飞红, 余文华, 王晓云, 郭伟健, 庄卓升, 梅廷媛, 张秋萍, 李锋, 李玉春, 吴毅
- DANG Feihong, YU Wenhua, WANG Xiaoyun, GUO Weijian, ZHUANG Zhuosheng, MEI Tingyuan, ZHANG Qiuping, LI Feng, LI Yuchun, WU Yi
- 中国渡濑氏鼠耳蝠种名订正
- Taxonomic Clarification of Myotis rufoniger from China
- 四川动物, 2017, 36(1): 7-13
- Sichuan Journal of Zoology, 2017, 36(1): 7-13
- 10.11984/j.issn.1000-7083.20160214
-
文章历史
- 收稿日期: 2016-08-06
- 接受日期: 2016-11-16
2. 山东大学(威海)海洋学院, 山东威海 264209
2. Marine College, Shandong University (Weihai), Weihai, Shandong Province 264209, China
Chrysopteron (Jentink,1910)是Tate (1941)根据形态划分的7个鼠耳蝠亚属之一,也是迄今唯一得到分子系统发育学证据支持的亚属。虽然该亚属辨别特征明确,即翼膜均具有与彩蝠Kerivoula picta相似的黑褐色斑块,上颌门齿Ⅰ1和Ⅰ2具发达4裂结构(Tate,1941),但其属下种类设置一直混乱(Simmons,2005),存在大量的同物异名与种名误用问题。近期,Csorba等(2014)通过系统性分析Chrysopteron亚属内成员的形态特征与遗传差异完成了该亚属的物种厘定,并澄清了其分类学中的疑难。
传统认为,Chrysopteron亚属在中国区域存在2个有效种(王应祥,2003;Smith,解焱,2009),一类体毛鲜艳,呈金黄色到浅棕色,腹毛较浓,耳朵边缘有模糊的黑色,拇指和后肢为棕色,郑锡奇等(2010)将其划分为金黄鼠耳蝠Myotis formosus (Hodgson,1835),Jiang等(2010)则认为其为M. flavus (Shamel,1944);而另一类则全身赭红色,耳壳边缘、鼻端、前肢第一指及后脚之脚掌、五趾与爪、尾巴末端均带黑色,郑锡奇等(2010)认为该类群为渡濑氏鼠耳蝠M. rufoniger (Tomes,1858),而国内其余学者则将其划分为绯鼠耳蝠M. formosus (Hodgson,1835)(罗蓉,1993;刘颖等,2005;罗键,高红英,2006;江廷磊等,2007;余燕等,2010)。这种在种类鉴定与种名运用上的矛盾说明其物种分类设置仍存在问题,急需进行分类厘定工作。本研究以采自江西、广东的标本为研究对象,在充分收集整理文献的基础上,通过形态学与系统发育学方法对其进行物种厘定,现将结果报道如下。
1 材料与方法 1.1 标本采集2012-2014年利用蝙蝠竖琴网在广东省韶关市南岭国家森林公园(113°01′135″E,24°55′896″N,海拔1 016 m)﹑江西省井冈山国家级自然保护区(114°10′875″E,26°37′143″N,海拔777 m)和江西省萍乡市芦溪县羊狮幕(114°11′189″E,27°35′604″N,海拔407 m)分别捕获鼠耳蝠标本2只、6只和1只(均为雄性),编号为GZHU 12282、12294、13301、13320、13331、13538、13480、13481、14435,现均保存于广州大学华南生物多样性保护与利用重点实验室。
1.2 形态学度量与系统发育学分析按照哺乳动物测量标准(Bates & Harrison,1997;杨奇森等,2007),用电子天平称体质量(TANITA,精确到0.1 g),使用数显游标卡尺(成量电子数显游标卡尺,精确到0.01 mm)对标本的13项外形指标和15项头骨指标进行测量(表 1)。
| 项目 Item |
本研究This study (n=9) |
Csorba et al.,2014 | ||||
| Myotis formosus | Myotis rufoniger | |||||
| Mean±SD | Range | Mean±SD (n) | Range | Mean±SD (n) | Range | |
| 体质量Wt/g | 8.6±3.3 | 6.9~11.1 | - | - | - | - |
| 头体长HB/mm | 50.59±2.42 | 47.25~54.39 | - | - | - | - |
| 尾长TL/mm | 49.75±3.17 | 45.48~54.62 | - | - | - | - |
| 耳长E/mm | 16.44±1.46 | 14.75~19.07 | - | - | - | - |
| 后足长HF/mm | 10.73±0.54 | 9.81~11.69 | - | - | - | - |
| 前臂长FA/mm | 46.34±0.85 | 44.58~47.34 | 49.3±2.13 (12) | 45.5~53.0 | 49.0±2.46 (24) | 45.0~56.0 |
| 胫骨长Tib/mm | 23.25±1.04 | 21.76~24.43 | - | - | - | - |
| 颅全长GTL/mm | 17.59±0.23 | 17.16~17.82 | 18.62±0.46 (17) | 17.97~19.45 | 18.16±0.55 (26) | 16.98~19.24 |
| 颅基长CBL/mm | 16.34±0.30 | 15.93~16.81 | - | - | - | - |
| 枕犬长CCL/mm | 15.71±0.22 | 15.38~15.99 | 16.61±0.39 (18) | 15.85~17.30 | 16.29±0.58 (28) | 15.27~17.71 |
| 颧宽ZB/mm | 11.08±0.49 | 10.00~11.57 | 12.23±0.32 (16) | 11.76~12.94 | 11.30±0.45 (24) | 10.04~12.24 |
| 脑颅宽BB/mm | 8.02±0.17 | 7.78~8.27 | 8.61±0.23 (17) | 8.13~9.05 | 8.03±0.21 (29) | 7.61~8.03 |
| 脑颅高BH/mm | 6.12±0.16 | 5.88~6.34 | 6.50±0.24 (13) | 5.89~6.91 | 6.33±0.25 (22) | 6.00~7.16 |
| 腭桥长PL/mm | 8.02±0.58 | 7.24~9.00 | - | - | - | - |
| 眶间宽IOW/mm | 3.99±0.19 | 3.70~4.30 | 4.48±0.14 (19) | 4.00~4.66 | 4.08±0.13 (31) | 3.84~4.44 |
| 枕底宽BOW/mm | 1.90±0.16 | 1.69~2.15 | - | - | - | - |
| 乳突外宽WTB/mm | 8.95±0.27 | 8.41~9.28 | 9.33±0.22 (17) | 8.86~9.73 | 8.93±0.28 (26) | 8.37~9.34 |
| 上齿列长C1-M3/mm | 7.00±0.11 | 6.81~7.14 | 7.44±0.23 (18) | 6.92~7.90 | 7.54±0.29 (31) | 6.88~8.14 |
| 上犬齿宽C1-C1/mm | 4.72±0.10 | 4.60~4.90 | 5.31±0.20 (18) | 4.98~5.68 | 4.93±0.21 (31) | 4.37~5.37 |
| 上臼齿宽M3-M3/mm | 7.15±0.33 | 6.40~7.55 | 7.90±0.24 (14) | 7.45~8.22 | 7.15±0.24 (27) | 6.59~7.54 |
| 下齿列长C1-M3/mm | 7.42±0.20 | 7.15~7.77 | 7.96±0.24 (14) | 7.41~8.37 | 8.00±0.29 (27) | 7.50~8.66 |
| 下颌骨长ML/mm | 13.36±0.17 | 13.20~13.70 | 13.98±0.39 (15) | 13.18~14.53 | 13.77±0.55 (27) | 12.69~15.17 |
| 下颌骨高MH/mm | 3.47±0.45 | 2.50~3.90 | - | - | - | - |
基因组总DNA的提取方法如下:取约20 mg肌肉或肝脏组织,用TaKaRa MiniBEST Universal Genomic DNA Extraction Kit (TaKaRa)提取总DNA。线粒体细胞色素b(Cyt b)基因扩增引物为Cyt b-F:5'-AAATCACCGTTGTACTTCAAC-3'和Cyt b-R:5'-TAGAATATCAGCTTTGGGTG-3'(Li et al., 2006)。PCR反应总体系为30 μL:Premix Taq 15 μL,ddH2O 13.2 μL,引物各0.4 μL,模板DNA 1 μL。PCR反应程序:94 ℃预变性4 min;94 ℃ 45 s,46 ℃ 45 s,72 ℃ 60 s,35个循环;72 ℃延伸10 min,测序工作由上海美吉生物医药科技有限公司完成。
测序结果使用GENEIOUS 4.8.5(Drummond et al., 2011)人工校对,DNASP 5.10.01(Rozas et al., 2003)提取单倍型信息。从NCBI-nt数据库中下载Csorba等(2014)使用的Cyt b序列,将其与实验所得基因序列进行系统发育学分析,使用MUSCLE (Edgar,2004)比对排序,jModelTest v2(Posada,2008)选择最优核苷酸替代模型。后续的系统发育树构建使用GTR+I+G为进化模型,选择Kerivoula papillosa(EU188782)为外群。使用RAxML v7.2.7(Stamatakis et al., 2008)在CIPRES Science Gateway v3.1(Miller et al., 2010)中重建极似然树,自展500次估计节点支持度。使用MrBayes 3.0(Ronquist & Huelsenbeck,2003)重建贝叶斯树,以4条马尔可夫链搜寻较佳机率值的树形图,进行1 000万代的马尔可夫链运算,每1 000代抽样一次,舍弃前25%的后验概率树,分支节点的可信度以贝叶斯后验概率来佐证。对本研究中的渡濑氏鼠耳蝠序列使用TCS软件构建单倍型网络支系图,以明确其种下单倍型的亲缘关系。
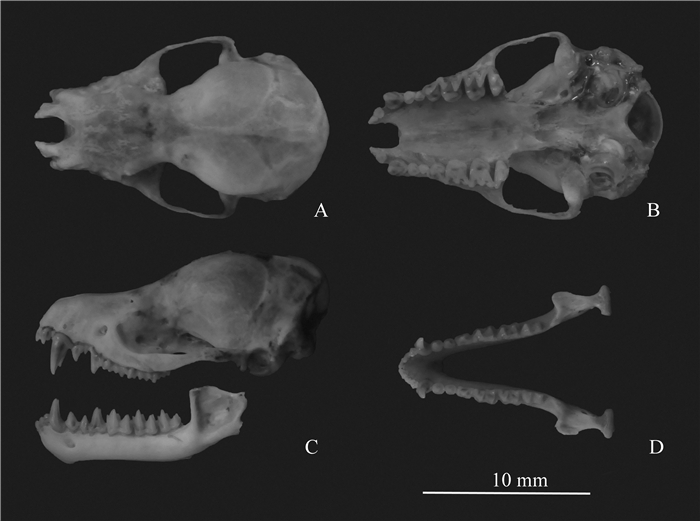
2 结果 2.1 形态学特征本研究中所收集的鼠耳蝠均为中等体型,体色艳丽,体毛橙棕色,翼膜起始于趾基部,尾膜起始于踝关节且呈褐色,掌间具三角形褐色大形斑块,翼膜背面沿上臂覆有短绒毛(图 1:A,C,D)。耳廓狭长,边缘略呈卵圆形,耳屏长且尖,具一小基叶;背毛长且呈橙褐色,毛基深褐色或近黑色,毛中浅黄色,毛端红褐色;腹面较背面色浅,与大部分翼膜同为鲜红褐色;耳廓端部边缘、五趾与爪、尾末端均呈黑色(图 1:A~D)。吻端较尖长,鼻孔边缘呈黑色(图 1:A)。体质量8.6 g±3.3 g,头体长50.59 mm±2.42 mm,前臂长46.34 mm±0.85 mm,尾长49.75 mm±3.17 mm (表 1)。头骨背面较平缓,颧弓发达,脑颅高而凸显(图 2:C)。上颌第3门齿小于第2门齿,犬齿发达,第1、2前臼齿较小,但第2前臼齿小于第1前臼齿且位于齿列内,下颌第2、3门齿均为4裂,齿式为2.1.3.3/3.1.3.3=38(图 2:B~D)。颅全长17.59 mm±0.23 mm,颅基长16.34 mm±0.30 mm (表 1)。从形态学特征与度量指标上,均与Tomes (1858)的M. rufoniger原始描述及Csorba等(2014)的渡濑氏鼠耳蝠M. rufoniger再描述相符。

|
| 图 1 雄性渡濑氏鼠耳蝠Myotis rufoniger外形特征(GZHU 13481) Fig. 1 The external characteristics of male Myotis rufoniger(GZHU 13481) A.头部侧面Lateral of head,B.背部毛色Dorsal pelage,C.背部与翼Dorsum and wings,D.足Hindfoot. |
| |
|
| 图 2 雄性渡濑氏鼠耳蝠Myotis rufoniger头骨形态特征(GZHU 13481) Fig. 2 Skull characteristics of male Myotis rufoniger(GZHU 13481) A.上颌背面Dorsal view of upper jaw,B.上颌腹面Ventral view of upper jaw,C.上、下颌侧面Lateral view of upper and under jaw,D.下颌Under jaw. |
| |
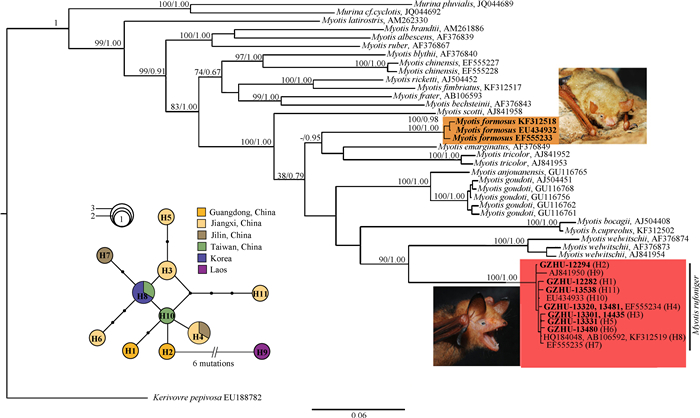
本研究所获得序列均与渡濑氏鼠耳蝠的基因库序列(如KF312519、EF555234、EF555235、AB106592、AJ841950、HQ184048)聚为高支持度的一支(自展值:100;后验概率:1.0),且与金黄鼠耳蝠并非姐妹群,二者亲缘关系较远(图 3)。渡濑氏鼠耳蝠的网络单倍型支系图结果显示:中国种群无显著遗传结构,与韩国种群混杂,但与老挝单倍型有较大的遗传差异(图 3)。
|
| 图 3 基于1 140 bp线粒体Cyt b基因构建的系统发生树及渡濑氏鼠耳蝠单倍型网络支系图 Fig. 3 The phylogenetic tree based on 1 140 bp of Cytochrome b gene of Myotis species and TCS network of Myotis rufoniger 红色方框代表渡濑氏鼠耳蝠,加粗字体部分指本项目的样本;橙色方框代表金黄鼠耳蝠。 Taxon in red box represents Myotis rufoniger, bold font part refers to the sample of this study; taxon in orange box represents Myotis formosus. |
| |
渡濑氏鼠耳蝠与绯鼠耳蝠均隶属于Chrysopteron亚属,但二者种类划分史一直混乱,导致了众多的分类疑难。Findley (1972)对M. flavus、M. formosus、M. hermani、M. rufoniger、M. rufopictus、M. welwitschii进行了形态比较,发现它们均很相似,将其划为一类,即formosus-group,但将这6个种归为M. formosus还是formosus-group并未表述清楚。其后,Honacki等(1982)在Findley (1972)的基础上将M. formosus与formosus-group归为同一种,引起了M. formosus和M. rufoniger种名使用的混乱。值得注意的是Tomes (1858)在Vesperlilio rufoniger定种时曾提出主要区分的特征在于耳缘呈黑色,背腹部毛尖呈亮红褐色(“ … ears edged with black,and dorsal and ventral hairs tipped with bright rufous … ”)。随后,Kuroda (1938)、Findley (1972)和Koopman (1994)把M. formosus作为M. rufoniger的同物异名导致二者种名使用更加混乱。这也直接影响到近期的相关研究:Kim等(2011)发表了采于韩国“M. formosus”(序列号为HQ184048)的线粒体全基因组,其与Kawai等(2003)的“M. formosus”和Jiang等(2010)的“M. watasei”的Cyt b序列吻合度为100%,但Jiang等(2010)的“M. watasei”在特征上明显与渡濑氏鼠耳蝠相符。此外,在Stadelmann等(2004)和Ruedi等(2013)的研究中均公布了“M. formosus”的序列,但在序列特征与遗传差异上均与本研究中的渡濑氏鼠耳蝠相近,且在系统发生树中聚为一支,该结果提示了“M. formosus”学名存在错用的情况。Francis等(1999)也暗示数据库中的“M. formosus”其实为渡濑氏鼠耳蝠。而Jiang等(2010)错将M. formosus(金黄鼠耳蝠)与渡濑氏鼠耳蝠(M. rufoniger)作为同物异名,尽管他们准确分辨出2种Chrysopteron亚属物种,但二者却被冠以错误的学名,他们将体型更大、毛色为黄色的标本辨认为“M. flavus”(实际应为“M. formosus”),而体型更小且毛色较红的标本鉴定为“M. formosus”(实际应为“M. rufoniger”)。近期,Csorba等(2014)对Chrysopteron亚属进行了细致的物种厘定,指出绯鼠耳蝠是一种体型中等,背毛为光亮黄褐色,耳朵边缘有隐约黑色,拇指和后足是棕色而非黑色的蝙蝠[“A medium-sized species of Chrysopteron. Individual dorsal hairs are mid-brown at base (approximately 10% of hair length),pale yellow distally for 80%-100% of hair length,or instead terminate inamid-brown tip slightly darker than the base. The general aspect of the dorsal fur is light yellow-brown. The ear is only faintly edged with black,and the thumb and hind foot are brown,not black.”];而渡濑氏鼠耳蝠则是耳廓边缘黑色,背腹部毛尖呈亮红褐色(“ears edged with black,and dorsal and ventral hairs tipped with bright rufous”)(Tomes,1858)。本研究中采自江西和广东的标本均为:背毛长,毛基深褐色或近黑色,毛中浅黄色,毛端红褐色;腹毛色较背面浅,翼膜大部分为红褐色,在其鼻尖、耳缘、拇指和爪均显著黑色,与Tomes (1858)所描述的渡濑氏鼠耳蝠相符,其外形与头骨指标也与Csorba等(2014)描述的渡濑氏鼠耳蝠数据相符。值得注意的是,国内不少文献描述的“绯鼠耳蝠M. formosus”均与渡濑氏鼠耳蝠特征相符合(罗蓉,1993;刘颖等,2005;罗键,高红英,2006;江廷磊等,2007;余燕等,2010),说明这些研究均误把“M. rufoniger”作为“M. formosus”了。在系统发育学上,该物种鉴定结果得到了系统树的支持,本实验所得的Cyt b序列均与渡濑氏鼠耳蝠NCBI中的基因序列(如KF312519、EF555234、EF555235、AB106592、AJ841950、HQ184048)聚为一支。而单倍型网络支系图显示:中国种群并非单系,其相互镶嵌的结构暗示这些区域的渡濑氏鼠耳蝠似乎源于一个大的混杂的祖先种群,或者种群间迄今仍存在基因交流。与渡濑氏鼠耳蝠不同,金黄鼠耳蝠M. formosus体毛鲜艳,呈金黄色到浅棕色(Dobson,1871),腹面较浓,虽耳朵边缘有模糊的黑色,但拇指和后肢为棕色,而非黑色,且在头骨指标上,其颧宽、眶间宽、上臼齿宽均略大于渡濑氏鼠耳蝠(图 2;表 1)。Shamel (1944)把来自台湾的M. flavus特征描述为“pale yellow bat”,并指出它比M. rufoniger和M. watasei的体型大。另外,Jiang等(2010)承认“M. flavus”和“M. rufoniger”是出现在台湾和亚洲大陆上的2个独立物种。综上所述,我们认为部分国内文献描述的“绯鼠耳蝠M. formosus”应为渡濑氏鼠耳蝠,其国内分布区可能包括:四川、贵州、广西、福建、浙江、江苏、安徽、上海、湖北、陕西、吉林、辽宁、重庆、江西、河南(董聿茂,1989;王岐山,1990;罗蓉,1993;张荣祖,1997;王应祥,2003;刘颖等,2005;罗键,高红英,2006;江廷磊等,2007;余燕等,2010),而金黄鼠耳蝠M. formosus目前在中国则呈间断式分布,仅在台湾和江西有分布记录。
值得注意的是,随着分子序列的指数式积累,物种鉴定问题也逐渐显现,尤其在采用分子方法进行物种鉴定的研究中,该问题更为严重。其中,Jiang等(2010)和Ruedi等(2013)所提供的“绯鼠耳蝠M. formosus”的Cyt b序列(AJ841950、EF555234、HQ184048、AB106592、EU434933、KF312519、EF555235)均为渡濑氏鼠耳蝠M. rufoniger的基因序列,Jiang等(2010)提供的M. flavus序列则真正属于M. formosus(EF555233、EU434932)。因此,如何确保数据库中物种鉴定序列信息的准确性,及序列信息出现问题后如何修正,这是数据库工作者与分类学研究者需要面对与解决的问题。
| 董聿茂. 1989. 浙江动物志(兽类)[M]. 杭州: 浙江科学科技出版社: 46-47. |
| 江廷磊, 冯江, 孙克萍, 等. 2007. 江西省翼手目新记录--绯鼠耳蝠[J]. 兽类学报, 27(2): 203–205. |
| 刘颖, 伦小文, 李振新, 等. 2005. 吉林省发现绯鼠耳蝠[J]. 动物学杂志, 40(1): 101–103. |
| 罗键, 高红英. 2006. 在重庆和辽宁发现绯鼠耳蝠Myotis formosus[J]. 四川动物, 25(1): 131–132. |
| 罗蓉. 1993. 贵州兽类志[M]. 贵阳: 贵州科技出版社: 116-117. |
| SmithAT, 解焱. 2009. 中国兽类野外手册[M]. 长沙: 湖南教育出版社: 335-349. |
| 王岐山. 1990. 安徽兽类志[M]. 合肥: 安徽科学技术出版社: 72-73. |
| 王应祥. 2003. 中国哺乳动物物种和亚种分类名录与分布大全[M]. 北京: 中国林业出版社: 43-44. |
| 杨奇森, 夏霖, 冯祚建, 等. 2007. 兽类头骨测量标准V:食虫目、翼手目[J]. 动物学杂志, 42(2): 56–62. |
| 余燕, 马金友, 牛红星. 2010. 河南省绯鼠耳蝠新纪录[J]. 四川动物, 29(2): 303–305. |
| 张荣祖. 1997. 中国哺乳动物分布[M]. 北京: 中国林业出版社: 23-55. |
| 郑锡奇, 方引平, 周政翰. 2010.台湾蝙蝠图鉴[M].台北:行政院农业委员会特有生物研究保育中心:76-79, 80-82. |
| Bates PJJ, Harrison DL. 1997. Bats of the Indian Subcontinent[M]. Kent, United Kingdom:Harrison Zoological Museum:204-205. |
| Csorba G, Chou CH, Ruedi M, et al. 2014. The reds and the yellows:a review of Asian Chrysopteron Jentink, 1910 (Chiroptera:Vespertilionidae:Myotis)[J]. Journal of Mammalogy, 95(4): 663–678. DOI:10.1644/13-MAMM-A-200 |
| Dobson GE. 1871. Notes on nine new species of Indian and Indo-Chinese Vespertilionidae, with remarks on the synonymy and classification of some other species of the same family[C]//Proceedings of the Asiatic Society of Bengal, 1871:213-215. |
| Drummond AJ, Ashton B, Buxton S, et al. 2011. Geneious v5.4[CP/OL].[2016-08-01]. http://www.geneious.com/. |
| Edgar RC. 2004. MUSCLE:multiple sequence alignment with high accuracy and high throughput[J]. Nucleic Acids Research, 32(5): 1792–1797. DOI:10.1093/nar/gkh340 |
| Findley JS. 1972. Phenetic relationships among bats of the genus Myotis[J]. Systematic Zoology, 21(1): 31–52. DOI:10.2307/2412256 |
| Francis CM, Guillen A, Robinson MF. 1999. Order Chiroptera:bats in wildlife in Lao PDR:1999 status report[M]. IUCN, Vientiane, Lao PDR:225-235. |
| Hodgson BH. 1835. Synopsis of the Vespertilionidae of Nipal[J]. Journal of the Asiatic Society of Bengal, 4: 699–701. |
| Honacki JH, Kinman KE, Koeppl JW. 1982. Mammal species of the world:a taxonomic and geographic reference[M]. Lawrence, Kansas:Allen Press, Inc. |
| Jentink FA. 1910. Chrysopteron Bartelsii, novum genus et nova species, from Java[J]. Notes from the Leyden Museum, 32(1): 73–77. |
| Jiang T, Sun K, Chou C, et al. 2010. First record of Myotis flavus (Chiroptera:Vespertilionidae) from mainland and China and a reassessment of its taxonomic status[J]. Zootaxa, 2414: 41–51. |
| Kawai K, Nikaido M, Harada M, et al. 2003. The status of the Japanese and East Asian bats of the genus Myotis (Vespertilionidae) based on mitochondrial sequences[J]. Molecular Phylogenetics and Evolution, 28(2): 297–307. DOI:10.1016/S1055-7903(03)00121-0 |
| Kim YM, Choi EH, Kim SK, et al. 2011. Complete mitochondrial genome of the Hodgson's bat Myotis formosus (Mammalia, Chiroptera:Vespertilionidae)[J]. Mitochondrial DNA, 22(4): 71–73. DOI:10.3109/19401736.2011.624598 |
| Koopman KF. 1994. Chiroptera:systematics[M]//Niethammer J, Schliemann H, Starck D. Handbuch der Zoologie 60. Berlin, Germany:Walter De Gruyter. |
| Kuroda N. 1938. A list of the Japanese mammals[M]. Tokyo, Japan: published by the author. |
| Li G, Jones G, Stephen JR, et al. 2006. Phylogenetics of small horseshoe bats from East Asia based on mitochondrial DNA sequence variation[J]. Journal of Mammalogy, 87(6): 1234–1240. DOI:10.1644/05-MAMM-A-395R2.1 |
| Miller MA, Pfeiffer W, Schwartz T. 2010. Creating the CIPRES Science Gateway for inference of large phylogenetic trees[C]//Proceedings of the Gateway Computing Environments Workshop (GCE). IEEE, 2010:1-8. http://www.oalib.com/references/5939947 |
| Posada DJ. 2008. Model test:phylogenetic model averaging[J]. Molecular Biology and Evolution, 25(7): 1253–1256. DOI:10.1093/molbev/msn083 |
| Ronquist F, Huelsenbeck JP. 2003. MrBayes 3:Bayesian phylogenetic inference under mixed models[J]. Bioinformatics, 19(12): 1572–1574. DOI:10.1093/bioinformatics/btg180 |
| Rozas J, Sánchez-Delbarrio JC, Messeguer X, et al. 2003. DnaSP, DNA polymorphism analyses by the coalescent and other methods[J]. Bioinformatics, 19(18): 2496–2497. DOI:10.1093/bioinformatics/btg359 |
| Ruedi M, Stadelmann B, Gager Y, et al. 2013. Molecular phylogenetic reconstructions identify East Asia as the cradle for the evolution of the cosmopolitan genus Myotis (Mammalia:Chiroptera)[J]. Molecular Phylogenetics and Evolution, 69(3): 437–449. DOI:10.1016/j.ympev.2013.08.011 |
| Shamel HH. 1944. A new Myotis from Formosa[J]. Journal of Mammalogy, 25(2): 191–192. DOI:10.2307/1375021 |
| Simmons NB. 2005. Order Chiroptera[M]//Wilson DE, Reeder DM. Mammal species of the world:a taxonomic and geographic reference 3rd ed. Baltimore, Maryland:Johns Hopkins University Press:312-529. |
| Stadelmann B, Herrera LG, Arroyo-Cabrales J, et al. 2004. Molecular systematics of the fishing bat Myotis (Pizonyx) vivesi[J]. Journal of Mammalogy, 85(1): 133–139. DOI:10.1644/1545-1542(2004)085<0133:MSOTFB>2.0.CO;2 |
| Stamatakis A, Hoover P, Rougemont J. 2008. A rapid bootstrap algorithm for the RAxML web servers[J]. Systematic Biology, 57(5): 758–771. DOI:10.1080/10635150802429642 |
| Tate GH, Archbold R. 1941. A review of the genus Myotis (Chiroptera) of Eurasia, with special reference to species occurring in the East Indies[M]. Bulletin of the American Museum of Natural History, 78:537-565. |
| Tomes RF. 1858. On the characters of four species of bat inhabiting Europe and Asia, and the description of a new species of Vespertilio inhabiting Madagascar[J]. Proceedings of the Zoological Society of London, 26(1): 78–90. DOI:10.1111/j.1469-7998.1858.tb06347.x |
 2017, Vol. 36
2017, Vol. 36




