扩展功能
文章信息
- 杨国坤, 关佳佳, 孙彩云, 王晓爱, 潘晓赋, 杨君兴, 李文笙
- YANG Guokun, GUAN Jiajia, SUN Caiyun, WANG Xiaoai, PAN Xiaofu, YANG Junxing, LI Wensheng
- 抚仙金线鲃促性腺激素亚基基因克隆及组织表达分析
- Gonadotropin Subunits cDNA Cloning and Tissue Expression in Sinocyclocheilus tingi
- 四川动物, 2016, 35(5): 686-690
- Sichuan Journal of Zoology, 2016, 35(5): 686-690
- 10.11984/j.issn.1000-7083.20160271
-
文章历史
- 收稿日期: 2015-09-08
- 接受日期: 2016-05-11
2. 遗传资源与进化国家重点实验室, 中国科学院昆明动物研究所, 昆明 650223
2. State Key Laboratory of Genetic Resources and Evolution, Kunming Institute of Zoology, Chinese Academy of Sciences, Kunming 650223, China
脊椎动物的生殖活动受脑-垂体-性腺轴调控,在此过程中,2种重要的促性腺激素(GTH)发挥着关键作用,分别为卵泡刺激素(FSH)和黄体生成素(LH)。这2种促性腺激素均为异源二聚体结构形式的糖蛋白,拥有同一种α亚基,并且通过非共价键分别与各自的FSHβ和LHβ结合,发挥着不同的生理功能(Gharib et al. ,1990)。大多数动物的促性腺激素都包含1个GTHα亚基、1个FSHβ或LHβ亚基,但在中华鲟Acipenser sinensis中却有2种GTHα亚基,分别为GTHαⅠ和GTHαⅡ(Cao et al., 2009)。促性腺激素各个亚基基因序列已经在多种鱼类中被确认,在鱼类的各个生长阶段和生殖循环过程中都有表达,并发挥着重要的生理功能(An et al., 2010)。在卵巢中,FSH和LH在早期卵巢的分化中起关键作用(An et al., 2010),LH可以促进卵泡成熟、排卵以及类固醇激素的合成,而在精子的发生及早期生殖系统的发育中,FSH可能起主要作用(Ando & Urano,2005;Guzman et al., 2009)。
抚仙金线鲃Sinocyclocheilus tingi属鲤形目Cypriniformes鲤科Cyprinidae金线鲃属Sinocyclocheilus,俗名波罗鱼,仅分布于云南省抚仙湖(杨君兴,陈银瑞,1995)。由于外来物种入侵和过度捕捞,抚仙金线鲃的种群数量急剧减少,现湖体种群数量稀少,仅有少量个体存活在沿湖的龙潭中(杨君兴,陈银瑞,1995;潘晓赋等,2009;王伟营等,2011)。目前对抚仙金线鲃的研究仅局限于人工繁殖和苗种培育技术(潘晓赋等,2009)、肌肉营养成分分析(赵亚鹏等,2013),其生殖系统方面的研究鲜有涉及,抚仙金线鲃人工繁殖中存在生殖系统紊乱的现象(Mylonas & Zohar,2007;Cabrita et al., 2009),不能实现塘养环境下的自然繁殖。本研究克隆抚仙金线鲃生殖关键基因GTHα、FSHβ以及LHβ的cDNA并分析它们在不同组织中的表达特性,为抚仙金线鲃繁殖生理的进一步研究提供基础数据。
1 材料和方法 1.1 材料实验用鱼由中国科学院昆明动物研究所珍稀鱼类保育研究基地提供,为人工繁殖的抚仙金线鲃,雌、雄鱼各3尾,体长12~15 cm,健康且性成熟。实验用鱼在光照、黑暗各12 h,循环水中驯养1周。本研究取样时间为7月,且雌鱼未排卵。实验时丁香酚麻醉后断头处死,迅速取出相应组织放入RNase free EP管中,并立即放于液氮,然后转至-80 ℃保存备用。
1.2 方法 1.2.1 RNA的提取和cDNA第一条链的合成利用Trizol法(Life Technologies)提取抚仙金线鲃垂体总RNA,利用超微量紫外检测仪(Nanodrop 2000C,Thermo Scientific)检测总RNA的浓度后,用M-MLV逆转录酶(Life Technologies)进行第一条链的合成,用内参基因β-actin,并用PCR Kit(东盛生物)做PCR验证第一条链合成质量,反应程序为94 ℃ 3 min; 94 ℃ 15 s,56 ℃ 15 s,72 ℃ 30 s,25个循环; 72 ℃ 5 min; 4 ℃保存。
1.2.2 GTHα、FSHβ和LHβ基因中间保守片段的克隆根据GenBank中鲤科鱼类斑马鱼Danio rerio、草鱼Ctenopharyngodon idella和青鱼Mylopharyngodon piceus相关基因的保守区域设计兼并引物(表 1),以验证过的垂体cDNA第一条链为模板,与各个基因设计好的兼并引物用Blend Taq-Plus(TOYOBO)扩增各个基因的中间保守片段,PCR反应程序为94 ℃ 3 min; 94 ℃ 30 s,56 ℃ 30 s,72 ℃ 30 s,35个循环; 72 ℃ 10 min; 4 ℃保存。PCR产物用E.Z.N.A胶回收试剂盒(OMEGA,Bio-Tek)回收后连接到PCR2.1载体(Invitrogen,Life Technologies)后克隆测序。
| 引物Primers | 序列Sequence (5’-3’) |
| The first fragment cloning of LH | |
| LH-ff-F1 | TRGWRAARGAVGGCTGTCC |
| LH-ff-R1 | AWSGTRCAGTCDGABGTGT |
| The first fragment cloning of FSH | |
| FSH-ff-F1 | GCTGTTGCCRGYGYTAATGAG |
| FSH-ff-R1 | GCTGAKARCWCCMCARTCTG |
| The first fragment cloning of GTH | |
| GTH-ff-F1 | ATGTTTTGGACAAGATAYGCTGRAG |
| GTH-ff-R1 | TTAAGAYTTRTGATAGTARCAGGTGC |
| 3’RACE of LH | |
| LH-3’-F1 | GAAGGAGGGCTGTCCAAAATGTCTG |
| LH-3’-F2 | TATCACTTACCCTGTGGCTCTC |
| 5’RACE of LH | |
| LH-5’-R1 | CATTTTGGACAGCCCTCCTTCTC |
| LH-5’-R2 | CCTGGAGGACAGTCTGGCAAG |
| LH-5’-R3 | TGGTAGACAGTAGAAAATGGG |
| 3’RACE of FSH | |
| FSH-3’-F1 | GTCGGCTCACCAATATCTCCAT |
| FSH-3’-F2 | AGTGTTTACCGTAGCCCAATG |
| 5’RACE of FSH | |
| FSH-5’-R1 | TGAGAGCACCCCAGTCTGTGATGTC |
| FSH-5’-R2 | CCATTCTTTGAAGTTACAGGTG |
| The ORF cloning of LH | |
| LH-ORF-F | ATGGGGACACCTGTCAAGATC |
| LH-ORF-R | CTAGTAAACAAGGAAATCCTCTC |
| The ORF cloning of FSH | |
| FSH-ORF-F | ATGAGGATGCGCTTCGTTGTTATGG |
| FSH-ORF-R | CTAATGTGCATTGCAGCTGAGTATC |
| The ORF cloning of GTH | |
| GTH-ORF-F | ATGTTTTGGACAAGATATGCTGGAG |
| GTH-ORF-R | TTAAGATTTATGATAGTAGCAGGTG |
| The quantitative of LH | |
| LH-qPCR-F | GAAGGAGGGCTGTCCAAAATGTCTG |
| LH-qPCR-R | AGGTGTCCATGGTGCACAGGCTG |
| The quantitative of FSH | |
| FSH-qPCR-F | CTTCGTTGTTATGGTGATGCTGTTG |
| FSH-qPCR-R | GCATCATTGGGCTACGGTAAACAC |
| The quantitative of GTH | |
| GTH-qPCR-F | GAATAACTTTGGATGTGAGGAG |
| GTH-qPCR-R | GTTTGACATCATTGACAAGCACC |
| Universal primers | |
| AUAP | GGCCACGCGTCGACTAGTAC |
| AAP | GGCCACGCGTCGACTAGTACGGGGGGGGGG |
| AP | GGCCACGCGTCGACTAGTAC(T)16 |
| β-actin | |
| actin-F | GGTATCGTGATGGACTCTGGTGA |
| actin-R | CAAAGTCAAGAGCCACATAGCAGAG |
用M-MLV逆转录酶进行第一条链合成,用于3’RACE的第一条链合成时用Oligo(dT)20做引物,而用于5’RACE第一条链合成时用AP做引物,并且用于5’RACE的模板第一条链合成后,产物用E.Z.N.A胶回收试剂盒回收,然后用加尾试剂盒(TaKaRa)加尾。根据测序得到的中间保守片段设计用于扩增3’和5’端的特异性引物并结合所需的接头引物AUAP和AAP(表 1),用Blend Taq-Plus进行3’RACE和5’RACE的扩增。5’RACE时第一轮以AAP和5’ -R1为引物,第二轮以AUAP和5’ -R2为引物;3’RACE时第一轮以AUAP和3’ -F1为引物,第二轮以AUAP和3’ -F2为引物,PCR反应程序为94 ℃ 3 min; 94 ℃ 30 s,54 ℃ 30 s,72 ℃ 1 min,35个循环; 72 ℃ 10 min; 4 ℃保存。PCR产物经回收、连接,克隆测序。
1.2.4 GTHα、FSHβ和LHβ基因的表达特性每尾鱼取14个组织,分别为垂体、下丘脑、脑(不含垂体和下丘脑)、脊髓、鳃、心脏、肝脏、胃、脂肪、肌肉、肾、头肾、脾脏和性腺(雄性为精巢,雌性为卵巢)。使用Trizol法提取各组织的RNA,每个样品取1 μg的总RNA用M-MLV逆转录酶进行cDNA的第一条链合成,用SYBR Green qPCR Mix(TOYOBO,Japan)以不同组织合成的第一条链cDNA稀释10倍后为模板,并以相应基因的定量引物为引物(表 1),β-actin为内参基因,进行实时荧光定量PCR。PCR反应程序为95 ℃ 1 min; 95 ℃ 15 s,56 ℃15 s,72 ℃ 30 s,40个循环。根据目的基因和内参基因的Ct值,使用比较Ct法计算目的基因的表达水平。
1.2.5 序列数据分析把测序得到的序列进行拼接,先用NCBI上ORF finder找到获得序列的开放阅读框;然后用SignalP 4.1 Server分析3种不同蛋白的信号肽(http://www.cbs.dtu.dk/services/SignalP/);使用SMART预测出3种蛋白的结构域(http://smart.embl-heidelberg.de/);使用Clustal Omega对不同物种的GTHα、FSHβ和LHβ的氨基酸序列作同源性分析(http://www.ebi.ac.uk/Tools/msa/clustalo/);使用NetNGlyc 1.0 Server找出3种蛋白的N-糖基化位点(http://www.cbs.dtu.dk/services/NetNGlyc/)。
2 结果 2.1 GTHα、FSHβ和LHβ基因的克隆及序列比对根据测序结果拼接后得到抚仙金线鲃GTHα、FSHβ和LHβ 3种基因的cDNA序列,GTHα(KU382238)基因开放阅读框长度为357 bp,编码118个氨基酸,其中第1~23位氨基酸为信号肽序列,第33~118位氨基酸为糖蛋白激素α结构域(GHA);FSHβ(KU382237)基因全长为856 bp,开放阅读框长度为393 bp,编码130个氨基酸,第1~19位氨基酸为信号肽序列,第21~128位氨基酸为糖蛋白激素β结构域(GHB),基因序列的815~820位点(AATAAA)为PolyA加尾信号;LHβ(KU382239)基因全长为930 bp,开放阅读框长度为441 bp,编码146个氨基酸,第1~27位氨基酸为信号肽序列,第31~137位氨基酸为糖蛋白激素β结构域(GHB),基因序列的815~820位点(AATAAA)为PolyA加尾信号。GTHα蛋白中有10个半胱氨酸残基和2个N-糖基化位点(-NIT-,-NHT-),FSHβ有11个半胱氨酸残基和1个N-糖基化位点(-NIS-),而LHβ有12个半胱氨酸残基和1个N-糖基化位点(-NET-)。氨基酸序列同源性比对发现,抚仙金线鲃的GTHα与其他鱼类的保守性较高,都在80%以上。除了与斑马鱼的同源性在75%左右以外,抚仙金线鲃的FSHβ和LHβ与其他鱼类的保守性同样较高(表 2)。
| 物种 | GTHα | FSHβ | LHβ |
| 抚仙金线鲃 Sinocyclocheilus tingi |
KU382238 100% |
KU382237 100% |
KU382239 100% |
| 鲤鱼 Cyprinus carpio |
X56497.1 98.31% |
AB003583.1 92.31% |
X59889.1 93.06% |
| 草鱼 Ctenopharyngodon idella |
EU095936.1 98.31% |
EF194762.1 86.82% |
EF565171.1 93.79% |
| 岩原鲤 Procypris rabaudi |
JX105891.1 97.46% |
JX105892.1 91.54% |
JX105893.1 97.26% |
| 鳙鱼 Hypophthalmichthysnobilis |
EU095937.1 97.46% |
EF552360.1 84.62% |
EF565164.1 93.15% |
| 鲫鱼 Carassius auratus |
AY800267.1 97.46% |
D88023.1 92.31% |
D88024.1 92.14% |
| 稀有鲫 Gobiocypris rarus |
JF340460.1 95.76% |
KC464360.1 90.77% |
KC464361.1 90.00% |
| 斑马鱼 Danio rerio |
AY522553.1 81.20% |
NM_205624.1 70.00% |
NM_205622.2 74.10% |
| 青鱼 Mylopharyngodon piceus |
— | AF319961.1 85.27% |
AF319960.1 93.53% |
| 齐口裂腹鱼 Schizothorax prenanti |
— | HM217217.1 90.77% |
HM217218.1 96.58% |
实时荧光定量PCR结果显示,GTHα、FSHβ和LHβ主要在垂体中表达,而GTHα和LHβ在雄鱼和雌鱼中的其他组织中表达量都非常低(图 1,图 3)。FSHβ在雄鱼和雌鱼的垂体中表达量最高。FSHβ在雌鱼脂肪和肌肉中也有少量的表达;FSHβ不仅在雄鱼脂肪和肌肉中有表达,而且在精巢、肝脏等组织中也有少量的表达(图 2)。
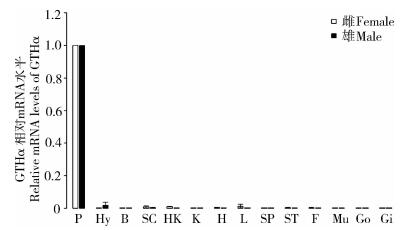
|
| 图 1 GTHα在抚仙金线鲃组织中的表达特性(平均值±标准误, n=3) Fig. 1 Tissue expression analysis of Sinocyclocheilus tingi GTHα by real-time PCR (Mean±SE, n=3) P.垂体,Hy.下丘脑,B.脑,SC.脊髓,HK.头肾,K.肾,H.心脏,L.肝脏,SP.脾脏,ST.胃,F.脂肪,Mu.肌肉,Go.性腺,Gi.鳃; 下图同。 P. pituitary, Hy. hypothalamus, B. brain, SC. spinal cord, HK. head kidney, K. kidney, H. heart, L. liver, SP. spleen, ST. stomach, F. fat, Mu. muscle, Go. gonad, Gi. gill; the same below. |
| |
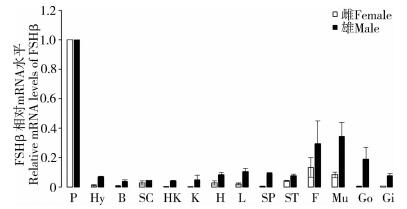
|
| 图 2 FSHβ在抚仙金线鲃组织中的表达特性(平均值±标准误, n=3) Fig. 2 Tissue expression analysis of Sinocyclocheilus tingi FSHβ by real-time PCR (Mean±SE, n=3) |
| |

|
| 图 3 LHβ在抚仙金线鲃组织中的表达特性(平均值±标准误, n=3) Fig. 3 Tissue expression analysis of Sinocyclocheilus tingi LHβ by real-time PCR (Mean±SE, n=3) |
| |
鱼类通过促性腺激素释放激素(gonadotropin-releasing hormone,GnRH)调节GTHs的合成与分泌,从而调节下游的性类固醇激素的合成与分泌,参与到下丘脑-垂体-性腺轴的生殖活动,FSH和LH在性成熟、精子发生和卵子发生以及排卵过程中发挥重要的作用。本文克隆得到抚仙金线鲃的GTHα、FSHβ和LHβ基因,经过序列比对发现,抚仙金线鲃GTHα与其他物种的同源性较高,而FSHβ和LHβ与其他物种的同源性较低,但相对而言,LHβ比FSHβ与其他物种的同源性高一些,这与草鱼的研究结果相似(Zhou et al., 2010)。抚仙金线鲃GTHα蛋白中有10个半胱氨酸残基和2个N-糖基化位点,并且在第58~87位氨基酸中有2对相邻的半胱氨酸和1个N-糖基化位点,这与真鲷Pagrosomus major的研究结果相似,推测可能跟受体的结合有关(Gen et al., 2000),在半滑舌鳎Cynoglossus semilaevis的研究中也发现类似的结构(Shi et al.,2015)。在抚仙金线鲃的FSHβ和LHβ的蛋白中分别有11个和12个半胱氨酸残基,这与南方鲇Silurus meridionalis(Wu et al., 2009)和中华鲟(Cao et al., 2009)相似。
抚仙金线鲃GTHα在雌鱼和雄鱼的垂体中表达,而在其他组织中的表达量非常低。这个结果与其他鱼类GTHα主要在垂体中表达的结果相似,然而有些鱼类GTHα除了在垂体中表达外,在其他组织中也有表达,例如斑马鱼(So et al., 2005)和半滑舌鳎(Shi et al., 2015)的脑、肾和肝脏中也有表达;南方鲇(Wu et al., 2009)和大西洋鳕Gadus morhua(Mittelholzer et al., 2009)卵巢中检测到有GTHα的表达。LHβ也主要在垂体中表达,而FSHβ除了在垂体中表达量最高外,在雌鱼和雄鱼的脂肪和肌肉中也有少量的表达,另外在雄鱼的精巢和肝脏中也有表达。对其他鱼类研究表明,FSHβ和LHβ虽然在垂体中表达量最高,在其他组织也有一定的表达,罗非鱼Oreochromis niloticus的脑(Parhar et al., 2003),斑马鱼的脑、肾、肝脏等(So et al., 2005),半滑舌鳎(Shi et al., 2015)、南方鲇(Wu et al., 2009)和大西洋鳕(Mittelholzer et al., 2009)的卵巢,慈鲷科Cichlidae鱼类的视前叶和下丘脑中也检测到FSHβ和LHβ的表达。由此可见,垂体以外的组织表达GTHs在鱼类中是一个普遍的现象。FSHβ在抚仙金线鲃垂体以外的组织中表达所起的作用需要进一步的实验进行探究。
本文克隆了抚仙金线鲃生殖调控中关键的3种基因GTHα、FSHβ和LHβ的序列,并对其进行了氨基酸序列分析,同时探索了3种基因在抚仙金线鲃不同组织中的表达特性,这为进一步研究GTHα、FSHβ和LHβ在抚仙金线鲃生殖调控的作用提供了基础数据。
| 潘晓赋, 刘淑伟, 李再云, 等. 2009. 抚仙金线鲃人工繁殖与鱼苗培育技术[J]. 动物学研究 , 30(4) : 463–467. |
| 王伟营, 杨君兴, 陈小勇. 2011. 云南境内南盘江水系鱼类种质资源现状及保护对策[J]. 水生态学杂志 , 32(5) : 19–29. |
| 杨君兴, 陈银瑞. 1995. 抚仙湖鱼类生物学和资源利用[M]. 昆明: 云南科技出版社 . |
| 赵亚鹏, 潘晓赋, 杨君兴, 等. 2013. 滇池金线鲃(Sinocyclocheilus grahami)与抚仙金线鲃(S. tingi)肌肉营养成分初步分析[J]. 动物学研究 , 34(6) : 636–639. |
| An KW, Lee J, Choi CY. 2010. Expression of three gonadotropin subunits and gonadotropin receptor mRNA during male-to-female sex change in the cinnamon clownfish, Amphiprion melanopus[J]. Comparative Biochemistry and Physiology, Part A: Molecular & Integrative Physiology , 156(4) : 407–415. |
| Ando H, Urano A. 2005. Molecular regulation of gonadotropin secretion by gonadotropin-releasing hormone in salmonid fishes[J]. Zoological Science , 22(4) : 379–389. DOI:10.2108/zsj.22.379 |
| Cabrita E, Robles V, Herraez P. 2009. Methods in reproductive aquaculture: marine and freshwater species[M]. Boca Raton: CRC Press . |
| Cao H, Zhou L, Zhang YZ, et al. 2009. Molecular characterization of Chinese sturgeon gonadotropins and cellular distribution in pituitaries of mature and immature individuals[J]. Molecular and Cellular Endocrinology , 303(1-2) : 34–42. DOI:10.1016/j.mce.2009.01.015 |
| Gen K, Okuzawa K, Senthilkumaran B, et al. 2000. Unique expression of gonadotropin-Ⅰ and -Ⅱ subunit genes in male and female red seabream (Pagrus major) during sexual maturation[J]. Biology of Reproduction , 63(1) : 308–319. DOI:10.1095/biolreprod63.1.308 |
| Gharib SD, Wierman ME, Shupnik MA, et al. 1990. Molecular biology of the pituitary gonadotropins[J]. Endocrine Reviews , 11(1) : 177–199. DOI:10.1210/edrv-11-1-177 |
| Guzman JM, Bayarri MJ, Ramos J, et al. 2009. Follicle stimulating hormone (FSH) and luteinizing hormone (LH) gene expression during larval development in Senegalese sole (Solea senegalensis)[J]. Comparative Biochemistry and Physiology, Part A: Molecular & Integrative Physiology , 154(1) : 37–43. |
| Mittelholzer C, Andersson E, Taranger GL, et al. 2009. Quantification of gonadotropin subunits GPalpha, FSHbeta, and LHbeta mRNA expression from Atlantic cod (Gadus morhua) throughout a reproductive cycle[J]. Comparative Biochemistry and Physiology, Part B:Biochemistry & Molecular Biology , 153(3) : 288–295. |
| Mylonas CC, Zohar Y. 2007. Promoting oocyte maturation, ovulation and spawning in farmed fish[M]//Babin PJ. The fish oocyte: from basic studies to biotechnological applications. Dordrecht:Springer Publishing Company, Inc: 437-474. |
| Shi B, Liu X, Xu Y, et al. 2015. Molecular characterization of three gonadotropin subunits and their expression patterns during ovarian maturation in Cynoglossus semilaevis[J]. International Journal of Molecular Sciences , 16(2) : 2767–2793. DOI:10.3390/ijms16022767 |
| So WK, Kwok HF, Ge W. 2005. Zebrafish gonadotropins and their receptors: Ⅱ. Cloning and characterization of zebrafish follicle-stimulating hormone and luteinizing hormone subunits-their spatial-temporal expression patterns and receptor specificity[J]. Biology of Reproduction , 72(6) : 1382–1396. DOI:10.1095/biolreprod.104.038216 |
| Wu F, Zhang X, Zhang W, et al. 2009. Expression of three gonadotropin subunits in Southern catfish gonad and their possible roles during early gonadal development[J]. Comparative Biochemistry and Physiology, Part A: Molecular & Integrative Physiology , 153(1) : 44–48. |
| Zhou Y, Niu Y, Tao M, et al. 2010. Molecular cloning, characterization and expression of FSH and LH beta subunits from grass carp (Ctenopharyngodon idella)[J]. Fish Physiology and Biochemistry , 36(2) : 213–221. DOI:10.1007/s10695-008-9223-4 |
 2016, Vol. 35
2016, Vol. 35




