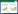扩展功能
文章信息
- 郭威, 厉萍, 杨焕超, 杜浩, 吴金明, 危起伟
- GUO Wei, LI Ping, YANG Huanchao, DU Hao, WU Jinming, WEI Qiwei
- 川陕哲罗鲑精子超微结构及形态学研究
- Study on the Morphology and Ultrastructure of Hucho bleekeri Kimura Spermatozoa
- 四川动物, 2016, 35(4): 550-555
- Sichuan Journal of Zoology, 2016, 35(4): 550-555
- 10.11984/j.issn.1000-7083.20160047
-
文章历史
- 收稿日期: 2016-03-07
- 接受日期: 2016-04-13
2. 中国科学院大学, 北京 100039;
3. 中国水产科学研究院长江水产研究所农业部淡水生物多样性保护重点实验室, 武汉 430223;
4. 华中农业大学水产学院, 武汉 430070
2. University of Chinese Academy of Sciences, Beijing 100039, China;
3. Key Laboratory of Freshwater Biodiversity Conservation, Ministry of Agriculture of China, Yangtze River Fisheries Research Institute, Chinese Academy of Fishery Sciences, Wuhan 430223, China;
4. Huazhong Agricultural University, Wuhan 430070, China
川陕哲罗鲑Hucho bleekeri Kimura隶属于鲑形目Salmoniformes鲑科Salmonidae哲罗鲑属Hucho。哲罗鲑属全世界现有5种,即多瑙河哲罗鲑H. hucho、远东哲罗鲑H. perryi、石川哲罗鲑H. ishikawae、太门哲罗鲑H. taimen和川陕哲罗鲑H. breekeri(董崇智等,1998)。其中,川陕哲罗鲑是我国特有种,又名贝氏哲罗鲑、虎嘉鱼、四川哲罗鲑、布氏哲罗鲑等,主要分布在29°N~ 33°N秦岭以南长江流域北侧一级支流岷江水系和汉江水系的上游山区激流环境中,是欧亚大陆鲑鳟鱼类中分布纬度最低的种类(丁瑞华等,2010)。
据鱼类学家分析,川陕哲罗鲑是第四纪冰川时期由北方扩散而来,冰河结束后在海拔较高、水温较低的河流中生存下来,并逐渐成为一个独立物种。作为气候变化历史上的一个有力物证,对动物地理学、鱼类系统发育以及气候变化等方面的研究具有较高的科研价值(申志新等,2005)。20世纪60年代以后,受环境恶化、过度捕捞等因素影响,川陕哲罗鲑野外资源量锐减,分布区域不断缩小,到20世纪80年代中期,其分布区域缩减至岷江干流上游、大渡河上游和青衣江上游(申志新等,2005),至20世纪末,野外数量已经极其稀少,仅在天全河上游、大渡河上游的足木足河及岷江上游的黑水河、陕西汉水支流的太白河和湑水河有少量发现(杨德国等,1999)。2012年,在陕西省太白县境内太白河中捕获川陕哲罗鲑成体19尾(杜浩等,2014)。由于野生资源的急剧下降,1988年被列为国家Ⅱ级重点保护野生动物,1998年被《中国濒危动物红皮书(鱼类)》列为濒危物种,2012年被世界自然保护联盟红色名录列为极危物种。
鱼类的精子外部形态以及内部结构常作为物种进化研究和分类学研究的工具,对于研究不同物种之间的亲缘关系具有重要的意义(Gwo,1995;Jamieson,1999)。硬骨鱼类的精子形态受其繁殖策略和分类地位等因素影响(Grier et al.,1978),其精子形态变化范围较大,大致可分为2种类型:Type Ⅰ和Type Ⅱ(Mattei,1970)。Type Ⅰ类型的精子具有能够转动的核,中心粒复合体位于核窝内且尾部对称分布;Type Ⅱ类型的精子没有核转动现象,中心粒复合体位于核窝外部且尾部不对称分布。由于硬骨鱼类的精子结构差异性较大,因此很难找到一个通用的模型对其进行概述(Mattei,1970)。大部分鱼类进行体外受精且精子具有尾部结构,而部分进行体内受精鱼类的精子则没有尾部结构(Jones & Butler,1988)。此外,精子形态对于研究污染物对细胞损伤和精子超低温冷冻等具有重要作用(Van Look & Kime,2003)。川陕哲罗鲑作为我国特有的濒危保护鱼类,对其繁殖生物学的研究却仍处于初级阶段。对其精子的超微结构和形态学开展研究,旨在丰富其生物学内容,为提高其人工繁殖的成功率提供参考数据。
1 材料方法 1.1 实验材料川陕哲罗鲑亲鱼于2014年4月采自陕西省宝鸡市太白县太白河镇的太白河中。在繁殖季节选取健康雄性亲鱼用MS222进行麻醉,用吸水纸擦干雄鱼生殖孔及其周围的水分、尿液以及其他杂质,由腹部向生殖孔方向轻轻挤压鱼腹部挤出精液,待挤出的精液为纯净的乳白色时,用干燥洁净的吸管吸取1.0 mL左右,转入2 mL干燥离心管,轻微离心(1 000 r·min-1,30 s)后加入2.5%戊二醛固定液,暂时放置于4 ℃恒温冰箱保存。扫描电子显微镜和透射电子显微镜样品的制备均在湖北省武汉市水生生物研究所分析测试中心进行。
1.2 扫描电镜的样品制备将采用2.5%戊二醛固定液固定的精子样品摇匀,均匀摊涂在载玻片上,在4 ℃冰箱中沉降24 h。然后用磷酸盐缓冲液(PBS)漂洗3次,每次10 min。用1%锇酸溶液固定90 min,随后用PBS漂洗,然后用梯度浓度分别为30%、50%、70%、80%、100%的乙醇溶液依次脱水,每个梯度浓度10 min,其中100%乙醇脱水重复1次。然后用50%乙酸异戊酯置换1次,100%乙酸异戊酯置换2次,每次10 min。再将样品放入二氧化碳临界点干燥器中干燥(XD-1,Eiko),然后用离子镀金仪(IB-3,Eiko)喷金镀膜,最后用扫描电子显微镜(Hitachi S-4800,Japan)观察拍照。
1.3 透射电镜样品制备将采用2.5%戊二醛固定液固定的精子样品用PBS漂洗3次,每次10 min。然后采用1%锇酸溶液4 ℃固定2 h。用PBS缓冲液冲洗3次,每次10 min。然后用梯度浓度分别为30%、50%、70%、80%、100%的乙醇溶液依次脱水,每个梯度浓度10 min,其中100%乙醇脱水重复1次。Epon812环氧树脂包埋,37 ℃、45 ℃、65 ℃温箱固化,每级固化24 h。然后用超薄切片机(UltracutE)切片,再用醋酸双氧铀硝酸铅染色。最后用透射电子显微镜(Hitachi HT-7700,Japan)进行观察拍照。
1.4 数据分析使用Olympics MicroImage Software(Version 4.0.1 for windows,Germany)对精子的各形态特征进行测量,并使用SPSS 20.0进行统计分析。分析结果以平均值±标准差表示。
2 结果与分析从形态学角度分析,川陕哲罗鲑的精子主要由3个部分组成:缺少顶体的头部、中片和尾部。头部主要由细胞核组成,无顶体结构(图 1:a);中片由袖 套结构和1个单独的线粒体组成(图 2:a,b);尾部呈细长形,主要由轴丝和质膜组成,可以分为2个部分:细长圆柱形的前端和侧扁形的末端(图 1:b)。 精子平均长度为41.07 μm±2.18 μm(n=35)(表 1)。

|
| 图 1 川陕哲罗鲑精子扫描电镜图 Fig. 1 Ultrastructure of Hucho bleekeri Kimura spermatozoa H.头部,MP.精子中片,F.尾部,TR.过渡区。 H.head,MP.mid-piece,F.flagellum,TR.transition region. |
| |

|
| 图 2 川陕哲罗鲑精子头部和中片扫描电镜图(a)和透射电镜图(b) Fig. 2 Ultrastructure of the head and mid-piece(a)and the longitudinal section(b)of Hucho bleekeri Kimura spermatozoa H.头部,MP.精子中片,F.尾部,M.线粒体,N.细胞核,CTC.中心粒复合体,CC.袖套腔,NF.核窝。 H.head,MP.mid-piece,F.flagellum,M.mitochondrion,N.nucleus,CTC.centriolar complex,CC.cytoplasmic canal,NF.nuclear fossa. |
| |
| 参数 | 变量(范围) | ||||
| 精子 | 总长/μm | ||||
| 41.07±2.1835 | |||||
| (30.71~45.74) | |||||
| 头部 | 长度/μm | 前端宽度/μm | 后端宽度/μm | ||
| 2.76±0.1546 | 1.88±0.1846 | 2.08±0.2046 | |||
| (2.37~3.10) | (1.48~2.32) | (1.56~2.52) | |||
| 中片 | 长度/μm | 宽度/μm | 线粒体直径/μm | 线粒体数目1 | |
| 0.56±0.116 | 0.81±0.1917 | 0.82±0.0821 | |||
| (0.35~0.70) | (0.37~1.02) | (0.44~0.91) | |||
| 尾部 | 长度/μm | 宽度/μm | 轴丝宽度/μm | 袖套腔宽度/nm | 桥型结构长度/nm |
| 34.74±5.0134 | 0.30±0.0761 | 0.17±0.0115 | 58.18±15.8013 | 15.03±0.3921 | |
| (24.22~43.3) | (0.18~0.50) | (0.15~0.18) | (40.55~77.24) | (14.75~16.42) | |
| 轴丝 | 外围双微管宽度/nm | 中央双微管宽度/nm | 径向轮辐长度/nm | 微管直径/nm | 轴丝类型9+2 |
| 49.56±3.1116 | 78.84±3.6012 | 31.44±13.1915 | 19.02±1.6231 | ||
| (45.89~54.92) | (76.31~82.64) | (27.90~45.12) | (16.42~0.96) | ||
精子头部平均长度 2.76 μm±0.15 μm(n=46)。头部前端宽度和后端宽度分别为1.88 μm± 0.18 μm(n=46)及2.08 μm±0.20 μm(n=46)(表 1)。精子头部被外层的质膜包裹,里面为细胞核。细胞核外包裹着1层核膜,由致密的颗粒状物质(染色质)组成,精子头部大部分被细胞核所占据。在精子头部下方,细胞质膜内陷形成了核窝,核窝包含精子尾部前端以及中心粒复合体。核窝的主要作用是将头部末端、中片以及精子尾部的前端有机地连接在一起。中心粒复合体由近端中心粒和远端中心粒组成,中心粒之间成直角状态相互紧贴在一起(图 2:b)。远端中心粒构成了精子尾部的初级结构。
精子中片较短,外部由袖套膜包被,构成袖套结构,袖套呈圆筒状,两侧对称(图 2:a)。中片平均长度为0.56 μm±0.10 μm(n=16),平均宽度为0.81 μm± 0.19 μm(n=17)(表 1)。靠近尾部的袖套外膜与细胞质膜相连,袖套内膜与尾部质膜相连,袖套腔的平均宽度为58.18 nm±15.80 nm(n=13)(表 1)。线粒体1个,呈不规则的圆球状,位于精子中片的一侧并与之紧贴,其平均直径为0.82 μm± 0.08 μm(n=21)(表 1)。线粒体的双层膜结构以及内嵴结构清晰可见(图 2:b)。
精子尾部起始于袖套腔底部,与远端中心粒相连,整体呈细长形,全长为34.74 μm±5.01 μm(n=34),平均直径为0.30 μm±0.07 μm(n=61)(表 1)。尾部可分为2个部分:前端呈细长的圆柱形,末端呈侧扁形,分界较为明显。尾部的主要结构为轴丝,宽度为 0.17 μm±0.01 μm(n=15)(表 1),外部包裹质膜(图 3)。在尾部,由向外伸展的质膜形成侧鳍结构,且呈不对称分布在轴丝两侧(图 4:a,b)。轴丝呈典型的“9+2”结构(图 3),由9组外围微管二联体和2组中央微管构成,中央微管的平均宽度为78.84 nm± 3.60 nm(n=12),外围微管二联体的平均宽度为49.56 nm ± 3.11 nm(n=16)(表 1)。中央微管之间由1个桥型结构连接(图 3),其平均宽度为 15.03 nm± 0.39 nm(n=21)(表 1)。微管直径较小,为19.02 nm±1.62 nm(n=31)(表 1)。径向轮辐位于外围微管和中央微管之间(图 3),其平均长度为31.44 nm±13.19 nm(n=15),在两者之间起连接作用(表 1)。
3 讨论本研究发现,川陕哲罗鲑精子主要由3个部分组成:头部、中片和尾部。精子头部无顶体结构,呈不规则的椭球形。无顶体结构的鱼类精子头部的形态差异较大,这种差异在鱼类分类学上有着重要的意义(Jamieson,1991;Mattei,1991;Van Look & Kime,2003)。很多种硬骨鱼类精子都没有顶体结构,例如比目鱼Scophthalmus maximus(Suquet et al.,1993)、罗非鱼Tilapia mossambica(Don & Avtalion,1993)。
精子缺少顶体结构这一特征是与卵细胞透明带上的受精孔协同进化的结果,精子通过受精孔,可以 进入到卵细胞完成受精过程(Medina et al.,2000)。 有研究表明,精子头部的尺寸与卵细胞上的受精孔的大小非常接近(Kim et al .,2011)。
|
| 图 3 川陕哲罗鲑精子尾部透射电镜图 Fig. 3 Ultrastructure of the longitudinal section of Hucho bleekeri Kimura spermatozoa flagellum A.轴丝,CM.细胞膜,F.尾部,B.桥型结构,PDM.外周双微管,CDM.中央双微管,9+2.轴丝结构,RS.径向轮辐。 A.aoneme,CM.cell membrane,F.flagellum,B.bridge,PDM.peripheral doublets of microtubules,CDM.central doublets of microtubules,9+2.axoneme pattern,RS.radial spoke. |
| |
川陕哲罗鲑精子头部为不规则的椭球形。细胞核外包裹着1层核膜,由致密的颗粒状物质(染色质)组成,精子头部大部分被细胞核所占据。在精子 头部下方,细胞质膜内陷形成了核窝。硬骨鱼类的精子头部形态差异也很大(Mattei,1991)。 Psenicka 等(2007)认为具有细长形头部的精子的发生过程更加复杂,其独特的头部结构是一种更加高级的形态。而且,精子的头部形态是否符合流体力学的特征,将会直接影响精子的运动能力和速率(Psenicka et al.,2007)。鲑科鱼类的精子头部大部分为椭球形(Lahnsteiner et al.,1991,1992;Gwo et al.,1996)。卵圆形头部的精子在其他硬骨鱼类中也有发现,例如,海鲷Sparus aurata(Maricchiolo et al.,2007)、白梭吻鲈Sander lucioperca(Kristan et al .,2014)以及金钱鱼Scatophagus argus(Madhavi et al.,2015)。核窝位于精子头部下方,长度大约是头部长度的三分之一。中心粒复合体的相对位置具有种间特异性,其相对位置差异性较大,从平行状态到垂直状态均有出现(Madhavi et al.,2015)。川陕哲罗鲑精子中心粒复合体位于核窝内,相对位置呈垂直状态。
|
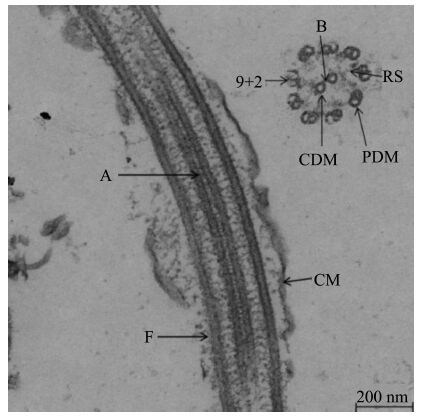
| 图 4 川陕哲罗鲑精子尾部扫描电镜图(a)和透射电镜图(b) Fig. 4 Ultrastructure(a)and the cross section(b)of Hucho bleekeri Kimura spermatozoa flagellum F.尾部,SF.侧鳍。 F.flagellum,SF.side-fins. |
| |
川陕哲罗鲑精子中片较短,外部由袖套膜包被,构成袖套结构,袖套呈圆筒状,两侧对称。透射电镜照片显示,位于中片一侧并与之紧贴有1个不规则圆球状的线粒体。精子中片的主要作用是连接精子头部与尾部,并为精子的运动提供能量。鲑科鱼类精子一般只有1个线粒体,如樱花钩吻鲑Oncorhynchus masou(Gwo et al.,1996)、河鳟Thymallus thymallus(Lahnsteiner et al.,1991)。线粒体数目在不同种、属的鱼类中不同,如金钱鱼精子有5~6个(Madhavi et al.,2015)、豹纹鳃棘鲈Plectropomus leopardus有5~6个(Gwo et al.,1994)、褐石斑鱼Epinephelus bruneus有6~9个(Kim et al.,2013)。在不同种、属的鲑科鱼类的精子中,线粒体的形状也存在差别。例如,河鳟精子的线粒体为螺旋形,而其他鲑科鱼类精子的线粒体大部分为圆球状或者圆柱状(Lahnsteiner et al.,1991;Gwo et al.,1996)。线粒体的主要作用是产生ATP,精子可以利用这些能量在水中快速游动从而进入到卵细胞中,以顺利完成受精作用(Billard et al.,2000)。因此,作为精子运动能量的来源,线粒体数目在精子活力和鱼类繁殖过程等方面的作用尤为重要(Lahnsteiner & Patzner,1995)。但是,也有研究表明,在某些鱼类中,精子中线粒体数目与精子的生存能力没有直接的关系(Lahnsteiner & Patzner,2008)。3种鲑亚科鱼类中,精子活力没有显著性差异(Lahnsteiner & Patzner,2008)。因此,精子线粒体数目与精子活力之间的关系并不是单一的,仍需要进一步的研究证明。除此之外,精子的速率以及持续时间也受到中片形状和大小的影响(Baccetti et al.,1984)。有研究表明,体内受精的鱼类精子中片结构比体外受精的鱼类更加复杂(Lahnsteiner et al.,1997)。川陕哲罗鲑精子中片较短小,且具有1个细长形的尾部,这有利于精子快速通过水环境进入卵细胞完成受精作用。
川陕哲罗鲑精子尾部较长,呈圆柱形,在尾部末端由1个短的过渡区域分成2个部分:前端呈细长的圆柱形,末端呈侧扁形。单一且细长的尾部在其他鲑科鱼类中都有出现,例如河鳟(Lahnsteiner et al.,1991)、樱花钩吻鲑(Gwo et al.,1996)、虹鳟O. mykiss和棕鳟Salmo trutta(Drokin et al.,1998)。具有单一的尾部且尾部垂直于头部细胞核的精子属于Type Ⅰ 类型(Mattei,1991)。本研究中川陕哲罗鲑精子具有类似的特征,因此属于TypeⅠ类型。TypeⅠ类型精子的尾部轴丝具有典型的“9+2”结构,这在硬骨鱼类中较为常见(Mattei,1991)。轴丝是尾部的基本骨架,在精子运动的过程中为尾部提供支撑(Gwo,1995)。精子之间存在竞争是被普遍认可的。精子的大小和外部形态与受精过程息息相关,决定着竞争的结果(Sailer et al .,1996;Hirai et al.,2001)。川陕哲罗鲑精子尾部较长,长度约是头部的12.5倍。有研究表明,在高强度的竞争环境中,细长形的精子能够更有效地利用能量,在受精过程中具有竞争优势,更容易完成受精(Oppliger et al.,2003)。研究发现,侧鳍结构并非是种间或属间的特异性结构,在很多种鱼类的精子尾部中均有出现,例如,樱花钩吻鲑(Gwo et al.,1996)、中华鲟Acipenser sinensis(Wei et al.,2007)、白梭吻鲈(Kristan et al .,2014)。以上几种鱼类精子中的侧鳍结构均呈对称分布,但是,川陕哲罗鲑精子的侧鳍结构呈不对称性分布。具有不对称性侧鳍结构的鱼类还包括虹鳟(谷伟等,2014)、白斑红点鲑Salvelinus leucomaenis(张永泉等,2011)、星突江鲽Platichthys stellatus(刘长琳等,2009)等。目前为止,侧鳍结构的功能仍不是十分清楚,不同的学者给出了不同的结论:Afzelius(1978)认为侧鳍结构与精子的受精率没有直接的关系;Stoss(1983)则认为侧鳍结构有可能提高精子的受精率。但可以肯定的是,它能够增加精子运动能力,对提高精子完成受精作用具有积极意义(Maricchiolo et al.,2004;Psenicka et al.,2007)。
致谢: 感谢中国科学院水生生物研究所电子显微镜实验室的技术人员在技术方面的支持! 2016, Vol. 35
2016, Vol. 35