扩展功能
文章信息
- 刘宁, 陈春山, 时晓, 杜迎春, 何宏轩
- LIU Ning, CHEN Chunshan, SHI Xiao, DU Yingchun, HE Hongxuan
- 细鳞鲑细菌性败血症病原菌的分离鉴定及药敏实验
- Isolation, Identification and Antimicrobial Sensitivity of Pathogen from Brachymystax lenok with Septicemia
- 四川动物, 2016, 35(3): 435-439
- Sichuan Journal of Zoology, 2016, 35(3): 435-439
- 10.11984/j.issn.1000-7083.20160018
-
文章历史
- 收稿日期: 2016-01-12
- 接受日期: 2016-04-13
2. 中国科学院动物研究所, 北京 100101
2. Institute of Zoology, Chinese Academy of Sciences, Beijing 100101, China
细鳞鲑Brachymystax lenok属鲑形目Salmoniformes鲑科Salmonidae细鳞鱼属Brachymystax,是我国名贵的陆封型冷水性珍稀鱼类(王所安,1989),具有重要的生态、科研和经济价值。近年来,由于生态环境恶化、人为干扰等因素的影响,细鳞鲑在我国的分布区域急剧缩小,种群数量锐减,1988年被列为国家Ⅱ级重点保护水生野生动物,并被《中国濒危动物红皮书》收录 (乐佩琦,陈宜瑜,1998)。
北京市水生野生动植物救护中心养殖的细鳞鲑出现鳍条、头部充血,眼球突出,死亡等现象。解剖后发现腹腔内有积水,肝脏有出血点。在无菌环境下,从死亡的21尾细鳞鲑体内分离得到一优势菌株,检测率为100%,并将该菌命名为SS-2。经生化鉴定、16S rDNA序列分析确定为嗜水气单胞菌Aeromonas hydrophila,用该菌感染健康细鳞鲑能够引起其腹鳍基部出血、体表溃疡等症状,与自然患病鱼体症状一致,确定其为致病菌。本研究对该菌株进行药敏实验,为细鳞鲑细菌性疾病的防控技术研究奠定了基础。
1 材料与方法 1.1 实验材料 1.1.1 实验对象患病细鳞鲑21尾,健康细鳞鲑24尾,体质量15~18 g,体长10~12 cm,均取自北京市水生野生动植物救护中心;阳性菌株嗜水气单胞菌取自中国科学院动物研究所野生动物疫病实验室菌库。
1.1.2 实验试剂与设备胰蛋白胨大豆琼脂(TSA)、营养肉汤培养基购自北京陆桥技术有限责任公司;PhoenixTM 100全自动细菌鉴定/药敏分析仪(美国BD公司);标准药敏试纸购自中国食品药品检定研究院;DNA Marker DL2000购自宝生物工程(大连)有限公司;2×Taq PCR Master Mix和琼脂糖凝胶回收试剂盒购自天根生化科技(北京)有限公司。室内全封闭循环过滤水族箱(长115 cm×宽60 cm×高50 cm)采用自动控温装置,水温控制在15 ℃±1 ℃。
1.1.3 引物合成采用细菌16S rDNA通用引物27F和1492R,引物序列为27F:5’-AGAGTTTGATCCTGGCTCAG-3’,1492R:5’-GGTTACCTTGTTACGA-CTT-3’,由北京六合华大基因科技股份有限公司合成。
1.2 实验方法 1.2.1 患病鱼体的剖检无菌条件下按照从外到内的原则,对具有典型病症的细鳞鲑进行临床检查。检查体表、鳃、内脏等有无病变。
1.2.2 细菌的分离、纯化无菌条件下,用接种环蘸取病灶、鳃、肝、脾等病变部位,采用划线法接种于TSA培养基上,28 ℃恒温培养18~24 h,观察细菌的生长状况及菌落特征,挑选形态、色泽一致的优势菌落进行纯化,反复纯化2次以获得单菌落,4 ℃冷藏备用。
1.2.3 细菌的生化鉴定首先对分离菌株SS-2进行革兰氏染色,根据染色结果选择相应的检测板(阳性板-PID或阴性板-NID),并在Phoenix肉汤试管上标记好样本号;其次,用无菌棉拭子蘸取分离菌株的新鲜纯培养物,置于Phoenix肉汤试管中混悬,盖上试管盖颠倒混匀(避免产生气泡),再用PhoenixSpec比浊仪将浊度调至0.5~0.6;最后,将接种物沿填充端口倒入51孔检测板中(确保每个孔都填满),盖上检测板密封盖并在30 min内上机检测,8~12 h读取检测结果。
1.2.4 16S rDNA基因扩增以分离纯化菌液、阳性对照菌液及阴性对照无菌肉汤作为模板,用50 μL反应体系进行PCR 扩增,其中引物浓度为10 μmol·L-1,反应体系为:上、下游引物各2 μL,纯化菌液2 μL,无菌水19 μL。PCR 反应条件设置为:94 ℃预变性5 min;94 ℃变性30 s,55℃退火30 s,72 ℃延伸45 s,30个循环;最后72 ℃延伸7 min。通过琼脂糖凝胶电泳对PCR产物进行检测,并对目的条带进行回收、测序。
1.2.5 人工感染实验选取健康细鳞鲑24尾,分别饲养在2个水循环控温水族箱内,实验前暂养14 d以适应环境。设实验组和对照组,每组12尾。根据相关资料(陈冬香,2010;朱成科等,2011;杨宁等,2014)和前期实验结果,按照平板计数法制成每毫升108 CFU的细菌悬液,通过背鳍基部注射方式进行感染,注射剂量为0.2 mL,对照组注射0.2 mL无菌肉汤。以15 d作为实验周期,期间每天观察受试细鳞鲑的活力、摄食、发病症状及死亡情况,并做好相关记录。最后,对感染发病细鳞鲑进行剖检、细菌分离、PCR鉴定,确定分离细菌的致病性。
1.2.6 药物敏感性实验选取26种抗菌药物,根据美国临床和实验室标准协会(CLSI)推荐的K-B琼脂法进行,将培养24 h的菌液均匀涂布于检测平板上,每个平板贴5张纸片,将平板倒置,28 ℃培养24 h,测量抑菌圈直径,药敏结果判定标准按照CLSI(2005)进行分析。
2 结果 2.1 病鱼的临床症状病鱼腹鳍、臀鳍基部及鳍条充血,肛门红肿突出;上下颌、鳃盖、眼眶周围等整个头部严重充血;腹腔内有积水,肝脏、肾脏等内脏器官颜色均较淡,且肝脏有出血点。
2.2 菌落的形态特征与理化特性分离菌株SS-2在TSA培养基28 ℃培养24 h,菌落长势良好,呈圆形光滑、边缘整齐、半透明或不透明,较隆起,未见水溶性棕色色素产生,有特殊气味。经革兰氏染色为阴性短杆菌(图 1)。PhoenixTM100全自动细菌鉴定系统结果显示分离菌株SS-2为嗜水气单胞菌Aeromonas hydrophila(表 1),结合各项生理生化指标与《伯杰氏细菌学手册》等材料中所列的嗜水气单胞菌基本吻合,仅在L-丙氨酸、赖氨酸脱羧酶反应、蔗糖和阿拉伯糖的利用上存在差异。因此,初步将分离菌株SS-2鉴定为嗜水气单胞菌。

|
| 图 1 分离菌株SS-2的菌落形态(a)、革兰氏染色(b) Fig. 1 Colony morphology (a) and gram-stain (b) of SS-2 strain |
| |
| 伯杰氏标准 | 分离菌株 | ||
| 项目 | 结果 | 项目 | 结果 |
| 7 ℃(水浴)营养液中生长 | + | 37 ℃(水浴)营养液中生长 | + |
| 在TSA培养基上有褐色色素 | - | 在TSA培养基上有褐色色素 | - |
| 铵离子和葡萄糖为唯一氮源和碳源 | + | 铵离子和葡萄糖为唯一氮源和碳源 | + |
| L-精氨酸 | + | L-精氨酸 | + |
| L-天门冬素 | + | L-天门冬素 | + |
| L-组氨酸 | + | L-组氨酸 | + |
| L-谷氨酸 | + | L-谷氨酸 | + |
| L-丝氨酸 | + | L-丝氨酸 | + |
| L-丙氨酸 | + | L-丙氨酸 | - |
| 7.5%NaCl营养液 | - | 7.5%NaCl营养液 | - |
| 由葡萄糖产气 | + | 由葡萄糖产气 | + |
| 0.1%色氨酸的移动液中产生吲哚 | + | 0.1%色氨酸的移动液中产生吲哚 | + |
| 由2.5%胨水中产生H2S | + | 由2.5%胨水中产生H2S | + |
| Voges-proskauer反应 | + | Voges-proskauer反应 | + |
| 葡糖酸盐氧化酶测定 | + | 葡糖酸盐氧化酶测定 | ND |
| 赖氨酸脱羧酶反应 | + | 赖氨酸脱羧酶反应 | - |
| 分解半乳糖 | + | 分解半乳糖 | + |
| 分解蔗糖 | + | 分解蔗糖 | - |
| 分解甘露醇 | + | 分解甘露醇 | + |
| 分解阿拉伯糖 | + | 分解阿拉伯糖 | - |
| 分解七叶苷 | + | 分解七叶苷 | + |
| +示阳性, -示阴性, ND示未检测到结果。 | |||
| + positive, - negative, ND indicates there is no response to the test. | |||
分离菌株SS-2扩增后的16S rDNA序列条带如图 2,其条带位置与阳性对照条带位置一致,为1 500 bp左右。将SS-2的16S rDNA序列递交NCBI进行BLAST比对分析,结果SS-2的基因序列与GenBank中的嗜水气单胞菌(KF578015.1)具有较高的同源性。这与PhoenixTM100全自动细菌鉴定系统鉴定的结果一致,即可确定分离菌株SS-2为嗜水气单胞菌。

|
| 图 2 分离菌株SS-2 16S rDNA PCR扩增结果 Fig. 2 PCR results of 16S rDNA of strain SS-2 M. D 2 000 Marker, 1. 阴性对照, 2. 嗜水气单胞菌SS-2, 3. 人工感染分离菌株, 4. 阳性对照。 M. D 2 000 Marker, 1. Negative control, 2. Aeromonas hydrophila SS-2, 3. Artificial infection strain, 4. Positive control. |
| |
实验组细鳞鲑1周内开始发病,初期病鱼游动迟缓、精神沉郁,离群独游,动作缓慢或阵发性急游;随着感染时间加长病鱼出现背部体色发黑,眼睛及其周围出血,腹鳍、臀鳍基部及肛门红肿、充血,有的个体背鳍基部溃疡;死亡个体鳃颜色变淡,腹部积水,肝脏、肾脏有出血点,与自然患病个体症状基本一致。发病及死亡数量随感染时间持续增加,至感染中期(第7~9天)累计发病8尾,其中累计死亡5尾,至第15天实验结束,发病率为100%,仅存活1尾(图 3)。此外,死亡现象多出现在实验中后期,死亡率高达91.67%。通过对死亡个体的细菌分离、纯化、PCR鉴定(图 2),再次得到嗜水气单胞菌。综合上述实验结果,嗜水气单胞菌是引起细鳞鲑发病的致病菌,由该致病菌引起的疾病症状符合细菌性败血症。注射无菌肉汤的对照组细鳞鲑进食及活动正常,未发病。
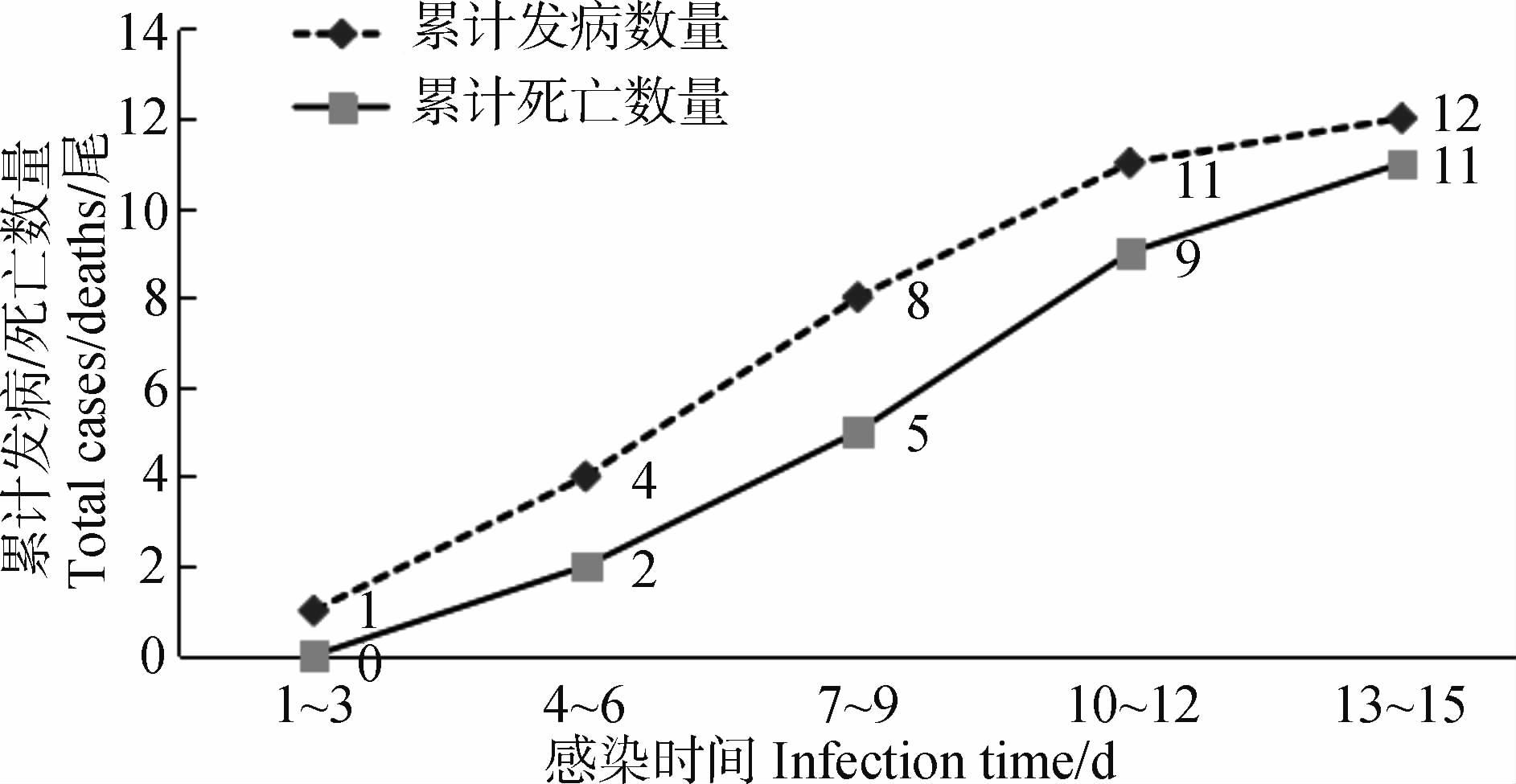
|
| 图 3 人工感染实验结果 Fig. 3 Result of artificial infection |
| |
在26种常用抗菌药物中,分离菌株SS-2对氨苄西林、头孢呋辛钠、卡那霉素等10种抗生素敏感; 对羧苄西林、头孢噻肟、环丙沙星、新霉素等9种抗生素中度敏感;对大观霉素、诺氟沙星、四环素等7种药物耐受(表 2)。
| 药物名称 | 药物含量/μg | 抑菌圈直径/mm | 药物敏感性 |
| 羧苄西林 Carbenicillin | 100 | 22.64 | I |
| 氨苄西林 Ampicillin | 10 | 23.19 | S |
| 头孢噻肟 Cefotaxime | 30 | 21.77 | I |
| 头孢噻吩 Cephalothin | 30 | 16.07 | I |
| 头孢西丁 Cefoxitin | 30 | 16.61 | I |
| 头孢曲松 Ceftriaxone | 30 | 20.37 | I |
| 头孢呋辛钠 Cefuroxime Sodium | 30 | 21.69 | S |
| 卡那霉素 Kanamycin | 30 | 21.56 | S |
| 妥布霉素 Tobramycin | 10 | 20.04 | S |
| 万古霉素 Vancomycin | 30 | 12.13 | R |
| 大观霉素 Spectinomycin | 100 | 0 | R |
| 阿奇霉素 Azithromycin | 15 | 26.24 | S |
| 新霉素 Neomycin | 30 | 21.16 | I |
| 红霉素 Erythromycin | 15 | 20.49 | I |
| 磷霉素 Fosfomycin | 200 | 22.32 | S |
| 阿米卡星 Amikacin | 30 | 23.52 | S |
| 奈替米星 Netilmicin | 30 | 24.41 | S |
| 呋喃妥因 Nitrofurantoin | 300 | 14.85 | I |
| 磺胺甲恶唑 Sulfamethoxazole | 300 | 25.4 | S |
| 甲氧苄啶 Trimethoprim | 25 | 22.33 | S |
| 诺氟沙星 Norfloxacin | 10 | 11.83 | R |
| 环丙沙星 Ciprofloxacin | 5 | 17.9 | I |
| 利福平Rifampin | 5 | 15 | R |
| 萘啶酸 Nalidixic Acid | 30 | 7.64 | R |
| 痢特灵 Furazolidone | 10 | 13.45 | R |
| 四环素 Tetracycline | 30 | 10.95 | R |
| R.耐药, I.中度敏感, S.敏感。 | |||
| R.drug resistance, I.moderately sensitive, S.sensitive. | |||
近年来,由于鱼类养殖密度增大、水质恶化等因素,各种细菌引起的疾病发病频繁,其中已报道的鱼类细菌性病原涉及气单胞菌属、弧菌属、假单胞菌、爱德华氏菌属等十几属的数十种 (殷站,徐伯亥,1995;杨兴丽,2001)。嗜水气单胞菌在有的资料中也记作亲水气单胞菌,是一种广泛存在于水体中可引起鱼类及其他水生动物多种病害的细菌。陈言峰等(2015)从宝石鲈Scortum barcoo体内分离出2株嗜水气单胞菌,病鱼表现为肝脏土黄色、肛门红肿、腹部膨胀有积水,鱼体表面溃烂部位少;梁利国和谢骏(2013)从青鱼Mylopharyngodon piceus体内分离出嗜水气单胞菌,病鱼表现为腹部肿胀、肛门红肿;此外,该菌也能引起草鱼Ctenopharyngodon idellus、黄鳝Monopterus albus、鲢鱼Hypophthalmichthys molitrix、鲤鱼Cyprinus carpio、泥鳅Misgurnus anguillicaudatus、鳗鱼、团头鲂Megalobrama amblgcephala等多种淡水养殖鱼类发生细菌性败血症,在不同的文献中也常根据病症将其称为暴发病、出血病、腹水病等(陈怀清,陆承平,1991;徐伯亥等,1993;张晓君等,2006;陈婷婷等,2014),此菌致死率极高。
本研究中细鳞鲑也出现类似败血症的症状,从发病鱼体内分离得到菌株SS-2,经过对其形态学、生理生化特征及16S rDNA基因序列分析,鉴定为嗜水气单胞菌。通过人工感染实验,进一步证实细鳞鲑腹鳍、臀鳍及眼睛充血或出血死亡等是由嗜水气单胞菌引起。通过药物敏感性实验发现,该菌株对26种药物中绝大多数符合《渔用药物使用准则》的抗菌药物具有敏感性(10种敏感,9种中度敏感),仅有7种药物表现出耐药性,耐药范围相对较小。因此,在对感染嗜水气单胞菌的细鳞鲑用药治疗过程中应注重药物的选取和用量,避免盲目用药。另外,人工感染实验表明,健康细鳞鲑从感染细菌到出现症状需1周左右时间,从发病到死亡也需1周左右的时间,在这一时间段内采取用药防治措施对治愈疾病、降低死亡率具有重要意义。
细鳞鲑是中华人民共和国农业部在东北、西北、华北地区进行生态修复增殖放流的珍稀鱼类,是近几年推广养殖的冷水鱼新品种,发病率很低。经过调研,近几年在黑龙江、吉林、陕西等地养殖场相继出现的苗种不明原因死亡现象,症状基本与本实验病鱼相同,由于细鳞鲑对药物敏感性较强,治疗效果不佳会造成一定经济损失。该致病菌的检出,提醒养殖单位要对细鳞鲑疾病预防引起高度重视。根据本实验结果,在细鳞鲑发病1周内,采取内服和水体消毒方法,可以取得较好的治疗效果,而且细鳞鲑对上述实验药物未产生应激反应。
 2016, Vol. 35
2016, Vol. 35




