扩展功能
文章信息
- 杨涛, 付家豪, 陈金龙, 叶芳艳, 左木林, 侯东敏, 朱万龙
- YANG Tao, FU Jiahao, CHEN Jinlong, YE Fangyan, ZUO Mulin, HOU Dongmin, ZHU Wanlong
- 季节性模拟对大绒鼠能量代谢的影响
- Effect of Seasonal Simulation on Energy Metabolism of Eothenomys miletus
- 四川动物, 2016, 35(3): 414-420
- Sichuan Journal of Zoology, 2016, 35(3): 414-420
- 10.11984/j.issn.1000-7083.20160013
-
文章历史
- 收稿日期: 2016-01-09
- 接受日期: 2016-04-13
2. 昆明市海口林场, 昆明 650114
2. Haikou Forest Farm of Kunming, Kunming 650114, China
环境温度对哺乳动物的分布特征有重要的影响(Abelenda,2003),小型哺乳动物的体温调节、能量消耗及分配在一定程度上反映了动物对环境温度变化的适应能力(Tomasi,Horton,1992)。在应对冬季冷环境的胁迫时,许多小型哺乳动物主要通过增加产热来维持体温恒定(Jansky,1973;Wunder,1984)。因此研究小型哺乳动物对环境温度变化的适应策略,对理解其生活史对策、生理适应和进化均具有重要意义(王政昆,孙儒泳,1994)。静止代谢率(resting metabolic rate,RMR)是指动物在清醒状态下维持正常生理活动的最低能量消耗水平,RMR的高低反映了不同物种或不同个体间的能量消耗水平(Degen,1997)。瘦素(leptin)是由白色脂肪组织分泌的一类蛋白质激素,在维持小型哺乳动物能量收支平衡方面起重要作用。研究表明:瘦素可能参与了动物的体质量和能量代谢的调节(Friedman,Halaas,1998)。反馈环假说认为动物体质量的平衡是受血清瘦素浓度影响的,同时血清瘦素浓度可以反映动物的体脂含量,研究表明瘦素浓度与体脂含量呈正相关关系(Friedman,Halaas,1998)。研究表明高原鼠兔Ochotona curzoniae的体质量、摄食量、血清瘦素浓度以及基础代谢率等存在季节性变化(Wang,2006),其中血清瘦素浓度与体质量和体脂含量呈正相关关系,与产热能力呈负相关关系。以上结果说明高原鼠兔在季节性变化条件下,瘦素可能作为脂肪信号参与了其体质量和能量代谢的适应性调节。
大绒鼠Eothenomys miletus主要栖息于高原山林地区,分布于我国横断山及其附近地区,是横断山脉地区的特有类群及典型代表(郑少华,1993)。横断山脉地处青藏高原东南部,是我国特有的高山峡谷地区,山脉南北走向,地势西高东低,海拔高度变化大,形成明显的气候过渡区,为动植物的生存提供了多样的栖息环境(吴征镒,王荷生,1985)。此外,该地区哺乳动物物种丰富,特有物种和古老物种比例高,被誉为"第四纪冰期动物的避难所"(张荣祖,1999)。相关研究表明:冷驯化49 d可以显著降低大绒鼠的体质量和体温,增加摄入能、消化能及代谢能,增加基础代谢率和非颤抖性产热,显著影响肝脏线粒体呼吸等,这些都说明在冷驯化条件下,大绒鼠会采取适当降低体质量和体温、增加产热等途径来维持能量代谢平衡(朱万龙等,2008)。加之横断山区年温差小,日温差大的特点,大绒鼠每天都需要经历高温和低温的胁迫,那么大绒鼠在短时期内的温度和光照的转换对其体质量和能量代谢是如何影响的还未知,因此本实验在之前的研究基础上,研究短期季节性模拟(由夏季转入冬季)对大绒鼠体质量调节和能量代谢的影响,通过对体质量、摄食量、RMR、血清瘦素浓度、体脂含量等相关指标进行测定,以阐明该物种对横断山区季节性环境变化的生存适应机制。
1 材料与方法 1.1 实验动物概况大绒鼠于2015年3—4月捕自昆明市呈贡县梁王山的灌木丛和农田中,带回云南师范大学生命科学学院(昆明)动物实验室,饲养于鼠盒内(长260 mm×宽160 mm×高150 mm);单只饲养,自然光照,每日喂以浸泡过的玉米,用塑料瓶供水。动物在实验室适应2周以后进行实验,分为实验组(季节模拟组)和对照组。实验动物均为非繁殖成年个体。实验组(n=14)在模拟夏季环境中(25 ℃,16L∶[8D)驯化14 d,之后转入模拟冬季环境中(5 ℃,8L∶16D)驯化8 d。对照组(n=8)在模拟夏季环境中(25 ℃,16L∶8D)驯化22 d。每2 d测定一次体质量和摄食量。22 d后2组动物均处死取血,测量血清瘦素浓度。
1.2 RMR测定在实验0 d、7 d、14 d、21 d和22 d用ADML870开放式呼吸仪(ADInstruments Pty Ltd,Australia)测定大绒鼠的RMR,计算方法见Hill(1972)。呼吸室体积为500 mL,进入呼吸室的气体流量为200 mL·min-1,温度控制在25 ℃±0.5 ℃,实验30 min前将动物放入呼吸室以适应呼吸室的环境,实验中测定1 h,每隔1 min记录一次数据,选取10个稳定连续的最低值来计算基础代谢率。
1.3 摄食量测定大绒鼠的摄食量采用食物平衡法测定(Drozdz,1975)。每2 d测定一次实验组和对照组体质量和摄食量,定时喂食(10∶00—11∶00),手工仔细分离剩余食物,置于65 ℃真空干燥箱干燥至恒重,称重(精确到0.01 g)。
1.4 血清瘦素浓度测定处死大绒鼠后取血,4 ℃静置1 h后,于4 ℃下以4 000 r·min-1离心30 min,吸取上层血清置于-80 ℃超低温冰箱内保存。血清送北京百泰克生物技术有限公司进行血清瘦素浓度的测定。
1.5 体脂含量和身体组成测定实验结束后解剖大绒鼠。分离出胃、小肠、大肠及盲肠,再小心去除肠系膜及其他组织,平展为最大长度,不要拉伸,测量其质量和长度(精确至0.1 cm),用解剖剪仔细将胃肠器官完全取出,并将其纵切,用生理盐水充分冲洗内容物,用滤纸吸干多余的生理盐水,称量鲜重。再分离出心脏、肝脏、脾脏、肺、肾脏等器官,置于烘箱内(60 ℃)烘至恒重,称量干重。体脂含量采用SoxtecTM2043型浸提仪(福斯中国有限公司)测定:将胴体置于烘箱内(60 ℃)烘至恒重,用小型粉碎机粉碎混匀,称取1~1.5 g样品进行测定。
1.6 统计分析实验数据采用SPSS 19.0进行分析,所有数据均符合正态分布。大绒鼠体质量、摄食量、RMR采用重复测量方差(repeated measures ANOVA)分析。实验组和对照组的体质量、摄食量、RMR、血清瘦素浓度和体脂含量的差异采用独立样本t检验分析。血清瘦素浓度与体脂含量的关系采用Pearson相关分析。结果以平均值±标准误表示,P<0.01为差异有高度统计学意义,P<0.05为差异有统计学意义。
2 结果 2.1 体质量经重复测量方差分析,实验组体质量变化差异有统计学意义(F=1.911,P<0.05),实验组体质量在16 d较对照组下降5.22%,18 d下降8.11%,实验组和对照组差异有统计学意义(t=2.658,P<0.05),而22 d后2组体质量差异有高度统计学意义(t=6.894,P<0.01,图 1),实验组较对照组下降12.54%。
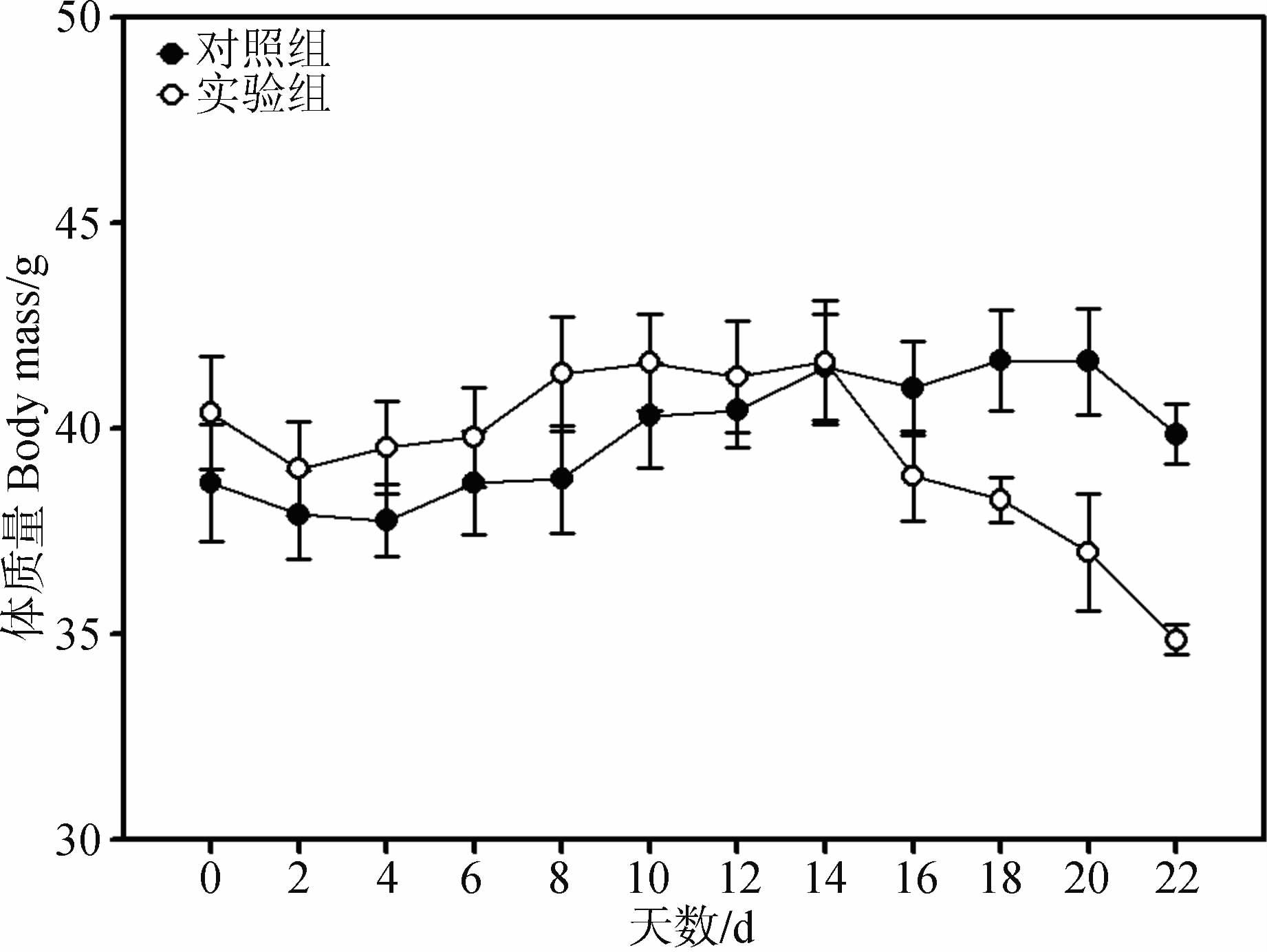
|
| 图 1 季节性模拟对大绒鼠体质量的影响 Fig. 1 Effect of seasonal simulation on body mass in Eothenomys miletus |
| |
经重复测量方差分析,对照组摄食量变化差异无统计学意义(F=0.345,P>0.05);实验组摄食量变化差异具有高度统计学意义(F=8.850,P<0.01);22 d后实验组摄食量在较对照组增加58.23%,差异具有高度统计学意义(t=-4.322,P<0.01,图 2)。

|
| 图 2 季节性模拟对大绒鼠摄食量的影响 Fig. 2 Effect of seasonal simulation on food intake of Eothenomys miletus |
| |
经重复测量方差分析,对照组RMR变化差异无统计学意义(F=0.502,P>0.05);实验组RMR变化差异具有高度统计学意义(F=9.969,P<0.01);实验组RMR较对照组增加82.22%,差异具有高度统计学意义(t=-6.652,P<0.01,图 3)。
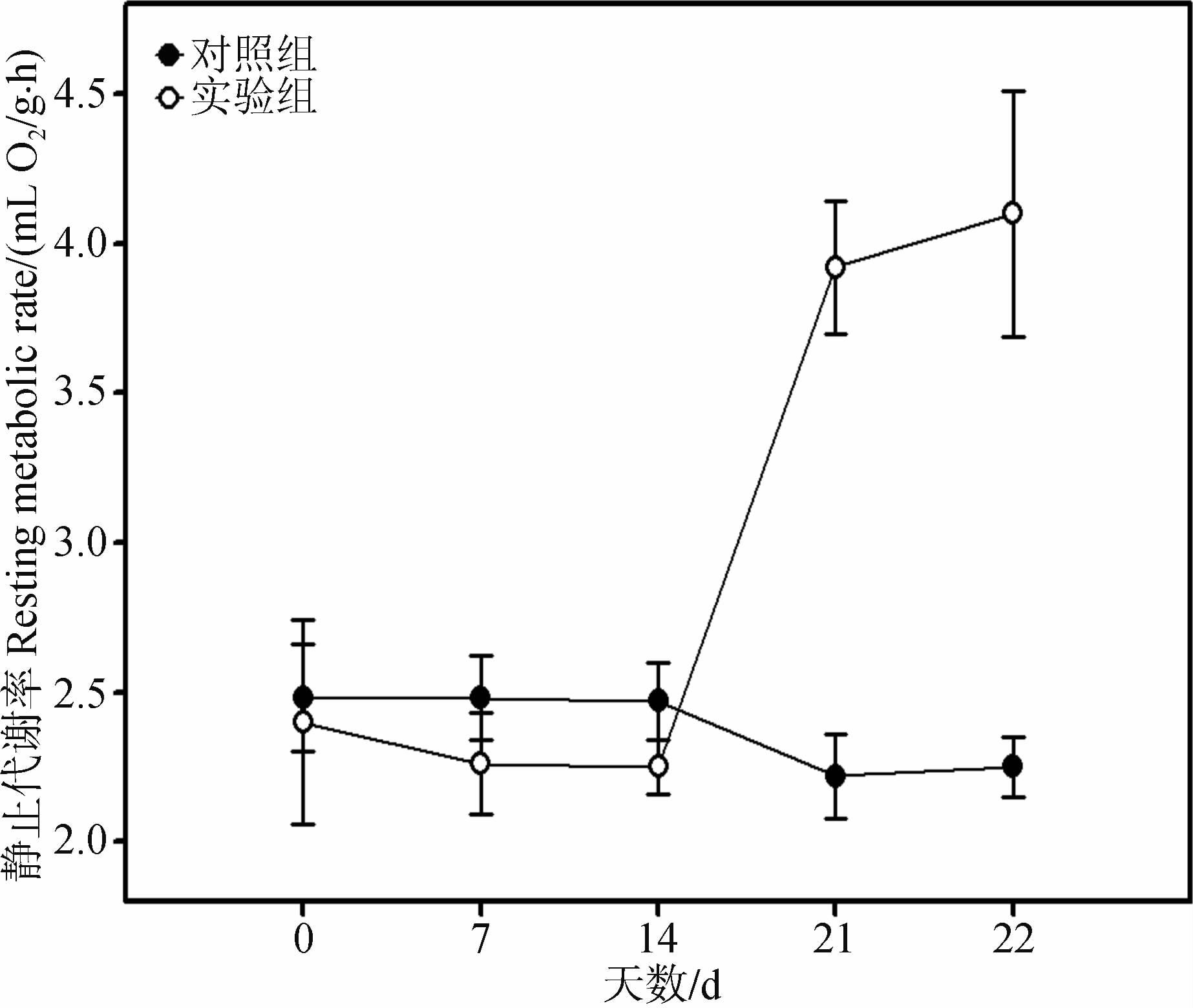
|
| 图 3 季节性模拟对大绒鼠静止代谢率的影响 Fig. 3 Effect of seasonal simulation on resting metabolic rate of Eothenomys miletus |
| |
22 d后实验组和对照组体脂含量差异有统计学意义(t=2.507,P<0.05),实验组体脂含量较对照组降低11.69%,血清瘦素浓度较对照组降低30.29%。相关性分析表明体脂含量和血清瘦素浓度呈显著正相关(r=0.512,P<0.05,图 4)。
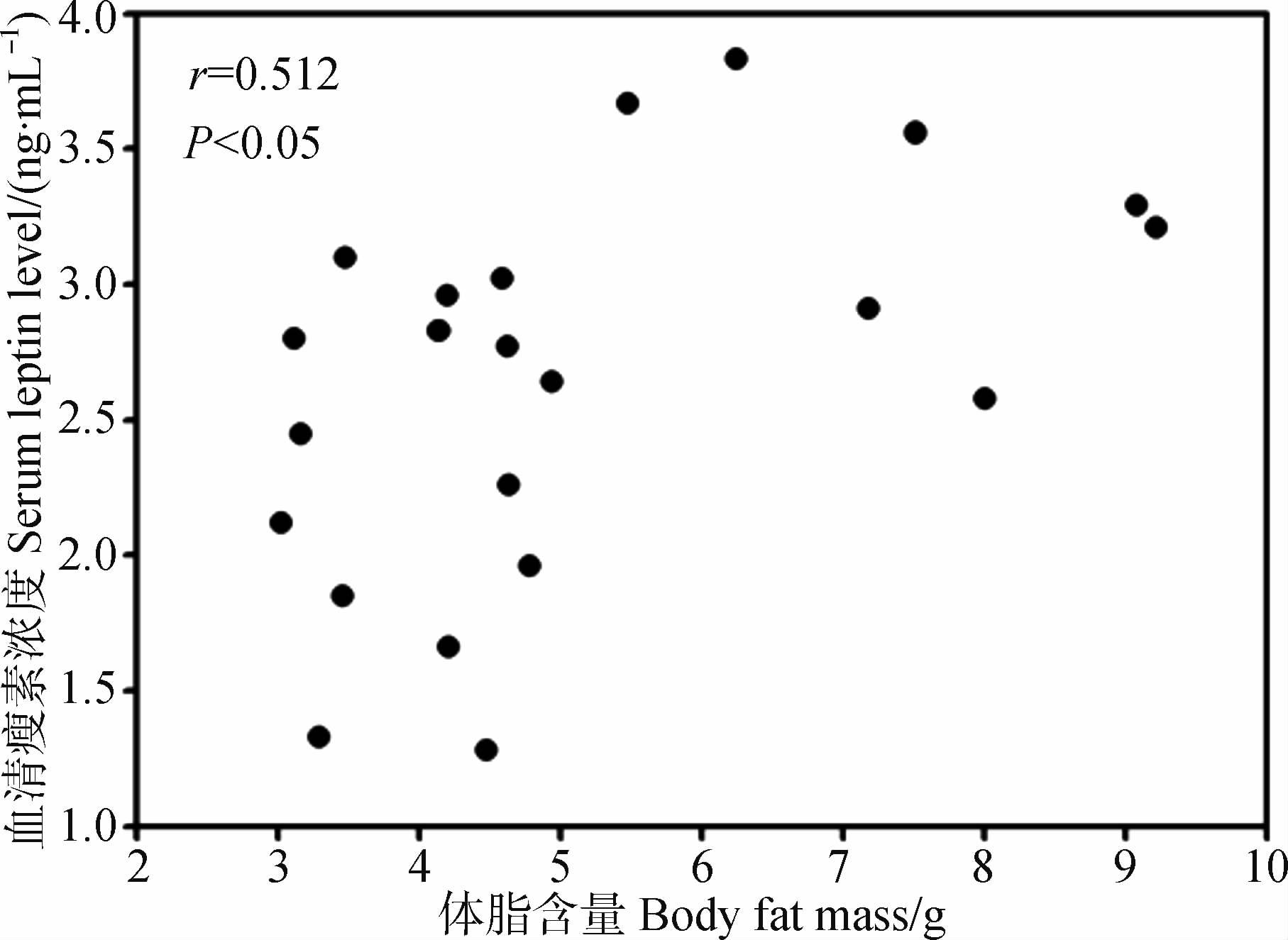
|
| 图 4 季节性模拟大绒鼠体脂含量与血清瘦素浓度的相关性 Fig. 4 Relationship between body fat mass and serum leptin level under seasonal simulation |
| |
季节性模拟对大绒鼠的胴体质量和肝脏质量有显著影响,其中实验组胴体质量较对照组下降7.51%,实验组肝脏质量较对照组增加11.04%(胴体质量:t=2.678,P<0.05;肝脏质量:t=-3.122,P<0.01,表 1)。22 d后2组小肠湿重差异有高度统计学意义(t=-4.947,P<0.01,表 2),实验组较对照组增加95.89%;2组大肠湿重差异有统计学意义(t=-2.796,P<0.05,表 2),实验组较对照组增加50.88%;2组盲肠湿重差异具有高度统计学意义(t=-3.621,P<0.01,表 2),实验组较对照组增加73.68%。
| 项目Items | 对照组 Control group | 实验组 Experiment group | t | P | |
| 胴体湿重Wet carcass mass/g | 32.48 ± 0.80 | 29.55 ± 0.74 | 2.678 | <0.05 | |
| 器官质量Organ mass/mg | 肝脏 Liver | 2 058.2 ± 112.1 | 2 843.1 ± 210.4 | -3.122 | <0.01 |
| 心脏 Heart | 263.6 ± 16.4 | 266.2 ± 16.4 | -0.108 | >0.05 | |
| 肺 Lung | 278.2 ± 17.5 | 266.9 ± 13.3 | 0.523 | >0.05 | |
| 脾 Spleen | 77.3 ± 6.0 | 80.0 ± 8.6 | -0.250 | >0.05 | |
| 肾 Kidneys | 440.0 ± 26.8 | 433.1 ± 24.6 | 0.190 | >0.05 | |
| 项目Items | 对照组Control group | 实验组 Experiment group | t | P | |
| 胃 Stomach | 长度Length/cm | 2.2 ± 0.1 | 2.5 ± 0.1 | -1.118 | >0.05 |
| 含内容物重Mass with content/mg | 1 086.4 ± 145.4 | 1 445.4 ± 202.9 | -1.390 | >0.05 | |
| 湿重Wet mass/mg | 190.9 ± 10.6 | 228.5 ± 15.8 | -1.899 | >0.05 | |
| 干重Dry mass/mg | 53.6 ± 3.6 | 113.8 ± 34.8 | -1.582 | >0.05 | |
| 小肠Small intestine | 长度Length/cm | 39.0 ± 0.8 | 37.8 ± 0.8 | 1.079 | >0.05 |
| 含内容物重Mass with content/mg | 1 420.0 ± 101.4 | 1 603.8 ± 91.5 | -1.348 | >0.05 | |
| 湿重Wet mass/mg | 132.7 ± 7.3 | 260.0 ± 24.7 | -4.589 | <0.01 | |
| 干重Dry mass/mg | 31.8 ± 10.3 | 57.7 ± 11.3 | -1.667 | >0.05 | |
| 大肠Large intestine | 长度Length/cm | 18.91 ± 0.80 | 18.51 ± 0.50 | 0.472 | >0.05 |
| 含内容物重Mass with content/mg | 514.5 ± 47.1 | 463.1 ± 47.3 | 0.765 | >0.05 | |
| 湿重Wet mass/mg | 150.9 ± 14.6 | 227.7 ± 23.3 | -2.676 | <0.05 | |
| 干重Dry mass/mg | 44.5 ± 15.2 | 46.9 ± 6.5 | -0.152 | >0.05 | |
| 盲肠 Caecum | 长度Length/cm | 15.5 ± 0.7 | 16.2 ± 0.6 | -0.853 | >0.05 |
| 含内容物重Mass with content/mg | 1 401.8 ± 152.2 | 1 846.9 ± 163.8 | -1.964 | >0.05 | |
| 湿重Wet mass/mg | 224.5 ± 21.4 | 390.0 ± 40.4 | -3.432 | <0.01 | |
| 干重Dry mass/mg | 28.2 ± 3.8 | 40.8 ± 8.4 | -1.373 | >0.05 | |
目前关于小型哺乳动物体质量季节性变化的研究很多,如对小型啮齿类动物的研究(Heldmaier,1982; Dark,Zucker,1986;Klingenspor,2000)。研究表明:在应对低温胁迫时,小型哺乳动物的体质量变化可以分为3种类型:第一种是小型哺乳动物通过降低体质量的方式来适应冷胁迫(Heldmaier,1989;Bartness,2002),降低体质量可以在食物缺乏和低温环境条件下减少能量的绝对消耗(Lovegrove,2005),如橙腹田鼠Microtus ochrogaster、草原田鼠Microtus pennsylvanicus(王德华,王祖望,1990;; Voltura,Wunder,1998)和小林姬鼠Apodemus sylvaticus(Corp,1999)等;第二种是小型哺乳动物通过增加体质量来适应冷环境,如环颈旅鼠Dicrostonys groenlandicus、黄金仓鼠Mesocricetus auratu( Nagy,Negus,1993)和中缅树鼩Tupaia belangeri(张武先,2002);第三种是小型哺乳动物的体质量没有明显的季节变化,如小林姬鼠(Corp,1999)、非洲刺毛鼠Acomy cahirinus(Klaus,1988)和长爪沙鼠Meriones unguiculatus(Khokhlova,2000)等。本实验中,大绒鼠在模拟夏季环境驯化的14 d中,实验组与对照组体质量保持相对稳定,实验组驯化14 d后迅速转入冬季模拟环境,其体质量迅速下降,22 d后实验组体质量与对照组差异具有高度统计学意义。大绒鼠体质量的变化与本研究组之前对大绒鼠进行冷驯化时体质量下降一致,也进一步证明了大绒鼠在应对冬季寒冷环境时反应时间较短,能及时通过降低体质量来适应冷环境,推测与其栖息环境密切相关。大绒鼠分布于横断山区,属典型的低纬度高海拔地区,大绒鼠每天都要经历高温和低温的胁迫,因此在转入模拟冬季的环境中,大绒鼠通过可降低体质量来适应环境的改变。
3.2 RMR和摄食量RMR是小型哺乳动物主要的能量消耗方式,在能量平衡调节中起重要作用(李兴升等,2004),受温度、食物、动物的活动性等因素的影响(Terblanche,2007)。能量的摄入、利用以及分配效率等对小型哺乳动物的生存具有重要的意义(Karasov,1986;Hambly & Speakman,2005)。在较长的时间内,动物能量的平衡取决于能量摄入与能量消耗的多少。因此生活在食物资源较差的环境中,动物一般会降低其能量需要和提高能量的利用率(Townsend,1987;Haim,1987;McNab,1989)。研究表明,许多小型哺乳动物的能量收支表现出明显的季节性变化(Mueller & Diamond,2001;Bartness,2002),如梅氏更格卢鼠Dipodomys merriami(Rousseau,2003)、壮沙鼠Meriones crassus和俾格米小沙鼠Gerbillus henleyi(Nagy & Gruchacz,1994)等。还有一些小型哺乳动物的能量收支没有明显的季节性变化,如丽色黄鼠Spermophilus saturatus(Degen,Khokhlova,1997)和博塔囊鼠Thomomys bottae等(Kenagy,1989)。在本实验中,实验组和对照组大绒鼠的RMR差异具有高度统计学意义,22 d后实验组RMR较对照组增加82.22%,说明大绒鼠在季节性转换的过程中需要增加产热来维持其基本的生命活动。实验组大绒鼠的摄食量在16 d后显著高于对照组,说明在由温暖转为低温的过程中,大绒鼠需要增加食物摄入量来弥补产热的增加,从而维持能量稳态(朱万龙等,2008)。
3.3 体脂含量和血清瘦素浓度体脂含量是反映动物营养状态的一个重要指标(Wang,2006)。当食物资源缺乏时,动物不能同化足够的能量来维持自身的能量需求,从而动用体内储存的能量来抵抗外界环境的胁迫(李兴升等,2004)。血清瘦素在小型哺乳动物的能量摄入和能量支出过程中起着重要的调节作用。血清瘦素浓度的水平可以反映体脂含量,并且能将该信号传递给大脑,以调节食物的摄入量和能量的消耗,并能抵抗肥胖(Campfield,1995; Friedman,Halaas,1998;Michael,2000)。肥胖小鼠血清瘦素浓度明显高于正常体质量的小鼠(Hervey,1959;Coleman,1978)。对加卡利亚仓鼠Phodopus sungoris sungoris而言,脂肪组织中瘦素基因的表达量在冬季明显减少,这可能说明低温可以抑制瘦素的分泌或瘦素基因的表达(Klingenspor,2000)。一般来说,血清瘦素浓度和体脂含量之间呈正相关(Nieminen & Hyvarinen,2000;Rousseau,2003)。在本实验中,对照组和实验组在22 d后体脂含量差异有统计学意义,说明在季节性转换的过程中,大绒鼠需要动用脂肪来弥补能量消耗的增加,降低体脂含量可能是大绒鼠适应低温环境的重要生理策略之一。此外,体脂含量和血清瘦素浓度呈显著正相关,说明瘦素可能参与了大绒鼠在该环境下的体质量调节。
3.4 内脏器官和消化道大绒鼠在季节性环境模拟的转化过程中,相关的代谢器官也发生了变化。作为产热最主要的器官之一,肝脏的变化是最明显的。在本实验中,季节模拟对大绒鼠的肝脏质量影响显著,说明在转入模拟冬季的环境中,大绒鼠通过增加肝脏质量以增加冷环境下的产热能力。同样,作为食物消化吸收的场所,动物消化道形态结构与食性、食物质量及能量需求等密切相关(柳鹏飞等,2010)。许多研究表明,消化道形态的改变在动物适应能量消耗增加或食物质量降低等方面占重要的地位(王蓓等,2009;蔡金红等,2010)。在本实验中,大绒鼠的小肠、大肠和盲肠湿重差异具有统计学意义或具有高度统计学意义,说明在季节转换过程中,大绒鼠通过加快对食物的消化来获取更多的能量。 综上所述,在模拟季节性变化的过程中,大绒鼠通过降低体质量、增加摄食量和产热来应对冷环境的胁迫。此外,瘦素在该过程中参与了大绒鼠的体质量调节。
 2016, Vol. 35
2016, Vol. 35




