扩展功能
文章信息
- 朱万龙, 陈金龙, 叶芳艳, 左木林, 张浩
- ZHU Wan-long, CHEN Jin-long, YE Fan-gyan, ZUO Mu-lin, ZHANG Hao
- 限食条件下下丘脑神经肽基因表达量对中缅树鼩体质量调节的影响
- Effects of Hypothalamic Neuropeptide Genes Expression on Body Mass Regulation of Tupaia belangeri under Food Restriction
- 四川动物, 2016, 35(3): 404-408
- Sichuan Journal of Zoology, 2016, 35(3): 404-408
- 10.11984/j.issn.1000-7083.20160002
-
文章历史
- 收稿日期: 2016-01-04
- 接受日期: 2016-01-30
2. 昆明市海口林场, 昆明 650114
2. Haikou Forest Farm of Kunming, Kunming 650114, China
生理和行为的可塑性对小型哺乳动物适应环境变化起着重要的作用(Vezina &Williams,2003)。已有研究表明:在长时间尺度上,动物器官的形态和功能与持续耗能有关,而在短时间尺度上与动物的有氧运动能力有关(Speakman &McQueenie,1996;Derting &Austin,1998)。在不可预测的自然环境中,食物资源的可利用性对于动物的生存至关重要(Liang&Zhang,2006),动物在环境改变(包括食物资源的改变)的条件下会调整自身的体质量、食物摄入量和能量支出,但是最近的研究表明食物摄入量对动物的体质量和能量平衡的影响是不一致的(Zhao&Cao,2009),如食物限制可以降低大鼠的体质量(Sucajtys-Szulc et al.,2008),但对小鼠的体质量却没有影响(Hambly&Speakman,2005),因此,在短时间尺度上研究食物资源的改变对于动物能量稳态的可塑性并不清楚。
瘦素对小型哺乳动物的能量摄入和能量支出有着重要的调节作用(Friedman&Halaas,1998)。许多研究表明瘦素与脂肪含量存在正相关关系( Zhu et al.,2011; Zhu et al.,2012)。此外,还有研究表明食物限制可以降低小型哺乳动物的血清瘦素浓度( Klingenspor et al.,2000; Rousseau et al.,2003)。下丘脑神经肽在限食条件下对于动物的生存也很重要。研究表明喂以高脂食物,可以使大鼠的神经肽Y(neuropeptide Y,NPY)表达量和体质量显著增加(Toshihiro &Akio,2001);长期的饥饿使大鼠下丘脑的NPY表达量增加(Sucajtys-Szulc et al.,2008);哺乳期的大鼠在限食条件下较自由取食组的NPY表达量显著增加(Abizaid et al.,1997)。长期的饥饿使得实验组绵羊的体质量、体脂含量显著下降,而刺鼠相关蛋白(agouti aelated peptide,AgRP)表达量则显著增加,阿片促黑色素原(pro-opiomelanocortin,POMC)和可卡因-安他非明转录调节肽(cocaine and amphetamine regulated transcript peptide,CART)表达量显著降低(Henry et al.,2001);在限食的条件下,肥胖型大鼠比健康型大鼠的AgRP表达量增加(Harrold et al.,1999);同时在食物短缺的条件下,西伯利亚仓鼠Phodopus sungorus会增加AgRP表达量以维持能量稳态(Mercer et al.,1999)。也有研究表明高脂食物可以显著增加大鼠的体质量、瘦素浓度和胰岛素含量,但对POMC表达量没有影响(Marco et al.,2013),而长期喂食高脂食物的大鼠,其后代的POMC表达量较对照组明显上调( Lukaszewski et al.,2013)。此外,禁食也可以使大鼠的CART表达下降( Tian et al.,2004)。48 h的饥饿使小鼠的CART表达下降,食欲增加(Yoo et al.,2011)。
中缅树鼩Tupaia belangeri为东洋界特有种。之前的研究表明,短期的禁食和重喂食可以改变中缅树鼩的体质量、瘦素浓度、产热能力和相关生化指标(Gao et al.,2014),中缅树鼩的体质量、能量代谢和下丘脑神经肽基因表达量具有季节性变化(朱万龙等,2014),低温会影响中缅树鼩的NPY、POMC和CART表达量(张浩等,2015)。因此,本研究在以上研究基础上从神经水平来探讨下丘脑神经肽基因是如何调节限食条件下中缅树鼩的体质量和能量代谢,同时阐明瘦素是如何作用于下丘脑神经肽基因。
1 材料与方法 1.1 动物来源中缅树鼩于2014年6月捕自云南省昆明市禄劝地区,捕捉后带回云南师范大学生命科学学院(昆明)动物饲养房单盒饲养,中度光照(12L∶12D),温度控制在25 ℃±1 ℃,自由取食和饮水。
1.2 动物处理所捕中缅树鼩为非繁殖期成年个体。选取18只(10♀,8♂)随机分为2组:对照组(n=8),自由取食和饮水;限食组(n=10),食物量为每日取食量的80%,自由饮水。25 ℃,12L∶12D条件下驯化4 周。第0天和第28天测定体质量和食物摄入量,28 d后处死,测定体脂含量、下丘脑神经肽基因表达量及血清瘦素浓度。实验前,对照组和限食组中缅树鼩的体质量差异无统计学意义(P>0.05)。
1.3 体脂含量的测定对照组和实验组中缅树鼩于实验28 d后处死。体脂含量用索氏抽提法(SoxtecTM 2043型浸提仪,福斯中国有限公司)测定(Gao et al.,2014)。去除尸体内脏,保留消化道上的脂肪,置于烘箱中至恒重(60 ℃),小型粉碎机将样品粉碎混匀,称取2 g左右用干燥滤纸包严、烘干、称重,此时的质量记为a,放入含50%~67%体积乙醚的抽提瓶中,滤纸包的高度低于虹吸管,水浴(70 ℃)加热、回流,乙醚回流次数控制在每小时120~150滴,回流时间约5 h,抽提完毕,取出的滤纸烘干、称重,此时的质量记为b。样品中的体脂含量=a-b。
1.4 血清瘦素浓度测定对照组和实验组中缅树鼩于实验28 d后处死取血,4 ℃静置1 h后于4 ℃ 4 000 r·min-1离心30 min,取上层血清置于-80 ℃超低温冰箱保存。血清瘦素浓度采用瘦素放射免疫分析试剂盒(美国Linco公司)进行测定(朱万龙等,2014)。
1.5 下丘脑神经肽表达量测定中缅树鼩的下丘脑总RNA参照高纯总RNA快速抽提试剂盒(BioTeke Co.)提供的方法进行提取与纯化。琼脂糖凝胶电泳检测RNA的纯度和完整性。提取和纯化的RNA置于-80 ℃保存。cDNA第一链的合成以下丘脑总RNA为模板,oligo(dT)18为反转录引物,按照M-MLV Frist Strand Kit试剂盒(Invitrogen Co.)方法进行。反应体系为:RNA模板8 μL,10 mM dNTP 1 μL,Oligo(dT)1 μL,0.1 M DTT 2 μL,5×第一链合成缓冲液4 μL,M-MLV 1 μL,RNase ddH2O 3 μL,总反应体系20 μL。反应完毕后,-20 ℃保存。NPY、AgRP、POMC、CART基因cDNA核心序列扩增的引物参照朱万龙等(2014)。
以上述cDNA第一链为模板进行RT-PCR,反应体系总体积25 μL,其中模板DNA(10 ng·μL-1)1 μL,25 mmol·L-1 MgCl2 2 μL,上、下游引物各1 μL,Taq酶(4 U·μL-1)0.5 μL,ddH2O 16 μL,反应条件如下:95 ℃预变性5 min;95 ℃变性30 s,54 ℃~56 ℃退火60 s,72 ℃ 延伸90 s,37个循环。RT-PCR产物以0.8%琼脂糖凝胶电泳检测。
采用ABI-7000TM荧光定量PCR(FQ-PCR)仪(美国应用生物系统公司)扩增模板cDNA,并检测荧光信号。FQ-PCR反应体系总体积20 μL,其中模板1.8 μL,KAPA SYBR FAST qPCR Master Mix(2×)10 μL,上、下游引物(200 nM)各0.4 μL,Rox Low 0.4 μL,ddH2O 7 μL。反应条件如下:95 ℃预变性3 min;95 ℃变性3 s,60 ℃退火30 s,30个循环;熔解曲线阶段95 ℃变性15 s,60 ℃退火 30 s,72 ℃延伸30 s。
采用比较CT值法(2-ΔΔCT法)计算相对定量,公式为:①改变的倍数(fold-change)=2-ΔΔCT;②ΔΔCT=(CT靶基因-CT内参)处理组-(CT靶基因-CT内参)未处理组。对于对照组样本,ΔΔCT=0,2-△△CT=1,对于实验组样本,如果2-△△CT>1,说明该基因表达量增加,如果2-△△CT<1,则说明该基因表达量下降。
1.6 统计分析采用SPSS 13.0进行实验数据的统计分析。数据经过正态分布和方差齐性检验,符合参数检验条件。不同性别中缅树鼩的生理指标差异无统计学意义,合并所有数据。体质量、体脂含量、血清瘦素浓度和下丘脑表达量的组间差异均采用独立样本t检验。血清瘦素浓度与体脂含量的关系采用Pearson相关分析。数据以平均值±标准误(Mean±SE)表示,P<0.05表示差异具有统计学意义,P<0.01表示差异具有高度统计学意义。
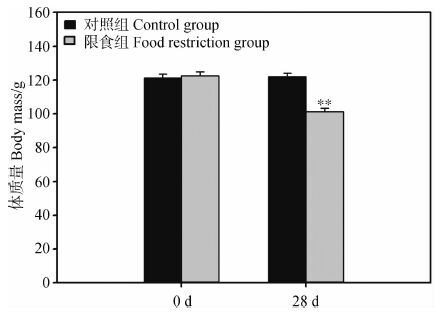
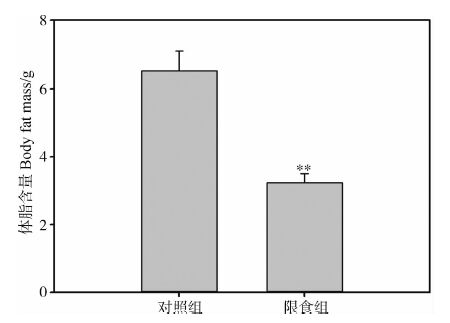
2 结果 2.1 体质量和体脂含量实验前对照组和限食组中缅树鼩体质量分别为121.35 g±2.21 g和122.03 g±2.17 g,差异无统计学意义(t1,16=-0.124,P>0.05)。28 d后,2组体质量差异具有高度统计学意义(t1,16=4.21,P<0.01,图 1),限食组的体质量较对照组降低了16.94%。2组的体脂含量在28 d后差异具有高度统计学意义(t1,16=3.56,P<0.01,图 2),对照组和限食组中缅树鼩体脂含量分别为6.54 g±0.58 g和3.24 g±0.26 g,限食组的体脂含量较对照组降低了50.46%。
|
| 图 1 限食条件下中缅树鼩的体质量变化 Fig. 1 Effect of food restriction on body mass of Tupaia belangeri * P<0.05,** P<0.01; 下同; the same below. |
| |
|
| 图 2 限食条件下中缅树鼩的体脂含量变化 Fig. 2 Effect of food restriction on body fat mass of Tupaia belangeri |
| |
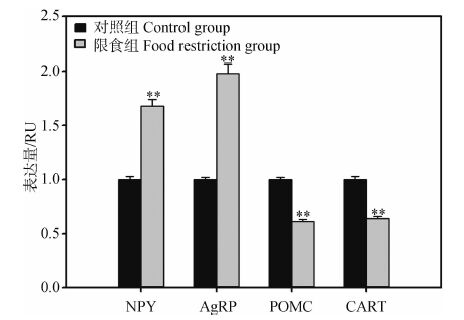
2组中缅树鼩的血清瘦素浓度在28 d后差异具有统计学意义(t1,16=2.13,P<0.05,图 3),限食组较对照组降低了32.61%。瘦素浓度与体脂含量呈正相关关系(r=0.54,P <0.05)。限食条件下,2组中缅树鼩下丘脑神经肽基因NPY、AgRP、POMC和CART表达量差异均具有高度统计学意义(NPY:t1,16=-4.32,P<0.01;AgRP:t1,16=-6.03,P<0.01;POMC:t1,16=2.95,P<0.01;CART:t1,16=2.61,P<0.01,图 4)。

|
| 图 3 限食条件下中缅树鼩的血清瘦素浓度变化 Fig. 3 Effect of food restriction on serum leptin level of Tupaia belangeri |
| |
|
| 图 4 限食条件下中缅树鼩的下丘脑神经肽基因的表达量变化 Fig. 4 Effect of food restriction on expression of hypothalamic neuropeptides genes of Tupaia belangeri |
| |
在不同食物数量或质量的驯化条件下,小型哺乳动物会出现显著的体质量变化(Zhang&Wang,2008)。研究表明体质量的改变程度受食物限制程度的影响:如果限食程度较小,动物可以维持能量稳态和体质量平衡,这主要是通过增加消化道吸收能力,调整产热和降低活动行为;相反,如果限食程度较大,动物就不能维持能量稳态,从而导致体质量下降(Sucajtys-Szulc et al.,2008)。在本研究中,中缅树鼩的体质量在限食组显著降低,这与昆明小鼠的研究结果一致(Zhao et al.,2009)。限食对中缅树鼩的体脂含量影响差异有高度统计学意义,说明中缅树鼩在限食条件下需要动员脂肪去弥补食物不足导致的产热。在限食条件下中缅树鼩的体质量和体脂含量降低的程度高于温度驯化实验中的结果(张浩等,2015),而与季节性驯化的结果相似(朱万龙等,2014),说明中缅树鼩在野外对于食物的敏感性高于温度,这可能和其分布有关:中缅树鼩主要栖息在热带亚热带地区,环境温度较高,因此对温度的敏感度低。
瘦素在小型哺乳动物体质量调节中有重要作用(Abelenda et al.,2003)。“脂质理论”认为血清瘦素水平可以反映体脂含量(Schneider et al.,2000)。本研究结果表明瘦素浓度和体脂含量呈正相关,支持瘦素可以作为一个脂类信号分子(Zhao&Wang,2006)。下丘脑神经肽基因作为调节体质量的影响因素,其中NPY和AgRP为促食类神经肽,其表达量的增加使动物食欲增加,从而增加食物摄入量,导致体质量增加,相反,POMC和CART为厌食类神经肽,其表达量的增加会降低动物食欲,使食物摄入量减少,体质量下降。之前的研究表明:不同的食物质量和数量可以改变大鼠的NPY表达量和体质量(Toshihiro&Akio,2001;Sucajtys-Szulc et al.,2008);在限食条件下,哺乳期的大鼠较自由取食组的NPY表达量显著增加(Abizaid et al.,1997 )。长期限食使动物的体质量、体脂含量显著下降,而AgRP表达量则增加,POMC和CART的表达量显著降低( Henry et al.,2001);在食物限制的条件下,大鼠和西伯利亚仓鼠的AgRP表达量也会增加(Harrold et al.,1999;Mercer et al.,2000)。但也有研究表明高脂食物可以显著增加大鼠的体质量、瘦素浓度,但对POMC表达量的影响差异不显著(Marco et al.,2013),而长期喂食高脂食物的大鼠,它们的后代POMC表达量较对照组的显著上调(Lukaszewski et al.,2013 )。此外,禁食也可使大鼠和小鼠的CART表达下降(Tian et al.,2004;Yoo et al.,2011)。本研究结果表明:限食条件下中缅树鼩的下丘脑神经肽基因表达量差异均有统计学意义,说明中缅树鼩在限食环境下,通过增加NPY和AgRP表达量增加食欲,降低产热,从而维持生存。在限食条件下,由于食物不足,POMC和CART表达量降低,有利于增加食物摄入。瘦素通过参与NPY/AgRP和POMC/CART通路调节中缅树鼩的体质量和能量代谢。通过比较限食条件和温度驯化的结果(张浩等,2015),可以看出瘦素浓度和下丘脑神经肽基因表达量对食物的敏感性更高,这和体质量变化趋势一致。但考虑到瘦素和NPY、AgRP、POMC、CART四类神经肽均和食物摄入有关,因此在野外环境条件下,中缅树鼩受哪个因子的作用更强,有待于进一步的研究。
综上所述,中缅树鼩在限食条件下通过降低体质量、体脂含量和血清瘦素浓度来维持生存,下丘脑神经肽基因NPY和AgRP表达量显著增加,而POMC和CART表达量显著降低。以上结果表明食物是影响中缅树鼩体质量调节的重要因素,瘦素在限食条件下通过调节下丘脑神经肽基因的表达量来调节其能量稳态。
 2016, Vol. 35
2016, Vol. 35




