扩展功能
文章信息
- 王春伶, 张富铁, 曹文宣, 王剑伟
- WANG Chunling, ZHANG Futie, CAO Wenxuan, WANG Jianwei
- 重金属胁迫下稀有鲫抑制消减杂交文库的筛选与分析
- Construction and Analysis of the Subtractive cDNA Library of Gobiocypris rarus Treated by Cd and Pb
- 四川动物, 2016, 35(3): 372-377
- Sichuan Journal of Zoology, 2016, 35(3): 372-377
- 10.11984/j.issn.1000-7083.20150403
-
文章历史
- 收稿日期: 2015-12-17
- 接受日期: 2016-03-24
2. 中国科学院水生生物多样性与保护重点实验室, 武汉 430072;
3. 中国科学院大学, 北京 100049
2. The Key Laboratory of Aquatic Biodiversity and Conservation, Chinese Academy of Sciences, Wuhan 430072, China;
3. University of Chinese Academy of Sciences, Beijing 100049, China
镉(Cd)和铅(Pb)等重金属污染对生物的生理活动、生长发育及基因表达产生重要影响(Zhu et al.,2011)。水体重金属污染不仅影响生活在其中的水生生物,还威胁人类健康,这种情况已经受到我国政府的高度重视。本研究将稀有鲫Gobiocypris rarus作为实验对象,希望阐述其应答重金属胁迫的分子机理,寻找适合监测水体重金属污染的分子标记物。
抑制消减杂交(suppression subtractive hybridization,SSH)是Diatchenko等(1996)在mRNA差别显示基础上建立的一种新的消减杂交方法,它具有灵敏度高、操作简单、假阳性低、速度快及效率高等特点,是目前克隆差异表达基因的重要手段之一,可以克隆出极为重要的基因。James等(2010)对印度明对虾Fenneropenaeus indicus感染白斑综合症病毒后的肝胰腺组织进行研究,发现抗菌肽相关的克隆在所建消减库中最为丰富,另外还包括信号转换、能量传导以及抗氧化酶类方面的克隆,这为甲壳类动物先天免疫及差异表达基因作用的研究奠定了基础。
核糖体是合成蛋白质的细胞器,主要成分是核糖体RNA(rRNA)和核糖体蛋白(ribosomal protein,RP),它们在蛋白质合成中发挥重要作用,也参与复制、转录、RNA加工、DNA修复等过程(Wool,1996)。有文献报道,RP基因家族在肿瘤发生和发展过程中发挥重要作用,RP的异常表达将引发各种疾病,包括肿瘤发生、免疫疾病、代谢病等(陈宏等,2005;李英华等,2012)。目前有研究表明,部分核糖体大亚基和小亚基蛋白能参与调控p53信号传递反应。p53是重要的肿瘤抑制因子,具有DNA损伤修复、促进细胞凋亡、分化及增殖抑制等功能,并通过调控细胞周期行进和促进细胞凋亡,发挥肿瘤抑制功能(李小光等,2013),其过表达或激活可引发细胞死亡,低表达或失活会导致肿瘤发生(Mirzayans et al.,2012)。在斑马鱼Danio rerio中,核糖体S7、S8、S15a、S18、S29、L7、L13、L23a、L35、L36等基因发生突变会导致斑马鱼癌症的产生(Amsterdam et al.,2004),这可能与RP执行的相关功能有关。
关于稀有鲫的核糖体研究还比较少,本研究利用SSH技术以Cd暴露的稀有鲫肝组织和未处理的对照组构建正反文库,筛选差异表达基因,克隆得到Rps18基因,并研究其在稀有鲫体内的表达情况。同时利用实时荧光定量PCR(real time-PCR,qPCR)技术分析Rps18基因在Pb处理后稀有鲫肝组织和肌肉组织中的表达情况,为稀有鲫应答重金属胁迫的研究奠定基础。
1 材料方法 1.1 试验鱼饲养试验用稀有鲫来自中国科学院水生生物研究所,2月龄,正常生长,健康状况良好,体长2.1 mm±0.2 mm。按照急性毒性试验的方法,分为5个试验组和1个对照组,每个浓度设置3个平行。将稀有鲫饲养在5 L的玻璃缸中,每缸10条,试验期间水温控制在25 ℃±1 ℃,光暗比为16 h∶8 h,试验期48 h。试验期间详细观察并记录鱼体中毒反应及死亡情况,利用SPSS计算48 h半致死浓度(48 h LC50)。Cd和Pb的48 h LC50分别为400 μg·L-1和3.9 mg·L-1。
正式试验开始前,稀有鲫需要在试验环境中驯化48 h。设置6个试验组和2个对照组,试验组Pb浓度为3.9 mg·L-1,对照组浓度为0 mg·L-1,条件如上所述。在试验开始后0 h、1 h、6 h、12 h、24 h和48 h分别从试验组和对照组取样,主要包括肝组织和肌肉组织。取样后迅速将样品放入RNAlater(Sigma)溶液中,留作进一步分析。
1.2 RNA提取将1.1中的组织放入研磨器中加RNA Lysis Buffer进行充分研磨,取175 μL裂解液移至1.5 mL EP管中,加入350 μL RNA Dilution Buffer,按SV Total RNA Isolation System(Promega,USA)试剂盒说明书进行操作,用紫外分光光度仪和0.8%琼脂糖凝胶电泳对RNA进行定量定性分析。
1.3 mRNA分离纯化用约300 μg合并后的总RNA分离纯化mRNA,按照PolyATtractR mRNA Isolation Systems说明书进行mRNA分离。
1.4 抑制消减杂交具体操作按Clontech PCR-SelectTM cDNA Subtraction Kit说明书进行。以重金属处理组为试验方(tester),以对照组为驱动方(driver)进行正向消减杂交;以对照组为试验方,重金属处理组为驱动方进行反向消减杂交。
1.5 cDNA消减文库的构建分别从正向和反向消减杂交的2次PCR产物中各取2 μL与1 μL PGEM-T Vector连接,4 ℃过夜。从体系中取5 μL转化受体菌(大肠杆菌Escherichia coli DH5α),于氨苄抗性筛选的琼脂糖平板上挑取单克隆于LB培养基中培养过夜,按常规保存菌种。
1.6 PCR鉴定插入片段取1 μL细菌培养液作PCR模板,以插入片段两侧的载体序列M13F和M13R作引物,PCR扩增插入片段。PCR体系(20 μL):10×PCR Buffer 2 μL,M13F和M13R(10 mmol·L-1)各0.6 μL,dNTP Mix(2.5 mmol·L-1)0.5 μL,Mg2+ 2 μL,Taq酶0.3 μL,菌液1 μL,灭菌水13 μL。PCR反应条件:94 ℃预变性5 min;94 ℃30 s,49 ℃40 s,72 ℃1 min,35个循环;最后72 ℃延伸8 min。
1.7 快速扩增cDNA末端(RACE)技术获得Rps18基因序列RACE操作过程按照Clontech SMARTTM RACE cDNA Amplification Kit具体说明进行。基因特异引物(GSPs)分别为:GSP1:5’-AGTAGTCTTTGCGCGGAACCAGC-3’;GSP2: 5’-GTCACCACCCTCTCAACCTCATCCT-3’。5’-RACE过程:第一链由总RNA、5’-CDS primer A和SMARTⅡA oligo经过GSP1和10×universal primer A mix PCR反应获得;3’-RACE过程:第一链由总RNA和3’-CDS primer A经过GSP2和10×universal primer A mix PCR反应获得,PCR反应条件:94 ℃30 s,56 ℃30 s,72 ℃3 min。反应产物克隆至载体PGEM-T中进行测序。所得序列经BLAST分析比对,并用Clustal X和MEGA 4.0分别对不同物种Rps18基因的核苷酸序列和氨基酸序列进行分析。
1.8 qPCR技术分析Rps18基因表达情况用SuperReal PreMix(SYBR Green)(TIANGEN)对Pb处理后肝组织和肌肉组织不同时间点的Rps18基因表达情况进行分析。qPCR在CFX96TM Real-Time System(Bio-Rad)上进行,β-actin作为内参基因(Liu et al.,2008;Su et al.,2008)。qPCR体系(20 μL):2×SuperReal PreMix 10 μL,引物各0.5 μL,模板1 μL。目的基因和内参基因的引物见表 1。PCR反应条件:95 ℃15 min;95 ℃15 s,60 ℃15 s,72 ℃25 s,39个循环;熔解曲线:65 ℃5 s至95 ℃。内参基因和管家基因引物的扩增效率分别为96.8%和97.5%。用2-△△Ct计算目的基因的相对表达量变化,其中Ct为达到阈值时扩增的循环数,具体公式为:相对表达量变化=2-△△Ct,△△Ct=[Ct(目的)-Ct(内参)]处理组-[Ct(目的)-Ct(内参)]对照组(Livak & Schmittgen,2001)。
| 基因名称 | 5’-3’引物序列 | 扩增效率/% |
| β-actinF | TGGTATGGGACAGAAAGAC | 96.8 |
| β-actinR | TGTAGAAGGTGTGATGCC | 96.8 |
| Rps18F | TGGTTCCTAAACAGACAGA | 97.5 |
| Rps18R | ATCTTCTTCAGCCTCTCC | 97.5 |
用SPSS进行数据分析,采用单因素方差分析统计方法(One-Way ANOVA)和Duncan’s多重比较方法对数据进行分析,当P<0.05时差异有统计学意义。
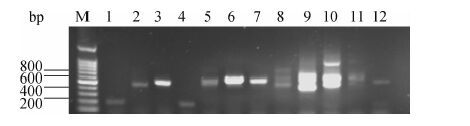
2 结果 2.1 消减文库筛选结果消减效率的高低是构建消减文库的关键。通过检测稀有鲫管家基因β-actin在消减和未消减PCR产物中的表达量来分析所构建消减文库的消减效率。结果显示,当以未消减的cDNA为模板时,β-actin基因在25个PCR循环时就开始出现扩增产物,而差减后的cDNA则在35个循环时才出现扩增条带(图 1),这表明经过2次杂交和2次抑制PCR,已经将试验方和驱动方中相同的序列大幅度消减,构建的文库消减效率达210,构建文库质量较好。随机挑选146个克隆进行测序,结果表明片段大小集中在200~600 bp,且多数为单克隆片段(图 2),其中86条测序成功的片段去除载体和接头序列后得到有效表达序列标签(expressed sequence tag,EST)序列40条。将测序得到的EST序列在BLAST数据库中比对,得到9个抗逆相关基因,这些基因均与逆境防御反应相关,表明稀有鲫经过Cd暴露后自身产生防御反应。此外,经Cd暴露后,稀有鲫肝脏中Rps18基因在48 h时试验组和对照组表达量存在差异(图 3)。

|
|
图 1 PCR检测β-actin cDNA的消减效率电泳图
Fig. 1 Subtraction efficiency of subtracted and unsubtracted
|
| |
|
|
图 2 消减cDNA文库外源插入片段的检测
Fig. 2 Identification of inserted exogenous fragment of the subtracted cDNA library
|
| |
|
|
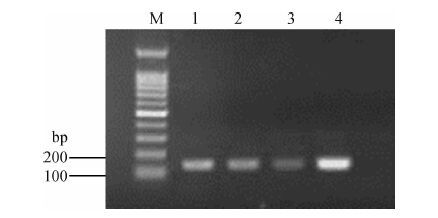
图 3 稀有鲫经Cd暴露后肝组织不同时间点Rps18 mRNA丰度变化电泳图
Fig. 3 The electrophoretogram of the level of Rps18 mRNA in Gobiocypris rarus liver after exposure to Cd
|
| |
从SSH文库筛选出245 bp Rps18基因的表达序列标签。经3’-RACE和5’-RACE扩增得到2段长度分别为418 bp和306 bp的片段,利用DNAMAN及BLAST进行序列分析、比对及拼接,最后得到Rps18基因序列长度为525 bp(GenBank 登录号为KF836434)。克隆得到的稀有鲫Rps18基因包括3’非翻译区38 bp,5’非翻译区28 bp,编码区459 bp,编码152个氨基酸残基,起始密码子为ATG,终止密码子为TAA(图 4)。该序列中A、T、G、C的含量分别为28.4%、20.6%、22.6%和28.4%。

|
| 图 4 稀有鲫Rps18基因核苷酸和氨基酸序列 Fig. 4 Nucleotide and deduced amino acid sequence of Rps18 gene in Gobiocypris rarus |
| |
稀有鲫Rps18基因152个氨基酸残基中脂肪族氨基酸37个,芳香族氨基酸10个,不含半胱氨酸。ClustalX分析表明,Rps18基因氨基酸序列具有一定的保守性,与大西洋鲑Salmo salar、非洲爪蟾Xenopus laevis、米氏叶吻银鲛Callorhinchus milii、大熊猫Ailuropoda melanoleuca和长牡蛎Crassostrea gigas的相似性分别为94.74%、95.39%、92.76%、92.76%和79.61%(图 5)。

|
| 图 5 稀有鲫的Rps18基因和其他物种Rps18基因的氨基酸序列比对 Fig. 5 Comparison of Gobiocypris rarus Rps18 amino acid sequence with other species |
| |
使用MEGA 4.0软件的邻接法(Neighbor-joining,NJ)构建系统进化树,并用 bootstraps 进行了500次重复(图 6)。绘制进化树所用物种包括:人Homo sapiens、家犬Canis familiaris、牛Bos taurus、野猪Sus scrofa、黑鼠Rattus rattus、褐家鼠R. norvegicus、热带爪蟾X.(Silurana)tropicalis、非洲爪蛙、长牡蛎、痢疾变形虫Entamoeba histolytica、果蝇Drosophila melanogaster和斑马鱼,结果表明稀有鲫Rps18基因和斑马鱼Rps18基因聚在一起,亲缘关系最近。

|
| 图 6 构建的核糖体蛋白基因家族进化树 Fig. 6 Phylogenetic tree of ribosomal protein family Hs. 人Homo sapiens,Cf. 家犬Canis familiaris, Bt. 牛Bos taurus,Ssc. 野猪Sus scrofa,Rr. 黑鼠Rattus rattus,Rn. 褐家鼠 R. norvegicus,Xt. 热带爪蟾Xenopus(Silurana)tropicalis,Xl. 非洲爪蟾X. laovis,Cg. 长牡蛎Crasso strea gigas,Eh. 痢疾变形虫Entamoeba histolytica, Dm. 果蝇Drosophila melanogaster. Dr. 斑马鱼Danio rerio. |
| |
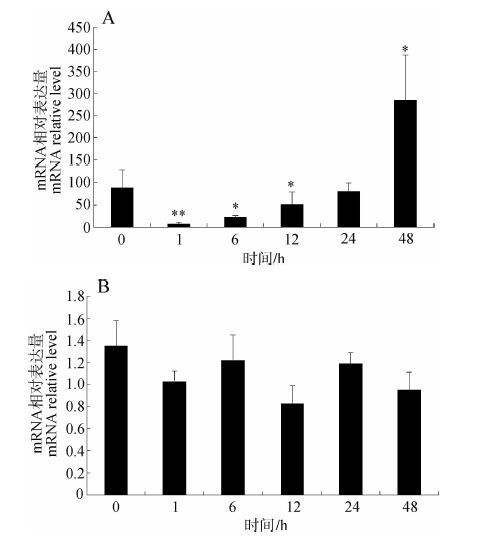
利用qPCR技术检测稀有鲫经Pb暴露后Rps18基因在肝组织和肌肉组织不同时间点的表达情况。与对照组相比,暴露开始1 h后,肝脏中Rps18基因的表达受到明显抑制(15倍);在6 h时抑制作用减弱(4倍);暴露进行到12 h和24 h时,抑制作用逐渐消失,Rps18基因的表达量回归正常值(1~1.9倍);在暴露48 h时,Rps18 基因的表达受到诱导(2.9倍)(图 7:A)。肌肉组织中Rps18基因的相对表达量无明显变化(0.83~1.35倍)(图 7:B)。
|
| 图 7 稀有鲫铅(3.9mgL-1)暴露后肝脏组织(A)和肌肉组织(B)中不同时间Rps18基因的相对表达量 Fig. 7 Rps18 mRNA level in liver(A)and muscle(B) after 3.9 mg·L-1 Pb exposure |
| |
SSH技术通过去除试验方和驱动方中相同基因,并富集差异表达基因来筛选目的基因,这种方法可以消除cDNA群体内部各分子间丰度的差异,从而分离与低丰度转录对应的cDNA克隆(Diatchenko et al.,1996)。因此,对于筛选稀有鲫经重金属暴露后差异表达的基因有很大帮助。本研究从消减文库中获得多个差异表达的cDNA片段,序列分析表明,这些片段均与防御反应有关。主要包括Apolipoprotein C-I、金属硫蛋白、Nuclear factor(erythroid-derived 2)-like 2a、Na+/K+ ATPase、heat shock protein 27、phosphoenolpyruvate carboxykinase及ribosom-al protein S18基因等。这说明稀有鲫为应对重金属暴露的刺激,自身产生防御反应,引起一些基因的表达量变化。
本文重点研究了稀有鲫经铅暴露后肝组织和肌肉组织在不同时间点Rps18基因表达量的变化情况。Rp主要功能是参与蛋白质合成。此外,它还有核糖体外功能,如参与一些重要生理生化过程,对机体生长、肿瘤发生发展也有一定影响(Rajasekhar et al.,2003)。有报道表明Rps18基因表达量的降低可能影响核糖体信号传导进而影响生长促进基因的转录(Lai et al.,2009)。本研究认为,在暴露开始阶段,目的基因表达量降低可能会影响其他相关基因的转录过程,是机体的应激反应。随着暴露进行,在48 h时目的基因表达量又出现升高现象,这样可以去除重金属暴露后机体产生的过量活性氧,降低重金属暴露对机体的损害。但是Rps18基因的表达量在肌肉组织中没有明显变化,这可能与肌肉组织富集重金属的能力较弱有关(Cao et al.,2012)。
 2016, Vol. 35
2016, Vol. 35




