据估计全球盐土与碱土面积超过8.3×108 hm2,这其中有一半以上是碱性土壤[1]。碱性土壤不仅含有高浓度的盐分,同时还具有高pH值的特性,经测定碱性土壤的pH值范围是8.5-11[2]。在碱性土壤中生长的植物不仅受到单盐毒害(高浓度的Na+、CO32-和HCO3-),而且还受到高pH值对植物的伤害。已发表的研究结果显示土壤高pH值会降低土壤磷、铁和锌等矿质元素的有效性[3-4],并产生NH3的毒害作用[5],打破植物体内活性氧的平衡[6-7],严重抑制了植物的光合作用以及根系的生长[8-9]。由此可见,碱性盐对植物生长的伤害程度远远高于中性盐。目前科研工作者在碱性盐对植物的伤害机制方面已取得较好的进展[7],但在提高植物抗碱性研究方面仍有局限。
根际促生细菌能够通过多种作用机制促进植物生长发育,提高植物的抗逆性。例如,合成抗生素和抗真菌分子,与致病微生物竞争植物根表面的结合位点以及降解异型生物质(如药物、杀虫剂等)[10];固氮菌帮助植物获得优质丰富的氮资源;分泌有机酸等物质溶解释放土壤中矿物磷酸盐中的养分,使其转化为植物能够利用的可溶性矿质营养,促进植物对矿质元素的吸收和利用;诱导系统性防御机制提高植物的抗胁迫能力;直接产生和分泌细胞分裂素、生长素、脱落酸、赤霉素等植物生长调节物质,调节植物的生长发育,促进植物生长;合成ACC脱氨酶,降解乙烯合成的直接前体ACC(1-氨基环丙烷-1-羧酸),进而降低胁迫条件下植物根系中乙烯的累积量,从而增加植物的抗胁迫能力等[11-14]。
已有大量研究结果表明含ACC脱氨酶的根际促生细菌能提高植物对重金属、干旱、中性盐以及洪涝等非生物胁迫的抗逆性[15],但是关于其提高植物抗碱性的研究却很有限。ACC脱氨酶可以将乙烯合成的直接前体ACC降解为氨和α-酮丁酸,作为细菌生存的氮源和碳源[16],在这个酶的催化作用下,植物组织中ACC的含量降低,乙烯的合成量便会减少。胁迫条件下迅速积累的高浓度乙烯是抑制植物生长的主要原因[16]。高pH值会导致植物体内乙烯及其合成前体ACC含量升高[17],那么接种含ACC脱氨酶的根际细菌是否能通过降低乙烯的含量来提高植物的耐碱性仍未知。
大豆是我国重要的经济作物,土壤碱化严重威胁着大豆生产。近几年,科研工作者从基因组学、转录组学、蛋白组学和代谢组学的层面细致地研究了大豆耐中性盐的机制[18-20]。但是关于大豆耐碱性的研究却比较有限,目前获得的比较有价值的发现是野生大豆比栽培型大豆耐碱[20],研究人员将野生大豆中的耐碱相关基因转到拟南芥或苜蓿中,以期提高植物的耐碱性[21-23],但是类似的研究结果在农业生产中的应用价值有限。
根际促生细菌Variovorax paradoxus 5C-2含有ACC脱氨酶,它具有良好的抗渗透压性、抗逆性和较强的竞争力[24-26]。V. paradoxus菌株的泛基因组和核心基因组在功能上与植物代谢的多样性和促进生长的性状有关[27]。已有实验探明V. paradoxus5C-2存活的环境条件:最适温度是28℃,存活温度范围是15-37℃,土壤pH的范围是5-9,土壤渗透势范围是-12 MPa到-0.14 MPa。它在田间土壤中能显著提高植物的抗旱性[28]。本实验室的前期研究结果显示,该菌能促进豌豆对矿质元素的吸收[29],并且能提高豌豆的抗盐性[30]。而接种该菌能否提高大豆的耐碱性还未知。本论文将研究碱胁迫条件下,接种根际细菌V. paradoxus 5C-2对大豆生长、光合作用和根系构型的影响,以期为提高作物的耐碱性提供新思路和新方法。
1 材料与方法 1.1 材料含ACC脱氨酶的PGPR菌株Variovorax parado-xus 5C-2,从俄罗斯农业微生物保藏中心(St Petersburg,Russian Federation)获得。试验所用大豆(Glycine max(L).Merr.)为中黄13大豆,购于中国农业科学院。
1.2 方法 1.2.1 菌悬液的制备将Variovorax paradoxus 5C-2接种于Bacto-Pseudomonas F(BPF)培养基上,在28℃恒温箱中培养3 d,选取生长良好的单菌落接种于50 mL BPF液体培养基中,放入摇床中(250 r/min,28℃过夜),富集培养至细菌的对数生长期。稀释菌悬液,将菌悬液浓度调整至108 CFU/mL即用分光光度计在波长540 nm处测得的OD值为0.537。接菌时,将4 mL菌液浇于每株大豆茎基部,然后用少量营养液冲下,使菌液到达根系周围。BPF固体培养基(g/L):酵母粉,10;胰蛋白胨,10;K2HPO4,1.5;MgSO4,1.5;Agar,16。BPF液体培养基(g/L):酵母粉,10;胰蛋白胨,10;K2HPO4,1.5;MgSO4,1.5。
1.2.2 大豆的培养选取颗粒饱满、大小近似的大豆种子,用10%的过氧化氢溶液浸泡消毒10 min,之后用去离子水冲洗干净,播种于装有灭过菌的干净石英砂的塑料花盆中,覆盖黑色塑料布以遮光,在温室中培养。待种子发芽时,揭开黑塑料布。种子萌发期间,每日适时适量补水。大豆幼苗长出第一对复叶后,选取长势相同,主根完整的幼苗移入盛有灭过菌的石英砂的花盆中,花盆体积大约是2.5 L。移苗后第2天,浇灌1/4 Hogland营养液。3 d后,浇灌1/2 Hogland营养液,再过3 d,浇灌全营养液。
Hogland营养液组成如下(单位:μmol/L):KNO3,2 800;Ca(NO3)2·4H2O,1 600;MgSO4· 7H2O,1 000;NH4NO3,2 000;NaH2PO4,600;Na-FeEDTA,40;H3BO3,10;ZnSO4,2;MnSO4· 4H2O,2;CuSO4·5H2O,0.5;Co(NO3)2·6H2O,0.2;H2MoO4,0.08。
1.2.3 加菌和盐碱处理移苗后第16天,开始接菌处理。将大豆幼苗分为2组,其中一组加菌,另一组不加菌,加菌组每4 d进行一次,每次加4 mL浓度为108 CFU/mL菌液,处理时间持续16 d。将加菌组和不加菌的大豆植株在组内分别分成4组,每组4-7个植株,之后进行以下处理(表 1)。具体的分组处理为:浇灌完全营养液的对照组(pH为6.02);含40 mmol/L NaCl的营养液(pH为6.03);含40 mmol/L钠离子的NaHCO3的营养液(pH为8.12);含40 mmol/L钠离子并且Na2CO3与NaHCO3以1:15混合的营养液(pH为9.04)。每2 d用充足的、相应处理的营养液浇灌大豆植株,直到有液体从盆子下部的小孔中流出。盐碱处理开始时间和结束时间与接菌处理一致。
测定生物量:大豆移苗后32 d,即盐碱处理以及接菌16 d后,将大豆植株分为地上部和根系,称量鲜重后,用烘箱将植株水分烘干至质量不再变化,称量其干重。
测定大豆主根长度和侧根总根长:在每个处理组中随机选取3株大豆根系,将其铺展开后,用尺子测量主根及侧根的长度,之后计算侧根的总长度。
测定气孔阻力:采用AP4型气孔计,移苗后第30天在9:00-11:00测定植株叶片的气孔阻力,测定部位为第5对三出复叶。
测定光合指标:采用超便携式调制叶绿素荧光仪MINI-PAM(德国,WALZ)及WinControl-3.2软件,移苗第32天在19:00-21:00间,测定植株叶片的光合作用荧光参数——初始荧光(Fo)和最大荧光(Fm),计算可变荧光Fv(Fv=Fm-Fo)和光系统Ⅱ(photosystem Ⅱ complex,PS Ⅱ complex)原初光能最大转换效率(Fv:Fm)。测定部位为大豆第4对三出复叶。
测定叶绿素含量:移苗后第31天,即盐碱处理和接菌处理15 d,取大豆植株的第五对复叶,将叶片洗净,用吸水纸吸干表面水分,去大叶脉后,剪碎叶片,用于测定叶绿素的含量,测定方法详见《植物生物学实验指导》[31]。
1.2.5 数据分析采用Microsoft Office Excel 2016和GraphPad Prism 6.0软件处理试验数据,对不同盐碱处理的小组中的接菌组、未接菌组进行统计分析及2个独立样本t-检验,对不同处理的小组进行组间单因素方差分析比较。其中显著性检验P值为0.05。
2 结果 2.1 盐碱处理条件下,接种根际促生细菌V. paradoxus 5C-2对大豆干重的影响中性盐(NaCl)和碱性盐(NaHCO3和Na2CO3)中钠离子的浓度都是40 mmol/L,分别处理大豆后发现,与对照植株相比中性盐对大豆地上部生物量没有影响,但是碱性盐对地上部生物量的抑制效应却非常显著,在pH为8.12和9.04的条件下分别降低了39%和51%。接种根际细菌V. paradoxus 5C-2后,对照组、中性盐处理和碱性盐处理的大豆地上部生物量分别增加了15%、8%、19%和27%。在pH值是9.04的条件下,根际细菌促进地上部干重增长的比例最大(图 1-A)。
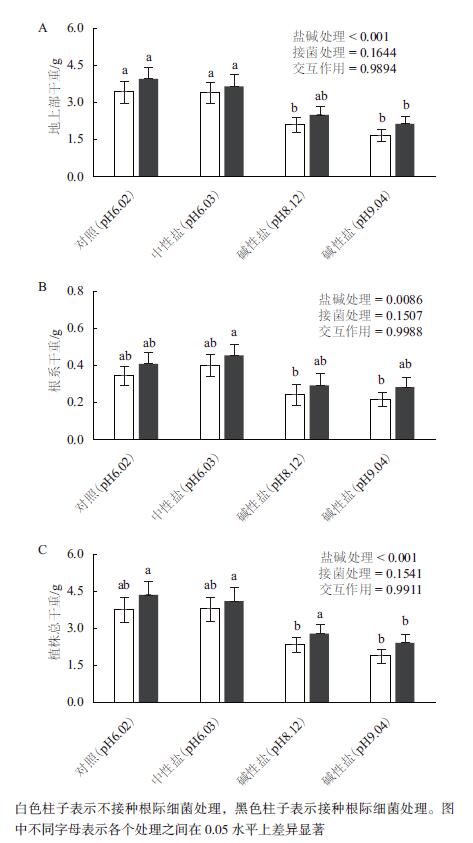
|
| 图 1 盐碱和接菌处理16 d(移苗32 d),大豆地上部(A)、根系(B)以及整个植株的干重(C) |
中性盐处理导致大豆根系干重增加了15%,然而碱性盐(pH分别为8.12和9.04)处理却使根系干重降低了31%和37%。接种V. paradoxus 5C-2后,对照组、中性盐处理和碱性盐处理的大豆根系干重分别增加了18%、14%、21%和31%。在pH值是9.04的条件下,根际细菌促进根系干重增长的比例最大(图 1-B)。
中性盐和碱性盐处理以及根际细菌对大豆整个植株干重的影响与对地上部干重的影响一致。双因素方差分析结果还表明,盐碱处理与细菌接种处理对植物生物量的影响之间没有明显的交互作用(P > 0.05),即V. paradoxus 5C-2改善植物生长的效应和盐碱处理抑制植物生长的效应是相互独立的。
2.2 盐碱处理条件下,接种根际促生细菌V. paradoxus 5C-2对大豆根系构型的影响双因素方差分析结果表明,与对照相比,中性盐处理的大豆侧根总长度没有明显变化,但是碱性盐处理时大豆侧根总长度显著降低,分别降低了36%和57%。接菌处理后,对照组大豆根系侧根总长度显著升高。中性盐和碱性盐处理的植株接菌处理后,侧根总长度分别提高了12%、36%和17%(图 2-A)。
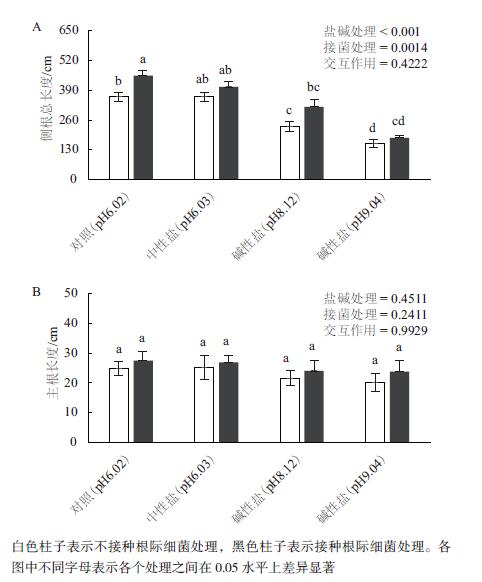
|
| 图 2 盐碱和接菌处理16 d(移苗32 d),大豆侧根总长度(A)和主根长度(B) |
双因素方差分析结果表明,盐碱处理以及接菌处理对大豆主根长度均未产生显著性影响,但是从数值上来看,碱性盐处理导致主根长度降低了13%和18%。加菌处理后,对照组、中性盐处理和碱性盐处理的大豆主根长度分别增加了11%、7%、11%和18%(图 2-B)。
双因素方差分析结果还表明,盐碱处理与细菌接种处理对植物根系构型的影响之间没有明显的交互作用(P > 0.05),即V. paradoxus 5C-2对植物根系构型的影响和盐碱处理对根系构型的负面效应是相互独立的。
2.3 盐碱处理条件下,接种根际促生细菌V. paradoxus 5C-2对大豆叶片气孔阻力的影响双因素方差分析结果表明,碱性盐胁迫处理和接种细菌处理都会显著影响大豆的气孔阻力。如图 3所示,未接菌时,含40 mmol/L钠离子的中性盐对大豆气孔阻力没有影响,但是含40 mmol/L钠离子的碱性盐处理却显著提高了气孔阻力,在pH值分别是8.12和9.04的条件下,气孔阻力分别升高了176%和209%。接菌处理后,对照组和中性盐处理的大豆叶片气孔阻力没有明显变化,但是碱性盐处理的大豆气孔阻力却出现显著降低,分别降低了25%和16%。
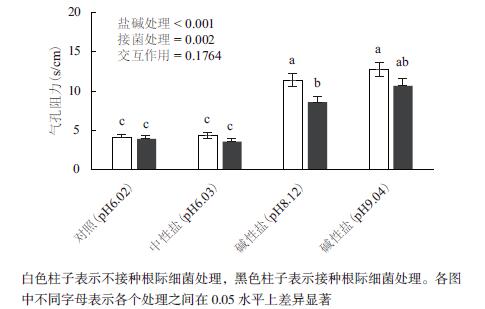
|
| 图 3 盐碱和接菌处理14 d(移苗30 d),大豆第五对复叶叶片的气孔阻力 |
双因素方差分析结果还表明,盐碱处理与细菌接种处理对植物气孔阻力的影响之间没有明显的交互作用(P > 0.05),即V. paradoxus 5C-2对植物气孔阻力的影响和盐碱处理的效应是相互独立的。
2.4 盐碱处理条件下,接种根际促生细菌V. paradoxus 5C-2对大豆叶绿素含量的影响双因素方差分析结果表明,盐碱处理会显著影响大豆完全展开叶片中叶绿素a的含量。当用中性盐处理时,大豆第5对三出复叶中叶绿素a的含量显著高于对照组,但是碱性盐处理的大豆叶绿素a的含量显著低于对照,分别降低了55%和71%。接菌处理导致对照组、中性盐处理和碱性盐处理的大豆叶片中叶绿素a含量有升高的趋势,分别提高了30%、21%、23%和89%(图 4-A)。
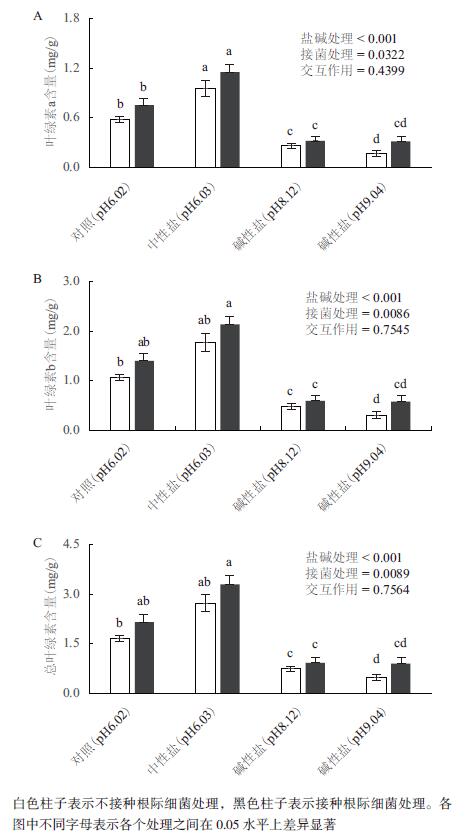
|
| 图 4 盐碱和接菌处理15 d(移苗31 d),大豆第五对复叶的叶绿素a(A)、叶绿素b(B)以及总叶绿素含量(C) |
碱性盐处理会显著影响大豆完全展开叶片中叶绿素b的含量。未接菌时,中性盐处理的大豆叶片中叶绿素b的含量增加了64%,但是碱性盐处理的大豆叶绿素b的含量却显著降低,分别降低了55%和71%。在各种盐碱处理条件下,接菌处理都提高了大豆叶绿素b的含量。接种V. paradoxus 5C-2后,对照组、中性盐处理和两种碱性盐处理的大豆叶片中叶绿素b含量分别升高了31%、22%、25%和87%(图 4-B)。盐碱处理和接菌处理后大豆叶片中总叶绿素含量的变化趋势与叶绿素a和叶绿素b相似。
分析结果还表明,盐碱处理与细菌接种处理对叶绿素含量的影响之间没有明显的交互作用(P > 0.05),即V. paradoxus 5C-2对叶绿素含量的影响和盐碱处理的效应是相互独立的。
2.5 盐碱处理条件下,接种根际促生细菌V. paradoxus 5C-2对大豆光合效率的影响Fv/Fm的数值代表暗适应叶片的原初光化学反应的最大量子产量,它能衡量叶绿体进行光合作用的最大潜能。中性盐导致光系统的最大光合潜能(Fv/Fm)显著升高,但是碱性盐处理使Fv/Fm分别降低了23%和39%,而接菌处理可以提高Fv/Fm,且这种提高效应在pH值是9.04时是显著的。对照组、中性盐处理和两种碱性盐处理的大豆接种细菌后Fv/Fm分别提高了3%、2%、5%和23%(图 5)。

|
| 图 5 盐碱和接菌处理16 d(移苗32 d),大豆第4对三出复叶的最大光合潜能。 |
盐碱处理与细菌接种处理对Fv/Fm的影响之间没有明显的交互作用(P > 0.05),即V. paradoxus 5C-2对Fv/Fm的影响和盐碱处理的效应是相互独立的。
3 讨论中性盐与碱性盐的相似之处在于都含有Na+,而不同之处是中性盐主要以NaCl和Na2SO4的形式存在,而碱性盐主要以NaHCO3和Na2CO3的形式存在。为了排除Na+的作用效应,更好地探究碱性(高pH值)对大豆生长发育的影响以及根际促生细菌V. paradoxus 5C-2在高pH值条件下对大豆的作用效果,我们对实验方案做了以下设定:即40 mmol/L NaCl、含有40 mmol/L Na+的碱性盐NaHCO3以及Na2CO3与NaHCO3以1:15的比例混合。实验结果表明,与对照组相比,40 mmol/L NaCl处理的大豆地上部和根系的干重没有显著变化,但是叶绿素a的含量和最大光合潜能(Fv/Fm)都显著升高,这说明中黄13大豆具有一定的耐中性盐的能力。当用含40 mmol/L Na+的碱性盐(pH值分别为8.12和9.04)处理16 d后,大豆地上部的生物量显著降低,根系干重也大幅减少,分别降低了31%和37%,侧根总长度、叶绿素含量以及光合效率也都降低,气孔阻力显著升高,这些实验结果表明高pH值严重抑制了大豆的生长,这与已发表的研究结果一致[7-9]。
接种含ACC脱氨酶的根际促生细菌V. paradoxus 5C-2后,在各种盐碱处理条件下,大豆地上部和根系的干重均增加,而且增加的幅度随着胁迫程度的加剧而明显增大。在碱胁迫条件下,尤其在pH值是9.04时,接菌处理后大豆的侧根总长度、叶绿素含量以及最大光合潜能均明显升高,气孔阻力急剧下降,这些实验结果表明在高pH值条件下接种根际细菌V. paradoxus 5C-2能明显缓解碱对大豆的胁迫效应。
当植物遭受碱胁迫时,植物根系的生长显著降低[7-9],这与本实验结果相一致。高pH值通常会导致植物体内乙烯及其前体ACC含量升高[10]。施用乙烯合成前体ACC可以迅速降低拟南芥根尖细胞的分裂速率[32-33],抑制根系的伸长生长[9]。这些实验证据表明,碱胁迫时植物体内增加的乙烯和ACC在根细胞伸长生长和细胞分裂过程中都起着负调控的作用。接种V. paradoxus 5C-2后,大豆根组织中乙烯浓度可能降低,从而缓解了高pH对根系生长的抑制效应。
叶绿素是绿色植物叶绿体内参与光合作用的重要色素,在光合作用中起捕获和传递能量的作用[34]。叶绿素的含量与植物的光合效率密切相关。当植物体遭受干旱、高温等非生物胁迫时,乙烯含量的累积会诱导叶绿素降解,促进叶片的衰老和脱落。外源施加乙烯生物合成抑制剂AVG或乙烯感知抑制剂1-MCP能够延缓燕麦(Avena sativa)、小麦(Triticum aestivum)、棉花(Gossypium hirsutum L.)和匍茎剪股颖(Agostis stolonifera)等植株叶片在高温和干旱胁迫下的衰老,并增加叶片中叶绿素的含量[35-37]。由此可知,降低乙烯在植物体中的累积量将缓解叶绿素的降解过程,增加叶绿素的含量[38]。乙烯能显著提高柑橘果皮中叶绿素降解相关基因CitNYC和CitChlase的表达量,从而导致叶绿素含量的降低。CitERF13是乙烯响应过程中转录因子ERF基因中的一种,被证明是CitPPH启动子潜在的直接调控物,在柑橘(Citrus sinensis)、番茄(Solanum lycopersicum)和烟草(Nicotiana)等植物的叶绿素降解过程中起重要的作用[39]。接菌V. paradoxus 5C-2可能降低了大豆组织中乙烯的含量,从而阻止叶绿素降解过程中相关酶基因的表达,减缓叶绿素的降解速率。
气孔是植物与外界交换气体的窗口。植物以向外界散失水分为代价来获取CO2,以满足光合碳固定所需。研究发现中性盐胁迫导致豌豆(Pisum sativum)气孔阻力增加,但是接种V. paradoxus 5C-2后,气孔阻力数值降低[30]。本实验中,当大豆遭遇碱胁迫时,气孔阻力的数值显著升高,但是接菌后气孔阻力明显降低,这意味着气孔开度比未接菌的大豆更大,有利于叶肉细胞与外界进行气体交换以获得更多的CO2用于光合作用的碳同化。对于C3植物,进入叶肉细胞中CO2的量是限制植物光合效率的主要因素。
由以上实验结果可知,根际促生细菌V. paradoxus 5C-2可能通过调控多个生理过程来缓解高pH值对大豆的伤害。这种细菌促进大豆侧根和主根的生长,改变植物根系构型,而且还有研究结果显示接种含ACC脱氨酶的根际细菌能提高大豆的根系导水率[40],因为它使根系中乙烯的合成量降低,削弱了乙烯对水通道蛋白活性的抑制作用,从而提高根系的导水率[41]。根系生长和根系构型的改善以及根系导水率的提高最终改善了大豆的水分关系,使得气孔阻力降低,植物获得了更多的CO2。与此同时,乙烯含量的降低还减缓了叶绿素的降解过程,从而使植物在碱胁迫的条件下保持一定的光合能力。
在这些实验基础之上,未来我们还需从生理和分子的层面进行深入研究,具体分析V. paradoxus 5C-2通过调控哪些基因的表达来改变根系构型,这种细菌对叶绿素降解过程中关键酶基因表达模式的调控作用,以及对其他激素合成与降解的影响,以期为提高植物的耐碱性提供一种环保有效的策略。
4 结论本实验结果表明含40 mmol/L Na+的中性盐对大豆没有抑制作用,但是碱性盐却导致大豆生长显著降低。接种含ACC脱氨酶的根际细菌V. paradoxus5C-2能提高植物在碱胁迫条件下的生长,并且在较高pH值条件下其作用效果更明显,表明此类细菌可以缓解碱性盐对大豆的胁迫效应。
| [1] | |
| [2] |
Wang L, Seki K, Miyazaki T, et al. The cause of soil alkalinization in the Songnen plain of northeast China[J]. Paddy Water Environment, 2009, 7: 259-270. DOI:10.1007/s10333-009-0166-x |
| [3] |
Brady NC, Weil RR. The nature and properties of soils[M]. Prentice-Hall Inc, New Jersey, 1996.
|
| [4] |
Marschner H. Mineral nutrition of higher plants[M]. 2nd Edition. London: Academic Press, 1995.
|
| [5] |
Schenk M, Wehrmann J. The influence of ammonia in nutrient solution on growth and metabolism of cucumber plants[J]. Plant Soil, 1979, 52: 403-414. DOI:10.1007/BF02185583 |
| [6] |
Guo R, Shi LX, Yan CR, et al. Ionomic and metabolic responses to neutral salt or alkaline salt stresses in maize (Zea mays L.) seedlings[J]. BMC Plant Biology, 2017, 17: 4. DOI:10.1186/s12870-016-0955-5 |
| [7] |
Zhang H, Liu XL, Zhang RX, et al. Root damage under alkaline stress is associated with reactive oxygen species accumulation in rice (Oryza sativa L.)[J]. Frontiers in Plant Science, 2017, 8: 1580. DOI:10.3389/fpls.2017.01580 |
| [8] |
Higuchi K, Ono K, Araki S, et al. Elongation of barley roots in high pH nutrient solution is supported by both cell proliferation and differentiation in the root apex[J]. Plant Cell and Environment, 2017, 40: 1609-1617. DOI:10.1111/pce.12969 |
| [9] |
Chen H, Zhang Q, Cai H, et al. Ethylene mediates alkaline-induced rice growth inhibition by negatively regulating plasma membrane H+-ATPase activity in roots[J]. Frontier Plant Science, 2017, 8: 1839. DOI:10.3389/fpls.2017.01839 |
| [10] |
Haas D, Defago G. Biological control of soil-borne pathogens by Fluorescent Pseudomonads[J]. Nature Reviews Microbiology[J], 2005, 3(4): 307-319. DOI:10.1038/nrmicro1129 |
| [11] |
Bhattacharyya PN, Jha DK. Plant growth-promoting rhizobacteria (PGPR) :emergence in agriculture[J]. World J Microbiol Biotechnol, 2012, 28: 1327-1350. DOI:10.1007/s11274-011-0979-9 |
| [12] |
Nadeem SM, Ahmad M, Zahir ZA, et al. The role of mycorrhizae and plant growth promoting rhizobacteria (PGPR) in improving crop productivity under stressful environments[J]. Biotechnology Advances, 2014, 32: 429-448. DOI:10.1016/j.biotechadv.2013.12.005 |
| [13] |
Tabassum B, Khan A, Tariq M, et al. Bottlenecks in commercialisation and future prospects of PGPR[J]. Applied Soil Ecology, 2017, 121: 102-117. DOI:10.1016/j.apsoil.2017.09.030 |
| [14] |
Etesamia H, Maheshwarib DK. Use of plant growth promoting rhizobacteria (PGPRs) with multiple plant growth promoting traits in stress agriculture :Action mechanisms and future prospects[J]. Ecotoxi Environ Safety, 2018, 156: 225-246. DOI:10.1016/j.ecoenv.2018.03.013 |
| [15] |
Glick BR, Penrose DM, Li JA. model for the lowering of plant ethylene concentrations by plant growth-promoting bacteria[J]. Journal of Theoretical Biology, 1998, 190(1): 63-68. |
| [16] |
Glick BR. Bacteria with ACC deaminase can promote plant growth and help to feed the world[J]. Microb Res, 2014, 169: 30-39. DOI:10.1016/j.micres.2013.09.009 |
| [17] |
Li J, Xu HH, Liu WC, et al. Ethylene inhibits root elongation during alkaline stress through AUXIN1 and associated changes in auxin accumulation[J]. Plant Physiology, 2015, 168(4): 1777-1791. DOI:10.1104/pp.15.00523 |
| [18] |
Qi XP, Li MW, Xie M, et al. Identification of a novel salt tolerance gene in wild soybean by whole-genome sequencing[J]. Nature Communication, 2014, 5: 43-40. DOI:10.1038/ncomms5340 |
| [19] |
Zhang J, Yang DS, Li MX, et al. Metabolic profiles reveal changes in wild and cultivated soybean seedling leaves under salt stress[J]. PLoS One, 2016, 11(7): 0159627. |
| [20] |
Li M, Guo R, Jiao Y, et al. Comparison of salt tolerance in soja based on metabolomics of seedling roots[J]. Frontier Plant Science, 2017, 8: 1101. DOI:10.3389/fpls.2017.01101 |
| [21] |
Yu Y, Liu A, Duan XB, et al. GsERF6, an ethylene-responsive factor from Glycine soja, mediates the regulation of plant bicarbonate tolerance in Arabidopsis[J]. Planta, 2016, 244: 681-698. DOI:10.1007/s00425-016-2532-4 |
| [22] |
Jia BW, Sun MZ, DuanMu HZ, et al. GsCHX19. 3, a member of cation/H+ exchanger superfamily from wild soybean contributes to high salinity and carbonate alkaline tolerance[J]. Scientific Reports, 2017, 7: 9423. DOI:10.1038/s41598-017-09772-3 |
| [23] |
Song XW, Duamu HZ, Yu Y, et al. GsJ11, identified by genome-wide analysis, facilitates alkaline tolerance in transgenic plants[J]. Plant Cell, Tissue and Organ Culture, 2017, 129: 411-430. DOI:10.1007/s11240-017-1188-5 |
| [24] |
Satola B, Wübbeler JH, Steinbüchel A. Metabolic characteristics of the species Variovorax paradoxus[J]. Applied Microbiol Biotech, 2013, 97: 541-560. DOI:10.1007/s00253-012-4585-z |
| [25] |
Han JI, Choi HK, Lee SW, et al. Complete genome sequence of the metabolically versatile plant growth promoting endophyte Variovorax paradoxus S110[J]. Journal of Bacteriol, 2011, 193: 1183-1190. DOI:10.1128/JB.00925-10 |
| [26] |
Belimov AA, Hontzeas N, Safronova VI, et al. Cadmium-tolerant plant growth-promoting bacteria associated with the roots of Indian mustard (Brassica juncea L. Czern.)[J]. Soil Biology Biochemistry, 2005, 37: 241-250. DOI:10.1016/j.soilbio.2004.07.033 |
| [27] |
Bhattacharyya C, Bakshi U, Mallick I, et al. Genome-guided insights into the plant growth promotion capabilities of the physiologically versatile Bacillus aryabhattai strain AB211[J]. Frontiers Microbiol, 2017, 8: 411. |
| [28] |
Teijeiro RG, Belimov AA, Dodd IC. Microbial inoculum development for ameliorating crop drought stress :A case study of Variovorax paradoxus 5C-2[J]. New Biotechnology, 2020, 56: 103-113. DOI:10.1016/j.nbt.2019.12.006 |
| [29] |
Jiang F, Chen L, Belimov AA, et al. Multiple impacts of the plant growth promoting rhizobacterium Variovorax paradoxus 5C- 2 on nutrient and ABA relations of Pisum sativum[J]. J Exp Bot, 2012, 63(18): 6421-6430. DOI:10.1093/jxb/ers301 |
| [30] |
Wang QY, Dodd IC, Belimov AA, et al. Rhizosphere bacteria containing 1-aminocyclopropane-1-carboxylate deaminase increase growth and photosynthesis of pea plants under salt stress by limiting Na+ accumulation[J]. Functional Plant Biology, 2016, 43: 161-172. DOI:10.1071/FP15200 |
| [31] |
刘宁, 刘全儒, 姜帆, 于明. 植物生物学实验指导[M]. 北京: 高等教育出版社, 2016. Liu N, Liu QR, Jiang F, Yu M. Experimental guidance of plant biology[M]. Beijing: Higher Education Press, 2016. |
| [32] |
Staal M, de Cnodder T, Simon D, et al. Apoplastic alkalinization is instrumental for the inhibition of cell elongation in the Arabidopsis root by the ethylene precursor 1-aminocyclopropane-1-carboxylic acid[J]. Plant Physiology, 2011, 155: 2049-2055. DOI:10.1104/pp.110.168476 |
| [33] |
Street IH, Aman S, Zubo Y, et al. Ethylene inhibits cell proliferation of the Arabidopsis root meristem[J]. Plant Physiology, 2015, 169: 338-350. DOI:10.1104/pp.15.00415 |
| [34] |
Pružinská A, Tanner G, Anders I, et al. Chlorophyll breakdown : Pheophorbide a oxygenase is a rieske-type iron-sulfut protein, encoded by the accelerated cell death 1 gene[J]. Proceedings of the National Academy of Sciences of the United States of America, 2003, 100: 15259-15264. DOI:10.1073/pnas.2036571100 |
| [35] |
Xu Y, Huang BR. Effects of folar-applied ethylene inhibitor and synthetic cytokinin on creeping bentgrass to enhance heat tolerance[J]. Crop Science, 2009, 49: 1876-1884. DOI:10.2135/cropsci2008.07.0441 |
| [36] |
Chen Y, Cothren JT, Chen DH, et al. Ethylene-inhibiting compound 1-MCP delays leaf senescence in cotton plants under abiotic stress conditions[J]. Journal of Integrative Agriculture, 2015, 14(7): 1321-1331. DOI:10.1016/S2095-3119(14)60999-0 |
| [37] |
Jespersen D, Yu JJ, Huang B. Metabolite responses to exogenous application of nitrogen, cytokinin, and ethylene inhibitors in relation to heat-induced senescence in creeping bentgrass[J]. PLoS One, 2015, 10(3): 1-19. |
| [38] |
Yuan C, Cothren JT, De-Hua C, et al. Ethylene-inhibiting compound 1-MCP delays leaf senescence in cotton plants under abiotic stress conditions[J]. Journal of Agricultural Sciences, 2015, 14(7): 1321-1331. |
| [39] |
Yin XR, Xie XL, Xia XJ, et al. Involvement of an ethylene response factor in chlorophyll degradation during citrus fruit degreening[J]. Plant Journal, 2016, 86(5): 403-412. DOI:10.1111/tpj.13178 |
| [40] |
Li YS, Mao XT, Tian QY, et al. Phosphorus deficiency induced reduction in root hydraulic conductivity in Medicago falcate is associated with ethylene production[J]. Environmental and Experimental Botany, 2009, 67(1): 172-177. DOI:10.1016/j.envexpbot.2009.05.013 |
| [41] |
Groppa MD, Benavides MP, Zawoznik MS. Root hydraulic conductance, aquaporins and plant growth promoting microorganisms :a revision[J]. Applied Soil Ecology, 2012, 61: 247-254. DOI:10.1016/j.apsoil.2011.11.013 |





