尽管国内滤泡性淋巴瘤(follicular lymphoma,FL)的发病率明显低于欧美国家,但随着诊疗水平的进步,FL的确诊率正呈逐年上升趋势[1]。病理分级为1~3a级的FL进展缓慢,属侵袭性较低的低级别FL;而3b级FL的临床表现及生物学特性与弥漫性大B细胞淋巴瘤(diffuse large B-cell lymphoma,DLBCL)相似,且可以向更高级别转化,属侵袭性较高的高级别FL。高级别FL与低级别FL的治疗策略相差较大,临床上需对FL的侵袭性进行评价[2-3]。目前FL的治疗方法以全身化疗为主,而化疗中期疗效是选择后续治疗方案的重要参考。因此,对FL侵袭性进行准确评估以及了解基线18F-FDG PET/CT检查与中期疗效的相关性对于FL的诊疗非常重要。
18F-FDG PET/CT作为基于糖代谢显像的全身性检查手段,在DLBCL等淋巴瘤亚型的诊治中的应用日益广泛,其有效性逐渐被临床证实和认可[4-7],18F-FDG PET/CT在FL诊疗中的应用也被国内外指南所推荐[8-9]。笔者主要探讨18F-FDG PET/CT基线SUVmax在初诊FL患者侵袭性评价中的价值及其与化疗中期疗效的相关性。
1 资料与方法 1.1 一般资料回顾性分析2011年6月至2017年9月于我院PET/CT中心行基线18F-FDG PET/CT检查的初诊为FL的患者。入选标准:组织病理学证实为FL或FL/DLBCL混合型;应用R-CHOP(利妥昔单抗联合环磷酰胺、阿霉素、长春新碱和泼尼松)化疗方案至少3个周期。排除标准:虽行组织病理学检查但FL病理分级不明确;检查前有针对FL的放化疗史;有其他恶性肿瘤病史。本研究共入选FL患者48例,其中,男性20例,女性28例,平均年龄(48.79±18.25)岁。其中18例患者在化疗中期(3个周期后)再次行18F-FDG PET/CT检查进行中期疗效评价。本研究经我院伦理委员会批准(审批号:2017087)。入选患者均签署了知情同意书。
1.2 PET/CT检查方法及图像分析扫描仪器采用美国GE公司Discovery VCT PET/CT。显像剂18F-FDG由日本住友公司回旋加速器生产,放化纯度>95%,放射性浓度>370 MBq/mL,pH值为4~8。检查前患者禁食4~6 h,给药前血糖水平控制在8.3 mmol/L以下。给药剂量为3.70~5.55 MBq/kg体重,嘱患者检查前口服胃肠道对比剂碘海醇(35 g I/100 mL,北京北陆药业股份有限公司生产)以改善胃肠道显影。注射后静卧50 min,排空膀胱后行PET/CT显像。扫描范围自颅顶至股骨中上段。扫描条件:管电压120 kV,管电流110 mA,旋转速度0.7 s/周,床速29.46 cm/s,矩阵512×512;PET发射扫描采用三维采集,矩阵128×128,根据患者身高采集6~8个床位,1.5 min/床位。采用有序子集最大期望值法进行图像重建,并利用同机CT透射数据对PET图像进行衰减校正,将校正后的PET图像与CT图像融合获得横轴面、矢状面及冠状面的PET、CT及PET/CT融合图像。
由两位有5年以上PET/CT诊断经验的影像医师进行阅片,诊断病灶并测量代谢最高病灶的SUVmax,意见不一致时全科集体讨论决定。SUVmax测量在美国GE公司AW4.4工作站上进行。
中期疗效评价测量病灶瘦体质量SUV(SUV of lean body mass, SUL)及1 cm3体积内平均SUL峰值。
1.3 FL病理分级和临床分期根据2008年世界卫生组织分类标准[10],依据显微镜下中心母细胞和中心细胞的数量对FL进行分级,将其分为1、2、3a、3b级。根据Ann Arbor分期标准[11],基于受累淋巴结的分布以及节外器官的侵犯情况将FL分为Ⅰ~Ⅳ期,并根据Ann Arbor分期将患者分为局限期组(Ⅰ~Ⅱ期)和播散期组(Ⅲ~Ⅳ期)。
1.4 化疗方案及化疗中期疗效评估所有入选患者均首选一线R-CHOP方案至少化疗3个周期,并视情况辅以保肝、保胃、止吐、水化、碱化、解救及对症支持治疗。
中期疗效评估均以患者化疗后3个周期18F-FDG PET/CT为检查手段,参照PERCIST 1.0标准[12]由两位阅片的影像医师进行评价,将疗效分为:完全缓解(complete response,CR),可测量靶病灶18F-FDG摄取完全消失,低于肝脏平均摄取值,且不能与周围血池本底相区别;部分缓解(partial response,PR),可测量靶病灶SUL峰值降低至少30%,且绝对值下降至少0.8 SUL单位,无新病灶出现;疾病进展(progressive disease,PD),SUL峰值增加30%,或肿瘤摄取的可见范围扩大,或出现新病灶;其余情况评价为疾病稳定(stable disease,SD)。CR组包括CR患者,非CR组包括PR、SD和PD患者。
1.5 统计学分析应用Graphpad Prism 6软件对数据进行分析。符合正态分布的连续资料数据用均数±标准差(x±s)表示,两个样本均数比较用两个独立样本均数的t检验;非正态分布资料用中位数表示,两个样本均数比较用Mann-Whitney U检验。两个样本率的比较用Fisher精确检验法。不同Ann Arbor分期与SUVmax的相关性应用Spearman相关性分析。P<0.05表示差异有统计学意义。
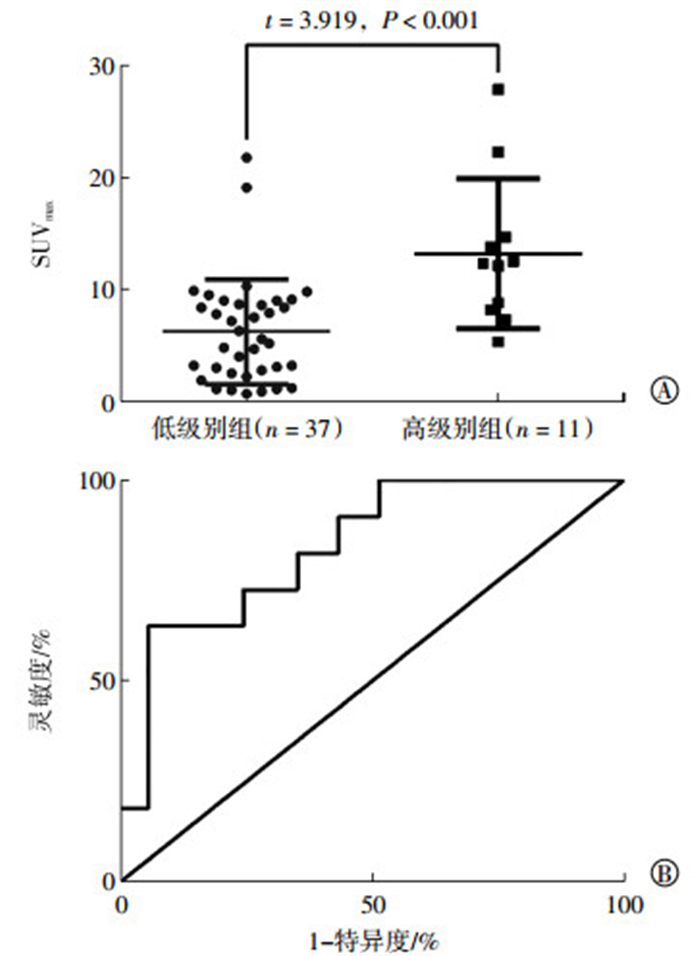
2 结果 2.1 基线SUVmax评估FL侵袭性的价值本研究中48例FL患者依据组织病理学分级分为低级别组(1级、2级、3a级)37例和高级别组(3b级及以上)11例。其中,高级别组包含2例病理诊断结果为FL和DLBCL混合型的患者,1例前期病理诊断结果为FL 3b级,后续化疗效果不佳再次取病理组织证实为DLBCL患者,此3例考虑为FL向DLBCL转化,纳入高级别FL组。低级别组和高级别组患者的基线SUVmax分别为6.23±4.68(0.9~21.8)和13.20±6.68(5.3~27.9),差异具有统计学意义(t=3.919,P<0.001)。受试者工作特征曲线(receiver operating characteristic curve, ROC)曲线下面积为0.835,当SUVmax为11.2时,诊断高级别FL的灵敏度和特异度分别为63.64%和94.59%。基线SUVmax对FL侵袭性的评估效能见图 1。
|
图 1 基线SUVmax评估滤泡性淋巴瘤的侵袭性 Figure 1 Evaluation of baseline SUVmax on the invasiveness among follicular lymphoma patients 图中,A:低级别组和高级别组基线SUVmax;B:基线SUVmax预测滤泡性淋巴瘤病理分级的受试者工作特征曲线。SUVmax:最大标准化摄取值。 |
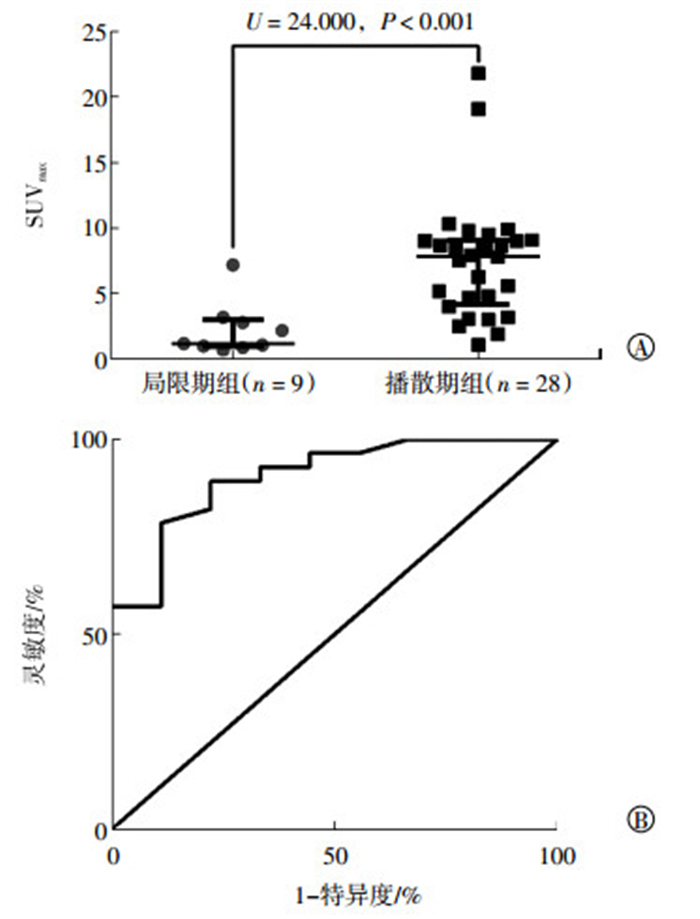
本研究48例FL患者中分期为Ⅰ~Ⅳ期的患者分别为3、12、13和20例。通过Spearman相关性分析评价SUVmax与各分期的相关性,结果未见明显相关性(r=0.242,P=0.098)。局限期组和播散期组患者SUVmax分别为6.11±6.28和8.61±5.67,差异无统计学意义(t=1.365,P=0.179)。但低级别FL患者中局限期组和播散期组的SUVmax中位数分别为1.20和7.85,非参数检验表明两组间差异具有统计学意义(U=24.000,P<0.001)。ROC曲线下面积为0.905,当SUVmax为3.6时,诊断低级别FL病变播散期的灵敏度和特异度分别为78.57%和88.89%,基线SUVmax对低级别FL播散程度的评估效能见图 2。高级别FL患者中局限期组和播散期组的SUVmax中位数分别为10.45和12.50,差异无统计学意义(U=11.000,P=0.528)。
|
图 2 基线SUVmax评估低级别滤泡性淋巴瘤的播散程度 Figure 2 Evaluation of baseline SUVmax on disease dissemination among low-grade follicular lymphoma patients 图中,A:局限期组和播散期组低级别滤泡性淋巴瘤的基线SUVmax;B:基线SUVmax预测低级别滤泡性淋巴瘤播散期的受试者工作特征曲线。SUVmax:最大标准化摄取值。 |
本研究48例患者的中位随访期为16个月(1~77个月),其中2例病理分级为1级的FL患者在检查后10个月和68个月复发,1例病理分级为2级的FL患者在检查后36个月复发;1例病理分级为3级的FL患者在11个月后再次经组织病理学检查结果证实转变为DLBCL。至随访结束无死亡病例。因复发及死亡病例数较少,本研究只对中期疗效进行评价分析。
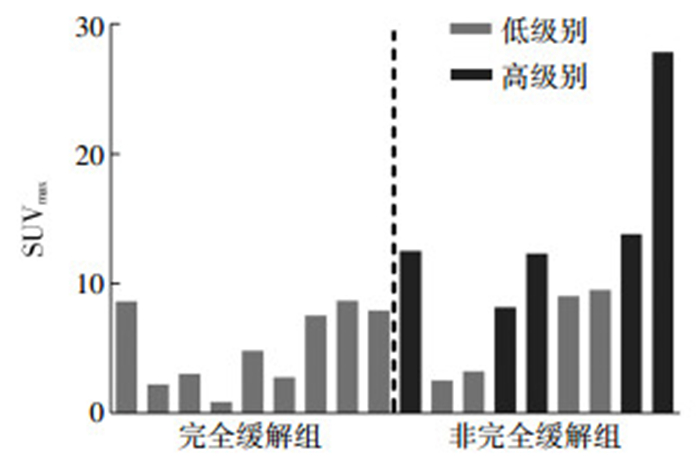
本研究48例FL患者中有18例在3个R-CHOP化疗周期后再次行18F-FDG PET/CT检查,中期疗效CR者9例,非CR者9例,且全部为PR,无SD和PD患者。其中,9例CR者全部病理分级为低级别FL,9例非CR者中包括4例低级别FL和5例高级别FL,具体情况见图 3。CR组和非CR组间年龄(t=0.602,P=0.556)、性别(P=0.153)、局限期或播散期(P=0.576)的差异均无统计学意义。但两组间基线SUVmax分别为5.16±3.05和10.99±7.45,差异具有统计学意义(t=2.172,P=0.045)。典型病例见图 4、图 5。
|
图 3 滤泡性淋巴瘤患者基线SUVmax与中期疗效的相关性 Figure 3 Baseline SUVmax and interim therapeutic response among follicular lymphoma patients 图中,SUVmax:最大标准化摄取值。 |
|
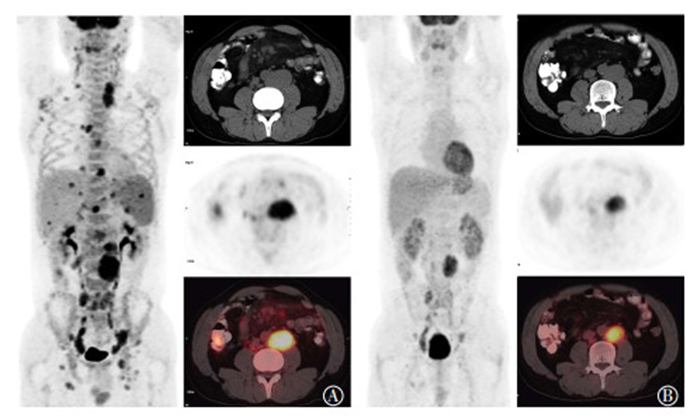
图 4 非完全缓解组滤泡性淋巴瘤患者治疗前后18F-FDG PET/CT图像对比 Figure 4 The 18F-FDG PET/CT images comparison of one follicular lymphoma patient in the non-complete response group before and after therapy 患者男性,39岁,图中,A:患者化疗前最大密度投影图(左栏)示全身多发高代谢淋巴结,CT、PET及PET/CT融合图像(右栏自上而下)示左侧腹膜后增大淋巴结,基线最大标准化摄取值约为12.3;B:3个周期利妥昔单抗联合环磷酰胺、阿霉素、长春新碱和泼尼松化疗后,全身最大密度投影图(左栏)示大部分病灶代谢消失,但CT、PET及PET/CT融合图像(右栏自上而下)可见原左侧腹膜后增大淋巴结较治疗前略有缩小,代谢仍高,最大标准化摄取值约为6.2,疗效评价为部分缓解。 |
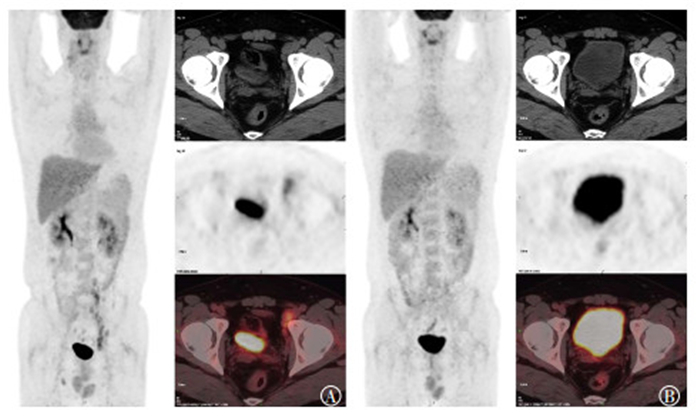
|
图 5 完全缓解组滤泡性淋巴瘤患者治疗前后18F-FDG PET/CT图像对比 Figure 5 18F-FDG PET/CT images comparison of one follicular lymphoma patient in the complete response group before and after therapy 患者男性,32岁,图中,A:患者化疗前最大密度投影图(左栏)示全身多发低-中代谢的淋巴瘤累及淋巴结,CT、PET及PET/CT融合图像(右栏自上而下)示左侧髂血管走行区多枚增大淋巴结,基线最大标准化摄取值约为4.8;B:3个周期利妥昔单抗联合环磷酰胺、阿霉素、长春新碱和泼尼松化疗后,全身最大密度投影图(左栏)示全身未见异常代谢淋巴结,CT、PET及PET/CT融合图像(右栏自上而下)示左侧髂血管走行区增大淋巴结消失,疗效评价为完全缓解。 |
FL作为一种国内相对少见的B细胞淋巴瘤,随着对其发病机制及临床诊治研究的逐步深入,目前已有相对比较成熟的临床指南用于指导其临床治疗[1, 8-9]。但仍有某些关键临床问题需要解决或改善,比如如何全面评估多部位受累FL患者疾病的侵袭性以制定合适的治疗方案,以及如何根据患者的个体治疗效应及时调整化疗方案。笔者通过对初诊为FL患者化疗前的18F-FDG PET/CT基线SUVmax与患者病理分级、Ann Arbor分期以及R-CHOP中期疗效进行统计学分析,结果表明FL患者的基线SUVmax可有效评估FL的侵袭性,并与R-CHOP化疗方案的中期疗效、低级别FL病变播散程度密切相关。
不同病理分级的FL可表现为惰性(1~2级、3a级)和侵袭性(3b级及以上)两种截然不同的生物学进程,临床上需采用不同的治疗方案[1, 13-14]。因此,FL患者化疗前面临的首个关键问题就是如何有效评估疾病的侵袭性。目前临床上大多沿用2008年世界卫生组织分类标准中对FL患者取病理标本进行病理分级的方法,病理分级法除了具有创伤性和在某些情况下取材困难外,还有其他一些不足,例如FL作为一种全身性疾病,不同部位的病变具有异质性,且具有向DLBCL逐步进展的特性,因此病理分级法具有部位取材和时间取材的偏倚性,难以对全身病变的侵袭性进行系统性的全面评价[1]。18F-FDG PET/CT作为一种全身性的检查方法,可一站式对全身多部位病灶的糖代谢水平进行检测,研究结果证实18F-FDG水平与FL的侵袭性密切相关,如戴娜等[15]和丁重阳等[16]的研究结果都表明了1~2级FL与3级FL化疗前SUVmax的差异具有统计学意义。我们对纳入的48例FL患者进行了不同病理分级的组间SUVmax差异分析,将1~2级和3a级纳入低级别组,3b级纳入高级别组,实现了真正意义上FL惰性和侵袭性亚型的划分,结果表明高级别FL具有更高的基线SUVmax。需要注意的是,虽然本研究中低级别组和高级别组的基线SUVmax差异有统计学意义,但两者有一定范围的交叉,低级别组有2例SUVmax也较高(>19),而高级别组也有部分病例的SUVmax低于低级别组的平均值。有研究者认为高低级别淋巴瘤SUVmax的交叉可能源于病变葡萄糖转运蛋白1表达的不同[17]。本研究与上述多个研究结果中相同病理分组的SUVmax有少许出入,如戴娜等[15]、丁重阳等[16]及本研究结果中低级别组SUVmax分别为5.26、6.90和6.23,而高级别组SUVmax分别为9.54、12.4和13.2。本研究中高级别组SUVmax略高,可能与本研究高级别组纳入的是3b分级的FL患者,而上述其他两项研究高级别组纳入的是3a和3b分级的FL患者有关。另外,机器性能和选取的研究人群不同也可能会影响SUVmax。上述多个研究的结论较为一致,即基线SUVmax与FL病理分级密切相关,可有效反映FL侵袭性,在临床评价FL侵袭性方面可作为病理分级的有力补充。
淋巴瘤患者开始化疗后何时及如何改变化疗方案是临床面临的另外一个难题,目前的基本思路是根据临床指南和疗效评估结果进行化疗方案调整,但FL较为特殊,不但不同病理分级间的生物学行为差别较大,还有向更高级别类型进展的特性,给临床及时更改个体化化疗方案带来了挑战,不合适的治疗方案会导致化疗不足或者化疗过度的严重后果。临床上采用传统影像学RECIST评价标准对淋巴瘤进行疗效评估的效果并不理想,会低估一些体积较小但受累的病变[18]。我们通过PERCIST标准对疗效进行评价具有更高的效能。18F-FDG PET/CT基线SUVmax对淋巴瘤疗效和预后的预测价值目前研究结论不一,部分研究者认为基线SUVmax与淋巴瘤的预后密切相关[19-20],近期也有研究结果表明治疗中期和末期PET/CT检查及SUVmax的变化值与淋巴瘤的预后相关,而非基线SUVmax[21-22]。但基线SUVmax与中期疗效的相关性研究相对较少。本研究中参与化疗中期疗效评估的18例患者中9例为CR,另9例为非CR,其中CR者具有更低的基线SUVmax,表明基线SUVmax与R-CHOP方案的中期疗效具有一定的相关性。
本研究结果表明整体FL患者基线SUVmax与Ann Arbor分期并无明显相关性,此结论与既往大多研究结果较为一致[13]。根据Ann Arbor分期将FL分为局限期组和播散期组,两组间的SUVmax差异没有统计学意义。但在低级别FL患者中,播散期组的基线SUVmax明显高于局限期组,提示基线SUVmax是预测低级别FL病变播散程度的可靠指标。
本研究有以下不足:①本研究样本量较小,且48例患者中只有18例患者治疗后进行了18F-FDG PET/CT复查,故部分结论还有待大样本研究进一步证实;②未行18F-FDG PET/CT在FL患者长期疗效及预后评估中的研究,原因是FL大多表现为惰性生物学行为,复发率较低,生存期较长,复发及预后预测需要更长的研究周期,本研究中复发及死亡病例数较少,无法进行统计学分析。
总之,本研究结果表明基于18F-FDG PET/CT检查的基线SUVmax可有效评估FL的侵袭性,并与R-CHOP方案的中期疗效、低级别FL病变播散程度密切相关,可与病理检查联合作为临床FL管理的有力工具。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 戴云秀负责论文数据获取及论文撰写;杨光杰、王振光负责课题设计、论文审阅及修订;赵钰鋆、于明明负责论文数据获取;李大成、武凤玉、刘思敏负责论文数据分析。
| [1] |
中华医学会血液学分会, 中国抗癌协会淋巴瘤专业委员会.
中国滤泡性淋巴瘤诊断与治疗指南(2013年版)[J]. 中华血液学杂志, 2013, 34(9): 820–824.
DOI:10.3760/cma.j.issn.0253-2727.2013.09.020 Chinese Society of Hematology, Chinese Medical Association, ChineseSociety of Lymphoma, ChineseAnti-cancer Association. Chinese guidelines for diagnosis and treatment of follicular lymphoma(2013)[J]. Chin J Hematol, 2013, 34(9): 820–824. DOI:10.3760/cma.j.issn.0253-2727.2013.09.020 |
| [2] |
叶琇锦, 钱文斌.
滤泡性淋巴瘤预后和分层治疗策略[J]. 中国实用内科杂志, 2015, 35(2): 99–101.
DOI:10.7504/nk2015010105 Ye XJ, Qian WB. The current prognostic tools and strategy for treating follicular lymphoma[J]. Chin J Pract Intern Med, 2015, 35(2): 99–101. DOI:10.7504/nk2015010105 |
| [3] | Mendez M, Torrente M, Provencio M. Follicular lymphomas and their transformation:Past and current research[J]. Expert Rev Hematol, 2017, 10(6): 515–524. DOI:10.1080/17474086.2017.1326812 |
| [4] | Yang G, Nie P, Wang Z, et al. 18F-FDG hepatic superscan caused by a non-germinal center subtype of diffuse large B-cell lymphoma[J]. Eur J Nucl Med Mol Imaging, 2016, 43(10): 1928. DOI:10.1007/s00259-016-3399-0 |
| [5] |
刘青青, 王振光, 王楠, 等.
非霍奇金淋巴瘤与广泛淋巴结转移癌的18F-FDG PET/CT淋巴结影像特征比较[J]. 中华核医学与分子影像杂志, 2016, 36(2): 142–145.
DOI:10.3760/cma.j.issn.2095-2848.2016.02.010 Liu QQ, Wang ZG, Wang N, et al. Characteristics of lymph nodes on 18F-FDG PET/CT imaging in patients with non-Hodgkin's lymphoma and widespread lymph node metastases carcinoma[J]. Chin J Nucl Med Mol Imaging, 2016, 36(2): 142–145. DOI:10.3760/cma.j.issn.2095-2848.2016.02.010 |
| [6] |
吕清湖, 唐明灯, 林端瑜, 等.
原发鼻咽淋巴瘤与鼻咽癌的18F-FDG PET/CT诊断与鉴别[J]. 国际放射医学核医学杂志, 2017, 41(3): 166–172.
DOI:10.3760/cma.j.issn.1673-4114.2017.03.002 Lyu QH, Tang MD, Lin DY, et al. Value of 18F-FDG PET/CT examination in the differential diagnosis of primary nasopharyngeal lymphoma and nasopharyngeal carcinoma[J]. Int J Radiat Med Nucl Med, 2017, 41(3): 166–172. DOI:10.3760/cma.j.issn.1673-4114.2017.03.002 |
| [7] |
秦文琼, 高硕.
PET/CT与临床预后因素在弥漫大B细胞淋巴瘤疗效评价及预后评估中的应用[J]. 国际放射医学核医学杂志, 2017, 41(6): 437–442.
DOI:10.3760/cma.j.issn.1673-4114.2017.06.010 Qin WQ, Gao S. Application of PET/CT and clinical factors in the therapeutic and prognostic evaluation of diffuse large B cell lymphoma[J]. Int J Radiat Med Nucl Med, 2017, 41(6): 437–442. DOI:10.3760/cma.j.issn.1673-4114.2017.06.010 |
| [8] | Younes A, Hilden P, Coiffier B, et al. International Working Group consensus response evaluation criteria in lymphoma(RECIL 2017)[J]. Ann Oncol, 2017, 28(7): 1436–1447. DOI:10.1093/annonc/mdx097 |
| [9] |
中华医学会核医学分会PET与分子影像学组.
淋巴瘤18F-FDG PET/CT显像临床应用指南(2016版)[J]. 中华核医学与分子影像杂志, 2016, 36(5): 458–460.
DOI:10.3760/cma.j.issn.2095-2848.2016.05.017 Imaging Group of Chinese Society of Nuclear Medicine. Clinical practice guideline of 18F-FDG PET/CT in lymphoma(2016 edition)[J]. Chin J Nucl Med Mol Imaging, 2016, 36(5): 458–460. DOI:10.3760/cma.j.issn.2095-2848.2016.05.017 |
| [10] | Jaffe ES. The 2008 WHO classification of lymphomas:implications for clinical practice and translational research[J]. Hematology Am Soc Hematol Educ Program, 2009, 2009(1): 523–531. DOI:10.1182/asheducation-2009.1.523 |
| [11] | Finn WG, Kroft SH. New classifications for non-Hodgkin's lymphoma[J]. Cancer Treat Res, 1999, 99(99): 1–26. DOI:10.1007/978-0-585-38571-6_1 |
| [12] | O JH, Lodge MA, Wahl RL. Practical PERCIST:A Simplified Guide to PET Response Criteria in Solid Tumors 1[J]. Radiology, 2016, 280(2): 576–584. DOI:10.1148/radiol.2016142043 |
| [13] | Takata K, Miyata-Takata T, Sato Y, et al. Pathology of follicular lymphoma[J]. J Clin Exp Hematop, 2014, 54(1): 3–9. DOI:10.3960/jslrt.54.3 |
| [14] | Fischer T, Zing NPC, Chiattone CS, et al. Transformed follicular lymphoma[J]. Ann Hematol, 2018, 97(1): 17–29. DOI:10.1007/s00277-017-3151-2 |
| [15] |
戴娜, 吴翼伟, 章斌.
18F-FDG PET/CT对不同分级和分期滤泡性淋巴瘤诊断及预后评估的价值[J]. 中华核医学与分子影像杂志, 2014, 34(1): 23–26.
DOI:10.3760/cma.j.issn.2095-2848.2014.01.008 Dai N, Wu YW, Zhang B. Grading, staging and prognosis of follicular lymphoma:the value of 18F-FDG PET/CT[J]. Chin J Nucl Med Mol Imaging, 2014, 34(1): 23–26. DOI:10.3760/cma.j.issn.2095-2848.2014.01.008 |
| [16] |
丁重阳, 李天女, 孙晋, 等.
18F-FDG PET/CT在滤泡性淋巴瘤分期及疗效评价中的临床价值[J]. 中华核医学与分子影像杂志, 2014, 34(3): 179–182.
DOI:10.3760/cma.j.issn.2095-2848.2014.03.005 Ding CY, Li TN, Sun J, et al. Clinical value of 18F-FDG PET/CT in clinical staging and therapeutic evaluation of follicular lymphoma[J]. Chin J Nucl Med Mol Imaging, 2014, 34(3): 179–182. DOI:10.3760/cma.j.issn.2095-2848.2014.03.005 |
| [17] | Rodriguez M, Rehn S, Ahlström H, et al. Predicting malignancy grade with PET in non-Hodgkin's lymphoma[J]. J Nucl Med, 1995, 36(10): 1790–1796. |
| [18] | Minamimoto R, Fayad L, Advani R, et al. Diffuse large B-Cell lymphoma:prospective multicenter comparison of early interim FLT PET/CT versus FDG PET/CT with IHP, EORTC, deauville, and PERCIST criteria for early therapeutic monitoring[J]. Radiology, 2016, 280(1): 220–229. DOI:10.1148/radiol.2015150689 |
| [19] | Suh C, Kang YK, Roh JL, et al. Prognostic value of tumor 18F-FDG uptake in patients with untreated extranodal natural killer/T-cell lymphomas of the head and neck[J]. J Nucl Med, 2008, 49(11): 1783–1789. DOI:10.2967/jnumed.108.053355 |
| [20] | Ahmadzadehfar H, Rodrigues M, Zakavi R, et al. Prognostic significance of the standardized uptake value of pre-therapeutic 18F-FDG PET in patients with malignant lymphoma[J]. Med Oncol, 2011, 28(4): 1570–1576. DOI:10.1007/s12032-010-9584-2 |
| [21] | Tychyj-Pinel C, Ricard F, Fulham M, et al. PET/CT assessment in follicular lymphoma using standardized criteria:central review in the PRIMA study[J]. Eur J Nucl Med Mol Imaging, 2014, 41(3): 408–415. DOI:10.1007/s00259-013-2441-8 |
| [22] | Angelopoulou MK, Mosa E, Pangalis GA, et al. The significance of PET/CT in the initial staging of hodgkin lymphoma:experience outside clinical trials[J]. Anticancer Res, 2017, 37(10): 5727–5736. DOI:10.21873/anticanres.12011 |
 2018, Vol. 42
2018, Vol. 42


