鼻咽是头颈部结外淋巴瘤累及Waldeyer淋巴环时常受累部位之一,研究证实鼻咽部非霍奇金淋巴瘤(non-Hodgkin's lymphoma,NHL)占Waldeyer环淋巴瘤的10%~28%[1-2]。鼻咽部最常见恶性肿瘤是鼻咽癌(nasopharyngeal carcinoma,NPC),在影像学检查中发现鼻咽肿块而缺乏特异性征象时,原发鼻咽淋巴瘤(primary nasopharyngeal lymphoma,PNL)常易被误诊为NPC,而二者在治疗及预后上均有明显差别。18F-FDG PET/CT能同时从解剖及功能代谢方面对病变进行评价,在肿瘤诊断、疗效评价、监测复发等方面应用广泛,在怀疑为鼻咽部肿瘤的患者中,PET/CT常用于病变的定性及分期诊断。目前国内外关于PET/CT对PNL与NPC鉴别诊断方面的研究较少,我们通过分析对比两者PET/CT影像学表现,以期提高二者诊断的准确率,减少误诊。
1 资料与方法 1.1 一般资料收集2012年至2016年先后在本院行18F-FDG PET/CT并经病理确诊为NPC或PNL的104例病例,其中NPC71例(男性46例、女性25例),年龄16~74岁,平均年龄(44±14)岁;PNL 33例(男性24例、女性9例),年龄11~78岁,平均年龄(50±20)岁,包括弥漫性大B细胞淋巴瘤(diffuse large B cell lymphoma, DLBCL)19例、NK/T细胞淋巴瘤4例、T细胞淋巴瘤3例、Burkitt淋巴瘤1例、套细胞淋巴瘤1例、经典型霍奇金淋巴瘤4例、黏膜相关淋巴组织边缘区B细胞淋巴瘤1例。
所有患者均于检查前签署了知情同意书,本研究获得了单位伦理委员会的批准。
1.2 纳入及排除标准(1)初诊患者,接受PET/CT检查前未进行抗肿瘤治疗;(2)均在检查前后1周内行鼻咽镜检查并活检,获取常规组织学及免疫组化结果;(3)淋巴瘤病例中最大肿块中心位于鼻咽部,且剔除PET/CT检查中除鼻咽以外Waldeyer环或全身广泛浸润的病例;(4)病理资料完整。
1.3 18F-FDG PET/CT检查方法采用荷兰Philips公司生产的Gemini TF 64 PET/CT仪,18F-FDG由日本住友公司HM-10回旋加速器生产,放化纯度>95%。患者检查前禁食6 h以上,控制血糖范围在3.9~7.5 mmol/L。经静脉注射185~370 MBq 18F-FDG后,安静休息约60 min,排尿后仰卧位上机扫描。头颈部与体部采用不同采集参数分开扫描,头颈部扫描自颅顶至上胸部采集3个床位,后行体部扫描,范围自上胸部至大腿根部,CT扫描采集条件分别为120 kV,300 mA,矩阵512×512,层厚2 mm;120 kV,200 mA,矩阵512×512,层厚5 mm。PET以1 min/床位的速度采集。采用三维模式采集,应用CT数据进行衰减校正,在EBW2.0后处理工作站上将PET图像和CT图像融合,分别得到横断面、矢状面及冠状面的PET、CT及PET/CT融合图像。
1.4 分析指标每例患者均由两名有5年工作经验的核医学科医师独立阅片并综合得出结论,意见不一致时由科内讨论决定。分析内容包括病变体积(MedEx软件自动勾画代谢肿瘤体积)、对称或不对称、单侧或双侧(越过中线体积超过肿块体积10%判定为双侧)、范围(完全或不完全浸润黏膜壁)、周围浸润(是否累及口咽壁、咽旁间隙、椎前肌、颅底骨质、鼻后孔)、SUVmax;有颈部淋巴结转移或浸润者记录其最大者长径及短径、SUVmax、坏死及相互融合情况,确诊淋巴结是否为转移或浸润,通过PET/CT或MRI随访证实,经放疗或化疗后淋巴结体积有明显增大或缩小考虑为淋巴结转移或浸润。
1.5 统计学分析应用SPSS13.0统计软件进行分析。SUVmax、病变体积数据以均数±标准差(x±s)表示,数据符合正态分布、方差齐时采用t检验,方差不齐时采用校正t检验;病变形态、范围、周围浸润、淋巴结坏死之间的比较采用χ2检验。P<0.05表示差异有统计学意义。
2 结果 2.1 病变形态、范围33例PNL患者中20例病变呈弥漫性浸润鼻咽全壁(双侧对称14例、双侧不对称6例),未完全浸润全壁13例(单侧7例、双侧6例);71例NPC患者中10例呈弥漫性浸润鼻咽全壁(双侧对称4例、双侧不对称6例),未完全浸润全壁61例(单侧39例、双侧22例);PNL与NPC累及全壁与不全、单侧与双侧、对称与不对称间差异均有统计学意义(表 1)。
| 表1 PNL与NPC患者PET/CT显像各参数的比较 Table 1 Parameters of PNL and NPC in PET/CT imaging |
33例PNL患者中26例病变局限于鼻咽壁,7例累及深部结构(4例浸润颅底骨质、2例累及椎前肌、4例累及咽旁间隙),71例NPC患者中17例局限于鼻咽壁,54例累及深部结构(33例累及颅底骨质、29例累及椎前肌、21例累及咽旁间隙),两者间差异有统计学意义(χ2=27.94,P<0.001);33例PNL患者中21例病变凸入鼻后孔(21/33,63.6%),71例NPC患者中24例凸入鼻后孔(24/71,33.8%),差异有统计学意义(χ2=8.17,P<0.05)(表 1)。PNL及NPC典型PET/CT表现见图 1。
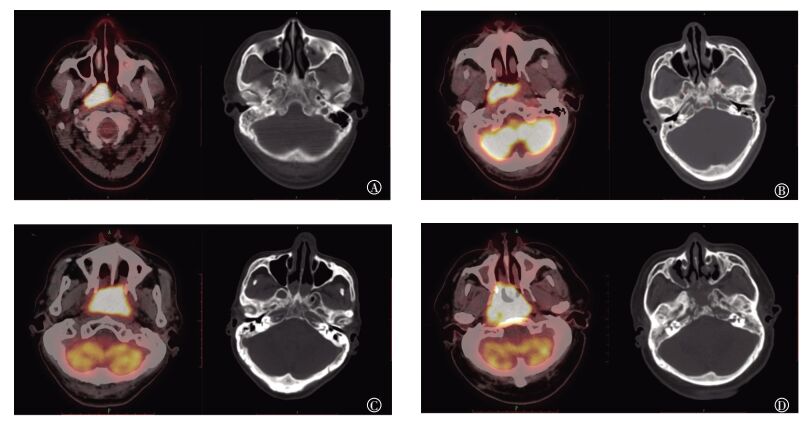
|
图 1 鼻咽淋巴瘤和鼻咽癌患者的典型PET/CT表现图中, A、C为淋巴瘤病例, B、D为鼻咽癌病例, 左侧为PET/CT融合图像, 右侧为对应病例颅底CT骨窗图像。A:男性, 53岁, 弥漫性大B细胞淋巴瘤患者, 病变凸入鼻后孔, 与翼内肌、椎前肌分界清楚, 邻近颅底未见明确骨质改变;B:男性, 62岁, 非角化性未分化癌患者, 病变累及鼻咽壁范围, 与A病例大致相仿, 但颅底可见明显骨质破坏;C:男性, 66岁, 弥漫性大B细胞淋巴瘤患者, 病变累及全鼻咽壁, 凸入鼻后孔, 呈大致对称性生长, 与椎前肌分界清楚, 虽紧贴颅底, 但骨质无明显破坏;D:男性, 59岁, 非角化性未分化癌患者, 病变呈弥漫性生长, 凸入鼻后孔, 双侧不对称, 累及椎前肌及双侧咽旁间隙, 颅底见明显骨质破坏。 Figure 1 Typical PET/CT imaging features of primary nasopharyngeal lymphoma and nasopharyngeal carcinoma paients |
PNL患者的鼻咽肿块体积为(0.18~27.53)×104 mm3,平均(3.70±5.53)×104 mm3;DLBCL患者的鼻咽肿块体积为(0.18~27.53)×104 mm3,平均(5.05±6.89)×104 mm3;NPC患者的鼻咽肿块体积为(0.14~10.74)×104 mm3,平均(2.06±2.31)×104 mm3,PNL、DLBCL组与NPC组间的差异均无统计学意义(t=1.63、1.85,均P>0.05)。PNL、DLBCL、NPC组肿块SUVmax分别为2.8~29.0(12.00±6.34)、5.0~29.0(14.26±6.42)、3.1~28.2(10.09±4.41),PNL组与NPC组间差异无统计学意义(t=1.55,P>0.05),DLBCL组与NPC组间差异有统计学意义(t=2.67,P<0.05)。
2.4 淋巴结大小、SUVmax、坏死及融合情况33例PNL患者中有26例同时伴有咽旁或颈部淋巴结浸润,71例NPC中有51例伴有咽旁或颈部淋巴结转移,不同患者淋巴结SUVmax、最大者长径、短径及平均直径间的差异均无统计学意义(t=0.79、1.37、2.03、1.71,均P>0.05)(表 1);26例伴有咽旁或是颈部淋巴结浸润的PNL患者中3例可见轻度坏死(3/26,11.5%),51例伴有咽旁或颈部淋巴结轻移的NPC患者中31例可见坏死(31/51,60.8%),两者间的差异有统计学意义(χ2=16.94,P<0.001);26例伴有咽旁或颈部淋巴结浸润的PNL患者中淋巴结融合5例(5/26,19.2%),51例伴有咽旁或颈部淋巴结转移的NPC患者中淋巴结融合6例(6/51,11.8%),两者间的差异无统计学意义(χ2=0.78,P>0.05)(表 1)。PNL及NPC淋巴结浸润或转移典型PET/CT表现见图 2。

|
图 2 鼻咽淋巴瘤和鼻咽癌淋巴结浸润或转移患者的典型PET/CT表现图中, 左侧为平扫CT图像, 右侧为PET/CT融合图像;A:男性, 66岁, 弥漫性大B细胞淋巴瘤患者, 为淋巴结颈部淋巴瘤浸润病例, 该病例淋巴结较大, 密度较均匀, 放射性摄取较均匀;B:女性, 53岁, 非角化性未分化鼻咽癌患者, 为鼻咽癌颈部淋巴结转移病例, 该病例中有2枚淋巴结未见坏死, 呈高代谢, 1枚淋巴结平扫见明显低密度坏死, 代谢较未坏死淋巴结明显减低。白色箭头所示为受肿瘤浸润或转移的淋巴结。 Figure 2 Typical PET/CT imaging features of lymphatic involvement or metastasis in primary nasopharyngeal lymphoma and nasopharyngeal carcinoma paients |
在我国NPC和PNL是鼻咽部最为常见的恶性肿瘤,尤其在我国部分南方省份NPC的发病率居高。PET/CT能同时获得功能代谢显像和解剖显像,并且能评价全身肿瘤浸润情况,可弥补传统检查方法的不足。近年,PET/CT在淋巴瘤及NPC的诊断、分期疗效评估及检测复发等方面均具有重要临床应用价值[3-7]。
3.1 病灶形态分析PNL与NPC均起源于鼻咽壁黏膜,文献报道鼻咽部淋巴瘤常表现为弥漫浸润等密度肿块,且常为外生型肿块而阻塞鼻孔[8-10],而NPC更倾向于侵犯邻近深部肌肉及颅底[11-13]。本研究结果显示,PNL更倾向于对称或不对称弥漫性生长,同时更易凸入后鼻孔而阻塞气道,这与临床中鼻咽淋巴瘤患者多以鼻塞为首发症状相符。另外,即使PNL肿块较大,肿块紧贴肌肉或颅底,较少出现肌肉或骨质浸润,King等[8]报道NHL侵犯邻近蝶窦壁的发生率约14%,且多为浅浸润,斜坡、蝶骨大翼受侵犯极为罕见;本研究中4例(12%)浸润颅底骨质,均表现为翼突或翼突根部轻度骨质密度不均匀增高,我们认为该征象仍与肿块生长方式有关,因PNL肿块更倾向于向上、向前生长,但常局限于颅骨以下,当肿块较大紧贴翼突根部时,少部分病例可出现骨质改变。张嵘等[14]发现在MRI影像上PNL向深度侵犯并不少见,颅底骨质破坏占29.3%,邻近肌肉侵犯占48.8%,主要原因可能是在CT图像上病变对周围小肌肉及颅底骨质轻微浸润难于显示,但其相对于NPC破坏的程度明显较小。NPC多呈单侧或不对称生长,较少累及全壁,生长方式更倾向于向后、向上侵犯,颅底骨质除翼突外常累及斜坡、蝶骨及颞骨岩部,当肿块边缘紧贴骨质时骨质多呈较明显成骨或溶骨性改变。NPC肿块较大时也常向前凸入鼻后孔,但相对PNL少见,两者差异有统计学意义,当PNL或NPC肿块超出鼻后孔时均易向鼻腔内生长。
3.2 病灶体积、SUVmax分析本研究结果显示,虽然PNL浸润全壁者占多数(20/33,60.6%),但肿块体积与NPC患者相比差异并无统计学意义,DLBCL患者与NPC患者间肿块体积差异亦无统计学意义。Cho等[9]对PNL及NPC体积进行了对比研究,得出PNL的体积要大于NPC,可能与PNL临床症状出现较晚有关,PNL较少向深部组织浸润,且生长相对缓慢,较少出现坏死、出血,临床多以鼻塞为首发症状;而NPC较易坏死及侵犯深部结构,引起鼻衄或相应神经系统症状就诊。本研究结论与之不相符,可能与测量方法或样本差异有关,其主要通过勾画鼻咽部MRI异常信号ROI获得,而本研究中的病例是通过软件自动勾画肿瘤代谢体积获得。肿瘤SUVmax与病变病理类型、分化程度、免疫表型、体积等有关,淋巴瘤的病理类型繁多,不同病理亚型淋巴瘤的18F-FDG摄取程度存在差异[15]。另外,部分非惰性淋巴瘤在病理上会有惰性分化,PET/CT表现为糖代谢稍高或假阴性,影响肿瘤代谢体积。因此,为了尽量减少不同病理亚型所致代谢水平差异过大的影响,我们另外单独选取样本量较多的DLBCL与NPC患者进行比较。本研究结果显示,PNL与NPC患者鼻咽部病变SUVmax差异无统计学意义,但DLBCL与NPC患者间SUVmax差异有统计学意义,由于其他病理亚型淋巴瘤例数较少,我们未进行下一步分析。张建华等[15]研究证实,不同NHL亚型18F-FDG摄取明显不同,侵袭性B细胞NHL代谢活性高于惰性B细胞NHL、T细胞NHL,惰性B细胞NHL代谢活性明显低于侵袭性B细胞NHL、T细胞NHL。本研究中淋巴瘤除DLBCL外其余病理亚型例数较少,因此暂未进行进一步分析讨论,有待积累其他病理亚型的病例。
3.3 咽旁间隙及双颈部淋巴结浸润或转移分析在头颈部结外淋巴瘤中超过50%的患者在初诊或病程中出现淋巴结浸润[16]。但由于PNL与NPC均较易出现咽旁或颈部淋巴结浸润,本研究的病例中两者无明显差异;同时,淋巴结大小、相互融合倾向间的差异也无统计学差异。罗德红等[17]研究了1100例NPC患者后发现,49.4%的转移性淋巴结密度不均匀,这与鳞癌或未分化癌生长速度较快,容易出现缺氧、坏死有关。张嵘等[14]研究结果显示,41例PNL患者中27例合并咽后或颈部淋巴结受侵,仅1例出现坏死。李静等[18]研究结果证实,恶性淋巴瘤颈部淋巴结增强CT多表现为双侧、多发、密度均匀近等于肌肉的淋巴结肿大,但中央低密度在未行治疗的淋巴瘤中亦非少见,应注意与转移性癌鉴别。PET/CT判断淋巴结坏死与否和淋巴结大小及坏死程度有关,淋巴结较大、坏死明显时,PET较平扫CT更加灵敏;而相对于小病灶,仅能通过平扫判断是否存在密度差异,出现假阴性的概率比增强CT高,我们采用头颈部与体部分开扫描的方法,以最大程度提高头颈部CT分辨率,51例NPC淋巴结转移中的31例患者(60.8%)淋巴结检出存在明显或轻度低密度区,PNL患者中仅检出3例(11.5%)出现坏死,两者间的差异有统计学意义,因此在PNL与NPC的PET/CT鉴别中,当颈部淋巴结较大而密度较均匀且未出现可疑低密度坏死时,应考虑到淋巴瘤浸润的可能性。
由于鼻咽部病变在内镜下病理容易获得,临床确诊主要通过病理活检,PET/CT可作为辅助诊断,当鼻咽部肿块呈对称弥漫浸润性生长,无明显侵犯深部结构,凸向鼻后孔,合并咽旁或颈部淋巴结浸润,淋巴结较大但密度较均匀时,应更多地考虑淋巴瘤的可能性;当肿块呈单侧或不对称生长,侵犯颅底、椎前肌、咽旁间隙等深部结构,合并咽旁或颈部淋巴结转移时坏死较明显,则更倾向于诊断为NPC。不同病理亚型淋巴瘤代谢活性可高于或低于NPC,DLBCL的SUVmax高于NPC;病变体积不能作为鉴别PNL和NPC的主要诊断依据。
利益冲突 本研究由署名作者按以下贡献声明独立开展,不涉及任何利益冲突。
作者贡献声明 吕清湖负责研究命题的提出、设计与论文撰写;唐明灯负责论文审查;林端瑜、刘道佳、李生栩负责病例的入组及所需各参数测量、记录。
| [1] | Laskar S, Muckaden MA, Bahl G, et al. Primary non-Hodgkin's lymphoma of the nasopharynx:prognostic factors and outcome of 113 Indian patients[J]. Leuk Lymphoma, 2006, 47(10): 2132–2139. DOI:10.1080/10428190600733531 |
| [2] | Ezzat AA, Ibrahim EM, El Weshi AN, et al. Localized non-Hodgkin's lymphoma of Waldeyer's ring:clinical features, management, and prognosis of 130 adult patients[J]. Head Neck, 2001, 23(7): 547–558. DOI:10.1002/hed.1077 |
| [3] |
党娜, 徐文贵, 宋秀宇, 等.
18F-FDG PET-CT显像在原发结外淋巴瘤诊断中的应用价值[J]. 中华血液学杂志, 2014, 35(1): 35–39.
Dang N, Xu WG, Song XY, et al. The diagnostic value of 18F-FDG PET-CT imaging in patients with primary extranodal lymphoma[J]. Chin J Hematol, 2014, 35(1): 35–39. DOI:10.3760/cma.j.issn.0253-2727.2014.01.009 |
| [4] |
程玮, 常乃柏, 李江涛, 等.
18F-脱氧葡萄糖正电子发射计算机断层显像对淋巴瘤分期和预后评价的作用[J]. 白血病·淋巴瘤, 2012, 21(5): 277–281.
Cheng W, Chang NB, Li JT, et al. Role of 18fluoro-deoxyglucose positron emission tomography on staging and predicting outcome in patients with lymphoma[J]. J Leukemia Lymphoma, 2012, 21(5): 277–281. DOI:10.3760/cma.j.issn.1009-9921.2012.05.006 |
| [5] |
张雯杰, 郑容, 吴宁.
18F-氟代脱氧葡萄糖PET在鼻咽癌中的临床应用价值[J]. 国际放射医学核医学杂志, 2006, 30(2): 94–97.
Zhang WJ, Zheng R, Wu N. Application of 18F-fluorodeoxyglucose PET in nasopharyngeal carcinoma[J]. Int J Radiat Med Nucl Med, 2006, 30(2): 94–97. DOI:10.3760/cma.j.issn.1673-4114.2006.02.009 |
| [6] |
冯彦林, 王颖, 张宁, 等.
鼻咽癌不同模式放疗后的PET/CT早期评估价值的研究[J]. 国际放射医学核医学杂志, 2014, 38(4): 223–226, 246.
Feng YL, Wang Y, Zhang N, et al. Early evaluation value of PET/CT in nasopharyngeal carcinoma after different models of radiother-apy[J]. Int J Radiat Med Nucl Med, 2014, 38(4): 223–226, 246. DOI:10.3760/cma.j.issn.1673-4114.2014.04.004 |
| [7] |
田月丽, 兰晓莉, 张永学.
18F-FDG PET/CT在鼻咽癌综合治疗后患者随访及预后评估中的价值[J]. 国际放射医学核医学杂志, 2013, 37(6): 359–363, 377.
Tian YL, Lan XL, Zhang YX. Prognostic value of 18F-FDG PET/CT for nasopharyngeal carcinoma patients follow-up after comprehen-sive therapy[J]. Int J Radiat Med Nucl Med, 2013, 37(6): 359–363, 377. DOI:10.3760/cma.j.issn.1673-4114.2013.06.009 |
| [8] | King AD, Lei KI, Richards PS, et al. Non-Hodgkin's lymphoma of the nasopharynx:CT and MR imaging[J]. Clin Radiol, 2003, 58(8): 621–625. DOI:10.1016/S0009-9260(03)00182-X |
| [9] | Cho KS, Kang DW, Kim HJ, et al. Differential diagnosis of primary nasopharyngeal lymphoma and nasopharyngeal carcinoma focusing on CT, MRI, and PET/CT[J]. Otolaryngol Head Neck Surg, 2012, 146(4): 574–578. DOI:10.1177/0194599811434712 |
| [10] |
李晓清, 杨天和, 林建忠, 等.
鼻咽部淋巴瘤的MRI表现[J]. 磁共振成像, 2015, 6(5): 349–353.
Li XQ, Yang TH, Lin JZ, et al. Nasopharyngeal lymphoma on MRI[J]. Chin J Magn Reson Imaging, 2015, 6(5): 349–353. DOI:10.3969/j.issn.1674-8034.2015.05.006 |
| [11] | King AD, Bhatia KS. Magnetic resonance imaging staging of nasopharyngeal carcinoma in the head and neck[J]. World J Radiol, 2010, 2(5): 159–165. DOI:10.4329/wjr.v2.i5.159 |
| [12] | King AD, Lam WW, Leung SF, et al. MRI of local disease in nasopharyngeal carcinoma:tumour extent vs tumour stage[J]. Br J Radiol, 1999, 72(826): 734–741. DOI:10.1259/bjr.72.860.10624338 |
| [13] | Zhang SX, Han PH, Zhang GQ, et al. Comparison of SPECT/CT, MRI and CT in diagnosis of skull base bone invasion in nasopha-ryngeal carcinoma[J]. Biomed Mater Eng, 2014, 24(1): 1117–1124. DOI:10.3233/BME-130911 |
| [14] |
张嵘, 谢传淼, 莫运仙, 等.
鼻咽非霍奇金淋巴瘤的MRI表现与侵犯特点[J]. 中华放射学杂志, 2011, 45(2): 170–173.
Zhang R, Xie CM, Mo YX, et al. Non-Hodgkin lymphoma at nasopharynx:features of MRI[J]. Chin J Radiol, 2011, 45(2): 170–173. DOI:10.3760/cma.j.issn.1005-1201.2011.02.017 |
| [15] |
张建华, 王荣福, 范岩, 等.
18F-FDG PET/CT评价初诊非霍奇金淋巴瘤代谢活性及其与免疫表型的相关性[J]. 中华医学杂志, 2014, 94(33): 2576–2579.
Zhang JH, Wang RF, Fan Y, et al. Metabolic activity measured by 18F-FDG PET/CT in newly diagnosed patients with non-Hodgkin lymphoma:correlation with immunophenotyped[J]. Natl Med J China, 2014, 94(33): 2576–2579. DOI:10.3760/cma.j.issn.0376-2491.2014.33.006 |
| [16] | Hanna E, Wanamaker J, Adelstein D, et al. Extranodal lymphomas of the head and neck. A 20-year experience[J/OL]. Arch Otolaryngol Head Neck Surg, 1997, 123(12):1318-1323. DOI:10.1001/archotol.1997.01900120068011. |
| [17] |
罗德红, 周纯武, 姚雪松, 等.
鼻咽癌颈部淋巴结转移的CT表现[J]. 临床放射学杂志, 2007, 26(12): 1199–1203.
Luo DH, Zhou CW, Yao XS, et al. The CT Manifestations of the Cervical Lymphnode Metastasis of the Nasopharyngeal Carcinoma[J]. J Clin Radiol, 2007, 26(12): 1199–1203. DOI:10.3969/j.issn.1001-9324.2007.12.008 |
| [18] |
李静, 石木兰, 王爽.
恶性淋巴瘤和头颈部鳞癌颈部受累淋巴结的CT与病理比较[J]. 中华放射学杂志, 2002, 36(8): 737–740.
Li J, Shi ML, Wang S. CT manifestations of cervical lymph node pathology:lymphoma vs metastatic squamous cell carcinoma[J]. Chin J Radiol, 2002, 36(8): 737–740. DOI:10.3760/J.ISSN:1005=1201.2002.08.016 |
 2017, Vol. 41
2017, Vol. 41


