文章信息
- 王薇, 雷璐碧, 赵倩, 赫广达, 季润青, 李京阔, 张丽华.
- Wang Wei, Lei Lubi, Zhao Qian, He Guangda, Ji Runqing, Li Jingkuo, Zhang Lihua
- 急性心力衰竭再入院及死亡风险预测模型研究进展
- Progress in research of models for predicting the risk of readmission and mortality among patients with acute heart failure
- 中华流行病学杂志, 2023, 44(12): 2005-2011
- Chinese Journal of Epidemiology, 2023, 44(12): 2005-2011
- http://dx.doi.org/10.3760/cma.j.cn112338-20230527-00336
-
文章历史
收稿日期: 2023-05-27
2. 新疆医科大学第一附属医院心脏中心, 乌鲁木齐 830054
2. Department of Cardiology, the First Affiliated Hospital of Xinjiang Medical University, Urumqi 830054, China
心力衰竭是各种心脏疾病的严重和终末期表现,具有高住院率、高病死率等特点[1-2]。我国现有心力衰竭患者超过1 500万,约占全球的1/4,已成为重要的公共卫生问题[3]。其中,急性心力衰竭是心力衰竭症状和体征的迅速发生或突然恶化并伴有血浆利钠肽水平升高的临床综合征,起病急、需紧急接受治疗并导致住院。我国每年急性心力衰竭住院人数超过100万,且急性心力衰竭患者出院后1年死亡率、因心力衰竭再入院率高达17.4%、32.4%[4]。尽管在过去十年中,心力衰竭治疗取得了长足进步,但因其病情复杂,总体预后仍较差。
急性心力衰竭患者出院后30 d再入院率及1年死亡率是评价心力衰竭医疗质量的重要指标[5]。据此开展急性心力衰竭患者预后风险预测研究,能够量化疾病风险、掌握疾病影响因素、进行风险分层、开展分类管理,从而预判急性心力衰竭患者预后情况,为优化临床决策、开展个体化精准治疗、提高生存质量、改善预后提供证据,对合理规划医疗资源、全面提升我国急性心力衰竭医疗质量至关重要。本文旨在从研究人群、预测因子、建模方法、模型应用等方面进行综述,在介绍国内外主要急性心力衰竭再入院和死亡风险预测模型的基础上,重点概述现有模型局限性及今后发展方向,以期为国内急性心力衰竭风险预测模型相关研究提供思路。
1. 国内外主要急性心力衰竭再入院及死亡风险预测模型:在PubMed中使用"heart failure"[Title/Abstract] AND("readmission"[Title/Abstract] OR "rehospitalization"[Title/Abstract] OR "mortality"[Title/Abstract])AND "predict"[Title/Abstract]作为检索词,在中国知网以TI="心衰" AND(TI="再入院" OR TI="死亡")AND TI="预测"作为检索词,对国内外主要急性心力衰竭预后风险预测研究进行检索。在检索时间内(2000年1月1日至2023年4月30日),共检索到2 965篇相关研究用于进行标题/摘要筛选。排除标准:①非预测模型研究;②慢性心力衰竭;③综述/方法学研究;④仅会议摘要/非正式发表;⑤评论;⑥书籍;⑦其他不相关研究。对46篇文献进行全文筛选,最终纳入17篇用于本文综述。
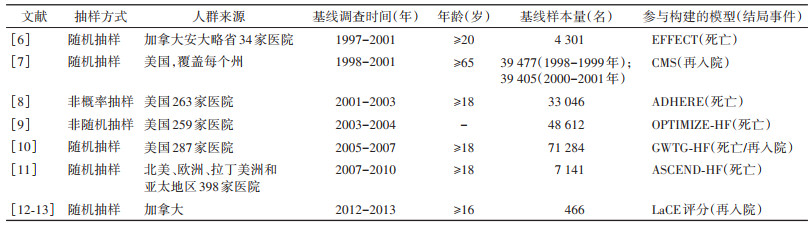
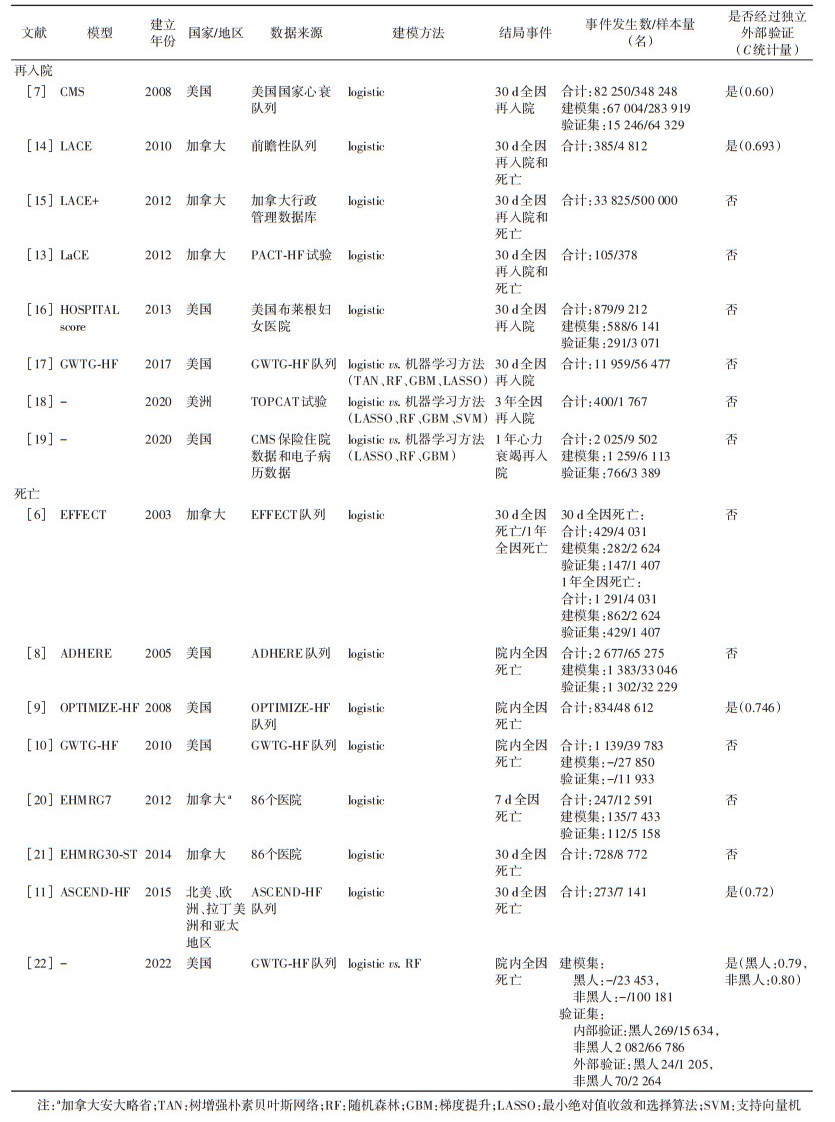
(1)国外模型概述:目前国外已有数十项急性心力衰竭患者再入院和死亡风险预测模型研究,主要由欧美国家基于数个大规模、多中心人群队列或临床试验开展。其中美国国家心衰队列建立年代最早、人群范围最广且样本量最大,其系列研究成果对指导心力衰竭临床实践产生了积极深远的影响。常见模型见表 1。
急性心力衰竭患者再入院风险预测模型常见特征:①研究人群:多为≥65岁老年人群,射血分数类型比例存在较大差异,部分研究仅针对射血分数降低型或保留型心力衰竭人群;②研究设计类型:主要基于队列研究、临床试验、行政管理数据库、电子病案记录(EMR)构建,但样本量和结局事件发生率差异较大;③研究结局:多以30 d全因再入院或30 d心力衰竭再入院作为短期结局,部分研究将1年或3年再入院作为长期预后结局(表 2);④预测因子:人口学信息(如性别、年龄、种族等),社会经济学特征(如文化程度、职业状况、同住情况、社会支持等),危险因素(如吸烟、饮酒等),临床特征(如血压、心率、BMI、呼吸频率、静息时是否呼吸困难、纽约心功能分级等),病史或合并症(如心力衰竭、高血压、冠心病、糖尿病、慢性阻塞性肺疾病、脑血管疾病、抑郁、痴呆、肾功能不全等),实验室检测指标(如B型利钠肽、C反应蛋白、血红蛋白、肌钙蛋白、尿素氮、血肌酐、血钾、血钠等),药物治疗(如β受体阻滞剂等),住院服务(如过去12个月内住院次数、是否急诊入院、住院期间流程、住院天数等)等;⑤模型表现:C统计量多在0.60~0.70之间,仅有部分模型经过外部验证(表 2)。相较于再入院预测模型,死亡预测模型特点:①研究人群:数个死亡预测模型已开始纳入来自于多个国家、多个种族的人群,包括亚洲地区人群;②研究结局:包括短期死亡(院内、出院后7 d及30 d)及中长期死亡(1~5年)(表 2);③统计方法:早期以传统统计方法为主,随着临床研究和统计学的发展,机器学习等方法逐渐被使用;④模型表现:模型C统计量多在0.60~0.80之间,仅有部分模型经过外部验证(表 2)。
(2)国内模型概述:我国急性心力衰竭患者再入院和死亡风险预测模型研究始于2020年,目前建立的模型不足10个,均基于1~2个研究中心前瞻性队列研究构建,样本量在500~3 000名。
就再入院风险预测模型来说,2021年,Zhuang等[23]在547名住院心力衰竭患者中通过Cox比例风险回归模型构建10年全因再入院风险预测模型,纳入年龄、生命体征、实验室检查结果、运动测试数据、病史等作为预测因子,内部验证显示中等区分度(C统计量为0.62)。2022年,Zhang等[24]在551名 > 60岁的住院心力衰竭患者中通过logistic模型构建30 d全因再入院风险预测模型,纳入手术史、是否自行改变用药、信息获取能力、社会支持、抑郁、生活质量作为预测因子,外部验证显示较好区分度(C统计量为0.80)。
就死亡风险预测模型来说,2020年,Yang等[25]在854名 > 65岁的住院心力衰竭患者中使用Cox比例风险回归模型构建30 d和1年全因死亡预测模型,纳入人口统计学指标、合并症、实验室检查结果和用药数据作为预测因子,内部验证显示30 d和1年预测模型的C统计量分别为0.78和0.74。同年,Wang等[26]在10 000余名住院心力衰竭患者中使用基于领域判别约束的加权多重经验核学习方法预测30 d全因死亡和1年全因死亡率,纳入年龄、性别、心率、合并症病史、用药和实验室检查结果作为预测因子,内部验证显示30 d和1年预测模型的C统计量分别为0.89和0.88。
2. 现有急性心力衰竭再入院及死亡风险预测模型的局限性:
(1)数据来源:现有的急性心力衰竭预后风险预测模型多基于西方人群,数据来源包括:①队列研究及临床试验纳入的住院心力衰竭患者;②出院后居住于社区的心力衰竭患者;③国家或地区行政管理数据库中发生过心力衰竭再入院或死亡的患者,如医疗保险数据等;④国家或地区医疗卫生机构EMR中发生过心力衰竭再入院或死亡的患者等。一项系统综述显示,纳入EMR数据能在一定程度上提升仅使用行政管理数据或研究数据构建模型的表现能力,但提升能力有限[27],主要原因:①EMR数据结构及收集内容因研究中心而异,缺乏统一性和标准化,因此据此建立的预测模型在推广和应用上存在一定限制;②EMR数据无法收集患者社会经济水平、功能状态等指标,因此对于提升模型的预测能力贡献有限。我国的几项研究多基于单个研究中心,亟需开展一系列针对我国急性心力衰竭预后风险预测的研究。
(2)预测因子筛选:现有模型纳入预测因子从几个到几十个不等。实际上,模型的简便性是其推广中重要的考虑因素,预测因子所包含的信息和数量并非越多越好:预测因子信息越是方便获取或便于测量,模型的可推广性越好;预测因子越多,模型越容易出现过拟合的情况;预测因子纳入模型包含的取值区间越宽,模型所能提供的预测信息越丰富[28]。
预测因子筛选策略对于预测模型效果具有重要影响。在数据驱动策略下,预测因子筛选策略包括过滤法、封装法和嵌入法,这3种方法通常串联或并联使用[29]。然而,部分基于国家或地区行政管理数据库以及EMR建立的急性心力衰竭预后风险预测模型,由于数据存在多源异构、信息丰富、质量不一等特征,过度依赖机器学习方法,仅凭统计学预测效能获得构建模型的预测因子,而忽略了预测因子在指导临床实践中的实际效用。相对而言,知识驱动策略下,风险预测模型构建中会更多地考虑既往研究和专家意见,通过综合评估预测因子在指导临床实践中的重要性,如准确性、可靠性、可获得性、通用性等,来初步筛选潜在预测因子,再结合数据驱动策略来获得最终预测因子。总体来说,在预测因子筛选阶段,需要综合使用数据驱动策略和知识驱动策略,以保证预测模型在遵循临床指导价值的前提下,获得统计学预测效力的最优解。
(3)缺失数据处理:缺失数据处理方法是急性心力衰竭预后风险预测模型研究中经常遗漏的部分。若针对缺失数据进行填补,需考虑缺失模式、方法适用性及结果可靠性,必要时还需开展敏感性分析;若未针对缺失数据进行填补,将导致样本量减少而降低统计效能,造成选择偏倚。缺失数据填补与否均会增加模型构建、验证和推广的难度[28-29]。已有研究指出,预测模型研究应详细描述研究数据的缺失情况以及处理方法,包括具体插补的变量及插补次数;更推荐采用多重插补法进行缺失数据处理,因为其能保留缺失数据的随机性,相较单一插补法具有更高的准确率[30-31]。
(4)建模方法:logistic回归模型和Cox比例风险回归模型是构建预测模型的两种常见传统回归分析模型[31]。对于具有随访时间信息的中长期研究,若采用logistic回归模型来代替Cox比例风险回归模型的前提是研究者需要证明队列随访中不存在截尾数据[31]。然而,目前大部分使用传统回归分析方法的急性心力衰竭预后风险预测模型仍是基于logistic回归模型构建的,且未报告采用该方法的原因。
近年来,由于数据来源和人群范围不断扩大,传统回归模型多关注于推断因素与结局之间的关联程度及大小,难以在临床广泛应用中取得最佳性能,因此不足以满足大样本多维度数据模型构建的需求[32-35]。尽管机器学习方法相较于传统方法,在处理高维度、大样本数据时具有独特优势,通过合理设计目标函数,并在偏差和方差间寻找平衡,可以克服传统建模方法在处理预测因子与结局之间非线性关系方面的局限,但其在各类研究中对于提高预测模型表现及临床效用的结论并不一致[17, 19, 35-36]。有研究指出,预测模型的构建应充分考虑预测因子在指导临床实践中的意义,而非完全依赖于通过新型统计学技术获得最佳模型表现。实际上,使用具有良好研究设计的前瞻性队列研究和随机对照试验数据进行风险预测模型构建,研究者更倾向于注重心力衰竭特异性预测因子的数据采集过程、质量、结果及其在指导临床实践中的重要意义而采用传统回归模型;而基于国家行政管理数据库或EMR等大规模人群被动监测数据开展的风险预测模型构建研究,多数预测因子并非心力衰竭特异性收集,且数据质量存疑,研究者则更倾向于使用机器学习方法开展数据降维、特征提取、降噪、缺失值填补等工作,以此来在海量数据中寻找以模型表现为唯一指标的最优解[32-34, 36]。因此,预测模型构建时应充分考虑已有数据和人群特征,选择合理、可靠的方法开展研究。
(5)模型验证和应用:目前,国内临床指南中尚未推荐使用任何专门的急性心力衰竭预后风险预测模型。缺乏客观、无偏的外部验证是影响模型实际应用的原因之一。如果确实难以找到独立的外部验证数据集,推荐使用自抽样法来进行内部验证。自抽样法可以利用全部研究数据,能改善参数估计、降低模型过拟合的可能性[28, 37]。此外,既往急性心力衰竭预后风险预测模型大多是在部分国家、地区,或一些研究中心收集的人群中进行建模,这些模型多以统计学上的预测能力为主要评价指标,并未考虑其在不同级别的医疗机构或社区人群中的应用情况,也未考虑其在不同国家和种族人群中的推广情况,包括现有为数不多的中国人群模型能否应用于中国其他地区,都有待验证。因此,未来的研究应同时考虑预测模型的预测能力及其临床效用,也应纳入具有不同遗传背景和环境特征的研究对象来提高模型的应用。
3. 急性心力衰竭再入院及死亡风险预测模型发展方向及展望:
(1)整合多源数据以扩大模型构建的人群范围:目前用于开展急性心力衰竭预后风险预测模型的数据多为临床研究数据、行政管理数据等。未来,若能够将不同来源的数据进行有效融合和集成,包括对健康医疗大数据的整合、智能的数据分析算法、明确的健康和疾病管理方案以及配套的政策保障等,可以构建覆盖急性心力衰竭患者全生命周期涵盖危险因素暴露、诊疗、转归、结局、卫生服务利用以及医疗花费的个体数据资源,这将进一步打破现有资源因“信息孤岛”而面临的研究困境。通过将碎片化、非标准化的EMR数据与其他来源的数据资源互通、共享和结构化集成,利用数据分析挖掘技术,对数据信息进行动态化管理和使用,实现对各类资源的盘活及智能化健康管理,是基于数据驱动实现急性心力衰竭医疗服务质量增进、资源配置能力提升的体现[27]。
(2)探索可继续改进模型的预测因子:近年来由于转录组学、蛋白质组学和代谢组学等的发展,研究者发现了越来越多与心力衰竭有关的生物标志物,包括高敏C反应蛋白、生长分化因子-15、可溶性ST2等。有可能作为急性心力衰竭预后风险预测因子的生物标志物应具有的特点:生物学变异性小,不受年龄、营养状况或合并症的影响,方便测量等[38]。未来随着更多相关生物标志物的发现,将为改善急性心力衰竭预后风险预测模型性能提供更多的预测因子选择。
此外,多基因风险评分(PRS)预测心力衰竭预后风险是研究的热点方向。2020年,Li等[39]在1 000名中国人群队列中构建了包含8个单核苷酸多态性(SNPs)位点的PRS,并对慢性心力衰竭人群的预后进行了风险预测。2021年,有研究构建了包含11 503个SNPs位点的PRS,并在冠心病人群中预测了缺血性心力衰竭的死亡风险[40]。然而,鲜少有研究通过使用PRS在急性心力衰竭人群中评估预后风险,且对预测价值的评价也很有限。
(3)采用新兴模型构建方法并揭示原理:目前机器学习方法在预测急性心力衰竭预后风险研究中应用较为广泛,尤其是基于国家行政管理数据库和EHR等多源数据开展的相关研究,但其在各类研究中对于提高预测模型表现及临床效用的结论并不一致,在模型解读、临床应用及外推性方面仍存在局限[27, 35]。因此,未来应更进一步试图理解机器学习模型中的“黑箱”、开展对模型的外部验证以及可靠性评估研究是今后该领域发展的重要方向。例如,SHapley Additive exPlanation(SHAP)值及其可视化是相关领域的重要进展[41]。
(4)推进模型适用性调整及拓宽应用渠道:模型的适用性不仅取决于构建模型的人群所能代表的目标群体,还取决于预测因子在不同场景下开展风险评估时的可获得性。由于不同地区急性心力衰竭预后情况、个体危险因素以及医疗卫生服务水平分布不尽相同,这将会影响国内外已有模型的推广和应用。针对预测模型应用于不同地区、不同场景和不同人群可能面对的适用性问题,2019年建立的WHO模型在预测心血管疾病风险时采用了新的建模策略:基于不同类型的心血管疾病建立“初始模型”,然后根据目标地区的危险因素水平和疾病结局对“初始模型”进行校准,得到“校准后模型”[42]。但是该类建模思想在急性心力衰竭预后风险预测模型中尚未见报道。为了评估急性心力衰竭患者在入院时、住院期间、出院时以及社区管理等各个不同时期的再入院和死亡风险,拓宽模型应用场景,开发和验证包含不同预测因子的“风险预测评估工具包”将是提高其在不同级别医疗机构以及社区人群中应用性的良好途径。
4. 总结:预测个体未来发生疾病的风险是现代健康管理的关键一步。现有急性心力衰竭预后风险预测模型在人群范围、预测因子筛选、缺失数据处理、建模方法、模型验证和应用推广等方面仍存在一定的局限性,今后的研究应在上述方面不断精进。此外,寻找合适的建模及验证队列人群、提高模型的可推广性仍是今后研究的重点和难点所在。未来,随着数据壁垒打通以及多组学研究的发展,通过优化建模算法,探索潜在预测因子,以期进一步提高模型的预测能力和其在指导临床和公共卫生实践中的实际效用,从而全面提升我国急性心力衰竭医疗质量。
利益冲突 所有作者声明无利益冲突
| [1] |
Redfield MM, Borlaug BA. Heart failure with preserved ejection fraction: a review[J]. JAMA, 2023, 329(10): 827-838. DOI:10.1001/jama.2023.2020 |
| [2] |
Dunlay SM, Roger VL, Redfield MM. Epidemiology of heart failure with preserved ejection fraction[J]. Nat Rev Cardiol, 2017, 14(10): 591-602. DOI:10.1038/nrcardio.2017.65 |
| [3] |
Institute of Health Metrics and Evaluation. Global Burden of Disease (GBD) study[EB/OL]. [2023-05-27]. https://vizhub.healthdata.org/gbd-results/.
|
| [4] |
中国心血管健康与疾病报告编写组. 中国心血管健康与疾病报告2020概要[J]. 中国循环杂志, 2021, 36(6): 521-545. DOI:10.3969/j.issn.1000-3614.2021.06.001 The Writing Committee of the Report on Cardiovascular Health and Diseases in China. Report on cardiovascular health and diseases burden in China: an updated summary of 2020[J]. Chin Circ J, 2021, 36(6): 521-545. DOI:10.3969/j.issn.1000-3614.2021.06.001 |
| [5] |
国家心血管病医疗质量控制中心专家委员会心力衰竭专家工作组. 2020中国心力衰竭医疗质量控制报告[J]. 中国循环杂志, 2021, 36(3): 221-238. DOI:10.3969/j.issn.1000-3614.2021.03.002 Working Group on Heart Failure, National Center for Cardiovascular Quality Improvement (NCCQI). 2020 clinical performance and quality measures for heart failure in China[J]. Chin Circ J, 2021, 36(3): 221-238. DOI:10.3969/j.issn.1000-3614.2021.03.002 |
| [6] |
Lee DS, Austin PC, Rouleau JL, et al. Predicting mortality among patients hospitalized for heart failure: derivation and validation of a clinical model[J]. JAMA, 2003, 290(19): 2581-2587. DOI:10.1001/jama.290.19.2581 |
| [7] |
Keenan PS, Normand SLT, Lin ZQ, et al. An administrative claims measure suitable for profiling hospital performance on the basis of 30-day all-cause readmission rates among patients with heart failure[J]. Circ Cardiovasc Qual Outcomes, 2008, 1(1): 29-37. DOI:10.1161/CIRCOUTCOMES.108.802686 |
| [8] |
Fonarow GC, Adams KF, Abraham WT, et al. Risk stratification for in-hospital mortality in acutely decompensated heart failure: classification and regression tree analysis[J]. JAMA, 2005, 293(5): 572-580. DOI:10.1001/jama.293.5.572 |
| [9] |
Abraham WT, Fonarow GC, Albert NM, et al. Predictors of in-hospital mortality in patients hospitalized for heart failure: insights from the Organized Program to Initiate Lifesaving Treatment in Hospitalized Patients with Heart Failure (OPTIMIZE-HF)[J]. J Am Coll Cardiol, 2008, 52(5): 347-356. DOI:10.1016/j.jacc.2008.04.028 |
| [10] |
Peterson PN, Rumsfeld JS, Liang L, et al. A validated risk score for in-hospital mortality in patients with heart failure from the American Heart Association get with the guidelines program[J]. Circ Cardiovasc Qual Outcomes, 2010, 3(1): 25-32. DOI:10.1161/CIRCOUTCOMES.109.854877 |
| [11] |
Khazanie P, Heizer GM, Hasselblad V, et al. Predictors of clinical outcomes in acute decompensated heart failure: acute study of clinical effectiveness of Nesiritide in Decompensated heart failure outcome models[J]. Am Heart J, 2015, 170(2): 290-297. e1. DOI:10.1016/j.ahj.2015.04.006 |
| [12] |
Yazdan-Ashoori P, Lee SF, Ibrahim Q, et al. Utility of the LACE index at the bedside in predicting 30-day readmission or death in patients hospitalized with heart failure[J]. Am Heart J, 2016, 179: 51-58. DOI:10.1016/j.ahj.2016.06.007 |
| [13] |
Au AG, McAlister FA, Bakal JA, et al. Predicting the risk of unplanned readmission or death within 30 days of discharge after a heart failure hospitalization[J]. Am Heart J, 2012, 164(3): 365-372. DOI:10.1016/j.ahj.2012.06.010 |
| [14] |
van Walraven C, Dhalla IA, Bell C, et al. Derivation and validation of an index to predict early death or unplanned readmission after discharge from hospital to the community[J]. CMAJ, 2010, 182(6): 551-557. DOI:10.1503/cmaj.091117 |
| [15] |
van Walraven C, Wong J, Forster AJ. LACE+ index: extension of a validated index to predict early death or urgent readmission after hospital discharge using administrative data[J]. Open Med, 2012, 6(3): e80-90. |
| [16] |
Donzé J, Aujesky D, Williams D, et al. Potentially avoidable 30-day hospital readmissions in medical patients: derivation and validation of a prediction model[J]. JAMA Intern Med, 2013, 173(8): 632-638. DOI:10.1001/jamainternmed.2013.3023 |
| [17] |
Frizzell JD, Liang L, Schulte PJ, et al. Prediction of 30-day all-cause readmissions in patients hospitalized for heart failure: comparison of machine learning and other statistical approaches[J]. JAMA Cardiol, 2017, 2(2): 204-209. DOI:10.1001/jamacardio.2016.3956 |
| [18] |
Angraal S, Mortazavi BJ, Gupta A, et al. Machine learning prediction of mortality and hospitalization in heart failure with preserved ejection fraction[J]. JACC Heart Fail, 2020, 8(1): 12-21. DOI:10.1016/j.jchf.2019.06.013 |
| [19] |
Desai RJ, Wang SV, Vaduganathan M, et al. Comparison of machine learning methods with traditional models for use of administrative claims with electronic medical records to predict heart failure outcomes[J]. JAMA Netw Open, 2020, 3(1): e1918962. DOI:10.1001/jamanetworkopen.2019.18962 |
| [20] |
Lee DS, Stitt A, Austin PC, et al. Prediction of heart failure mortality in emergent care: a cohort study[J]. Ann Intern Med, 2012, 156(11): 767-775, W-261, W-262. DOI:10.7326/0003-4819-156-11-201206050-00003 |
| [21] |
Greig D, Austin PC, Zhou L, et al. Ischemic electrocardiographic abnormalities and prognosis in decompensated heart failure[J]. Circ Heart Fail, 2014, 7(6): 986-993. DOI:10.1161/CIRCHEARTFAILURE.114.001460 |
| [22] |
Segar MW, Hall JL, Jhund PS, et al. Machine learning-based models incorporating social determinants of health vs traditional models for predicting in-hospital mortality in patients with heart failure[J]. JAMA Cardiol, 2022, 7(8): 844-854. DOI:10.1001/jamacardio.2022.1900 |
| [23] |
Zhuang B, Shen T, Li DJ, et al. A model for the prediction of mortality and hospitalization in Chinese heart failure patients[J]. Front Cardiovasc Med, 2021, 8: 761605. DOI:10.3389/fcvm.2021.761605 |
| [24] |
Zhang XN, Yao Y, Zhang YW, et al. Prognostic value of patient-reported outcomes in predicting 30 day all-cause readmission among older patients with heart failure[J]. ESC Heart Fail, 2022, 9(5): 2840-2850. DOI:10.1002/ehf2.13991 |
| [25] |
Yang MX, Tao LY, An H, et al. A novel nomogram to predict all-cause readmission or death risk in Chinese elderly patients with heart failure[J]. ESC Heart Fail, 2020, 7(3): 1015-1024. DOI:10.1002/ehf2.12703 |
| [26] |
Wang Z, Wang BL, Zhou YM, et al. Weight-based multiple empirical kernel learning with neighbor discriminant constraint for heart failure mortality prediction[J]. J Biomed Inform, 2020, 101: 103340. DOI:10.1016/j.jbi.2019.103340 |
| [27] |
Mahmoudi E, Kamdar N, Kim N, et al. Use of electronic medical records in development and validation of risk prediction models of hospital readmission: systematic review[J]. BMJ, 2020, 369: m958. DOI:10.1136/bmj.m958 |
| [28] |
Wolff RF, Moons KGM, Riley RD, et al. PROBAST: a tool to assess the risk of bias and applicability of prediction model studies[J]. Ann Intern Med, 2019, 170(1): 51-58. DOI:10.7326/M18-1376 |
| [29] |
Steyerberg EW. Clinical prediction models: a practical approach to development, validation, and updating[M]. 2nd ed. Cham: Springer, 2019. DOI: 10.1007/978-3-030-16399-0.
|
| [30] |
Collins GS, Reitsma JB, Altman DG, et al. Transparent reporting of a multivariable prediction model for individual prognosis or diagnosis (TRIPOD): the TRIPOD statement[J]. BMJ, 2015, 350: g7594. DOI:10.1136/bmj.g7594 |
| [31] |
Moons KGM, Altman DG, Reitsma JB, et al. Transparent reporting of a multivariable prediction model for Individual Prognosis or Diagnosis (TRIPOD): explanation and elaboration[J]. Ann Intern Med, 2015, 162(1): W1-73. DOI:10.7326/M14-0698 |
| [32] |
Liu Y, Chen PHC, Krause J, et al. How to read articles that use machine learning: users' guides to the medical literature[J]. JAMA, 2019, 322(18): 1806-1816. DOI:10.1001/jama.2019.16489 |
| [33] |
Shah NH, Milstein A, Bagley SC. Making machine learning models clinically useful[J]. JAMA, 2019, 322(14): 1351-1352. DOI:10.1001/jama.2019.10306 |
| [34] |
Rajkomar A, Dean J, Kohane I. Machine learning in medicine[J]. N Engl J Med, 2019, 380(14): 1347-1358. DOI:10.1056/NEJMra1814259 |
| [35] |
Vollmer S, Mateen BA, Bohner G, et al. Machine learning and artificial intelligence research for patient benefit: 20 critical questions on transparency, replicability, ethics, and effectiveness[J]. BMJ, 2020, 368: l6927. DOI:10.1136/bmj.l6927 |
| [36] |
Morgan DJ, Bame B, Zimand P, et al. Assessment of machine learning vs standard prediction rules for predicting hospital readmissions[J]. JAMA Netw Open, 2019, 2(3): e190348. DOI:10.1001/jamanetworkopen.2019.0348 |
| [37] |
陈茹, 王胜锋, 周家琛, 等. 预测模型研究的偏倚风险和适用性评估工具解读[J]. 中华流行病学杂志, 2020, 41(5): 776-781. DOI:10.3760/cma.j.cn112338-20190805-00580 Chen R, Wang SF, Zhou JC, et al. Introduction of the Prediction model Risk Of Bias ASsessment Tool: a tool to assess risk of bias and applicability of prediction model studies[J]. Chin J Epidemiol, 2020, 41(5): 776-781. DOI:10.3760/cma.j.cn112338-20190805-00580 |
| [38] |
Aimo A, Bayes-Genis A. Biomarkers of inflammation in heart failure: from risk prediction to possible treatment targets[J]. Eur J Heart Fail, 2023, 25(2): 161-162. DOI:10.1002/ejhf.2771 |
| [39] |
Li SY, Sun Y, Hu SL, et al. Genetic risk scores to predict the prognosis of chronic heart failure patients in Chinese Han[J]. J Cell Mol Med, 2020, 24(1): 285-293. DOI:10.1111/jcmm.14722 |
| [40] |
Paranjpe I, Tsao NL, de Freitas JK, et al. Derivation and validation of genome-wide polygenic score for ischemic heart failure[J]. J Am Heart Assoc, 2021, 10(22): e021916. DOI:10.1161/JAHA.121.021916 |
| [41] |
Wang K, Tian J, Zheng C, et al. Interpretable prediction of 3-year all-cause mortality in patients with heart failure caused by coronary heart disease based on machine learning and SHAP[J]. Comput Biol Med, 2021, 137: 104813. DOI:10.1016/j.compbiomed.2021.104813 |
| [42] |
The WHO CVD Risk Chart Working Group. World Health Organization cardiovascular disease risk charts: revised models to estimate risk in 21 global regions[J]. Lancet Glob Health, 2019, 7(10): e1332-1345. DOI:10.1016/S2214-109X(19)30318-3 |
 2023, Vol. 44
2023, Vol. 44