文章信息
- 陶立元, 刘珏.
- Tao Liyuan, Liu Jue
- 目标仿真试验的基本原理、设计要素及其优缺点
- Basic principles, design elements, advantages and challenges of emulated target trial
- 中华流行病学杂志, 2023, 44(12): 1963-1969
- Chinese Journal of Epidemiology, 2023, 44(12): 1963-1969
- http://dx.doi.org/10.3760/cma.j.cn112338-20230515-00300
-
文章历史
收稿日期: 2023-05-15
2. 哈佛大学公共卫生学院, 马萨诸塞州 02115;
3. 北京大学公共卫生学院, 北京 100191
2. Harvard School of Public Health, Massachusetts 02115, United States;
3. School of Public Health, Peking University, Beijing 100191, China
随机对照试验(RCT)往往是干预措施效果评价的“金标准”。由于研究资源和伦理等因素的限制,RCT研究往往不是在所有研究方向上都可以开展的,此时不得不使用观察性研究的证据作为替代。但利用观察性研究数据来开展因果推断又经常被认为是不够严谨的[1-2],且有时观察性研究结果与RCT研究结果相差甚远[3]。
近年来,随着大型真实世界观察性研究数据的积累,在观察性数据中仿真模拟RCT的想法逐渐出现在一些观察性数据分析的思路中[4],即恰当地利用RCT的原则分析观察性研究中的部分数据。在此基础上,哈佛大学公共卫生学院Hernán和Robins[5]于2016年提出了一种基于真实世界研究数据或大型队列研究数据来模拟开展RCT的研究思路,即目标仿真试验(emulated target trial,ETT),又称目标试验仿真(target trial emulation)。近年来,ETT在各类医学问题的研究中得到了较为广泛的关注和应用[6-11],为真实世界数据分析提供了一种新的思路。不同领域的研究者基于电子病历数据、大型随访队列或医疗保险资料等真实世界数据开展了ETT研究,利用此类观察性数据进行仿真试验,获得了接近于RCT的因果推断结果,提供了高质量的研究证据。本文旨在对ETT的基本原理、设计要素、应用案例以及优缺点等相关内容进行探讨,以期为国内学者基于观察性研究资料开展ETT研究提供参考。
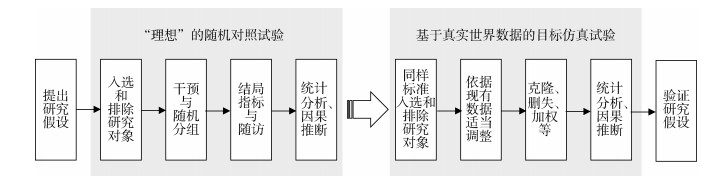
1. 基本原理:ETT是指在已有观察性研究数据中采用特定的方法筛选研究对象组成假设的RCT,遵照RCT研究的设计和分析原则,通过对该假设试验数据的分析得到类似RCT的研究结论[12]。ETT可在RCT研究不可行或尚未开展且同时存在有高质量观察性研究数据的情况下,利用高质量观察性数据仿真RCT研究,得出相应的高质量研究结论。如利用大规模真实世界数据模拟长期随访的实用性RCT(pragmatic RCT)研究[13],利用观察性队列数据模拟某些公共卫生措施对健康的影响效应[14-16],利用医院信息系统数据探索不同药物的治疗效果[17]等。ETT的开展可分为4步:①提出研究假设;②设计理想的目标试验相关要素:包括研究对象的入选和排除标准、干预措施、随机分组、结局指标、随访、统计分析与因果推断等;③利用现有数据仿真目标试验,包括理想试验的各相关要素;④验证研究假设。ETT研究步骤参照RCT,见图 1。
|
| 图 1 目标仿真试验基本流程 |
ETT研究需要严格按照RCT研究框架开展试验仿真,否则容易获得错误的结论[5]。因此在ETT的使用过程中需要明确几点:①当观察性研究中未采集足够的混杂因素信息时,即可能存在较多残余混杂时,不能盲目开展ETT分析;②需要在观察性研究中明确定义研究开始的时间点(即基线时间点),避免引入现使用者偏倚(prevalent user bias)和永恒时间偏倚(immortal time bias)等[18-19];③如果观察性研究在诊断方法或干预措施上存在局限,导致研究者无法仿真“理想”的RCT研究,此时可在ETT中做出适当的妥协或修改;④ETT毕竟是在观察性数据中开展的RCT仿真,因此它不能取代设计良好的RCT研究,而仅是RCT的一个补充。
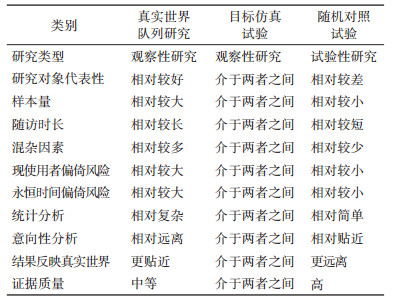
由于ETT研究遵照了RCT研究设计的严格思路和原则,同时利用真实世界队列研究数据开展研究,因此ETT同时具备了真实世界研究和RCT研究的优点和不足(表 1)。同时ETT的设计思路可帮助研究者发现原队列研究数据分析中的误区[20],识别原队列数据分析中可能存在的混杂和其他偏倚,提高队列数据分析的质量。
2. 设计要素:
(1)入选和排除标准:为了更好地仿真RCT研究,ETT研究对象的入选和排除标准必须与目标RCT保持一致。研究对象的入选和排除标准常包括人口学指标、疾病具体诊断、合并症、既往史和用药史等。除此之外,ETT的入选和排除标准中还常需要包括研究对象一定时长的随访情况,因为RCT研究往往具有规范的结局指标随访计划和测量方法[5, 21],但ETT的数据只能依赖于原观察性研究数据。研究对象在满足上述入选和排除标准后方可进入ETT。
由于是在真实世界数据中开展RCT仿真,因此ETT在入选和排除标准上有可能存在缺少重要变量的可能,比如对某病的诊断缺乏医生的诊断结果(可能是患者自报)。此时可考虑采用相关医学检查(如CT、核磁共振成像等)或检验结果进行替代,但这种替代的过程应该在局限性中进行说明[22]。有时也可能存在缺少研究对象诊断信息的情况,此时应调整ETT方案或放弃ETT研究。
ETT研究中需要注意的是研究对象的入选和排除标准是在研究对象基线入组时使用的,其中不应包括基线后的研究对象治疗依从性等信息[5, 21]。由于在RCT研究中研究者未知基线后研究对象的依从情况,因此在RCT研究中该情况往往不会出现,但在观察性研究的ETT分析中则可能出现。
(2)干预与随机分组:ETT研究需要依照目标RCT研究明确定义干预措施和干预周期,将符合干预方式的研究对象分为干预组,将不符合干预方式的研究对象分为对照组。如果在观察性数据中存在干预方式仅部分符合的研究对象,此时不应将其纳入ETT研究。ETT研究中干预方式的评价需要在基线时进行,这样可避免发生现使用者偏倚。
在RCT研究中,研究对象通过随机化过程被随机分配到不同的干预组,随机化过程在绝大部分情况下保障了组间基线的均衡性和组间的可交换性。但在ETT中,由于是利用观察性研究数据去仿真RCT,因此研究对象在实际情况下并没有得到随机分组。此时研究者可在基线时对研究对象进行随机分组模拟,通过相应的统计学方法来平衡组间基线特征差异[5, 23],此过程又可称为“事后随机化过程”。常用的统计学方法有倾向性得分匹配[24]、逆概率加权[25]、G方法[26]和双重稳健估计法[27]等。
但此类“事后随机化过程”并不是完美的,因为此类过程仅能控制已测混杂,而不能像真正的随机化过程一样同时控制已测和未测混杂的影响[5, 23]。且有时在观察性数据中这些已测混杂可能存在信息缺失或测量不准确的情况,此时研究者可依赖其他方式(如自然语言处理技术)对这些信息进行适当的弥补[28]。同时,研究者也可以通过工具变量和未测混杂敏感性分析的方法(如E-值)来对研究结果进行校正和稳健性估计[29]。
由于在观察性研究中往往不存在安慰剂和盲法,因此一般情况下ETT不能模拟安慰剂对照试验和盲法试验。但也有研究者认为常规医疗处理条件下的对照组效应可能与安慰剂效应类似[22]。
(3)定义基线时间点:在ETT研究中基线时间点的定义非常重要且往往存在难点,错误的定义容易引起试验的失败[30]。基线时间点在RCT研究中容易定义,即为研究对象符合入选和排除标准后入组和随机化的时间点,该时间点也是研究对象接受干预的时间点,同时也是研究对象结局指标随访开始的时间点。
在ETT研究中,研究对象可能在较长的时间范围内均符合入选和排除标准,但治疗或干预则是在某一特定时间点开始。如某研究拟探索降糖药物对2型糖尿病的治疗效果,患者可能患病数月依旧没有开始服用降糖药物,在此数月内研究对象均符合入选和排除标准,但只有患者开始服用降糖药物时基线时间点才发生。尽管此类情况在RCT研究中也可能存在,但RCT研究中的随机化过程可在一定程度上平衡不同组间从诊断至服药的时长影响。
因此ETT研究中干预组基线时间点的定义往往是研究对象符合入选和排除标准后且开始干预的时间点,而空白对照组的定义则只能是研究对象首次满足入选和排除标准的时间点。但此时可能会引入永恒时间偏倚[19],因此研究者需要在干预组与对照组的匹配时考虑采用年龄分层或者对干预前的人-时(person-time)信息进行调整等方式来进行控制。
在实际操作过程中,研究对象可能仅存在一个基线时间点,如比较不同给药剂量的治疗效果,大部分情况下研究对象不会在不同药物剂量间来回切换,因此符合入选和排除标准后的给药时间点即是基线时间点。有时研究对象也可能存在多个基线时间点,如某研究拟探索绝经后女性激素替代治疗的效果,此时未使用激素替代治疗的绝经后女性在50~60岁间均符合基线时间点。对存在多个基线时间点的处理可采用两种方式:①仅纳入一次,此时可采用首次合格的时间点或采用随机选择一个合格的时间点来纳入研究;②纳入多次,此时可采用嵌套设计的方法选取其多个合格的时间点来纳入研究,如García-Albéniz等[6, 9]针对乳腺癌和结直肠癌开展的研究。从统计的角度上来看,第二种方式更为高效,但由于同一个研究对象可能被使用多次,在研究过程中应该采用适当的方法来对估计的方差进行校正。
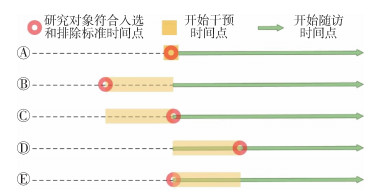
ETT研究中基线时间点要求研究对象符合入选和排除标准时间点、开始干预时间点和开始随访时间点相同,可称为“三点合一”,此时才是正确的基线时间点定义(图 2A),其他情况均是错误的情况,且可能引入偏倚(图 2B,C,D,E)。但在真实世界数据中往往会存在不符合“三点合一”的研究对象,研究者需要尽量将其排除。例如在探索房颤患者服用华法林的疗效和安全性研究中,可能会在以下情况下引入现使用者偏倚:①已经服用华法林两年的房颤患者(符合入选和排除标准)在此刻刚纳入疗效和安全性的评价与随访,此时研究对象在前两年的服药过程中所出现的疗效和安全性事件则不会纳入分析;②已经服用华法林两年的非房颤患者(即刚服用华法林时此患者并不符合入选和排除标准),在此刻符合入选和排除标准且纳入了疗效和安全性的评价与随访,此类患者之前的疗效和安全性事件也不会纳入分析。
|
| 注:A为正确定义;B,C,D,E为错误定义 图 2 目标仿真试验基线时间点定义 |
(4)结局指标与随访:ETT研究跟RCT研究一样需要事先定义结局指标(包括首要和次要结局指标)及其测量方法,然后使用观察性研究的随访数据信息来确定结局指标的测量结果。对ETT的研究方案也可以考虑进行类似RCT研究的注册[31],这也会提高结局指标评估的准确性和规范性。在结局指标的确定上最好能够有相关的验证措施,否则容易导致错误的估计[32-33]。同时对结局指标的评估如果能适当地采用盲法会更好,比如评估结局指标的临床医生并不知道研究对象的干预情况。
随访是指由研究的基线时间点开始,去记录研究的结局指标直至结局事件出现。随访在RCT研究中往往有明确的时间间隔,而在ETT研究中则只能依赖于现有数据中的随访测量情况。类似生存数据一样,在随访期间观察到结局发生的为完全事件,未观察到结局发生的为删失事件,删失事件又可分为左删失、右删失和区间删失,不同的删失数据应采用不同的生存分析方法进行分析。对于缺失数据的处理可以采用多重插补[34]或逆概率加权法[35]等进行分析。
(5)统计分析与因果推断:ETT研究的因果比较与RCT研究一样,通过对比不同干预措施组的结局指标情况,探索干预措施对结局的影响。RCT研究的比较往往采用意向性分析原则(ITT),以全分析集结果为主,以符合方案集结果为辅,理论上ETT中也应该与RCT保持一致。但在ETT研究中去实现ITT存在一些困难,因为在ETT数据中研究对象的依从性往往很难得到良好的测量,研究对象往往只会被记录为“干预”或者“非干预”,而很少去记录其接受干预的质量好坏(即依从性)。符合方案分析(PP)集分析在ETT研究中往往是最可行的,且该分析往往更有助于探索干预措施在真实世界中的疗效。但在ETT研究中的PP集分析不仅需要考虑基线的混杂,也需要考虑随访过程中的混杂[5],可以考虑通过G-方法分析来实现[36]。
ETT研究统计分析方法的选择需要参考结局指标的类型。如果结局指标是生存数据则需要选择Cox比例风险回归进行分析,如果结局指标是连续性指标则可选择相应的线性回归来开展分析。在数据分析时,往往需要进行多因素的分析,且需要同时纳入基线时的协变量和随访时的协变量进行分析。如果协变量在随访过程中出现了时间依赖性,则还需要考虑时依协变量的分析方法。
3. 应用案例及优缺点:
(1)ETT应用案例简介:既往有RCT研究表明在50~69岁人群中开展乳腺癌钼靶筛查可以明显降低乳腺癌的死亡率,那么在70~84岁女性中持续开展此筛查是否还有价值?该问题尚未得到相关RCT研究的证实。García-Albéniz等[9]利用美国医疗保险数据开展了ETT研究尝试回答该问题,其研究结果发现在70~74岁人群持续开展钼靶筛查依然有价值,而在75~84岁人群中开展钼靶筛查则无明显获益。该研究以假定的RCT研究为设计依据,从入选和排除标准、干预方式、干预分组、随访、结局指标、因果推断和统计分析等方面对ETT给出了研究方案,使ETT与假定的RCT研究设计尽可能相同。以干预分组为例,在ETT中,符合标准的研究对象会被随机分配入停止筛查组与持续筛查组两组,且按年龄层(70~74岁和75~84岁)进行分层随机,研究对象知道自己的随机分组结果(即不盲研究对象);在ETT中,研究者假设研究对象在以下变量上被随机分组:年龄、民族、既往健康状况(急诊和住院天数)、医保所在地区、既往疫苗接种情况、慢性病筛查情况、长期护理情况、合并慢性病情况等。
(2)ETT优势与局限性:RCT研究依然是干预措施效果评价的金标准,但常可能因为伦理情况不允许、研究经费消耗过大、或研究观察时间过长等因素的限制而无法开展RCT时。此时基于真实世界观察性数据开展ETT是较好的选择,能够提供更高质量的研究证据[37]。ETT研究像RCT研究一样有着良好定义的基线时间点,在此时间点上研究对象的随机化、干预起始和随访起始都同时开始,这就保障了ETT中对各组研究对象的干预实施和随访实施的同质化。而在观察性研究中,研究者往往根据是否“暴露”将研究对象分为“暴露组”和“非暴露组”,此时“暴露”可能是研究对象在参与该研究时“新发的”,也可能是“已有的”,这就会带来现使用者偏倚。在实际的临床研究中,可能存在的情况:①某临床队列研究拟探索阿仑膦酸钠对早期骨质疏松症的治疗效果,在队列中比较使用阿仑膦酸钠者和未使用阿仑膦酸钠者两组研究对象的终点结局指标(骨密度)的差异。此时使用阿仑膦酸钠组的研究对象往往是能够耐受该药(即无不良反应)且疗效不错的研究对象,这就可能因存在现使用者偏倚从而夸大药物的疗效。②由于骨质疏松症是一个无明显症状的隐匿性疾病,患者在不主动开展骨密度检查时很难发现自己的骨质疏松问题,因此队列研究中按照是否服药进行分组,就可能会出现组间研究对象基线疾病严重程度和患病时长不等的问题。③由于骨质疏松症治疗后骨密度的上升往往需要半年及更长的时间,如果研究者定义阿仑膦酸钠服药6个月以上者为干预组,那么在服药0~6个月之间发生了终点事件的研究对象则不会被纳入服药组,这就会引入永恒时间偏倚。这些偏倚可导致队列研究得到不正确的结论,而在队列研究中开展的ETT则可尽量避免上述偏倚的发生[38]。同时ETT还可通过相关统计学手段来控制研究过程中研究对象失访带来的选择偏倚,这更像是RCT研究中的ITT分析,而普通的观察性研究分析方式则更像是PP分析。
ETT研究往往是在大型的真实世界观察性数据中开展,使得ETT的研究结论更贴近真实世界的情况。大型的真实世界数据为研究结果提供了更加实用的可能,如研究对象的疾病严重程度、共病和年龄范围更为多样和广泛,此时研究结果更接近于真实世界的情况,而不像是解释性RCT研究结果外推性较为局限。长期随访的队列数据为研究具有足够的随访时长提供了保障,如结肠镜筛查对研究对象8年内结直肠癌发生风险的研究,该研究则可能会由于研究经费不足而很难开展相应的RCT研究。此外ETT研究也不存在霍桑效应,此时研究对象的依从性也会更贴近真实世界的情况。
ETT研究存在局限性。首先,在ETT研究中随机分组是通过统计学方法模拟的,这就可能会导致组间可能存在未测量的混杂因素,从而影响ETT的分析结果,这也说明ETT研究的质量在很大程度上取决原始观察性研究的质量。而在真正的RCT研究中,其随机化过程是可以控制已测和未测混杂的。其次,在ETT研究中起始时间点定义和确定也可能存在困难。研究者可能由于原队列研究未提供足够的信息而无法准确定义研究的起始时间点。再次,对于研究结局指标的随访和测量也可能存在不规范性,RCT研究可开展定期随访和准确测量,而真实世界研究的数据随访则不一定十分规范和及时。此外,由于在观察性研究中不存在盲法,因此一般情况下ETT研究不能模拟盲法试验。但也有研究者认为该情况并不是ETT的缺点而是其优点,因为研究者所需要探索的真实世界疗效本就不应在盲法的情况下开展[38]。
4. 小结与讨论:ETT自提出以来已在医学研究的各个领域得到了广泛的应用,研究人员利用该研究设计方法在诸多真实世界数据或长期随访的大型队列数据中开展了RCT的仿真,合理利用队列研究数据产出了高质量的研究证据。ETT也正是介于大型观察性研究和RCT之间的一种研究数据分析方法,它既有队列研究数据量大、随访时间长、真实世界性更好的优势,也有RCT研究设计严谨、混杂控制良好、研究结果更为可靠的优势。ETT已经成为了一种基于真实世界数据开展仿真研究的新思路。但值得注意的是,并不是所有的真实世界数据都可以采用ETT设计,尤其是当现有数据中资料有限,从而无法满足ETT设计要素的情况下,此时盲目开展ETT分析则可能会产出错误的结论。
利益冲突 所有作者声明无利益冲突
作者贡献声明 陶立元:论文撰写/修改;刘珏:论文撰写/修改/审阅、经费支持
| [1] |
Lodi S, Phillips A, Lundgren J, et al. Effect estimates in randomized trials and observational studies: comparing apples with apples[J]. Am J Epidemiol, 2019, 188(8): 1569-1577. DOI:10.1093/aje/kwz100 |
| [2] |
Stone GW, Pocock SJ. Randomized trials, statistics, and clinical inference[J]. J Am Coll Cardiol, 2010, 55(5): 428-431. DOI:10.1016/j.jacc.2009.06.066 |
| [3] |
Gordon AC, Mouncey PR, Al-Beidh F, et al. Interleukin-6 receptor antagonists in critically ill patients with Covid-19[J]. N Engl J Med, 2021, 384(16): 1491-1502. DOI:10.1056/NEJMc2108482 |
| [4] |
Danaei G, Rodríguez LAG, Cantero OF, et al. Observational data for comparative effectiveness research: an emulation of randomised trials of statins and primary prevention of coronary heart disease[J]. Stat Methods Med Res, 2013, 22(1): 70-96. DOI:10.1177/0962280211403603 |
| [5] |
Hernán MA, Robins JM. Using big data to emulate a target trial when a randomized trial is not available[J]. Am J Epidemiol, 2016, 183(8): 758-764. DOI:10.1093/aje/kwv254 |
| [6] |
García-Albéniz X, Hsu J, Bretthauer M, et al. Effectiveness of screening colonoscopy to prevent colorectal cancer among medicare beneficiaries aged 70 to 79 years: a prospective observational study[J]. Ann Intern Med, 2017, 166(1): 18-26. DOI:10.7326/M16-0758 |
| [7] |
Al-Samkari H, Gupta S, Leaf RK, et al. Thrombosis, bleeding, and the observational effect of early therapeutic anticoagulation on survival in critically Ill patients with COVID-19[J]. Ann Intern Med, 2021, 174(5): 622-632. DOI:10.7326/M20-6739 |
| [8] |
Franklin JM, Patorno E, Desai RJ, et al. Emulating randomized clinical trials with nonrandomized real-world evidence studies: first results from the RCT DUPLICATE initiative[J]. Circulation, 2021, 143(10): 1002-1013. DOI:10.1161/CIRCULATIONAHA.120.051718 |
| [9] |
García-Albéniz X, Hérnan MA, Logán RW, et al. Continuation of annual screening mammography and breast cancer mortality in women older than 70 years[J]. Ann Intern Med, 2020, 172(6): 381-389. DOI:10.7326/M18-1199 |
| [10] |
Bosch NA, Teja B, Law AC, et al. Comparative effectiveness of fludrocortisone and hydrocortisone vs hydrocortisone alone among patients with septic shock[J]. JAMA Intern Med, 2023, 183(5): 451-459. DOI:10.1001/jamainternmed.2023.0258 |
| [11] |
Dickerman BA, Gerlovin H, Madenci AL, et al. Comparative effectiveness of third doses of mRNA-based COVID-19 vaccines in US veterans[J]. Nat Microbiol, 2023, 8(1): 55-63. DOI:10.1038/s41564-022-01272-z |
| [12] |
Labrecque JA, Swanson SA. Target trial emulation: teaching epidemiology and beyond[J]. Eur J Epidemiol, 2017, 32(6): 473-475. DOI:10.1007/s10654-017-0293-4 |
| [13] |
Dawwas GK, Cuker A, Barnes GD, et al. Apixaban versus rivaroxaban in patients with atrial fibrillation and valvular heart disease: a population-based study[J]. Ann Intern Med, 2022, 175(11): 1506-1514. DOI:10.7326/M22-0318 |
| [14] |
Moreno-Betancur M, Lynch JW, Pilkington RM, et al. Emulating a target trial of intensive nurse home visiting in the policy-relevant population using linked administrative data[J]. Int J Epidemiol, 2023, 52(1): 119-131. DOI:10.1093/ije/dyac092 |
| [15] |
Dickerman BA, Gerlovin H, Madenci AL, et al. Comparative effectiveness of BNT162b2 and mRNA-1273 vaccines in U. S. veterans[J]. N Engl J Med, 2022, 386(2): 105-115. DOI:10.1056/NEJMoa2115463 |
| [16] |
Braitmaier M, Kollhorst B, Heinig M, et al. Effectiveness of mammography screening on breast cancer mortality - a study protocol for emulation of target trials using German health claims data[J]. Clin Epidemiol, 2022, 14: 1293-1303. DOI:10.2147/CLEP.S376107 |
| [17] |
Chen YCB, Liang CS, Wang LJ, et al. Comparative effectiveness of valproic acid in different serum concentrations for maintenance treatment of bipolar disorder: A retrospective cohort study using target trial emulation framework[J]. EClinicalMedicine, 2022, 54: 101678. DOI:10.1016/j.eclinm.2022.101678 |
| [18] |
Suissa S. Immortal time bias in pharmaco-epidemiology[J]. Am J Epidemiol, 2008, 167(4): 492-499. DOI:10.1093/aje/kwm324 |
| [19] |
Levesque LE, Hanley JA, Kezouh A, et al. Problem of immortal time bias in cohort studies: example using statins for preventing progression of diabetes[J]. BMJ, 2010, 340: b5087. DOI:10.1136/bmj.b5087 |
| [20] |
Gomes M, Latimer N, Soares M, et al. Target trial emulation for transparent and robust estimation of treatment effects for health technology assessment using real-world data: opportunities and challenges[J]. Pharmacoeconomics, 2022, 40(6): 577-586. DOI:10.1007/s40273-022-01141-x |
| [21] |
Hernán MA, Hernández-Díaz S, Robins JM. A structural approach to selection bias[J]. Epidemiology, 2004, 15(5): 615-625. DOI:10.1097/01.ede.0000135174.63482.43 |
| [22] |
Kutcher SA, Brophy JM, Banack HR, et al. Emulating a randomised controlled trial with observational data: an introduction to the target trial framework[J]. Can J Cardiol, 2021, 37(9): 1365-1377. DOI:10.1016/j.cjca.2021.05.012 |
| [23] |
Dahabreh IJ, Hernán MA. Extending inferences from a randomized trial to a target population[J]. Eur J Epidemiol, 2019, 34(8): 719-722. DOI:10.1007/s10654-019-00533-2 |
| [24] |
Deb S, Austin PC, Tu JV, et al. A review of propensity-score methods and their use in cardiovascular research[J]. Can J Cardiol, 2016, 32(2): 259-265. DOI:10.1016/j.cjca.2015.05.015 |
| [25] |
Hogan JW, Lancaster T. Instrumental variables and inverse probability weighting for causal inference from longitudinal observational studies[J]. Stat Methods Med Res, 2004, 13(1): 17-48. DOI:10.1191/0962280204sm351ra |
| [26] |
Toh S, Hernández-Díaz S, Logan R, et al. Estimating absolute risks in the presence of nonadherence: an application to a follow-up study with baseline randomization[J]. Epidemiology, 2010, 21(4): 528-539. DOI:10.1097/EDE.0b013e3181df1b69 |
| [27] |
Li JQ, Handorf E, Bekelman J, et al. Propensity score and doubly robust methods for estimating the effect of treatment on censored cost[J]. Stat Med, 2016, 35(12): 1985-1999. DOI:10.1002/sim.6842 |
| [28] |
Gruber S, Logan RW, Jarrín I, et al. Ensemble learning of inverse probability weights for marginal structural modeling in large observational datasets[J]. Stat Med, 2015, 34(1): 106-117. DOI:10.1002/sim.6322 |
| [29] |
Vanderweele TJ, Ding P. Sensitivity analysis in observational research: introducing the E-value[J]. Ann Intern Med, 2017, 167(4): 268-274. DOI:10.7326/M16-2607 |
| [30] |
García-Albéniz X, Hsu J, Hernán MA. The value of explicitly emulating a target trial when using real world evidence: an application to colorectal cancer screening[J]. Eur J Epidemiol, 2017, 32(6): 495-500. DOI:10.1007/s10654-017-0287-2 |
| [31] |
Berger ML, Sox H, Willke RJ, et al. Good practices for real-world data studies of treatment and/or comparative effectiveness: Recommendations from the joint ISPOR-ISPE Special Task Force on real-world evidence in health care decision making[J]. Pharmacoepidemiol Drug Saf, 2017, 26(9): 1033-1039. DOI:10.1002/pds.4297 |
| [32] |
Rodríguez LAG, Ruigómez A. Case validation in research using large databases[J]. Br J Gen Pract, 2010, 60(572): 160-161. DOI:10.3399/bjgp10X483472 |
| [33] |
Ives DG, Fitzpatrick AL, Bild DE, et al. Surveillance and ascertainment of cardiovascular events: The Cardiovascular Health Study[J]. Ann Epidemiol, 1995, 5(4): 278-285. DOI:10.1016/1047-2797(94)00093-9 |
| [34] |
Groenwold RHH, Donders ART, Roes KCB, et al. Dealing with missing outcome data in randomized trials and observational studies[J]. Am J Epidemiol, 2012, 175(3): 210-217. DOI:10.1093/aje/kwr302 |
| [35] |
Weuve J, Tchetgen TE, Glymour MM, et al. Accounting for bias due to selective attrition: the example of smoking and cognitive decline[J]. Epidemiology, 2012, 23(1): 119-128. DOI:10.1097/EDE.0b013e318230e861 |
| [36] |
Naimi AI, Cole SR, Kennedy EH. An introduction to g methods[J]. Int J Epidemiol, 2017, 46(2): 756-762. DOI:10.1093/ije/dyw323 |
| [37] |
Chemaitelly H, Ayoub HH, Almukdad S, et al. Protection from previous natural infection compared with mRNA vaccination against SARS-CoV-2 infection and severe COVID-19 in Qatar: a retrospective cohort study[J]. Lancet Microbe, 2022, 3(12): e944-955. DOI:10.1016/S2666-5247(22)00287-7 |
| [38] |
Usman MS, Pitt B, Butler J. Target trial emulations: bridging the gap between clinical trial and real-world data[J]. Eur J Heart Fail, 2021, 23(10): 1708-1711. DOI:10.1002/ejhf.2331 |
 2023, Vol. 44
2023, Vol. 44