文章信息
- 杨萱, 孙燕, 霍玉奇, 刘金瑾, 张晓华, 赵淑娴, 赵清霞, 张雪, 王艳, 陈昭云.
- Yang Xuan, Sun Yan, Huo Yuqi, Liu Jinjin, Zhang Xiaohua, Zhao Shuxian, Zhao Qingxia, Zhang Xue, Wang Yan, Chen Zhaoyun
- 河南省抗病毒治疗失败的艾滋病患者耐药特征
- Characteristics of drug resistance in HIV/AIDS patients with antiretroviral treatment failure in Henan Province
- 中华流行病学杂志, 2023, 44(11): 1795-1801
- Chinese Journal of Epidemiology, 2023, 44(11): 1795-1801
- http://dx.doi.org/10.3760/cma.j.cn112338-20230505-00279
-
文章历史
收稿日期: 2023-05-05
2002年河南省启动国家艾滋病免费抗病毒治疗(ART),是全国艾滋病患者较多和ART开展较早的省份之一。随着ART时间延长,依从性的下降,部分患者出现了ART失败。为应对ART失败,2009年河南省开始使用含有洛匹那韦/利托那韦的二线ART方案。但洛匹那韦/利托那韦存在腹泻、高脂血症、血糖异常等不良反应,且与多种慢性疾病的药物存在着药物相互作用,在一定程度上会影响ART依从性和ART疗效。整合酶抑制剂(INSTIs)具有强效抑制病毒、高耐药屏障、药物不良反应小、药物相互作用少的优势。河南省从2017年底开始陆续使用多替拉韦等INSTIs药物,更换洛匹那韦/利托那韦以减少其副作用,在改善ART耐受性和依从性的同时,极大地提高ART成功率。截至2020年底,河南省在治艾滋病患者60 521人,ART成功率达94.7%[1](病毒载量 < 1 000拷贝数/ml)。但是,由于河南省艾滋病患者ART时间较长和人数较多,而且绝大多数患者在县或县级以下定点医疗机构接受ART或在外长期务工,存在着ART失败和耐药的风险。为了更好地管理ART失败和耐药患者,郑州市第六人民医院自2018年开展耐药检测工作,免费为河南省ART失败患者进行基因型耐药检测(GRT)。本研究分析河南省ART失败艾滋病患者耐药特征,为河南省应对HIV-1耐药提供参考依据。
对象与方法1. 研究对象:2018年1月至2021年5月河南省18个城市接受ART的艾滋病患者。纳入标准:①ART时间≥6个月;②病毒载量≥1 000拷贝数/ml;③ART停药≤4周;④基本信息完整;⑤签署知情同意书。本研究已通过郑州市第六人民医院伦理委员会审查(批准文号:2019-04)。
2. 研究方法:
(1)一般资料:收集艾滋病患者血液样本、社会人口学特征和ART信息。内容包括性别、年龄、职业、感染途径、ART方案,耐药检测时最近1次CD4+T淋巴细胞(CD4)计数和病毒载量。人口学资料来源于HIV-1耐药登记记录,ART信息来源于国家ART数据库。血样标本均在门诊或住院部抽取。
(2)采用In-house方法进行HIV-1基因型耐药检测:均在郑州市第六人民医院转化医学研究中心完成。①HIV-1 RNA的提取与核酸扩增:按照标准操作程序,应用上海之江生物科技股份有限公司的核酸提取试剂盒(磁珠法)进行RNA的提取。以HIV-1 pol区蛋白酶(全长)、反转录酶(1~318个氨基酸)和整合酶基因(全长)为扩增区域,使用巢式PCR方法进行PCR扩增,扩增使用LA Taq™ Version 2.0(TaKaRa,Shiga,日本)DNA聚合酶。蛋白酶及反转录酶区域巢式PCR第一轮引物为PRO-F1和RT-R1,第二轮PCR引物为PRO-F2和RT-R2,对应目的片段长度约1 300 bp。整合酶区域巢式PCR第一轮引物为F4181和R5073,第二轮PCR引物为F4379和R5057,对应目的片段长度约700 bp。引物序列见表 1。扩增产物经1%琼脂糖凝胶电泳初步鉴定后,阳性样本送上海生工生物公司进行纯化和测序。②序列拼接与处理:使用DNAMAN和Chromas软件对目的基因序列进行拼接和分析,包括反转录酶区域、蛋白酶区域和整合酶区域的耐药突变位点。③耐药分析:耐药定义为任何一种ART药物出现低度及以上耐药。将得到的完整序列提交斯坦福大学的HIV-1耐药数据库(http://hivdb.stanford.edu/)在线网站分析,参照WHO的耐药突变位点列表,确定耐药突变位点和对各种ART药物的耐药程度。
3. 统计学分析:采用SPSS 25.0软件进行统计学分析。符合正态分布的计量资料采用x±s表示;偏态分布计量资料用M(Q1,Q3)表示,比较采用秩和检验;计数资料用例数和百分数表示,比较采用χ2检验。双侧检验,检验水准α=0.05。
结果1. 患者基本情况及耐药检测结果:
(1)患者基本情况:在887例ART失败的艾滋病患者中,样本成功扩增率为91.54%(812/887)。812例患者年龄(42.10±15.02)岁,年龄范围5~77岁,男性占73.28%(595/812),农民/农民工占44.70%(363/812),传播途径以性传播为主(52.34%,425/812),ART时间M(Q1,Q3)为5.18(1.96,9.77)年,ART方案以2个核苷类反转录酶抑制剂(NRTIs)联合非核苷类反转录酶抑制剂(NNRTIs)方案为主(73.40%,596/812)。最近1次CD4计数M(Q1,Q3)为76(22,200)个/μl,范围1~1 647个/μl。见表 2。
(2)耐药检测结果:在完成NRTIs、NNRTIs和蛋白酶抑制剂(PIs)的耐药检测812例患者中,完成INSTIs耐药检测663例,原因是2019年之前尚未全部开展INSTIs耐药检测。总的耐药率为83.25%(676/812),其中NRTIs、NNRTIs、PIs和INSTIs耐药率分别为73.40%(596/812)、80.54%(654/812)、5.54%(45/812)和2.56%(17/663),4类药物的耐药率差异有统计学意义(χ2=1 686.34,P < 0.001)。对2类药物同时耐药率为66.38%(539/812),对3类药物同时耐药率为5.79%(47/812)。在耐药≥2类药物者中,以NRTIs和NNRTIs同时耐药为主(71.67%,582/812)。
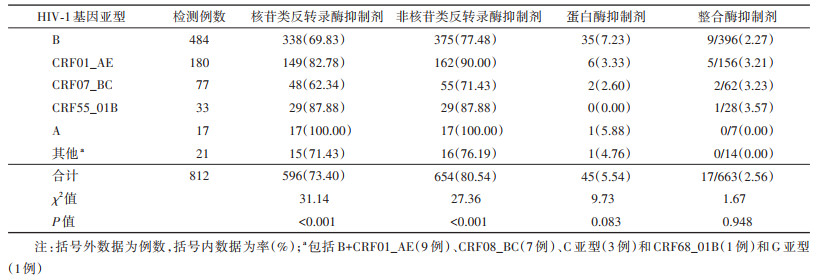
共检出9个HIV-1基因亚型,以B亚型为主(59.61%,484/812),其次为CRF01_AE亚型(22.17%,180/812)和CRF07_BC亚型(9.48%,77/812),不同基因亚型耐药率的差异有统计学意义(χ2=21.33,P=0.001)。不同的年龄、ART时长、ART方案和最近1次CD4计数的耐药率的差异有统计学意义(均P < 0.05)。见表 2。
2. 不同基因亚型对抗病毒药物的耐药情况:不同基因亚型对NRTIs和NNRTIs耐药率不同,差异均有统计学意义(χ2=31.14和χ2=27.36,均P < 0.001),A亚型耐药率最高,其次是CRF55_01B和CRF01_AE;不同基因亚型对PIs和INSTIs耐药率的差异无统计学意义(χ2=9.73,P=0.083;χ2=1.67,P=0.948)。见表 3。
3. 耐药突变位点和耐药突变:共检出67个耐药突变位点,其中NRTIs相关突变位点17个,包括184、65、70、215、67、115、41、151等,M184V/I突变率最高达63.42%(515/812),其次是K65R(27.46%,223/812)、K70R(23.28%,189/812)、T215Y(16.5%,134/812)。M184V/I且K65/R突变率为(21.67%,176/812),≥1个TAMs(基因位点41、67、70、210、215、219)突变率为50.25%(408/812),M184V/I且TAMs突变率为42.98%(349/812)。NNRTIs相关耐药突变位点17个,主要有103、190、106、181、179、221、101等。突变率位居前5位的分别是主要突变K103N/S(34.98%,284/812)、G190A/S(26.11%,212/812)、V106M/I(24.63%,200/812)、Y181C/I(24.14%,196/812)和次要突变V179D/E(20.81%,169/812)。PIs相关耐药突变位点21个,主要是46、82、54、33、10、47、58等,主要突变M46I、V82A/F、I54V/MV突变率分别为4.31%(35/812)、3.82%(31/812)、3.69%(30/812),次要突变L33F、L10F/FI突变率分别为1.97%(16/812)、1.85%(15/812),M46I、I54V和V82A同时突变率为1.60%(13/812)。INSTIs相关耐药突变位点12个,主要为157、263、140、138、163、97、155等,次要突变E157 Q/EQ突变率最高(3.47%,23/663),而主要突变R263K(0.75%,5/663)、G140A(0.75%,5/663)、E138EK(0.60%,4/663)突变率低。
4. 抗病毒药物耐药程度:在NRTIs中,拉米夫定和恩曲他滨耐药程度一致,以高度耐药为主(65.52%,532/812);阿巴卡韦和替诺福韦中/高度耐药分别占58.74%(477/812)和42.86%(348/812);齐多夫定的中/高度耐药占比最低(18.35%,149/812)。在NNRTIs中,奈韦拉平(77.46%,629/812)和依非韦伦(71.18%,578/812)以高度耐药为主;多拉韦林和利匹韦林的中/高度耐药分别占56.77%(436/768)和46.80%(380/812)。在PIs中,洛匹那韦/利托那韦中/高度耐药占比仅为4.19%(34/812)。INSTIs中,艾维雷韦和拉替拉韦耐药程度比较一致,中/高度耐药分别占1.66%(11/663)和1.21%(8/663),未发现比克替拉韦和多替拉韦的高度耐药。见表 4。
本研究发现,2018-2021年河南省艾滋病患者ART失败的耐药率(83.25%)高于我国报道的ART失败耐药率(57.00%)[2],也高于河南省前期报道的耐药率(78.21%)[3]。ART时间 < 1年者的耐药率高于ART≥5年者,与河南省前期报道耐药结果不一致[4],可能与近年来河南省ART前的非核苷类药物耐药率增加有关[5],提示须加强ART前的耐药检测。在ART药物中,2个核苷类药物联合非核苷类药物方案的耐药率高于2个核苷类药物联合PIs/INSTIs方案,这与PIs/INSTIs具有强效抑制病毒和高耐药屏障有关。因此,选择高耐药屏障药物方案,有助于降低耐药发生,提高ART成功率。ART失败且CD4计数 < 100个/µl患者的耐药率较高,提示ART失败后,如不及时干预,在病毒学突破基础上,容易继发出现CD4计数下降,导致更多基因突变的积累,引起更广泛的耐药[6-7]。为避免更多的耐药,建议加强ART后的病毒载量检测,尽早发现病毒学失败和及时更换用药方案。
河南省ART失败患者的HIV-1基因亚型以B亚型为主,与河南省早期报道的结果一致[8],但国内其他省份报道以CRF01_AE和CRF07_BC亚型为主[9-10]。不同的HIV-1基因亚型,对ART药物的反应和敏感性存在一定差异,会带来不同的耐药风险[11]。本研究发现,A亚型虽然耐药率最高,但该亚型在河南省占比较少。CRF01_AE和CRF55_01B亚型在河南省占有一定比例,耐药率均高于B和CRF07_BC亚型,与姚之莹等[12]报道的CRF01_AE耐药率高于其他亚型和Lan等[13]报道CRF55_01B耐药率达79.01%的结果基本一致。
核苷类耐药中,M184V/I突变率最高,其次为K65R,与国内外的研究结果一致[9, 14]。本结果显示:由于有多个核苷类药物耐药突变并存的情况,如M184V/I且K65R突变、M184V/I且TAMs突变,可能导致更多核苷类药物产生更高程度的耐药[15]。其中拉米夫定以高度耐药为主,阿巴卡韦、替诺福韦的中、高度耐药占50%左右。
非核苷类耐药中,突变率较高的是K103N/S、G190A/S、V106M/I、Y181C/I,这与国内及河南省前期报道结果一致[3, 16],这些突变一旦出现会导致对依非韦仑和奈韦拉平的高度耐药。由于非核苷类药物之间易出现交叉耐药,还会造成其他非核苷类药物的高度耐药 [17-18]。因此,本结果中不仅依非韦仑和奈韦拉平以高度耐药为主,还有新一代非核苷类药物利匹韦林和多拉韦林出现相当比例的中、高度耐药,极大地限制了新药的使用。
PIs和INSTIs突变发生较少。PIs突变率位居前3位的主要突变分别是M46I、V82A/F和I54V/MV。由于PIs的耐药屏障较高,产生耐药一般需要多个主要突变同时发生,在本研究中仅发现13例患者因M46I、V82A和I54V同时发生突变,造成洛匹那韦/利托那韦高度耐药。但由于河南省使用洛匹那韦/利托那韦患者较多[1],仍要警惕PIs耐药问题。在INSTIs中,以次要突变E157Q/EQ的突变率最高,主要突变Q148R/OH、N155H、R263K突变率低。在一代INSTIs中,拉替拉韦、艾维雷韦耐药屏障相对较低,1个主要突变Q148H/R或N155H/S可引起拉替拉韦高度耐药,且拉替拉韦和艾维雷韦存在交叉耐药[19];在二代INSTIs中,多替拉韦和比克替拉韦耐药至少需要≥2个主要突变,耐药屏障较高。虽然INSTIs在临床上应用时间较短,但本研究发现,有6例艾滋病患者对所有INSTIs全部耐药,造成后续方案选择困难。随着INSTIs进入医疗保险报销政策,艾滋病患者更多选择使用,临床上根据患者耐药结果合理规范使用,加强依从性教育,避免或减少INSTIs耐药的发生。
综上所述,河南省艾滋病患者ART失败的耐药率高,主要表现在NNRTIs和NRTIs耐药率高,耐药突变复杂多样。虽然目前INSTIs和PIs耐药相对较少,但耐药风险仍需警惕。建议有条件的情况下,对ART前的患者开展耐药检测,选择高耐药屏障药物治疗,在ART之后要及时进行病毒载量检测,评估疗效,一旦发现ART失败,尽快进行耐药检测和更换ART方案。对病毒载量50~1 000拷贝数/ml之间的患者开展耐药检测,也是及早发现耐药、应对HIV-1耐药的举措之一。
利益冲突 所有作者声明无利益冲突
作者贡献声明 杨萱:研究设计、论文撰写、数据分析;孙燕:研究指导、论文修改;霍玉奇、刘金瑾:实验操作,英文校对;张晓华、张雪:数据收集整理;赵淑娴、王艳:标本采集;赵清霞:研究指导、审阅文章;陈昭云:数据收集整理、统计分析
| [1] |
赵清霞, 窦萍, 李自钊. 河南省艾滋病免费抗病毒治疗20年——回顾与思考[J]. 中国艾滋病性病, 2022, 28(3): 261-263. DOI:10.13419/j.cnki.aids.2022.03.02 Zhao QX, Dou P, Li ZZ. Review of 20 years of free antiretroviral treatment of HIV/AIDS in Henan Province[J]. Chin J AIDS STD, 2022, 28(3): 261-263. DOI:10.13419/j.cnki.aids.2022.03.02 |
| [2] |
Wu J, Norris J, Liu HX, et al. The prevalence of HIV drug resistance among treatment-failure individuals and treatment-naïve individuals in China: a meta-analysis[J]. Biomed Environ Sci, 2014, 27(11): 858-871. DOI:10.3967/bes2014.123 |
| [3] |
陈昭云, 孙燕, 李超锋, 等. 艾滋病抗病毒治疗失败患者的耐药情况分析[J]. 中华传染病杂志, 2021, 39(8): 480-484. DOI:10.3760/cma.j.cn311365-20200925-00797 Chen ZY, Sun Y, Li CF, et al. Analysis of drug resistance in patients with acquired immunodeficiency syndrome who failed antiviral therapy[J]. Chin J Infect Dis, 2021, 39(8): 480-484. DOI:10.3760/cma.j.cn311365-20200925-00797 |
| [4] |
刘佳, 闫江舟, 杨文杰, 等. 河南省1 922例艾滋病一线抗病毒治疗失败患者中HIV耐药基因突变情况分析[J]. 中华预防医学杂志, 2015, 49(11): 950-955. DOI:10.3760/cma.j.issn.0253-9624.2015.11.005 Liu J, Yan JZ, Yang WJ, et al. Analysis of HIV-1 drug resistance among 1 922 individuals experiencing virological failure of first-line antiretroviral therapy in Henan province[J]. Chin J Prev Med, 2015, 49(11): 950-955. DOI:10.3760/cma.j.issn.0253-9624.2015.11.005 |
| [5] |
Liu JJ, Zhang XH, Hou MJ, et al. Prevalence of transmitted drug resistance mutations among patients infected with human immunodeficiency virus type 1 (HIV-1) in Henan Province, China[J]. Chin Med J, 2022, 135(22): 2750-2752. DOI:10.1097/CM9.0000000000002523 |
| [6] |
Espíndola MS, Lima LJG, Soares LS, et al. Dysregulated immune activation in second-line HAART HIV+ patients is similar to that of untreated patients[J]. PLoS One, 2015, 10(12): e0145261. DOI:10.1371/journal.pone.0145261 |
| [7] |
Iyidogan P, Anderson KS. Current perspectives on HIV-1 antiretroviral drug resistance[J]. Viruses, 2014, 6(10): 4095-4139. DOI:10.3390/v6104095 |
| [8] |
Li L, Sun GQ, Liang SJ, et al. Different distribution of HIV-1 subtype and drug resistance were found among treatment naïve individuals in Henan, Guangxi, and Yunnan province of China[J]. PLoS One, 2013, 8(10): e75777. DOI:10.1371/journal.pone.0075777 |
| [9] |
肖培培, 卢静, 胡海洋, 等. 2016年江苏省579例艾滋病抗病毒治疗失败患者HIV-1耐药突变状况及影响因素分析[J]. 中华预防医学杂志, 2017, 51(11): 988-993. DOI:10.3760/cma.j.issn.0253-9624.2017.11.007 Xiao PP, Lu J, Hu HY, et al. Drug resistance mutations and its associated factors among 579 HIV/AIDS patients experiencing failure of antiretroviral therapy in Jiangsu Province, China[J]. Chin J Prev Med, 2017, 51(11): 988-993. DOI:10.3760/cma.j.issn.0253-9624.2017.11.007 |
| [10] |
冯玉婷, 许玉军, 马岳绒, 等. 海南省抗病毒治疗失败HIV/AIDS患者HIV-1亚型及基因型耐药分析[J]. 中国热带医学, 2021, 21(6): 594-599. DOI:10.13604/j.cnki.46-1064/r.2021.06.18 Feng YT, Xu YJ, Ma YR, et al. Analysis of HIV-1 subtypes and genotyping drug resistance among HIV/AIDS patients with antiretroviral therapy failure in Hainan[J]. China Trop Med, 2021, 21(6): 594-599. DOI:10.13604/j.cnki.46-1064/r.2021.06.18 |
| [11] |
Gartner MJ, Roche M, Churchill MJ, et al. Understanding the mechanisms driving the spread of subtype C HIV-1[J]. E Bio Medicine, 2020, 53: 102682. DOI:10.1016/j.ebiom.2020.102682 |
| [12] |
姚之莹, 杨翠先, 张米, 等. 人类免疫缺陷病毒-1 CRF08_BC、CRF07_BC及CRF01_AE亚型耐药突变研究[J]. 中华传染病杂志, 2017, 35(10): 626-629. DOI:10.3760/cma.j.issn.1000-6680.2017.10.012 Yao ZY, Yang CX, Zhang M, et al. Study on drug resistance mutation of HIV-1 in CRF08_BC, CRF07_BC and CRF01_AE subtypes[J]. Chin J Infect Dis, 2017, 35(10): 626-629. DOI:10.3760/cma.j.issn.1000-6680.2017.10.012 |
| [13] |
Lan Y, Xin RL, Cai WP, et al. Characteristics of drug resistance in HIV-1 CRF55_01B from ART-experienced patients in Guangdong, China[J]. J Antimicrob Chemother, 2020, 75(7): 1925-1931. DOI:10.1093/jac/dkaa116 |
| [14] |
Rhee SY, Jordan MR, Raizes E, et al. HIV-1 drug resistance mutations: potential applications for point-of-care genotypic resistance testing[J]. PLoS One, 2015, 10(12): e0145772. DOI:10.1371/journal.pone.0145772 |
| [15] |
李敬云. HIV-1的耐药基因突变[J]. 中国艾滋病性病, 2010, 16(2): 195-197, 200. DOI:10.13419/j.cnki.aids.2010.02.011 Li JY. HIV-1 drug resistance mutations[J]. Chin J AIDS STD, 2010, 16(2): 195-197, 200. DOI:10.13419/j.cnki.aids.2010.02.011 |
| [16] |
Lin B, Sun XG, Su SL, et al. HIV drug resistance in HIV positive individuals under antiretroviral treatment in Shandong Province, China[J]. PLoS One, 2017, 12(7): e0181997. DOI:10.1371/journal.pone.0181997 |
| [17] |
Wang YL, de Clercq E, Li GD. Current and emerging non-nucleoside reverse transcriptase inhibitors(NNRTIs) for HIV-1 treatment[J]. Expert Opin Drug Met Toxicol, 2019, 15(10): 813-829. DOI:10.1080/17425255.2019.1673367 |
| [18] |
Menéndez-Arias L. Molecular basis of human immunodeficiency virus drug resistance: an update[J]. Antivir Res, 2010, 85(1): 210-231. DOI:10.1016/j.antiviral.2009.07.006 |
| [19] |
谢小慧, 于凤婷, 张霞, 等. HIV-1整合酶抑制剂耐药研究进展[J]. 中国艾滋病性病, 2020, 26(8): 900-902. DOI:10.13419/j.cnki.aids.2020.08.30 Xie XH, Yu FT, Zhang X, et al. Advances in drug resistance of HIV-1 integrase inhibitors[J]. Chin J AIDS STD, 2020, 26(8): 900-902. DOI:10.13419/j.cnki.aids.2020.08.30 |
 2023, Vol. 44
2023, Vol. 44