文章信息
- 张媛媛, 杭惠, 许倩, 刘成, 谭亚运, 崔朋伟, 包林, 刘慧, 路珊珊, 徐凤, 庞媛媛, 田歌, 张钧, 朱杰, 陈立凌.
- Zhang Yuanyuan, Hang Hui, Xu Qian, Liu Cheng, Tan Yayun, Cui Pengwei, Bao Lin, Liu Hui, Lu Shanshan, Xu Feng, Pang Yuanyuan, Tian Ge, Zhang Jun, Zhu Jie, Chen Liling
- 苏州市新型冠状病毒既往感染者再感染情况调查分析
- Investigation of 2019-nCoV reinfection in previously infected people in Suzhou
- 中华流行病学杂志, 2023, 44(11): 1756-1761
- Chinese Journal of Epidemiology, 2023, 44(11): 1756-1761
- http://dx.doi.org/10.3760/cma.j.cn112338-20230331-00199
-
文章历史
收稿日期: 2023-03-31
2. 苏州市卫生计生统计信息中心, 苏州 215000
2. Suzhou Health Planning Statistics Information Center, Suzhou 215000, China
自2020年新型冠状病毒(新冠病毒)感染全球大流行以来,新冠病毒不断出现变异,截至目前至少已鉴定出80种不同基因型变异株[1]。不同变异株的再感染风险有所不同,而Omicron变异株出现后人群再感染风险显著提升[2]。全国每日新冠病毒核酸检测阳性率在2022年12月25日达到29.2%的峰值[3]。今后可能面临新变异株的不断出现并引发新的流行,而新冠病毒疫苗加强接种和新冠病毒既往感染者先前产生的免疫力是否对后续的变异株有保护作用仍有待确定,在同等流行强度下,相较于社区人群,既往感染者再感染后的疾病特征目前尚不明确。本研究对苏州市新冠病毒既往感染者开展2022年12月8日至2023年1月18日(本轮疫情)再感染情况调查,旨在获取既往感染者在本轮疫情的再感染情况和疾病特征,比较分析再感染者和社区对照人群初次感染者本轮疫情感染后的疾病严重程度,为研究新冠病毒再感染风险、就诊率、重症率、疫苗保护率和疾病负担等提供可靠数据和参数依据。
对象与方法1. 研究对象:对2020年1月22日至2022年11月8日苏州市经中国传染病报告信息管理系统报告的新冠病毒既往感染者开展本轮疫情再感染情况调查。考虑新冠病毒感染者个体转阴时间以及感染后30 d内出现复阳比例较高的情况,本调查排除与初次感染间隔时间不足30 d的既往感染者,仅对2022年11月8日前进行疫情报告的既往感染者进行再感染调查。
为掌握社区人群新冠病毒实时感染率,苏州市于12月中旬按照常住人口千分之一的比例以分层抽样方法建立新冠病毒感染社区随访队列,共19 621人,队列人员在2022年12月8日前均无新冠病毒感染的疫情报告,本轮疫情初次感染组均从该随访队列中抽取,并与再感染组按1∶2成组匹配,匹配条件包括与再感染者同居住地(相同或相邻社区、村镇)、同年龄组且同性别。收集再感染组和初次感染组在本轮疫情感染后的就诊、住院、重症、临床症状和预后情况,比较分析再感染者和初次感染者的疾病严重程度。
2. 调查方法与质量控制:2023年1月16-18日由苏州市、县(区)两级CDC协作完成辖区内既往感染者和社区对照组的调查工作,采用自行设计的调查问卷,由调查员通过电话询问完成调查,同时收集既往感染者本轮疫情的疾病报告登记、苏州市全场景疫情病原体检测信息系统中已有的实时荧光RT-PCR核酸检测结果和医疗记录等资料。正式调查前,开展预调查和专家论证,所有调查员接受统一培训,调查问卷实行双人双录入的核对方式,确保其准确性和逻辑性。
3. 相关定义和分组:
(1) 本轮疫情感染的判断[4]:符合3种情况之一者:①实时荧光RT-PCR检测新冠病毒核酸阳性;②新冠病毒抗原检测阳性;③有流行病学史,出现新冠病毒感染相关症状(发热、咳嗽等)任何2项的人员。
(2) 再感染者:苏州市2020年1月22日至2022年11月8日经中国传染病报告信息管理系统报告的新冠病毒既往感染者,符合本轮疫情感染判断标准,并结合流行病学调查、实验室检测结果等综合判定排除复阳情况。
(3) 疫苗接种:新冠病毒疫苗接种信息均来自江苏省免疫规划信息管理系统,综合不同类型新冠病毒疫苗的接种程序,将新冠病毒疫苗接种史分为未接种、已接种但未完成全程、已全程接种、加强免疫3剂次、加强免疫4剂次。
(4) 疾病程度:基于WHO对新冠病毒感染及其症状的疾病程度分级原则[5],从无感染到死亡分为8个级别:0级:未感染;1级:不限制日常活动;2级:日常活动受限;3级(轻症):没有输氧气的住院治疗;4级(轻症):输氧的住院治疗;5级(重症):住院接受高流量氧疗;6级(重症):通过插管机械呼吸的住院治疗;7级(重症):接受机械呼吸和外部器官支持的住院治疗,例如Ecmo治疗;8级:死亡。
4. 统计学分析:采用Excel 2010软件建立数据库进行数据清理,采用SPSS.19.0软件对数据进行分析。定量资料用x±s、M(Q1,Q3)描述,分类资料用频数、构成比和率(%)描述,采用χ2检验进行组间分析。双侧检验,检验水准α=0.05。
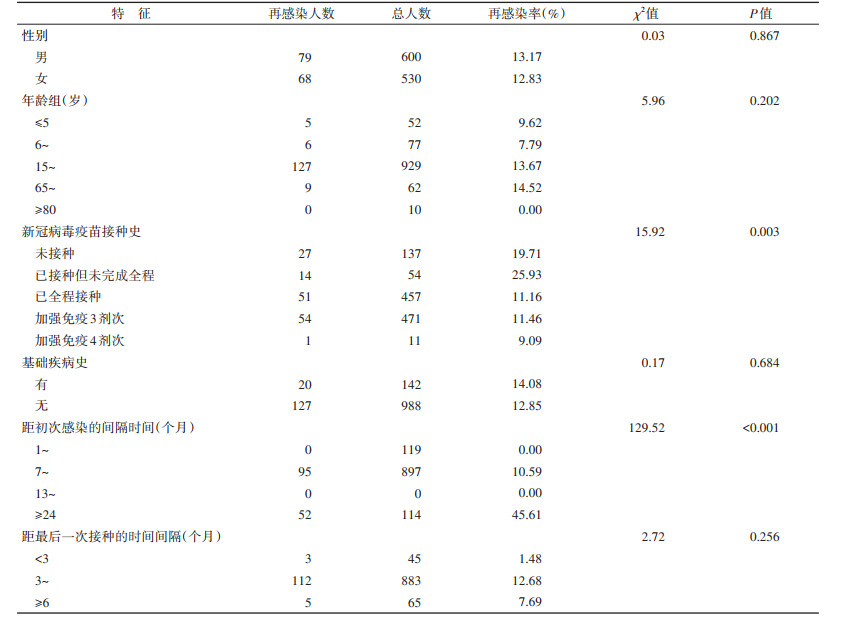
结果1. 基本情况:根据中国传染病报告信息管理系统,对2020年1月22日至2022年11月8日报告的既往感染者1 380人开展问卷调查,问卷回收率为81.88%(1 130/1 380)。根据调查反馈,既往感染者中有147人在本轮疫情中出现再感染,再感染率为13.01%(147/1 130)。
2. 不同特征既往感染者再感染率:再感染者中,不同性别、年龄及有无基础疾病史的组间再感染率差异无统计学意义(均P > 0.05)。不同新冠病毒疫苗接种史的再感染率差异有统计学意义(P=0.003),未接种和已接种但未完成全程的既往感染者再感染率均高于已全程接种和完成加强免疫者的再感染率,接种加强免疫4剂次疫苗既往感染者的再感染率最低(9.09%,1/11)。
距初次感染的间隔时间对再感染率的影响差异有统计学意义(P < 0.001),M(Q1,Q3)为310(263,1 048)d。距初次感染间隔时间在1~6个月者未发现再感染,7~12个月者再感染率为10.59%(95/897),≥24个月者再感染率为45.61%(52/114)。
既往感染者993人接种过新冠病毒疫苗,距最后一次接种的时间间隔对再感染率的影响差异无统计学意义(P=0.256)。见表 1。
3. 再感染组和初次感染组基本情况:再感染组147人中,男性79人(53.10%),女性68人(46.90%),年龄范围为3月龄至73岁,年龄为(37.20±15.53)岁。初次感染组294人中,男性158人(53.74%),女性136人(46.26%),年龄范围为1~79岁,年龄为(37.54±15.76)岁。两组人群的性别、年龄差异无统计学意义(均P > 0.05)。
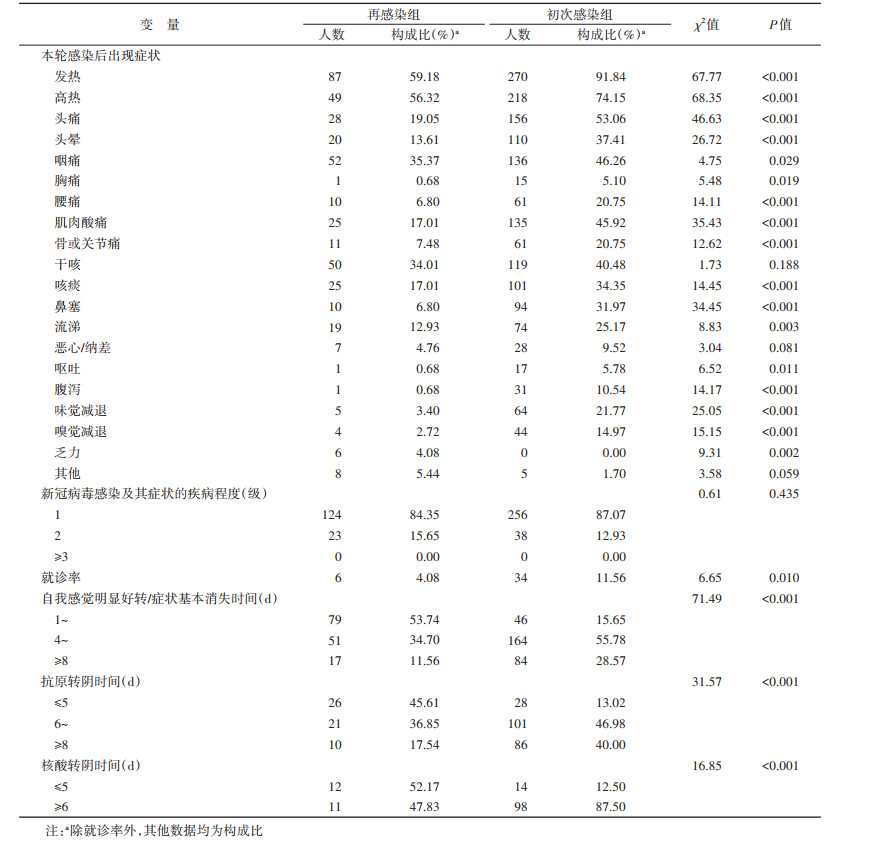
4.感染后临床症状:再感染组出现的主要症状为发热(59.18%)、咽痛(35.37%)、干咳(34.01%)、头痛(19.05%)、咳痰(17.01%)、肌肉酸痛(17.01%)和头晕(13.61%),其中56.32%的病例出现高热,体温M(Q1,Q3)为38.5(38.0,39.0)℃,发热持续时间M(Q1,Q3)为2(1,2)d。初次感染组出现的主要症状为发热(91.84%)、头痛(53.06%)、咽痛(46.26%)、肌肉酸痛(45.92%)、干咳(40.48%)、头晕(37.41%)、咳痰(34.35%),其中74.15%的病例出现高热,体温M(Q1,Q3)为39.0(38.5,39.2)℃,发热持续时间M(Q1,Q3)为2(2,3)d。再感染者和初次感染者出现的主要临床症状基本相同,除干咳、恶心/纳差和其他症状外,其余各项临床症状在两组间差异有统计学意义(均P < 0.05),再感染者发热后的最高体温和持续时间均低于初次感染者。
再感染者中就诊率为4.08%(6/147),住院率和重症率均为0,初次感染者就诊率为11.56%(34/294),无住院和重症病例,就诊率差异有统计学意义(P=0.010)。见表 2。
5.感染后预后情况:53.74%的再感染者自我感觉明显好转/症状基本消失时间为1~ d,55.78%的初次感染者的时间为4~7 d;45.61%的再感染者抗原转阴时间≤5 d,核酸转阴时间≤5 d的占比最高(52.17%),而初次感染者多在感染后≥6 d抗原/核酸转阴,两组在自我感觉明显好转/症状基本消失、核酸/抗原转阴时间差异有统计学意义(均P < 0.001)。见表 2。
讨论本研究既往感染者的再感染率为13.01%,而我国苏州市新冠病毒感染社区随访队列人群调查结果显示,本轮疫情标化感染率为82.34%,既往感染者再感染的风险是社区人群的0.04倍(结果未展示)。Pilz等[6]经RT-PCR检测确认的新冠病毒再感染率为0.27%,远低于本研究,而其余普通人群的感染率为2.85%,既往感染者再感染的风险是普通人群的0.09倍。美国的一项回顾性队列研究显示,初次感染90 d后经RT-PCR检测新冠病毒核酸阳性的再感染率为4.9%[7];印度研究显示,新冠病毒感染者的再感染率为4.5%[8]。本轮疫情研究结果与巴西的调查结果(14.5%)接近[9],但高于美国和印度的调查结果,一方面可能与流行强度有关,另一方面可能在感染判断上,本研究将抗原阳性和有新冠病毒感染的相关症状纳入阳性判断依据中有关。
本研究中既往感染者再感染距初次感染的间隔时间均在180 d(6个月)以上,M为310 d,长于美国(138.9 d)[7]、奥地利(212 d)[6]、卡塔尔(277 d)的研究结果[10]。有研究认为初次感染后至少6个月内体内仍表现为抗体阳性,再感染风险降低91%[11],在英国开展一项对医疗保健工作者的队列研究中,初次感染后长达6个月内未发现有症状的再感染[12],与本研究结果基本一致。
本研究发现,有新冠病毒疫苗接种史的既往感染者中,接种加强免疫4剂次疫苗的再感染率最低(9.09%)。卡塔尔的一项病例对照研究结果显示,既往感染且接种3剂次mRNA疫苗者对抗Omicron变异株感染的有效性最高[13],与本研究一致。既往感染和疫苗加强接种产生的混合免疫可能提供了较强的保护作用。
本研究再感染者就诊率为4.08%,低于初次感染者的就诊率(11.56%),再感染者中无住院和重症的发生。美国的一项研究提示,再感染者中很少发生住院和重症监护情况[7];卡塔尔的研究显示,再感染者中出现严重疾病的概率是初次感染者的0.12倍,再感染者中无重症和死亡病例报告[10]。本研究支持再感染的疾病严重程度轻于初次感染者[14-15],曾有病例报告研究报道再感染较初次感染症状更严重,管理成本更高[16-17],认为再感染的症状严重程度可能与初次感染后是否产生足够有效的免疫保护和感染时的病毒载量有关[16-19]。美国的一项研究提示,再感染的累积健康风险和负担随着感染次数的增加而增加,预防再感染可避免额外的健康风险[20]。
本研究中再感染者和初次感染者最多的症状为发热,分别为59.18%和91.84%,再感染者报告发热的最高体温和发热持续时间均低于初次感染者,Dhillon等[11]也发现在初次感染和再感染期间,发热是最常见的症状,与本研究结果一致。本研究还比较了再感染者和初次感染者的预后情况,发现再感染者核酸/抗原转阴时间和自我感觉明显好转/症状基本消失时间均比初次感染者短,恢复更快,与英国的一项新冠病毒再感染病例研究一致[21]。
本研究存在局限性。本调查具有地域局限性,且调查的既往感染者数量有限,可能存在偏倚;苏州市既往感染者主要感染新冠病毒原始株和Omicron变异株的不同亚型,而本轮疫情的流行毒株为Omicron变异株,主要为BA.5.2和BF.7及其亚型,受现有条件限制,未能开展不同变异株的再感染情况比较分析和再感染对既往人群的风险研究。
综上所述,本研究对苏州市新冠病毒既往感染者进行了再感染情况的调查分析,并排除了新冠病毒感染者个体排毒时间和复阳对判定再感染的影响,估算了苏州市本轮疫情的再感染率。本研究结果提示新冠病毒疫苗的加强接种可降低再感染的风险,现阶段要继续加强人群主动接种,对既往感染者可执行感染6个月后的加强接种,从而不断提高人群免疫水平,降低重症和死亡的风险[22],本研究对新冠病毒感染防控措施调整后我国的疫情风险预测具有一定参考价值。
利益冲突 所有作者声明无利益冲突
作者贡献声明 张媛媛:酝酿和设计实验、实施研究、采集数据、分析/解释数据、文章撰写;杭惠、许倩、刘成、谭亚运、崔朋伟、包林、刘慧、路珊珊、徐凤、庞媛媛、田歌:采集数据、支持;张钧:酝酿和设计实验、分析/解释数据、内容审阅、支持;陈立凌:酝酿和设计实验、实施研究、分析/解释数据、内容审阅、获取经费、研究指导、支持;朱杰:支持
| [1] |
Koyama T, Platt D, Parida L. Variant analysis of SARS-CoV-2 genomes[J]. Bull World Health Organ, 2020, 98(7): 495-504. DOI:10.2471/BLT.20.253591 |
| [2] |
Pulliam JRC, van Schalkwyk C, Govender N, et al. Increased risk of SARS-CoV-2 reinfection associated with emergence of Omicron in South Africa[J]. Science, 2022, 376(6593): eabn4947. DOI:10.1126/science.abn4947 |
| [3] |
中国疾病预防控制中心. 全国新型冠状病毒感染疫情情况[EB/OL]. (2023-02-15)[2023-03-25]. https://www.chinacdc.cn/jkzt/crb/zl/szkb_11803/jszl_13141/202303/ t20230325_264584.html.
|
| [4] |
World Health Organization. Public health surveillance for COVID-19: interim guidance[EB/OL]. (2022-07-22)[2023-01-12]. https://www.who.int/publications/i/item/who-2019-nCoV-surveillanceguidance-2020.7.
|
| [5] |
World Health Organization. Clinical management of COVID-19: living guideline[EB/OL]. (2022-09-15)[2023-01-12]. https://www.who.int/publications/i/item/WHO-2019-nCoV-Clinical-2022.2.
|
| [6] |
Pilz S, Chakeri A, Ioannidis JP, et al. SARS-CoV-2 re-infection risk in Austria[J]. Eur J Clin Invest, 2021, 51(4): e13520. DOI:10.1111/eci.13520 |
| [7] |
Sheehan MM, Reddy AJ, Rothberg MB. Reinfection rates among patients who previously tested positive for coronavirus disease 2019: a retrospective cohort study[J]. Clin Infect Dis, 2021, 73(10): 1882-1886. DOI:10.1093/cid/ciab234 |
| [8] |
Mukherjee A, Anand T, Agarwal A, et al. SARS-CoV-2 re-infection: development of an epidemiological definition from India[J]. Epidemiol Infect, 2021, 149: e82. DOI:10.1017/S0950268821000662 |
| [9] |
Cerqueira-Silva T, Andrews JR, Boaventura VS, et al. Effectiveness of CoronaVac, ChAdOx1 nCoV-19, BNT162b2, and Ad26. COV2. S among individuals with previous SARS-CoV-2 infection in Brazil: a test-negative, case-control study[J]. Lancet Infect Dis, 2022, 22(6): 791-801. DOI:10.1016/S1473-3099(22)00140-2 |
| [10] |
Abu-Raddad LJ, Chemaitelly H, Bertollini R, et al. Severity of SARS-CoV-2 reinfections as compared with primary infections[J]. N Engl J Med, 2021, 385(26): 2487-2489. DOI:10.1056/NEJMc2108120 |
| [11] |
Dhillon RA, Qamar MA, Gilani JA, et al. The mystery of COVID-19 reinfections: a global systematic review and meta-analysis[J]. Ann Med Surg, 2021, 72: 103130. DOI:10.1016/j.amsu.2021.103130 |
| [12] |
West J, Everden S, Nikitas N. A case of COVID-19 reinfection in the UK[J]. Clin Med, 2021, 21(1): e52-53. DOI:10.7861/clinmed.2020-0912 |
| [13] |
Altarawneh HN, Chemaitelly H, Ayoub HH, et al. Effects of previous infection and vaccination on symptomatic omicron infections[J]. N Engl J Med, 2022, 387(1): 21-34. DOI:10.1056/NEJMoa2203965 |
| [14] |
Lumley SF, O'Donnell D, Stoesser NE, et al. Antibody status and incidence of SARS-CoV-2 infection in health care workers[J]. N Engl J Med, 2021, 384(6): 533-540. DOI:10.1056/NEJMoa2034545 |
| [15] |
Borras-Bermejo B, Piñana M, Andrés C, et al. Characteristics of 24 SARS-CoV-2-sequenced reinfection cases in a tertiary hospital in Spain[J]. Front Microbiol, 2022, 13: 876409. DOI:10.3389/fmicb.2022.876409 |
| [16] |
Gaire D, Sah M, Singh B. COVID-19 reinfection in a young medical doctor: a case report[J]. J Nepal Med Assoc, 2021, 59(239): 712-715. DOI:10.31729/jnma.6450 |
| [17] |
Tillett RL, Sevinsky JR, Hartley PD, et al. Genomic evidence for reinfection with SARS-CoV-2: a case study[J]. Lancet Infect Dis, 2021, 21(1): 52-58. DOI:10.1016/S1473-3099(20)30764-7 |
| [18] |
Stokel-Walker C. What we know about covid-19 reinfection so far[J]. BMJ, 2021, 372: n99. DOI:10.1136/bmj.n99 |
| [19] |
Iwasaki A. What reinfections mean for COVID-19[J]. Lancet Infect Dis, 2021, 21(1): 3-5. DOI:10.1016/S1473-3099(20)30783-0 |
| [20] |
Bowe B, Xie Y, Al-Aly Z. Acute and postacute sequelae associated with SARS-CoV-2 reinfection[J]. Nat Med, 2022, 28(11): 2398-2405. DOI:10.1038/s41591-022-02051-3 |
| [21] |
Hanrath AT, Payne BAI, Duncan CJA. Prior SARS-CoV-2 infection is associated with protection against symptomatic reinfection[J]. J Infect, 2021, 82(4): e29-30. DOI:10.1016/j.jinf.2020.12.023 |
| [22] |
国务院应对新型冠状病毒感染疫情联防联控机制综合组. 关于印发应对近期新冠病毒感染疫情疫苗接种工作方案的通知[EB/OL]. (2023-04-06)[2023-04-10]. http://www.nhc.gov.cn/xcs/zhengcwj/202304/c8 db1a9 da0204fdb87c88 d7f70b284c0.shtml.
|
 2023, Vol. 44
2023, Vol. 44