文章信息
- 穆秋玥, 冯添, 黄飞, 罗周, 焦宇航, 高源雪, 管庆虎, 陈虎, 张锐智.
- Mu Qiuyue, Feng Tian, Huang Fei, Luo Zhou, Jiao Yuhang, Gao Yuanxue, Guan Qinghu, Chen Hu, Zhang Ruizhi
- 3岁及以上人群新型冠状病毒灭活疫苗接种反应临床观察分析
- Clinical observation on adverse reaction after vaccination of inactivated 2019-nCoV vaccine in population aged 3 years and above
- 中华流行病学杂志, 2023, 44(11): 1738-1743
- Chinese Journal of Epidemiology, 2023, 44(11): 1738-1743
- http://dx.doi.org/10.3760/cma.j.cn112338-20230328-00189
-
文章历史
收稿日期: 2023-03-28
2. 贵州省沿河县疾病预防控制中心免疫规划科, 沿河 565300
2. Department for Immunization Planning, Yanhe County Center for Disease Control and Prevention of Guizhou, Yanhe 565300, China
新型冠状病毒(新冠病毒)属于β属冠状病毒,人群普遍易感。主要传播途径为经呼吸道飞沫和密切接触传播[1]。截至2023年3月16日,全球累计报告新冠病毒感染确诊66 251万例,累计死亡677万例。2020年12月30日中国附条件上市使用第一批新冠病毒灭活疫苗(Vero细胞)。2021年3月国家卫生健康委员会发布《新冠病毒疫苗接种技术指南(第一版)》[2],疫苗接种成为中国新冠病毒防控重要措施。为获得新冠病毒灭活疫苗接种安全性证据,在贵州省开展≥3岁人群大规模接种新冠病毒灭活疫苗的安全性观察研究。
对象与方法1. 研究对象:采用开放式设计,于2021年6月至2022年7月在贵州省沿河县招募≥3岁人群作为研究对象。纳入标准:①未接种过任何新冠病毒疫苗或接种≥1剂次北京科兴中维生物技术有限公司研制的克尔来福®;②≥3岁人群;③同意签署知情同意书并自愿参加随访。排除标准:①既往发生过疫苗严重过敏反应者(如急性过敏反应、血管神经性水肿、呼吸困难等);②患有严重神经性系统疾病者(如横贯性脊髓炎、格林巴利综合征、脱髓鞘疾病等);③患急性疾病、慢性疾病的急性发作期、严重慢性疾病者;④接种时体温≥37.3 ℃。
2. 疫苗及免疫程序:研究疫苗为北京科兴中维生物技术有限公司生产的新冠病毒灭活疫苗(Vero细胞)(商品名:克尔来福®),主要成分为灭活的新冠病毒(CZ02株)。疫苗为预充注射剂型,规格0.5 ml/支,含灭活新冠病毒抗原600 SU。批号为A2021010016和A202105018,有效期均为2023年5月。研究疫苗按照(0,28)d免疫程序接种,接种部位为上臂外侧三角肌,每人剂量0.5 ml/次。疫苗均在2~8 ℃环境下储存、运输。本研究通过贵州省CDC疫苗临床试验伦理委员会审批(批准文号:2021-05-001,2021-08-001)。成年研究对象由本人签署知情同意书,3~7岁研究对象由监护人签署,8~17岁研究对象由本人及其监护人同时签署知情同意书。
3. 数据收集:采用统一的记录表进行数据收集,分为一般人口学信息和安全性观察信息。其中安全性观察信息包括每剂次疫苗接种后30 min内和0~28 d发生的不良反应。不良反应分为征集性不良反应和非征集性不良反应。征集性不良反应包括征集性全身不良反应(包括发热、急性过敏反应、皮肤黏膜异常、腹泻、厌食、呕吐、恶心、肌肉痛、头痛、咳嗽、疲劳乏力)和征集性局部不良反应(包括接种部位疼痛、硬结/肿胀、红晕、皮疹、瘙痒)。研究人员审核所有不良反应的发生时间、结束时间和严重程度分级。严重程度分级参照国家药品监督管理局发布的《预防用疫苗临床试验不良反应分级标准指导原则》分为1级(轻度)、2级(中度)、3级(严重)和4级(潜在的生命威胁)[3]。
4. 统计学分析:所有统计学分析采用Stata 17.0软件完成。采用Excel软件建立数据库,并双人复核。分年龄、剂次、患病情况计算不良反应发生率,并对不良反应的种类、严重程度(同一研究对象发生严重程度不一致的多个不良反应按照严重程度最高级别进行统计)、发生时间进行描述性分析,采用Fisher确切概率法或χ2检验对组间差异进行统计学分析。不良反应发生率=发生人数/接种人数×100%。双侧检验,检验水准α=0.05。
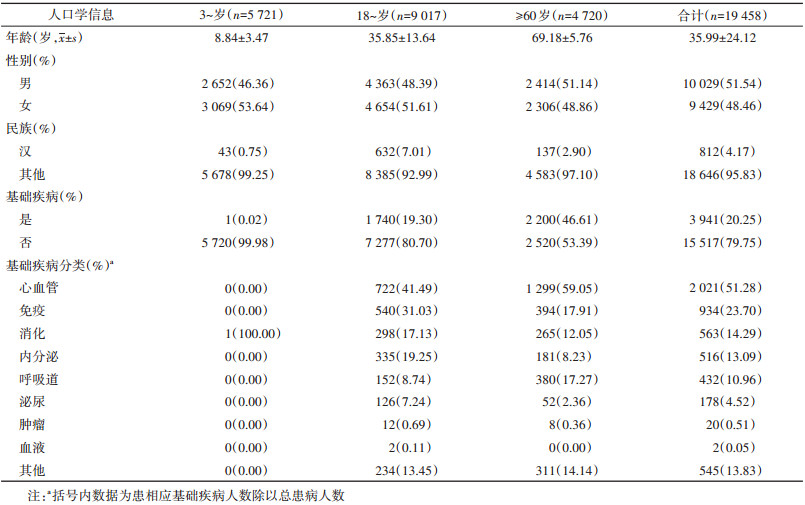
结果1. 基本情况:共纳入研究对象19 458人,3~、18~和≥60岁组分别纳入5 721、9 017和4 720人。男女性占比分别为51.54%和48.46%。其中≥60岁组中患基础疾病占比最高(46.61%,2 200/4 720)。见表 1。基础疾病分类占比前三位为心血管类疾病(27.52%,1 299/4 720)、免疫类疾病(8.35%,394/4 720)和呼吸道类疾病(8.05%,380/4 720)。
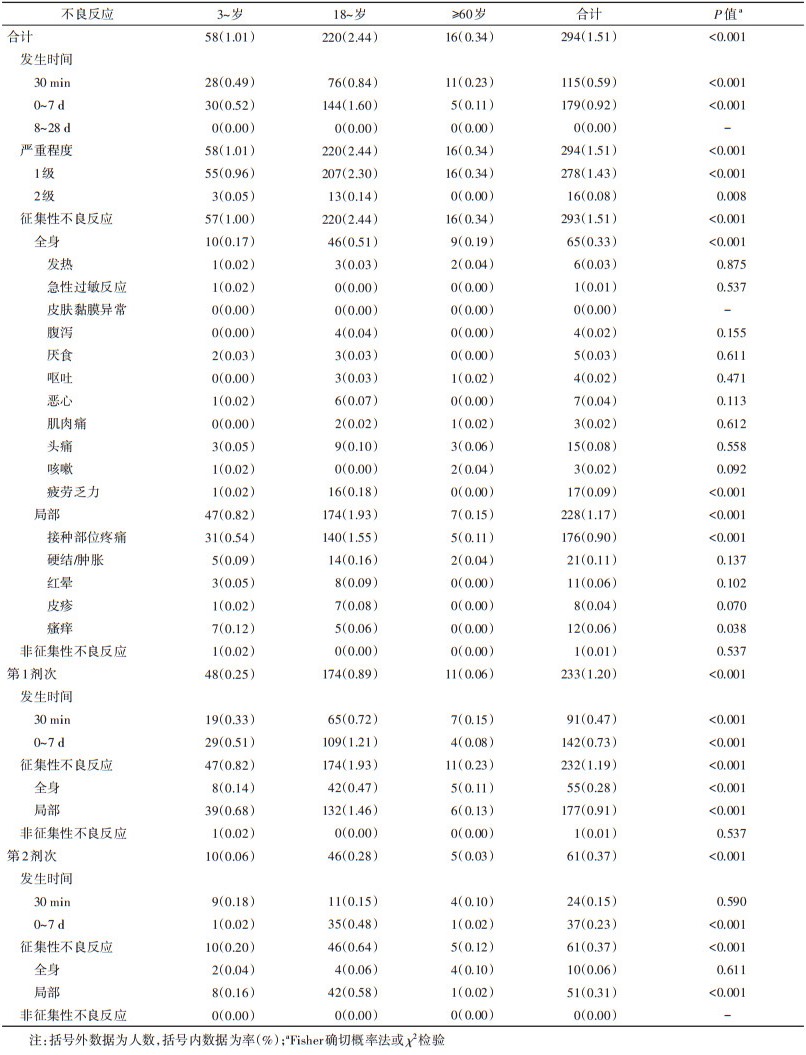
2. 不良反应概况:总不良反应发生率为1.51%(294/19 458),所有不良反应均发生在接种后7 d内,其中30 min内不良反应发生率为0.59%(115/19 458)。所有不良反应的严重程度为1级或2级,发生率分别为1.43%(278/19 458)和0.08%(16/19 458)。其中征集性和非征集性不良反应发生率分别为1.51%(293/19 458)和0.01%(1/19 458),征集性不良反应以局部不良反应为主,发生率为1.17%(228/19 458)。局部不良反应中接种部位疼痛的发生率较高,为0.90%(176/19 458);全身不良反应中疲劳乏力的发生率较高,为0.09%(17/19 458)。见表 2。
3. 不同年龄组不良反应发生情况:3~、18~及≥60岁组不良反应发生率分别为1.01%(58/5 721)、2.44%(220/9 017)和0.34%(16/4 730),差异有统计学意义(P < 0.001)。3~岁组以接种部位疼痛、瘙痒和硬结/肿胀常见,18~岁组以接种部位疼痛、硬结/肿胀和疲劳乏力常见,≥60岁组以接种部位疼痛、硬结/肿胀和头痛常见。各年龄组1级严重程度的不良反应发生率均较高,组间差异有统计学意义(P < 0.001)。见表 2。
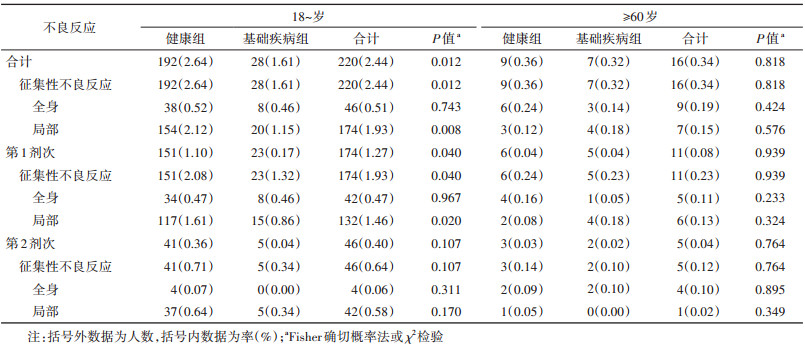
4. 不同健康状况成年人不良反应发生情况:18~岁组中健康组的不良反应发生率(2.64%,192/7 277)高于基础疾病组(1.61%,28/1 740),差异有统计学意义(P=0.012)。≥60岁组中健康组和基础疾病组不良反应发生率分别为0.36%(9/2 520)和0.32%(7/2 200),差异无统计学意义(P=0.818)。见表 3。
5. 不同剂次不良反应发生情况:第1剂次和第2剂次疫苗接种率分别为100.00%(19 458/19 458)和84.12%(16 368/19 458)。第1剂次总不良反应发生率(1.20%,233/19 458)高于第2剂次(0.37%,61/16 368),差异有统计学意义(P < 0.001)。其中3~、18~岁组不同剂次的不良反应发生率差异有统计学意义(P < 0.001),而≥60岁组差异无统计学意义(P > 0.05)。18~59岁人群中,健康组和基础疾病组不同剂次的不良反应发生率差异有统计学意义(均P < 0.05)。
讨论本研究纳入≥3岁人群共19 458人,2剂次新冠病毒灭活疫苗接种率达84.12%,研究规模较大,覆盖人群较广。参照WHO对于新冠病毒疫苗特殊关注的不良事件建议[4],同时重点考虑了患基础疾病人群的安全性观察,共纳入患基础疾病人群3 941人,其中18~岁1 740人,≥60岁2 200人。
本研究结果显示,≥3岁人群总不良反应发生率为1.51%,与Liu等[5]关于新冠病毒灭活疫苗安全性与免疫原性的系统综述结果相似;此外,本研究不良反应发生率低于疫苗Ⅲ期临床研究结果[6],已有研究结果表明,大规模公共疫苗接种后常见疑似预防接种异常反应的报告率低于临床试验[7]。
本研究不良反应均发生在7 d以内,严重程度多为轻度,以征集性不良反应为主。局部不良反应以接种部位疼痛最常见,全身不良反应以疲劳乏力最常见。第1剂次疫苗接种后的不良反应发生率为1.20%,显著高于第2剂次(0.37%),与李敏捷等[8]关于3~17岁儿童青少年接种新冠病毒灭活疫苗安全性评价和Yang等[9]对≥3岁人群大规模使用新冠病毒灭活疫苗的安全性研究类似。
本研究结果显示,不同年龄组不良反应发生率的组间差异有统计学意义,其中3~、18~和≥60岁组的不良反应发生率分别为1.01%、2.44%和0.34%。新冠病毒灭活疫苗的其他相关研究均有类似结果[8, 10-11]。成年人不良反应发生率较高,老年人发生率较低,分析原因可能为成年人能够主动报告不良反应,而老年人需要研究人员询问才报告。
此外,本研究发现18~59岁成年人中健康组不良反应发生率高于基础疾病组,组间差异有统计学意义,而≥60岁老年人组间差异无统计学意义。原因可能为成年人中患基础疾病人群占比明显低于老年人组,对研究结果产生一定影响。
目前新冠病毒感染疫情防控围绕保健康、防重症开展,由于老年人和患基础疾病人群感染新冠病毒后重症率和死亡率较高,成为新冠病毒灭活疫苗推荐接种的重点人群。但针对此类人群的大规模疫苗接种研究鲜有报道,存在疫苗犹豫现象[12-13]。本研究结果可为疫苗在真实世界中应用的安全性提供依据,特别是在老年健康人群和患基础疾病人群中。
本研究存在局限性。贵州省地属山区,青壮年外出务工现象常见,且研究对象年龄跨度大,由于外出、搬迁、死亡导致了8.70%(1 692/19 458)的失访,可能会对研究结果有一定影响;此外,18~、≥60岁组中患基础疾病人群占比差异较大,患不同基础疾病人群的占比差异也较大,后续可开展针对患不同基础疾病人群疫苗接种后的安全性研究。
综上所述,本研究使用的疫苗在≥3岁人群中接种后发生的不良反应主要为轻度,无严重程度为≥3级不良反应报告,表明疫苗接种的安全性良好,在老年健康人群和患基础疾病人群中均具有良好的安全性。
利益冲突 所有作者声明无利益冲突
作者贡献声明 穆秋玥:实施研究、分析/解释数据、撰写文章、指导;冯添:实施研究、统计分析;黄飞、罗周、焦宇航、高源雪、陈虎:实施研究、数据采集;管庆虎:实施研究、指导;张锐智:经费/行政与技术支持、指导
| [1] |
中华人民共和国国家卫生健康委员会. 关于印发新型冠状病毒感染诊疗方案(试行第十版)的通知[EB/OL]. (2023-01-05)[2023-03-18]. http://www.nhc.gov.cn/cmssearch/xxgk/getManuscriptXxgk.htm?id=32de5b2ff9bf4eaa88e75bdf7223a65a.
|
| [2] |
中华人民共和国国家卫生健康委员会. 新冠病毒疫苗接种技术指南(第一版)[EB/OL]. (2021-03-29)[2023-03-18]. http://www.gov.cn/xinwen/2021-03/29/content_5596577.htm.
|
| [3] |
国家药品监督管理局. 国家药监局关于发布预防用疫苗临床试验不良反应分级标准指导原则的通告(2019年第102号)[EB/OL]. (2019-12-31)[2023-03-20]. https://www.nmpa.gov.cn/xxgk/ggtg/qtggtg/20191231111901460.html.
|
| [4] |
World Health Organization. Monitoring and responding to AESI[EB/OL]. [2023-03-17]. https://cdn.who.int/media/docs/default-source/covid-19-vaccines-safety-surveillance-manual/training-slides_covid-19_vs_aesi02927042-43ab-4449-b633-e203b1a1bf31_12ab4d79-31b5-4aff-b301-260d5e5dbe78.pdf?sfvrsn=349552ff_8&Status=Master.
|
| [5] |
Liu Q, Qin CY, Liu M, et al. Effectiveness and safety of SARS-CoV-2 vaccine in real-world studies: a systematic review and meta-analysis[J]. Infect Dis Poverty, 2021, 10(1): 132. DOI:10.1186/s40249-021-00915-3 |
| [6] |
Tanriover MD, Doğanay HL, Akova M, et al. Efficacy and safety of an inactivated whole-virion SARS-CoV-2 vaccine (CoronaVac): interim results of a double-blind, randomised, placebo-controlled, phase 3 trial in Turkey[J]. Lancet, 2021, 398(10296): 213-222. DOI:10.1016/S0140-6736(21)01429-X |
| [7] |
Wu QH, Dudley MZ, Chen XH, et al. Evaluation of the safety profile of COVID-19 vaccines: a rapid review[J]. BMC Med, 2021, 19(1): 173. DOI:10.1186/s12916-021-02059-5 |
| [8] |
李敏捷, 王磊, 吴志伟, 等. 3~17岁健康儿童及青少年接种新型冠状病毒灭活疫苗安全性评价[J]. 中国公共卫生, 2022, 38(8): 985-989. DOI:10.11847/zgggws1138965 Li MJ, Wang L, Wu ZW, et al. Safety of inactivated COVID-19 vaccine in 3-17 years old healthy children[J]. Chin J Public Health, 2022, 38(8): 985-989. DOI:10.11847/zgggws1138965 |
| [9] |
Yang HT, Li Z, Zhang RZ, et al. Safety of primary immunization using inactivated SARS-CoV-2 vaccine (CoronaVac®) among population aged 3 years and older in a large-scale use: a multi-center open-label study in China[J]. Vaccine, 2023, 41(7): 1354-1361. DOI:10.1016/j.vaccine.2023.01.020 |
| [10] |
Jin LR, Li ZP, Zhang XY, et al. CoronaVac: a review of efficacy, safety, and immunogenicity of the inactivated vaccine against SARS-CoV-2[J]. Hum Vaccin Immunother, 2022, 18(6): 2096970. DOI:10.1080/21645515.2022.2096970 |
| [11] |
Wu ZW, Hu YL, Xu M, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine (CoronaVac) in healthy adults aged 60 years and older: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial[J]. Lancet Infect Dis, 2021, 21(6): 803-812. DOI:10.1016/S1473-3099(20)30987-7 |
| [12] |
龙思贵, 王健力, 张妍, 等. 新冠疫苗犹豫及其影响因素研究进展[J]. 中国感染控制杂志, 2022, 21(3): 305-310. DOI:10.12138/j.issn.1671-9638.20221710 Long SG, Wang JL, Zhang Y, et al. Advances in COVID-19 vaccine hesitancy and the influencing factors[J]. Chin J Infect Control, 2022, 21(3): 305-310. DOI:10.12138/j.issn.1671-9638.20221710 |
| [13] |
刘春梓, 庄英杰, 于燕波, 等. 新型冠状病毒疫苗犹豫研究进展[J]. 中华医院感染学杂志, 2021, 31(19): 2905-2909. DOI:10.11816/cn.ni.2021-210091 Liu CZ, Zhuang YJ, Yu YB, et al. Status and research progress of vaccine hesitancy for COVID-19[J]. Chin J Nosocomiol, 2021, 31(19): 2905-2909. DOI:10.11816/cn.ni.2021-210091 |
 2023, Vol. 44
2023, Vol. 44