文章信息
- 曹滨, 范雪亭, 王瑞欢, 栾秀丽, 钱程宇, 于晋杰, 刘海灿, 李马超, 李桂莲, 赵秀芹, 袁秀琴, 万康林.
- Cao Bin, Fan Xueting, Wang Ruihuan, Luan Xiuli, Qian Chengyu, Yu Jinjie, Liu Haican, Li Machao, Li Guilian, Zhao Xiuqin, Yuan Xiuqin, Wan Kanglin
- 结核多组分重组蛋白疫苗EPRHP014的免疫原性和保护效果的初步评价
- Preliminary evaluation of immunogenicity and protective effect of multicomponent recombinant protein vaccine EPRHP014 against tuberculosis
- 中华流行病学杂志, 2023, 44(10): 1653-1660
- Chinese Journal of Epidemiology, 2023, 44(10): 1653-1660
- http://dx.doi.org/10.3760/cma.j.cn112338-20230217-00088
-
文章历史
收稿日期: 2023-02-17
2. 中国疾病预防控制中心传染病预防控制所/传染病预防控制国家重点实验室, 北京 102206;
3. 温州医科大学检验医学院与生命科学学院, 温州 325035
2. National Institute for Communicable Disease Control and Prevention, Chinese Center for Disease Control and Prevention/State Key Laboratory of Infectious Disease Prevention and Control, Beijing 102206, China;
3. School of Life Sciences, College of Laboratory Medicine, Wenzhou Medical University, Wenzhou 325035, China
结核病在世界范围内广泛流行,严重威胁人类健康[1]。卡介苗(BCG)作为目前唯一获准用于预防结核病的疫苗(结核疫苗),免疫保护效果很不理想。因此,研发BCG接种后的加强型疫苗或替代BCG的新型结核疫苗对实现WHO的“终止结核病策略”至关重要[1-2]。
蛋白亚单位疫苗因其成分明确、安全性好等优势而成为一种较为理想的疫苗[3-4],其抗原选择的常见策略之一是联合使用结核分枝杆菌不同感染阶段的优势抗原以提高疫苗的保护效力。2021年WHO报道的14种临床期结核疫苗候选者中M72:AS01、H56:IC31、AEC:BC02三种亚单位疫苗选用结核分枝杆菌早期分泌蛋白抗原以及潜伏期相关蛋白抗原作为疫苗组分,在动物试验阶段和临床试验阶段均表现良好[3-5]。本研究采用EsxH、nPPE18、Rv2628、HspX和nPstS1五种蛋白构成抗原组合物,其中,EsxH是ESAT-6基因家族成员之一,具有诱导机体产生特异性细胞毒性T淋巴细胞、诱导高水平CD4+T淋巴细胞应答和IFN-γ分泌的能力,是结核疫苗研发常用的免疫优势抗原之一;PPE18蛋白可诱导巨噬细胞产生高水平IL-10,并促进体液免疫应答[6]。结核分枝杆菌潜伏感染时期表达的DosR调节蛋白Rv2628以及HspX等可诱导多种促炎性细胞因子的分泌,有效促进体液和细胞免疫应答[7-8]。PstS1是一种稳定表达的参与无机磷酸盐跨膜主动转运的蛋白,可诱导小鼠CD8+T淋巴细胞的激活并分泌多种Th1和Th17型细胞因子[9]。
疫苗接种后体内的抗原提呈细胞通过吞噬和加工处理抗原中T/B细胞表位而非整个抗原分子以达到激活特异性免疫应答的目的,前期研究结果显示,与全长抗原相比,经抗原表位预测和优化后的截短抗原,其氨基酸序列更短且免疫学评价结果更优,具有替代全长抗原作为结核疫苗组分的潜力[10-11]。TEpredict和IEDB-AR等软件是常见的基于HLA等位基因频率数据库的T细胞抗原表位预测工具,常用于各种病原体蛋白质的潜在免疫原性评估和抗原表位预测,研究显示综合利用TEpredict和IEDB-AR两种T细胞表位预测工具能提高表位预测的效率和准确性[12-13]。
本研究依据蛋白抗原表位预测、单一蛋白抗原免疫学研究、多组分蛋白亚单位联合使用效果优于单一蛋白抗原的前期研究基础,选用EsxH、Rv2628、HspX和两种经表位预测和优化后的优势蛋白抗原nPPE18和nPstS1,共5种蛋白抗原,构建多组分蛋白抗原组合物EPRHP014,包括5种蛋白抗原编码基因串联融合表达纯化的多组分蛋白抗原(EPRHP014f),和5种蛋白抗原分别表达纯化后混合的蛋白抗原(EPRHP014m),联合佐剂配置成免疫制剂,免疫小鼠,以BCG组为对照、观察抗原组合物EPRHP014f和EPRHP014m的免疫和抗感染保护效果。
材料与方法1. 菌株和载体:结核分枝杆菌H37Rv(ATCC 27294)、卡介苗中国株BCG-China(D2PB302)以及载体pET32a(+)由中国CDC传染病预防控制所保存,大肠埃希菌DH5α和感受态细胞BL21(DE3)购自中国北京全式金生物技术有限公司。
2. 主要试剂:氢氧化铝佐剂(佐剂)购自美国赛默飞世尔科技公司,BALB/c小鼠IFN-γ与IL-4检测ELISPOT试剂盒和小鼠淋巴细胞分离液购自中国北京达科为生物技术有限公司,Luminex多细胞因子检测试剂盒购自美国RD-Biotechne公司,辣根过氧化物酶(HRP)标记的羊抗鼠IgG、IgG1和IgG2a抗体购自中国苏州博奥龙科技有限公司。
3. 结核分枝杆菌的培养和准备:BCG-China和H37Rv均接种于7H9液体培养基[含10%OADC(油酸清蛋白葡萄糖过氧化氢酶添加剂)]中,37 ℃恒温静置培养,结核分枝杆菌使用前用7H9液体培养基洗涤3次后超声分散并调整至5×106 CFU/ml,将H37Rv菌液浓度调整至5 000 CFU/ml。
4. T细胞表位预测与筛选:依据美国国立生物技术信息中心数据库中结核分枝杆菌PPE18和PstS1蛋白抗原基因编码序列(Rv1196,Gene ID:886073;Rv0934,Gene ID:885724),检索并分析IEDB数据库公开涉及Rv1196和Rv0934的人T、B细胞表位;基于Rv1196和Rv0934核酸序列,利用TEpredict预测分析人T/B细胞表位并精确定位与表位序列相对应的Rv1196和Rv0934核酸序列,形成表位在基因区的分布图。将筛选得到的富含抗原表位的优势抗原表位集中区肽段构建成新的蛋白亚单位,分别为nPstS1和nPPE18。
5. 蛋白克隆表达与纯化:
(1)重组质粒构建:针对编码结核分枝杆菌单个抗原EsxH、nPPE18、Rv2628、HspX和nPstS1的基因Rv0288、nRv1196、Rv2628、Rv2031c和nRv0934设计特异性引物,以H37Rv基因组为模板,经PCR获得目的基因扩增产物,并用限制性核酸内切酶对产物进行双酶切后,利用T4连接酶将目的片段分别连接至pET32a表达载体。利用基因合成技术将前述5种蛋白的编码基因以Rv0288-nRv1196-Rv2628-Rv2031c-nRv0934的顺序顺次连接构建融合基因片段,经密码子优化后合成EPRHP014f的基因序列并连接至pET43.1a载体,各组分间通过柔性连接臂顺次连接(柔性连接臂的基因序列为GGTGGTTCTGGCGGT,氨基酸序列为Gly-Gly-Ser-Gly-Gly)。
(2)蛋白表达与纯化:将上述6种重组质粒转化进入大肠埃希菌BL21(DE3)感受态细胞,经1 mmol/L异丙基β-D-硫代半乳糖苷、37 ℃培养诱导目的蛋白表达。诱导结束后离心收集菌体并超声破碎,采用十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE)分析6种重组蛋白的表达形式。以包涵体形式表达的重组蛋白使用8 mol/L尿素变性溶解,可溶性表达的重组蛋白在超声裂解时即溶解于裂解液(20 mmol/L pH 8.0 Tris-HCl)中,使用Ni亲和层析技术纯化目的蛋白,使用含15、30、60、100和300 mmol/L咪唑浓度的洗脱液进行目的蛋白和杂蛋白的梯度洗脱分离,并梯度透析去除尿素、咪唑及其他小分子杂质,然后置于20 mmol/L pH 8.0 Tris-HCl中4 ℃透析14~16 h,最后超滤浓缩并用0.22 μm滤器滤过除菌,用BCA蛋白质测定试剂盒测定蛋白浓度后分装保存于-70 ℃。
6. 动物免疫:将30只6~8周龄的SPF级雌性BALB/c小鼠随机分成5组,每组6只,分别为PBS组(空白对照组)、佐剂组(阴性对照组)、BCG组(阳性对照组)、EPRHP014m组(将5种组分蛋白以等摩尔比混合配制成混合蛋白抗原EPRHP014m)和EPRHP014f组,采用配置好的免疫制剂进行皮下多点免疫,具体免疫剂量及时间点见表 1。末次免疫结束后10 d统一处死所有小鼠,采集血液和脾脏标本进行免疫学检测。实验动物均购自北京维通利华公司,饲养于中国CDC实验动物中心。
7. 血清特异性抗体效价检测:眼眶采血收集血液并采用间接ELISA法检测小鼠血清特异性IgG抗体及其亚型IgG1和IgG2a的效价。将对应蛋白以200 ng/孔包被于96孔酶标板;采用含0.05% Tween-20的磷酸盐缓冲溶液(PBST)洗板5次;弃尽孔内液体后加入5%脱脂奶粉37 ℃静置封闭2 h;PBST洗板5次后弃尽孔内液体,每孔加入100 μl倍比稀释的血清,37 ℃静置1 h后PBST洗板5次并弃尽孔内液体;加入用PBST 1∶5 000倍稀释的HRP标记羊抗鼠IgG、IgG1、IgG2a抗体(100 μl/孔),37 ℃静置1 h;PBST洗板5次并弃尽孔内液体,按照100 μl/孔加入TMB显色液,37 ℃避光孵育15 min后加入100 μl/孔终止液(2 mol/L H2SO4)终止反应;使用酶标仪检测各孔450 nm处的A值。
8. 细胞因子分泌水平的检测:颈椎脱臼处死小鼠后无菌摘取脾脏,采用70 μm筛网和小鼠淋巴细胞分离液研磨、密度梯度离心分离脾淋巴细胞,调整细胞浓度为1×106/ml。按照ELISpot预包被板的说明书操作,活化板子后将脾细胞以100 μl/孔与2 μg特异性抗原(包括BCG-China全菌蛋白、EPRHP014m、EPRHP014f、EsxH、nPPE18、Rv2628、HspX和nPstS1)在37 ℃孵育20 h后,检测分泌IFN-γ和IL-4的斑点形成细胞(SFC)数量。用Luminex多重微球技术检测脾细胞培养上清中GM-CSF、IL-12、IL-6和IL-10四种细胞因子水平。每组取100 μl上述调整好浓度的脾细胞置于24孔培养板中,加入10 μg/孔特异性抗原,37 ℃、5% CO2孵育72 h后,收集细胞上清,检测上述细胞因子分泌量。每次试验设置复孔,并检测3个生物学重复。BCG-China全菌蛋白的制备方法是取罗氏培养基上的新鲜菌体经PBS反复清洗,80 ℃水浴灭活并冰上超声后离心,将上清液用0.22 μm滤器过滤除菌。
9. 结核分枝杆菌体外生长抑制试验(MGIAs):取24孔细胞培养板,每孔中加入调整好浓度的脾细胞1 ml,接种50 CFU的H37Rv混悬液,同时取50 CFU混悬液直接涂布于7H10平板作对照,置于37 ℃、5% CO2培养箱中孵育96 h。孵育完毕离心培养物,弃各孔细胞培养液上清,500 μl无菌组织培养级水重悬细胞并室温孵育15 min以裂解细胞后涡旋混匀,取50 μl涂布于7H10平板后37 ℃培养2周,对各组平板进行菌落计数。每组脾细胞检测均设置复孔,并检测3个生物学重复。实验数据以lgCFU表示。
10. 统计学分析:实验各组动物的效价取以2为底的对数后进行t检验或秩和检验;细胞因子检测结果以及菌落计数结果均采用t检验或秩和检验,用GraphPad Prism 6软件绘图及SPSS 22.0软件进行统计学分析,以P < 0.05为差异有统计学意义。
结果1. T细胞表位筛选:综合分析表位预测分析结果,选择PPE18中评分较高的T细胞表位集中区域:第201~300位氨基酸,为nPPE18;选择PstS1的2个表位集中区(氨基酸序列分别为第57~135位和第268~373位),为nPstS1。
2. 重组蛋白表达与纯化:Rv0288、Rv1196、Rv2628、Rv2031c和Rv0934分别成功克隆至pET32a质粒中,并通过PCR和DNA测序验证。SDS-PAGE分析显示,nPPE18、Rv2628和nPstS1以包涵体蛋白形式表达,EsxH和HspX以可溶性蛋白形式表达。EPRHP014f以包涵体形式表达,蛋白分子量与预期相符且纯度较高(图 1),可用于后续的免疫实验。
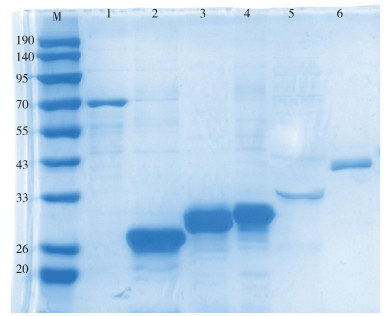
|
| 注:M:蛋白Marker;1:EPRHP014f;2:EsxH;3:nPPE18;4:Rv2628;5:HspX;6:nPstS1;1~6其理论分子量分别为70.10、31.07、31.40、33.71、36.35、40.75 kDa 图 1 表达纯化的EPRHP014f、EsxH、nPPE18、Rv2628、HspX和nPstS1的聚丙烯酰胺凝胶电泳 |
3. 血清特异性抗体效价:EPRHP014m组和EPRHP014f组免疫后小鼠血清IgG、IgG2a和IgG1抗体效价均与BCG免疫组小鼠血清抗体效价相当。见图 2A。EPRHP014m组和EPRHP014f组的IgG2a/IgG1水平低于BCG组(t=6.98,P=0.002;t=7.42,P=0.002)。见图 2B。以5种组分抗原EsxH、nPPE18、Rv2628、HspX、nPstS1以及EPRHP014f作为一抗测定EPRHP014f组小鼠针对上述5种抗原特异性IgG水平,结果显示nPPE18和nPstS1的IgG水平低于EPRHP014f(W=6.00,P=0.049;W=21.00,P=0.020),其余3种抗原与EPRHP014f差异无统计学意义。见图 2C。
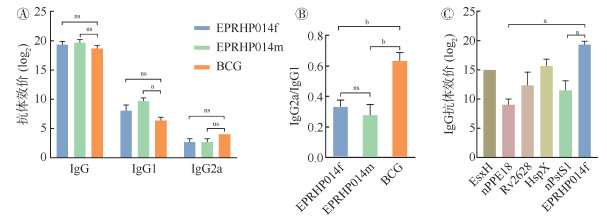
|
| 注:ns P > 0.05,差异无统计学意义;a P < 0.05,b P < 0.01,差异有统计学意义 图 2 EPRHP014m、EPRHP014f与卡介苗(BCG)免疫BALB/c小鼠血清IgG、IgG1和IgG2a比较 |
4. 致敏T淋巴细胞分泌细胞因子的水平:采用ELISpot技术检测对应抗原刺激后的SFC数,结果显示抗原组均高于PBS组以及佐剂组。且EPRHP014f组分泌IFN-γ的SFC数均高于EPRHP014m组以及BCG组(t=5.91,P < 0.001;t=2.45,P=0.046),EPRHP014m组与BCG组的差异无统计学意义(t=2.33,P=0.083)。见图 3A。IL-4检测结果显示,EPRHP014f组和EPRHP014m组小鼠脾细胞产生的IL-4 SFC数高于PBS组和佐剂组,且EPRHP014f组分泌IL-4的SFC数均高于EPRHP014m组以及BCG组(t=2.39,P=0.048;t=2.74,P=0.025),EPRHP014m组与BCG组的差异无统计学意义(t=0.17,P=0.870)。见图 3B。
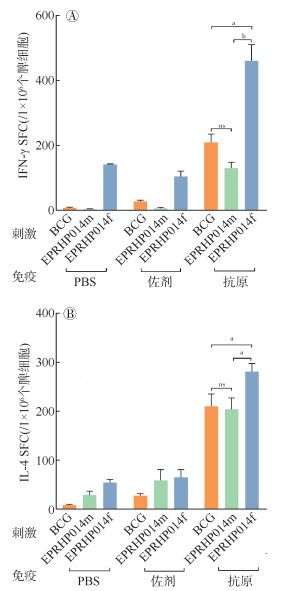
|
| 注:SFC:斑点形成细胞;ns P > 0.05,差异无统计学意义;aP < 0.05,bP < 0.001,差异有统计学意义;BCG:卡介苗 图 3 不同免疫组的BALB/c小鼠分泌IFN-γ与IL-4的细胞数差异 |
以PBS刺激作为阴性对照,测定EPRHP014f组和EPRHP014m组小鼠脾细胞对5种组分抗原特异性IFN-γ和IL-4的SFC数。EPRHP014f组与EPRHP014m组比较,两组间对5种组分抗原特异性IFN-γ的SFC数差异无统计学意义,且两组对nPPE18、Rv2628和HspX三种组分的抗原特异性IFN-γ分泌细胞数均高于PBS组(均W=6.00,P=0.049)。见图 4A。IL-4检测结果显示,EPRHP014m组对EsxH、nPPE18、Rv2628和HspX四种组分抗原的特异性IL-4的SFC数高于EPRHP014f组(均W=6.0,P=0.049),且EPRHP014f组对nPPE18和Rv2628以及HspX三种组分的抗原特异性IL-4分泌细胞数高于PBS组(均W=6.00,P=0.049),EPRHP014m组对5种组分的抗原特异性IL-4分泌细胞数均高于PBS组(均W=6.00,P=0.049)。见图 4B。
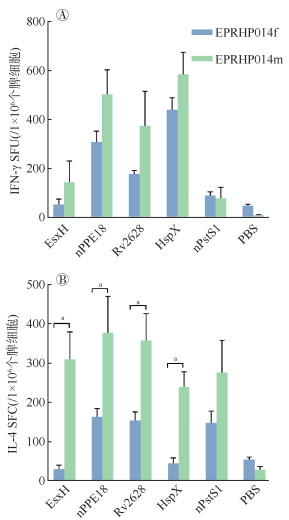
|
| 注:SFC:斑点形成细胞;aP < 0.05,差异有统计学意义 图 4 IFN-γ和IL-4分泌细胞对5种单个组分蛋白再刺激的反应 |
采用Luminex技术比较不同免疫组小鼠脾淋巴细胞经EPRHP014f、EPRHP014m混合蛋白或BCG全菌蛋白刺激后IL-6、IL-10、IL-12p70和GM-CSF四种细胞因子表达水平的组间差异。EPRHP014m组GM-CSF和IL-12p70两种细胞因子水平均高于BCG组(t=4.50,P=0.007;t=6.14,P=0.002),且EPRHP014m组和EPRHP014f组的IL-6、IL-10分泌水平均与BCG组相当。见图 5。
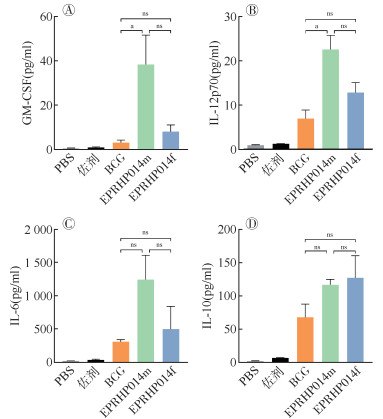
|
| 注:nsP > 0.05,差异无统计学意义;aP < 0.05,差异有统计学意义;BCG:卡介苗 图 5 免疫小鼠脾细胞释放的抗原特异性细胞因子水平 |
5. 不同免疫组的结核分枝杆菌体外生长抑制试验:将不同免疫组的脾细胞与结核分枝杆菌H37Rv共培养96 h后,用水裂解细胞释放胞内结核分枝杆菌并涂板,计算结核分枝杆菌生长菌落数,并比较不同组间菌落数差异。EPRHP014f组与EPRHP014m组菌落数均少于PBS组和佐剂组(EPRHP014f组:t=5.57,P=0.006;t=5.82,P=0.004;EPRHP014m组:t=5.69,P=0.005;t=5.96,P=0.002),且两组菌落数与BCG相当(t=1.45,P=0.178;t=2.16,P=0.056)。见图 6。
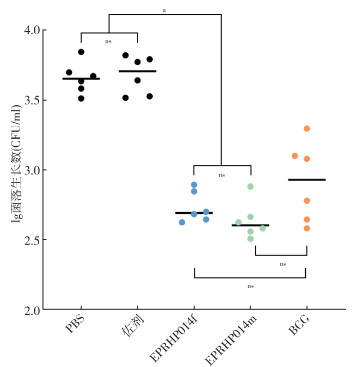
|
| 注:CFU:菌落形成单位;ns P > 0.05,差异无统计学意义;aP < 0.05,差异有统计学意义;BCG:卡介苗 图 6 免疫小鼠体外抑制结核分枝杆菌生长结果 |
鉴于BCG对结核病的预防效果有限且不适用于免疫缺陷病例[2],研发安全性高且免疫保护性好的疫苗已成为全球结核病控制的迫切需求。多组分蛋白亚单位疫苗适用于不同免疫状态的人群。由于感染人体的结核分枝杆菌包含不同代谢状态,故而将结核早期分泌抗原与潜伏期抗原联合佐剂制备多阶段亚单位疫苗成为目前的常见策略[14-15]。本研究选用5种成分明确的结核分枝杆菌保护性蛋白抗原,包括早期分泌蛋白抗原EsxH、潜伏期蛋白抗原Rv2628和HspX,稳定表达的抗原PPE18和PstS1的表位集中区nPPE18和nPstS1,构建抗原组合物EPRHP014的两种形式EPRHP014m和EPRHP014f。实验结果显示,EPRHP014m和EPRHP014f均可诱导机体产生较强的细胞免疫和体液免疫反应且具有良好的体外结核分枝杆菌生长抑制能力。
串联多个有效蛋白抗原编码基因,克隆表达多组分融合蛋白抗原具有特异性好、纯度高、成分明确、生产工艺简单等优势。但目前关于多组分融合蛋白与单抗原混合物诱导机体免疫反应能力的差异存在争议[16]。本研究通过测定EPRHP014f组和EPRHP014m组针对5种组分抗原的特异性抗体水平和IFN-γ、IL-4分泌水平的差异发现EPRHP014f融合蛋白产生的特异性抗体水平高于单个抗原作用,同时5种组分抗原可刺激两免疫组的小鼠产生抗原特异性细胞因子,提示抗原组合EPRHP014中各组分抗原均发挥了相应的免疫效应。
结核分枝杆菌是一种细胞内寄生菌,机体的抗结核免疫应答以细胞免疫为主。IFN-γ是重要的Th1型细胞因子,在机体抗结核免疫应答过程中发挥重要作用,目前已被WHO推荐为结核分枝杆菌检测的免疫学生物标志物,在结核病诊断和疫苗研发中发挥重要作用[17]。本研究结果显示,EPRHP014的两种形式均可诱导等同于甚至强于BCG的Th1免疫反应,EPRHP014f更强一些。IL-12p70是由IL-12p40和IL-12p35两个亚单位组成的异源二聚体,是诱导CD4+T细胞分化的关键因子并参与促进IFN-γ的分泌[18]。本研究结果显示,EPRHP014m与EPRHP014f组的IL-12分泌水平相当甚至高于BCG组,提示机体IL-12/IFN-γ炎症信号轴的激活,有利于机体对结核分枝杆菌的感染产生更全面的特异性免疫应答。
Phuah等[19]以非人灵长类动物为模型的研究结果显示机体可产生特异性抗体应对结核分枝杆菌感染,提示体液免疫反应可能参与了宿主对结核分枝杆菌感染的免疫调节。抗原特异性IgG是体液免疫中的重要效应分子,其两种亚型IgG1和IgG2a分别与Th1型免疫应答和Th2型免疫应答相关。本研究中,EPRHP014m和EPRHP014f免疫后的小鼠血清IgG、IgG1和IgG2a抗体效价与BCG免疫组相当或更高,提示两组均可诱导产生与BCG组相当或更强的体液免疫反应。EPRHP014m和EPRHP014f的IgG2a/IgG1比值低于BCG组,提示BCG免疫后的小鼠免疫反应偏向Th1型免疫反应,而EPRHP014m和EPRHP014f的免疫则诱导Th1-Th2平衡的免疫反应。IL-4和IL-6是重要的体液免疫相关细胞因子,主要由Th2细胞和巨噬细胞分泌,本研究表明EPRHP014f组小鼠脾细胞的IL-4分泌能力高于EPRHP014m和BCG组,而EPRHP014f和EPRHP014m两组的IL-6分泌水平与BCG组相当,提示EPRHP014f和EPRHP014m免疫后均能诱导机体产生较强的Th2型免疫反应。IL-10是一种重要的免疫调节因子,可在宿主抗菌反应中发挥积极作用[20]。本研究结果显示,EPRHP014f和EPRHP014m分泌水平与BCG组相当。一项基于基因缺陷小鼠的实验结果显示固有免疫反应也在机体抗结核免疫应答中发挥重要作用[21]。GM-CSF是一种重要的固有免疫相关细胞因子,具有诱导干细胞增殖分化为粒细胞和巨噬细胞的能力。本研究中,EPRHP014m组小鼠脾细胞GM-CSF分泌水平明显高于EPRHP014f和BCG组,提示EPRHP014m具有较强的调节增强固有免疫应答的作用。
综合特异性抗体和细胞因子检测的结果,发现EPRHP014抗原组合物的两种形式EPRHP014f和EPRHP014m均可诱导机体产生较强的细胞免疫和体液免疫应答。本研究采用的MGIAs作为结核疫苗保护性评价的指标具有操作简单和低偏倚等优势,已被证实用作攻毒试验具有较好的可靠性[22-23]。结果显示EPRHP014f、EPRHP014m组与BCG组对结核分枝杆菌的生长抑制效果相当,提示EPRHP014f与EPRHP014m可诱导机体产生较强的保护性免疫应答。
综上所述,对抗原组合物EPRHP014诱导小鼠免疫应答的初步探索中发现该组合物具有良好的免疫原性,与铝佐剂联合使用,免疫小鼠,可诱导小鼠产生Th1-Th2均衡的免疫反应,并且具有与BCG免疫相当的体外抑制结核分枝杆菌生长的能力,提示其可作为新型结核疫苗开发的候选组合物,为进一步研究新型结核疫苗提供了科学实验基础。另一方面,组合物EPRHP014的抗原组分中未包括常见结核γ-干扰素释放实验用的ESAT-6、CFP-10和TB7.7等抗原,不会对现有成熟的结核感染诊断技术产生影响,是一种具有良好潜力的结核疫苗候选组合物。
利益冲突 所有作者声明无利益冲突
作者贡献声明 曹滨:实验操作、论文撰写、分析和解释数据;范雪亭、王瑞欢、栾秀丽、钱程宇、于晋杰、赵秀芹:实验操作;刘海灿、袁秀琴、万康林:研究指导、论文修改、经费支持;李马超、李桂莲:研究指导、论文修改
| [1] |
Bagcchi S. WHO's global tuberculosis report 2022[J]. Lancet Microbe, 2023, 4(1): e20. DOI:10.1016/S2666-5247(22)00359-7 |
| [2] |
Ehrt S, Schnappinger D, Rhee KY. Metabolic principles of persistence and pathogenicity in Mycobacterium tuberculosis[J]. Nat Rev Microbiol, 2018, 16(8): 496-507. DOI:10.1038/s41579-018-0013-4 |
| [3] |
Jenum S, Tonby K, Rueegg CS, et al. A Phase Ⅰ/Ⅱ randomized trial of H56: IC31 vaccination and adjunctive cyclooxygenase-2-inhibitor treatment in tuberculosis patients[J]. Nat Commun, 2021, 12(1): 6774. DOI:10.1038/s41467-021-27029-6 |
| [4] |
Harris RC, Quaife M, Weerasuriya C, et al. Cost-effectiveness of routine adolescent vaccination with an M72/AS01E-like tuberculosis vaccine in South Africa and India[J]. Nat Commun, 2022, 13(1): 602. DOI:10.1038/s41467-022-28234-7 |
| [5] |
Lu JB, Guo XN, Wang CH, et al. Therapeutic effect of subunit vaccine AEC/BC02 on Mycobacterium tuberculosis post-chemotherapy relapse using a latent infection murine model[J]. Vaccines (Basel), 2022, 10(5): 825. DOI:10.3390/VACCINES10050825 |
| [6] |
Niu HX, Hu LN, Li Q, et al. Construction and evaluation of a multistage Mycobacterium tuberculosis subunit vaccine candidate Mtb10.4-HspX[J]. Vaccine, 2011, 29(51): 9451-9458. DOI:10.1016/j.vaccine.2011.10.032 |
| [7] |
殷月兰, 高云飞, 赵丹, 等. 结核分枝杆菌Rv2628蛋白的免疫生物学特性[J]. 生物工程学报, 2014, 30(2): 255-264. DOI:10.13345/j.cjb.130392 Yin YL, Gao YF, Zhao D, et al. Immunological characteristics of Mycobacterium tuberculosis antigen Rv2628[J]. Chin J Biotechnol, 2014, 30(2): 255-264. DOI:10.13345/j.cjb.130392 |
| [8] |
Pandey K, Singh S, Bhatt P, et al. DosR proteins of Mycobacterium tuberculosis upregulate effector T cells and down regulate T regulatory cells in TB patients and their healthy contacts[J]. Microb Pathog, 2019, 126: 399-406. DOI:10.1016/j.micpath.2018.11.029 |
| [9] |
Palma C, Spallek R, Piccaro G, et al. The M. tuberculosis phosphate-binding lipoproteins PstS1 and PstS3 induce Th1 and Th17 responses that are not associated with protection against M. tuberculosis infection[J]. Clin Dev Immunol, 2011, 2011, 690328. DOI:10.1155/2011/690328 |
| [10] |
Luan XL, Fan XT, Wang RH, et al. High Immunogenicity of a T-Cell epitope-rich recombinant protein Rv1566c-444 from Mycobacterium tuberculosis in immunized BALB/c mice, despite its low diagnostic sensitivity[J]. Front Immunol, 2022, 13: 824415. DOI:10.3389/fimmu.2022.824415 |
| [11] |
Wang XZ, Chen SS, Xu YJ, et al. Identification and evaluation of the novel immunodominant antigen Rv2351c from Mycobacterium tuberculosis[J]. Emerg Microbes Infect, 2017, 6(6): e48. DOI:10.1038/emi.2017.34 |
| [12] |
Zhao WL, Sher XW. Systematically benchmarking peptide-MHC binding predictors: From synthetic to naturally processed epitopes[J]. PLoS Comput Biol, 2018, 14(11): e1006457. DOI:10.1371/journal.pcbi.1006457 |
| [13] |
Mei ST, Li FY, Leier A, et al. A comprehensive review and performance evaluation of bioinformatics tools for HLA classⅠpeptide-binding prediction[J]. Brief Bioinform, 2020, 21(4): 1119-1135. DOI:10.1093/bib/bbz051 |
| [14] |
Aagaard C, Hoang T, Dietrich J, et al. A multistage tuberculosis vaccine that confers efficient protection before and after exposure[J]. Nat Med, 2011, 17(2): 189-194. DOI:10.1038/nm.2285 |
| [15] |
Bertholet S, Ireton GC, Ordway DJ, et al. A defined tuberculosis vaccine candidate boosts BCG and protects against multidrug-resistant Mycobacterium tuberculosis[J]. Sci Transl Med, 2010, 2(53): 53ra74. DOI:10.1126/scitranslmed.3001094 |
| [16] |
Andersen P. Vaccine strategies against latent tuberculosis infection[J]. Trends Microbiol, 2007, 15(1): 7-13. DOI:10.1016/j.tim.2006.11.008 |
| [17] |
Pai M, Denkinger CM, Kik SV, et al. Gamma interferon release assays for detection of Mycobacterium tuberculosis infection[J]. Clin Microbiol Rev, 2014, 27(1): 3-20. DOI:10.1128/CMR.00034-13 |
| [18] |
Trinchieri G. Interleukin-12: a proinflammatory cytokine with immunoregulatory functions that bridge innate resistance and antigen-specific adaptive immunity[J]. Annu Rev Immunol, 1995, 13: 251-276. DOI:10.1146/annurev.iy.13.040195.001343 |
| [19] |
Phuah JY, Mattila JT, Lin PL, et al. Activated B cells in the granulomas of nonhuman primates infected with Mycobacterium tuberculosis[J]. Am J Pathol, 2012, 181(2): 508-514. DOI:10.1016/j.ajpath.2012.05.009 |
| [20] |
Higgins DM, Sanchez-Campillo J, Rosas-Taraco AG, et al. Lack of IL-10 alters inflammatory and immune responses during pulmonary Mycobacterium tuberculosis infection[J]. Tuberculosis (Edinb), 2009, 89(2): 149-157. DOI:10.1016/j.tube.2009.01.001 |
| [21] |
Bryson BD, Rosebrock TR, Tafesse FG, et al. Heterogeneous GM-CSF signaling in macrophages is associated with control of Mycobacterium tuberculosis[J]. Nat Commun, 2019, 10(1): 2329. DOI:10.1038/s41467-019-10065-8 |
| [22] |
Walzl G, Ronacher K, Hanekom W, et al. Immunological biomarkers of tuberculosis[J]. Nat Rev Immunol, 2011, 11(5): 343-354. DOI:10.1038/nri2960 |
| [23] |
Jensen C, Holm LL, Svensson E, et al. Optimisation of a murine splenocyte mycobacterial growth inhibition assay using virulent Mycobacterium tuberculosis[J]. Sci Rep, 2017, 7(1): 2830. DOI:10.1038/s41598-017-02116-1 |
 2023, Vol. 44
2023, Vol. 44



