文章信息
- 马千里, 张岷, 刘丽珺, 周延, 袁伟, 杨玫, 刘少祥, 罗林云, 陈海平, 肖艳慧, 漆琪, 杨晓明.
- Ma Qianli, Zhang Min, Liu Lijun, Zhou Yan, Yuan Wei, Yang Mei, Liu Shaoxiang, Luo Linyun, Chen Haiping, Xiao Yanhui, Qi Qi, Yang Xiaoming
- 60岁及以上老年人再接种23价肺炎球菌多糖疫苗免疫原性及安全性临床研究
- Immunogenicity and safety of revaccination of 23-valent pneumococcal polysaccharide vaccine in people aged 60 years and above
- 中华流行病学杂志, 2023, 44(7): 1119-1125
- Chinese Journal of Epidemiology, 2023, 44(7): 1119-1125
- http://dx.doi.org/10.3760/cma.j.cn112338-20221130-01019
-
文章历史
收稿日期: 2022-11-30
2. 中国生物技术股份有限公司, 北京 100024;
3. 成都市新津区疾病预防控制中心, 成都 611430;
4. 四川天府新区公共卫生中心, 成都 610213;
5. 成都生物制品研究所有限责任公司, 四川省疫苗工程技术研究中心, 成都 610023
2. China National Biotech Group Company Limited, Beijing 100024, China;
3. Xinjin District Center for Disease Control and Prevention, Chengdu 611430, China;
4. Sichuan Tianfu New District Public Health Center, Chengdu 610213, China;
5. Chengdu Institute of Biological Products Co. Ltd, Sichuan Vaccine Engineering Technology Research Center, Chengdu 610023, China
肺炎链球菌是引起中国老年人发病和死亡的重要病因[1],其危害已经成为严重的公共卫生问题。全球多国研究显示接种肺炎球菌疫苗是预防肺炎链球菌感染的有效手段,尤其在老年人和患有慢性阻塞性肺疾病、糖尿病、心脏病等基础性疾病的高危人群中接种23价肺炎球菌多糖疫苗(PPV23),可降低侵袭性肺炎链球菌感染的疾病负担,具有显著成本效益[2-3]。有证据表明,PPV23对 < 75岁健康人群有明显的保护作用,但5年后保护作用减弱,保护率从48%降至15%[4],提示在初次接种PPV23间隔5年后可能有必要再接种1剂次以提供持续保护。本研究2021年在四川省成都市新津区和天府新区进行临床研究,探讨≥60岁老年人再接种PPV23的免疫原性及安全性。
对象与方法1. 研究对象:2021年3-11月在四川省成都市新津区和天府新区招募60~65岁的老年人。纳入标准:①入组年龄60~65岁;②签署知情同意书;③再接种组接种过国产PPV23并已间隔5年以上,首次接种组未接种过任何肺炎球菌疫苗;④入组前,经病史和临床检查,体温≤37.0 ℃。排除标准:①有过敏、惊厥、癫痫、脑病和精神病等病史或家族史者;②对疫苗中任一成分过敏者,既往有任何疫苗接种严重过敏史者;③患免疫缺陷病、恶性肿瘤治疗期间、接受免疫抑制剂治疗(口服类固醇激素)或HIV/AIDS导致的免疫力低下者,或密切接触的家庭成员中有先天性免疫疾病者;④入组前3个月内注射非特异性免疫球蛋白;⑤患急性发热性疾病体温 > 37.0 ℃者及传染病者;⑥有明确诊断的血小板减少或其他凝血障碍病史,可能造成皮下注射禁忌者;⑦已知或怀疑同时患有呼吸系统疾病、急性感染或慢性病活动期;⑧患严重心血管疾病、肝肾疾病、有并发症的糖尿病、感染性、化脓性及过敏性皮肤病;⑨研究者认为有可能影响试验评估的任何情况。终止标准:①违反方案规定,研究者认为应终止参加研究;②研究对象要求退出临床试验;③发生无法耐受的不良事件(AE),无论是否与试验药物有关;④研究对象的健康状况不允许其继续参加本试验。
2. 研究用疫苗:PPV23由成都生物制品研究所有限责任公司(CDIBP)生产,规格为0.5 ml/瓶,批号为20200311,有效期至2022年3月10日。
3. 研究设计:7家社区卫生服务中心通过告知、发放宣传品等方式招募60~65岁老年人。采集免疫前血标本后接种1剂次PPV23,间隔30 d采集免疫后血标本,采血窗口期为-2~10 d。疫苗接种后进行30 min留院观察,接种后发放日记卡,研究对象须在日记卡中记录接种后第0、1、3、5、7天的不良反应发生情况,并于第8天主动回访,第8~30天被动接收AE报告,第30天回收日记卡。在疫苗免疫原性评估方面,分析疫苗接种30 d后,再接种组与首次接种组的血清抗体几何平均浓度(GMC)水平和抗体平均2倍增长率间的差异。在疫苗安全性评估方面,研究人员收集受试者疫苗接种后30 d内的AE、严重不良事件(SAE)发生情况。
4. 实验室检测:血清抗体检测采用ELISA定量检测人血清中23种抗特定血清型肺炎链球菌荚膜多糖免疫球蛋白G(IgG)抗体,评估免疫前后抗体GMC、几何平均增长倍数(GMI)及抗体平均2倍增长率。
(1)荚膜多糖及质控血清:23个血清型的肺炎链球菌荚膜多糖由CDIBP生产;肺炎链球菌抗荚膜多糖抗体参考血清007sp购自英国生物标准品研究所;质控血清BW09和QC03由CDIBP制备。
(2)主要试剂及仪器:碱性磷酸酶标记的羊抗人IgG购自美国Southern Biotech公司;肺炎球菌C多糖购自丹麦血清研究所;酶联免疫吸附分析加样系统Microlab STAR Venus 8CH购自瑞士Hamilton公司,酶联免疫吸附工作站Freedom EVO 150购自瑞士Tecan公司;酶标仪VersaMAX购自美国Molecular Devices公司;96孔酶标板购自德国Greiner公司(655001)。
(3)检测方法:用各血清型相应浓度(最适包被浓度)的多糖包被酶标板(37 ℃,5 h);待测样品做梯度稀释,每个稀释度设置平行孔,经肺炎球菌C多糖吸收30 min后加至酶标板;2~8 ℃湿盒孵育过夜(18 h以内);洗板后加入碱性磷酸酶标记的羊抗人IgG(1∶2 000),室温反应2 h;洗板后加入新鲜配制的底物溶液避光显色2 h。读取405 nm和690 nm的A值。以007sp为参考血清,BW09和QC03为质控血清,在SoftMax软件中采用四参数法拟合参考曲线并计算待检血清中的IgG抗体浓度。所有数据遵循以下质控标准:空白对照A < 0.05,平行孔间变异系数 < 15%;每次试验的质控血清需落在检测值范围内。
5. 评价指标:①免疫原性评估:包括疫苗接种30 d后,血清抗体GMC、GMI及平均2倍增长率。PPV23血清抗体检测采用ELISA定量检测人血清中23种血清型肺炎链球菌荚膜多糖IgG抗体,2倍增长率定义为接种后抗体与接种前抗体水平的比值≥2倍。②安全性评价:包括局部AE发生率和全身AE发生率。按照接种后30 min与30 d内分别计算AE发生率。按国家药品监督管理局关于《预防用疫苗临床试验不良事件分级标准指导原则》中的内容和指标[5],对疫苗接种后的局部和全身反应进行判定。分别计算不同严重级别的AE发生率和症状发生率。
6. 伦理审查:本研究通过四川省CDC疫苗临床试验伦理委员会的审查(批准文号:SC0820201101);2021年1月,本研究在国外临床试验注册网站(http://clinicaltrials.gov)(注册号:NCT04701788)和国内临床试验注册网站(http://www.chictr.org.cn)(注册号:ChiCTR2100042000)注册。
7. 数据集:本研究分析涉及2类数据集,免疫原性评价分析使用免疫原性符合方案集(PPS),即符合纳入/排除标准、并按方案要求进行了全程随访、血清结果盲态核查未被剔除的研究对象均纳入PPS,该方案集内的受试者对方案更具依从性。安全性评价分析使用安全性分析集(SS),凡是接受疫苗接种,并进行了至少一次安全性评估的研究对象均进行安全性评价,并纳入SS。
8. 统计学分析:采用SAS 9.4软件进行统计学分析。定量资料用x±s描述;定性资料采用频数及频率描述。采用χ2检验比较组间抗体平均2倍增长率,采用配对t检验进行同组免疫前后抗体GMC、GMI比较。统计分析所有研究对象接种疫苗后的局部反应和全身反应,使用χ2检验比较组间发生率。双侧检验,检验水准α=0.05。
结果1.基本情况:研究期间共4名研究对象脱失,其中再接种组3名,首次接种组1名,脱失率为1.20%。纳入PPS共327名,其中再接种组217名,首次接种组110名;纳入SS共337名,其中再接种组224名,首次接种组113名。PPS中再接种组和首次接种组的年龄分别为(64.99±0.12)岁和(61.14±1.55)岁,两组间差异有统计学意义(P < 0.001);两组中男性占比分别为41.94%(91/217)、40.00%(44/110),两组间差异无统计学意义(P=0.737)。再接种组首次接种与再接种时间间隔最长为72个月,最短为57个月,时间间隔(62.26±3.15)个月。
2. 免疫原性:
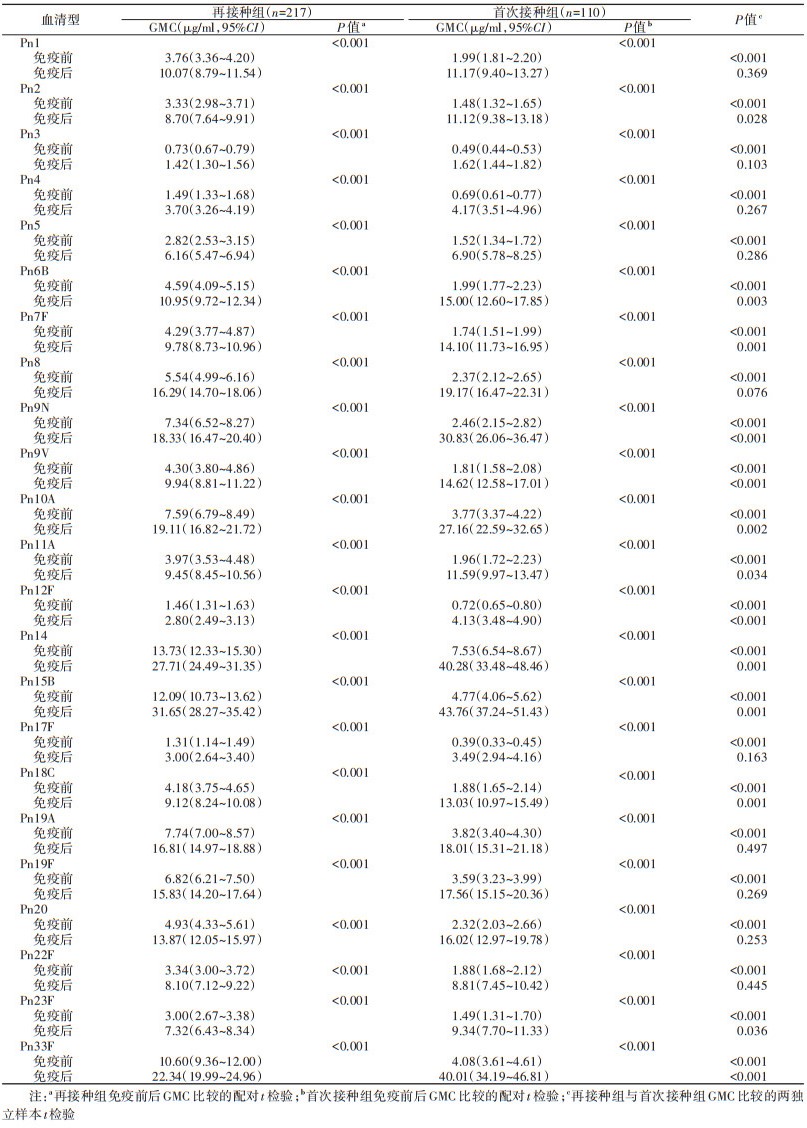
(1)抗体GMC:免疫原性观察显示,再接种组内免疫后的23个血清型肺炎链球菌荚膜多糖IgG抗体GMC为1.42~31.65 μg/ml,免疫前各型GMC为0.73~13.73 μg/ml,免疫后高于免疫前,差异均有统计学意义(P < 0.001)。首次接种组内免疫后的23个血清型抗体GMC为1.62~43.76 μg/ml,免疫前各型抗体GMC为0.39~7.53 μg/ml,免疫后高于免疫前,差异均有统计学意义(P < 0.001)。再接种组免疫前的23个血清型抗体GMC水平均高于首次接种组,差异均有统计学意义(P < 0.001)。首次接种组免疫后中的Pn2、Pn6B、Pn7F、Pn9N、Pn9V、Pn10A、Pn11A、Pn12F、Pn14、Pn15B、Pn18C、Pn23F、Pn33F共13种血清型抗体GMC高于再接种组,差异有统计学意义(P < 0.001),其余10种血清型Pn1、Pn3、Pn4、Pn5、Pn8、Pn17F、Pn19A、Pn19F、Pn20、Pn22F抗体GMC在两组间差异均无统计学意义(P > 0.05)。见表 1。
(2)抗体GMI:再接种组和首次接种组的抗体GMI分别为2.93(95%CI:2.75~3.11)和9.51(95%CI:8.23~10.78),再接种组低于首次接种组且差异均有统计学意义(P < 0.001)。再接种组23个血清型抗体GMI为2.16~3.60,首次接种组为3.86~16.13,再接种组低于首次接种组且差异均有统计学意义(P < 0.001)。见表 2。
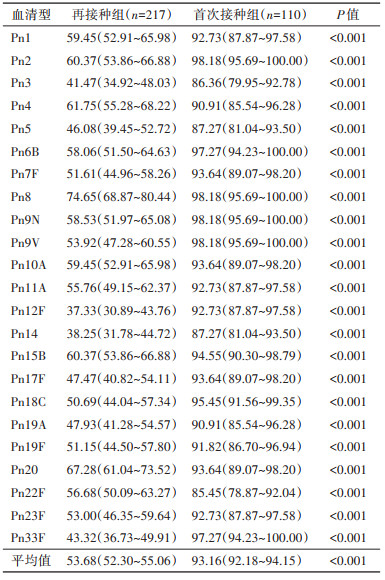
(3)抗体平均2倍增长率:PPS免疫原性观察显示,再接种组和首次接种组的抗体平均2倍增长率分别为53.68%(95%CI:52.30%~55.06%)和93.16%(95%CI:92.18%~94.15%),再接种组低于首次接种组且差异均有统计学意义(P < 0.001)。再接种组23个血清型肺炎链球菌夹膜多糖IgG抗体2倍增长率为37.33%~74.65%,首次接种组为85.45%~98.18%。见表 3。
3. 安全性:
(1)局部AE:接种PPV23后0~30 d,再接种组和首次接种组局部AE发生率分别为19.20%和13.27%,差异无统计学意义(P=0.174)。局部AE症状主要为触痛、硬结、发红、肿胀、皮疹。再接种组和首次接种组的触痛发生率为18.30%、13.27%,硬结发生率为4.02%、0.88%,发红发生率为3.13%、0,肿胀发生率为2.23%、0,皮疹发生率为0.45%、0;局部AE中无瘙痒报告。见表 4。
(2)全身AE:接种PPV23后0~30 d,再接种组和首次接种组全身AE发生率分别为0.89%和0,差异无统计学意义(P=0.553)。全身AE症状主要是再接种组报告呕吐和腹泻各1例,发生率为0.45%,与首次接种组比较差异无统计学意义(P=1.000);全身AE无发热、激惹或抑制、厌食、嗜睡、急性过敏反应报告。见表 4。
讨论中国老年人群疫苗接种率普遍较低,虽然2013年底上海市开始在≥60岁老年人群中开展PPV23免费接种,并逐步在成都、青岛、深圳等地区推行,国内肺炎球菌疫苗再接种的安全性和免疫原性数据仍欠缺。成都市自2015年开展≥60岁老年人接种PPV23项目,首批接种的老年人接种间隔已超过5年,本研究旨在评估PPV23在老年人群中间隔5年后再接种的免疫原性与安全性,完善我国老年人群PPV23的免疫策略。国外有研究表明,再次接种PPV23后抗体GMC较接种前显著升高,然而再接种后Pn1、Pn4、Pn6B、Pn7F、Pn8、Pn9V、Pn12F、Pn14、Pn18C、Pn19F、Pn23F血清型抗体水平低于首次接种后[6-8],有研究发现这种PPV23诱导的低反应性现象可能与记忆B细胞群的消耗有关[9]。但也有研究报道,再接种PPV23后Pn3、Pn4、Pn6B、Pn8、Pn9V、Pn12F、Pn14、Pn23F血清型抗体GMC与首次接种后的抗体GMC水平相当,差异无统计学意义[10-11],并未发现重复接种PPV23会导致免疫低反应性[11-12]。2016年Cornelius等[13]发现再接种PPV23诱导的抗体水平与首次接种相当。本研究中,再接种组的抗体平均2倍增长率与抗体GMI均低于首次接种组,主要由于再接种前的抗体GMC均高于首次接种前,即两组基线水平不一致,再接种组的抗体GMC基线水平高。国外对首次接种和再次接种肺炎球菌多糖疫苗后的免疫应答强度研究显示,年龄较大的成年人再接种PPV23后比同年龄段首次接种该疫苗的成年人所诱导的抗体水平要低,再接种组抗体GMC低于首次接种组[14],与本研究结果相似。WHO建议在肺炎球菌疫苗的临床免疫效力评价中使用调理吞噬实验(OPA)进行功能性抗体水平检测[15]。基于有研究发现OPA与ELISA测定的血清抗体效价相关性较高,且具有良好的一致性[16],本研究使用ELISA对PPV23免疫前后血清样本进行抗体浓度检测。前期有研究发现,与首次接种PPV23相比,再接种后同样具有良好的安全性[7-8, 12-14, 17-18]。本研究中也未发现再接种PPV23后发生AE的风险增加,安全性结果显示,再接种PPV23的AE和SAE发生率与首次接种差异无统计学意义。
本研究在60~65岁的老年人中接种PPV23 5年后的研究对象抗体水平高于未接种者;再接种PPV23后,抗体水平在1个月内迅速回升,然而再接种者抗体GMI水平低于首次接种者。首次接种PPV23老年人的抗体平均2倍增长率高于再接种者,表明PPV23再次接种可以提高老年人群的对肺炎链球菌的保护水平,但抗体平均2倍增长率较低。随着时间推移,有PPV23接种史者体内抗体水平逐年降低,但与无PPV23接种史者比较,仍然维持在一个较高水平,不能仅以抗体平均2倍增长率评价再接种人群的免疫原性效果。安全性结果显示,再接种同首次接种均有良好的安全性,局部症状以触痛、硬结、发红、肿胀、皮疹等一般反应为主。
美国CDC免疫实践咨询委员会推荐 > 65岁人群常规接种1剂PPV23,既往接种过1剂PPV23的 > 65岁人群应在首次接种后5年复种1剂次[19]。我国推荐PPV23用于 > 2岁感染肺炎链球菌、肺炎链球菌性疾病风险增加的人群,尤其是重点人群包括老年人群、慢性心血管疾病、慢性阻塞性肺疾病或糖尿病个体、患酒精中毒、慢性肝脏疾病和脑脊液、功能性或解剖性无脾个体、免疫功能受损人群、进行免疫抑制治疗的患者以及器官或骨髓移植患者[1]。本研究结果显示,≥60岁人群接种1剂次PPV23间隔5年后抗体水平衰减明显,复接种1剂次后抗体水平可快速上升,故建议≥60岁老年人特别是患有基础疾病或免疫功能低下者应及时接种1剂次PPV23,间隔5年后复种。
本研究存在局限性。本研究仅检测了IgG抗体这一免疫原性替代终点,并不能代表其真正的疫苗保护效果,可进一步探索真实世界中老年人群再接种PPV23后的疫苗保护效果评价。
利益冲突 所有作者声明无利益冲突
作者贡献声明 马千里、刘丽珺:论文撰写;张岷、陈海平、肖艳慧:酝酿设计试验、统计分析、内容审阅;周延、袁伟、杨玫:数据收集/整理;刘少祥、罗林云、杨晓明:研究指导、获取研究经费、行政、技术或材料支持;漆琪:研究指导、论文审阅
| [1] |
中华预防医学会, 中华预防医学会疫苗与免疫分会. 肺炎球菌性疾病免疫预防专家共识(2020版)[J]. 中华流行病学杂志, 2020, 41(12): 1945-1979. DOI:10.3760/cma.j.cn112338-20201111-01322 Chinese Preventive Medicine Association, Vaccine and Immunization Branch of the Chinese Preventive Medicine Association. Expert consensus on immunoprophylaxis of pneumococcal disease (2020 version)[J]. Chin J Epidemiol, 2020, 41(12): 1945-1979. DOI:10.3760/cma.j.cn112338-20201111-01322 |
| [2] |
Porchia BR, Bonanni P, Bechini A, et al. Evaluating the costs and benefits of pneumococcal vaccination in adults[J]. Expert Rev Vaccines, 2017, 16(2): 93-107. DOI:10.1080/14760584.2017.1242419 |
| [3] |
Ogilvie I, El Khoury A, Cui YD, et al. Cost-effectiveness of pneumococcal polysaccharide vaccination in adults: a systematic review of conclusions and assumptions[J]. Vaccine, 2009, 27(36): 4891-4904. DOI:10.1016/j.vaccine.2009.05.061 |
| [4] |
Andrews NJ, Waight PA, George RC, et al. Impact and effectiveness of 23-valent pneumococcal polysaccharide vaccine against invasive pneumococcal disease in the elderly in England and Wales[J]. Vaccine, 2012, 30(48): 6802-6808. DOI:10.1016/j.vaccine.2012.09.019 |
| [5] |
国家药品监督管理局. 关于发布预防用疫苗临床试验不良事件分级标准指导原则的通告(2019年第102号)[EB/OL]. (2019-12-26)[2022-10-10]. https://m.flyingspd.com/news/policy/5858.html.
|
| [6] |
Törling J, Hedlund J, Konradsen HB, et al. Revaccination with the 23-valent pneumococcal polysaccharide vaccine in middle-aged and elderly persons previously treated for pneumonia[J]. Vaccine, 2003, 22(1): 96-103. DOI:10.1016/s0264-410x(03)00521-8 |
| [7] |
Ohshima N, Nagai H, Matsui H, et al. Sustained functional serotype-specific antibody after primary and secondary vaccinations with a pneumococcal polysaccharide vaccine in elderly patients with chronic lung disease[J]. Vaccine, 2014, 32(10): 1181-1186. DOI:10.1016/j.vaccine.2013.09.060 |
| [8] |
Musher DM, Manof SB, Liss C, et al. Safety and antibody response, including antibody persistence for 5 years, after primary vaccination or revaccination with pneumococcal polysaccharide vaccine in middle-aged and older adults[J]. J Infect Dis, 2010, 201(4): 516-524. DOI:10.1086/649839 |
| [9] |
Clutterbuck EA, Lazarus R, Yu LM, et al. Pneumococcal conjugate and plain polysaccharide vaccines have divergent effects on antigen-specific B cells[J]. J Infect Dis, 2012, 205(9): 1408-1416. DOI:10.1093/infdis/jis212 |
| [10] |
Manoff SB, Liss C, Caulfield MJ, et al. Revaccination with a 23-valent pneumococcal polysaccharide vaccine induces elevated and persistent functional antibody responses in adults aged 65 > or = years[J]. J Infect Dis, 2010, 201(4): 525-533. DOI:10.1086/651131 |
| [11] |
Musher DM, Manoff SB, McFetridge RD, et al. Antibody persistence ten years after first and second doses of 23-valent pneumococcal polysaccharide vaccine, and immunogenicity and safety of second and third doses in older adults[J]. Hum Vaccin, 2011, 7(9): 919-928. DOI:10.4161/hv.7.9.15996 |
| [12] |
Hammitt LL, Bulkow LR, Singleton RJ, et al. Repeat revaccination with 23-valent pneumococcal polysaccharide vaccine among adults aged 55-74 years living in Alaska: no evidence of hyporesponsiveness[J]. Vaccine, 2011, 29(12): 2287-2295. DOI:10.1016/j.vaccine.2011.01.029 |
| [13] |
Cornelius R, Thomas H, Wichmann O, et al. Effectiveness, immunogenicity and safety of 23-valent pneumococcal polysaccharide vaccine revaccinations in the elderly: a systematic review[J]. BMC Infect Dis, 2016, 16(1): 711. DOI:10.1186/s12879-016-2040-y |
| [14] |
Plotkin SA, Orenstein WA, Offit PA. 疫苗[M]. 罗凤基, 杨晓明, 王军志, 等译. 6版. 北京: 人民出版社, 2017: 831. Plotkin SA, Orenstein WA, Offit PA. Vaccines[M]. Luo FJ, Yang XM, Wang JZ, et al, trans. 6th ed. Beijing: People's Publishing House, 2017: 831. |
| [15] |
World Health Organization. WHO workshop on standardization of pneumococcal opsonophagocytic assay[R]. Geneva: WHO, 2007.
|
| [16] |
李江姣, 杜慧竟, 陈驰, 等. 肺炎球菌结合疫苗两种免疫效果评价方法的比较分析[J]. 实用预防医学, 2014, 21(11): 1281-1284. DOI:10.3969/j.issn.1006-3110.2014.011.001 Li JJ, Du HJ, Chen C, et al. Comparison of two methods evaluating the immune effect of pneumococcal conjugate vaccine[J]. Pract Prev Med, 2014, 21(11): 1281-1284. DOI:10.3969/j.issn.1006-3110.2014.011.001 |
| [17] |
Jackson LA, Benson P, Sneller VP, et al. Safety of revaccination with pneumococcal polysaccharide vaccine[J]. JAMA, 1999, 281(3): 243-248. DOI:10.1001/jama.281.3.243 |
| [18] |
Kawakami K, Kishino H, Kanazu S, et al. Revaccination with 23-valent pneumococcal polysaccharide vaccine in the Japanese elderly is well tolerated and elicits immune responses[J]. Vaccine, 2016, 34(33): 3875-3881. DOI:10.1016/j.vaccine.2016.05.052 |
| [19] |
Advisory Committee on Immunization Practices. Pneumococcal vaccination: who and when to vaccinate CDC[EB/OL]. (2023-02-13)[2023-04-03]. https://www.cdc.gov/vaccines/vpd/pneumo/hcp/who-when-to-vaccinate.html.
|
 2023, Vol. 44
2023, Vol. 44