文章信息
- 王优一, 赵琦, 陈波, 王娜, 张铁军, 姜永根, 吴毅凌, 何纳, 赵根明, 刘星.
- Wang Youyi, Zhao Qi, Chen Bo, Wang Na, Zhang Tiejun, Jiang Yonggen, Wu Yiling, He Na, Zhao Genming, Liu Xing
- 上海市社区居民代谢相关慢性病组合与非酒精性脂肪肝患病关联分析
- Association between metabolism-related chronic disease combination and prevalence of non-alcoholic fatty liver disease in community residents in Shanghai
- 中华流行病学杂志, 2023, 44(7): 1106-1113
- Chinese Journal of Epidemiology, 2023, 44(7): 1106-1113
- http://dx.doi.org/10.3760/cma.j.cn112338-20230106-00012
-
文章历史
收稿日期: 2023-01-06
2. 上海市松江区疾病预防控制中心, 上海 201620
2. Songjiang District Center for Disease Control and Prevention, Shanghai 201620, China
非酒精性脂肪肝(NAFLD)是一种受遗传、饮食、环境等多因素相互作用的代谢相关疾病[1]。随着乙型肝炎疫苗的广泛接种及丙型肝炎药物的成功研发,NAFLD已超越病毒性肝炎,成为我国主要慢性肝病和健康体检肝功能酶学指标异常的重要原因[2]。NAFLD起始于单纯肝内脂肪沉积,部分可进展到非酒精性脂肪性肝炎(NASH)、肝硬化直至肝癌,起病隐匿,但早期干预可延缓或逆转病情进展。既往研究发现NAFLD是肥胖、2型糖尿病(T2DM)、MS等全身疾病累及肝脏的一种病理改变[3];高血糖还会明显加速NAFLD纤维化进展[4],进一步导致肝细胞癌发病率升高[5];同时NAFLD患者往往伴有血脂紊乱[6],增加心脑血管事件、T2DM、肝外癌症等疾病的风险,其发病风险随NAFLD的严重程度上升[7-8],这表明NAFLD可能与多种代谢相关慢性病互为因果、相互影响。据中国CDC研究报告显示,2015年我国居民因慢性病导致的死亡人数占全国总死亡人数的87%,其导致的疾病负担占总体的70%[9],而NAFLD合并慢性病可进一步导致两类疾病的进程恶化,增加患者死亡率。目前,NAFLD合并单一慢性病的流行病学研究较多,缺乏探索合并多种代谢相关慢性病与NAFLD关联的社区大样本人群研究。因此本研究利用上海郊区自然人群队列和生物样本库(SSACB)基线数据,描述上海市社区居民合并不同代谢相关慢性病的NAFLD患病率,并探索与NAFLD患病关联显著的慢性病共患组合,期望进一步明确高危人群,为社区NAFLD的早期防治提供科学依据。
对象与方法1. 研究对象:SSACB于2016年4月至2019年12月在上海市松江区、嘉定区、闵行区和徐汇区随机整群抽取11个社区,每个社区随机抽取1/3的居委会(村)作为研究现场,对抽取现场所有年龄≥18岁、拥有上海市户籍或在上海市居住≥5年的居民进行登记、问卷调查及体格检查,共招募研究对象69 116名。排除无问卷信息或体检信息者3 595名、在某些变量存在极端值者44名,最终共纳入65 477名研究对象。本研究通过复旦大学公共卫生学院伦理委员会审查(批准文号:IRB#2016-04-0586-S),研究对象均签署知情同意书。
2. 调查方法:采用统一设计的结构化问卷,由经过统一培训合格的调查员,在研究对象所属社区卫生服务中心进行面对面调查。问卷调查包括社会人口学信息(年龄、性别、职业、文化程度等)、生活行为方式(吸烟、饮酒、体力活动水平等)、个人及家族疾病史等。体格检查由社区医务人员采用标准方法进行测量,包括身高、体重、腰围、臀围、血压、腹部B超等。采集研究对象空腹静脉血2 ml,检测FPG(己糖激酶法,Roche C702)、糖化血红蛋白(HbA1c)(高效液相色谱法,TOSOH G8)、血尿酸(SUA)(比色法,Roche C702)、血脂4项(TC、TG、HDL-C、LDL-C)(酶比色法,Roche C501)等指标。实验室检测均由上海迪安医学检验中心完成。
3. NAFLD诊断标准:参照《非酒精性脂肪性肝病防治指南》(2018年更新版)[10]:①腹部B超影像表现符合弥漫性脂肪肝表征,且排除其他可致脂肪肝的特定疾病;②饮酒折合乙醇摄入量男性≤30 g/d,女性≤20 g/d。
4. 相关指标及定义:①纳入研究的5种常见代谢相关慢性病为肥胖、高血压、糖尿病、高脂血症和痛风。BMI=体重(kg)/身高(m)2,腰臀比(WHR)=腰围(cm)/臀围(cm)。符合以下任何1个条件即判定为肥胖:BMI≥28.0 kg/m2、男性腰围≥90 cm或WHR > 0.90、女性腰围≥85 cm或WHR > 0.85[11]。高血压:SBP≥140 mmHg(1 mmHg=0.133 kPa)和(或)DBP≥90 mmHg或既往有高血压病史[12]。糖尿病:FPG≥7.0 mmol/L和(或)HbA1c≥6.5%或既往有糖尿病史[13]。高脂血症(mmol/L):TC≥6.2和(或)TG≥2.3和(或)HDL-C < 1.0和(或)LDL-C≥4.1或既往有高脂血症病史[14]。痛风:男性SUA > 420 μmol/L或女性SUA > 360 μmol/L或既往有痛风病史[15]。用代谢相关慢性病及组合描述研究对象患有≥1种上述慢性病的具体情况。②吸烟:每天吸烟≥1支,持续 > 6个月。吸烟状况分为从不吸、过去吸和现在吸。③乙醇摄入量:按乙醇量、饮酒量和饮酒频率进行折算,分为0、0.1~、10.1~、20.1~和 > 30.0 g/d。④体力活动水平:根据2011年更新的主要体力活动纲要[16],计算每天代谢当量总时数(MET-h/d),分为 < 8.0、8.0~、24.0~和≥40.0。⑤其他协变量:年龄分为18~、30~、40~、50~、60~和≥70岁;文化程度分为小学及以下、初中、高中和大学及以上;婚姻状况分为已婚、离婚/丧偶和未婚;职业分为机关企事业单位管理人员、专业技术人员、工人、农民、军人和其他;静坐时间分为0~、4~和≥8 h/d;脂肪肝家族史分为否和是。
5. 统计学分析:采用SAS 9.4软件进行统计学分析。计量资料呈偏态分布采用M(Q1,Q3)描述,组间比较采用Wilcoxon秩和检验,计数资料采用频数、比例描述,组间比较采用χ2检验;运用多因素logistic回归模型分析代谢相关慢性病组合模式与NAFLD患病的关联,进一步按性别和年龄(< 60岁,≥60岁)进行分层分析。将从单一患1种到共患5种的共31类慢性病组合以亚变量形式进入模型,分别计算不同慢性病个数及组合的OR值及其95%CI。以NAFLD患病与否为因变量,将代谢相关慢性病组合模式及其他可能的影响因素(单因素P < 0.10)纳入二分类logistic回归模型。双侧检验,检验水准α=0.05。
结果1. 一般情况:共纳入65 477名研究对象,年龄M(Q1,Q3)为60(51,66)岁,其中男性26 616名(40.6%);27.0%为高中及以上文化程度;婚姻状况以已婚为主(91.2%);现在吸烟者占18.1%,男性占比(43.3%)高于女性(0.9%);男性BMI及腰围中位数均高于女性;其余生化检测指标(除HbA1c)男女性分布差异均有统计学意义(均P < 0.001)。见表 1。
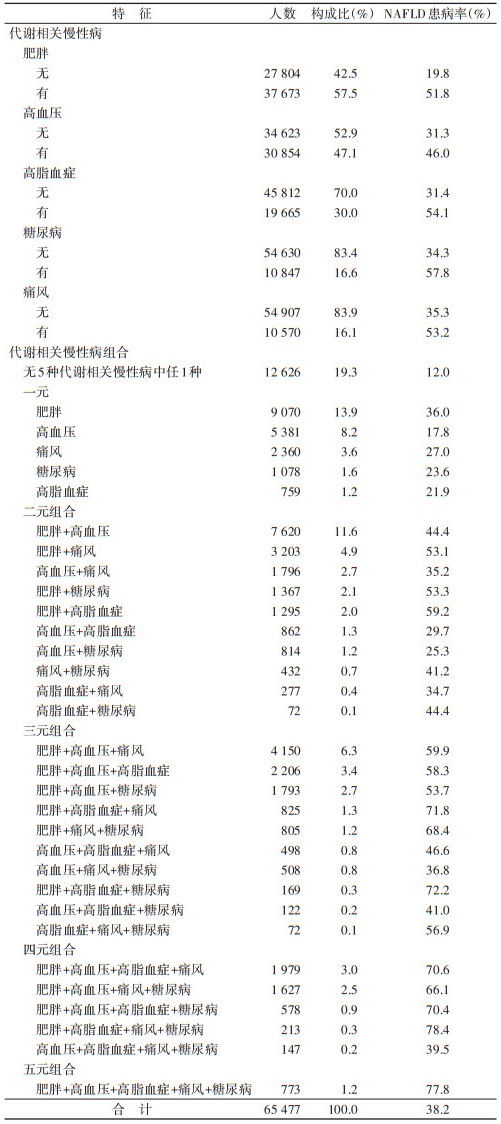
2. 代谢相关慢性病与NAFLD患病率:上海市社区居民NAFLD总患病率为38.2%。该人群中5种代谢相关慢性病患病率由高到低依次为肥胖(57.5%)、高血压(47.1%)、高脂血症(30.0%)、糖尿病(16.6%)和痛风(16.1%);糖尿病患者中NAFLD患病率最高(57.8%)。19.3%的居民未患5种代谢相关慢性病中任1种,其NAFLD患病率也最低(12.0%)。而28.5%、27.0%、17.1%、6.9%和1.2%的居民分别患有1、2、3、4和5种代谢相关慢性病。0.3%的居民同时患肥胖+高脂血症+痛风+糖尿病4种代谢慢性病,NAFLD患病率最高(78.4%);1.2%的居民同时患肥胖+高血压+高脂血症+痛风+糖尿病5种代谢慢性病,NAFLD患病率为77.8%。见表 2。
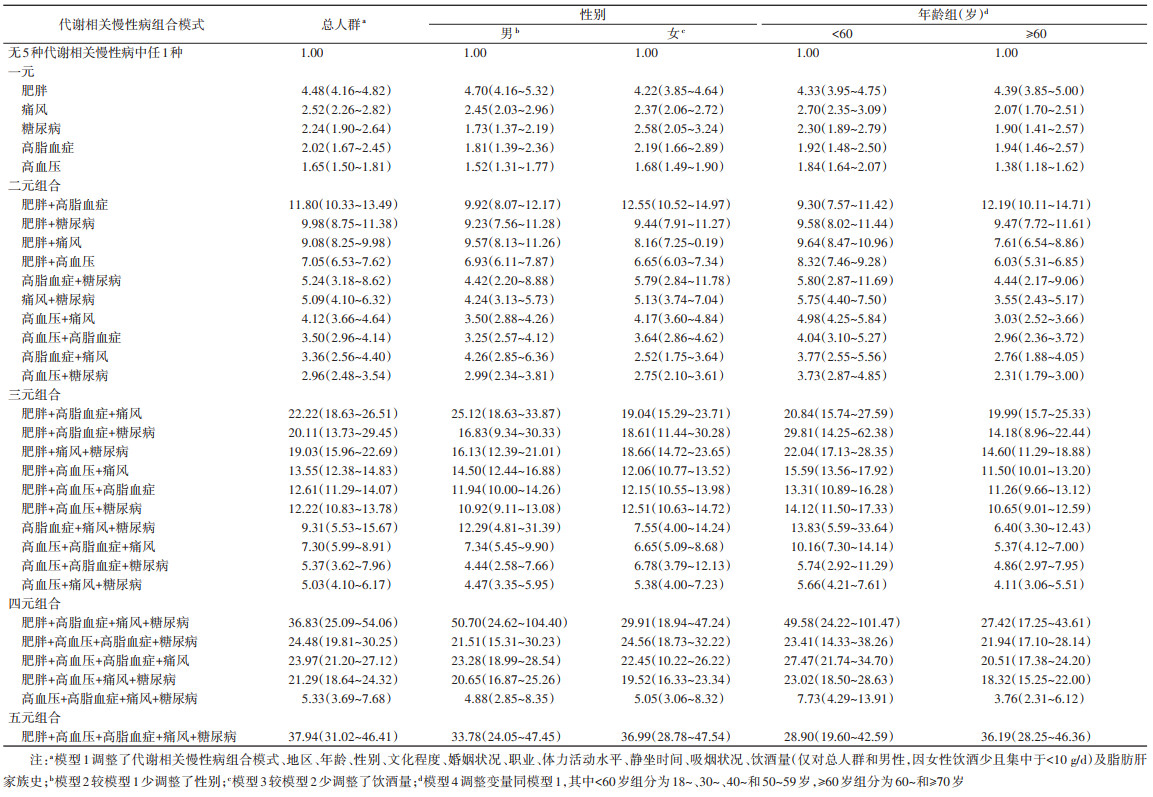
3. 合并代谢相关慢性病与NAFLD患病多因素logistic回归分析:多因素logistic回归分析结果显示,相较于无5种代谢相关慢性病中任1种者,与NAFLD患病关联最强的组合为肥胖+高血压+高脂血症+痛风+糖尿病(OR=37.94,95%CI:31.02~46.41),其次为肥胖+高脂血症+痛风+糖尿病(OR=36.83,95%CI:25.09~54.06)、肥胖+高血压+高脂血症+糖尿病(OR=24.48,95%CI:19.81~30.25)。按性别或年龄分层后,肥胖+高脂血症+痛风+糖尿病是男性(OR=50.70,95%CI:24.62~104.40)和 < 60岁组(OR=49.58,95%CI:24.22~101.47)与NAFLD患病关联最强的组合;肥胖+高血压+高脂血症+痛风+糖尿病是女性(OR=36.99,95%CI:28.78~47.54)和≥60岁组(OR=36.19,95%CI:28.25~46.36)与NAFLD患病关联最强的组合。见表 3。
本研究利用队列基线数据分析了上海市社区居民代谢相关慢性病共患模式与NAFLD患病的关联,发现该人群中约4/5的居民患≥1种代谢相关慢性病,在男性及 < 60岁人群中肥胖+高脂血症+痛风+糖尿病与NAFLD患病关联最强,在女性及≥60岁人群中关联最强的组合为肥胖+高血压+高脂血症+痛风+糖尿病。
上海市社区居民NAFLD总患病率为38.2%,高于同期中国其他地区如广东省东莞市(29.2%)[17]、北京市平谷区(26.8%)[18]和天津市(34.0%)[19],但低于同期沈阳市健康体检人群水平(43.5%)[20]。国内一项包括2 054 554名参与者的Meta分析显示,NAFLD在全国的总患病率为29.2%,在中国西北地区患病率尤其高(33.8%)[21]。然而,上海市社区居民NAFLD患病水平处于全国中上水平,可能与地区间经济状况、年龄分布、饮食结构、体力劳动强度等有关。
NAFLD是21世纪全球重要的公共健康问题之一,除可导致严重的肝脏并发症,近年来心脑血管事件被发现是NAFLD患者的主要死因之一[22]。本研究揭示肥胖+高血压+高脂血症+痛风+糖尿病是与NAFLD患病关联最强的共病组合,在同样慢性病共患个数的组合中,包含肥胖的组合比不包含者呈现更强的与NAFLD患病的关联,揭示了肥胖在代谢相关慢性病中与NAFLD关联的重要性。一项Meta分析显示肥胖个体患NAFLD的风险是体重正常者的3.5倍,且BMI与NAFLD发病风险之间存在剂量反应关系(BMI每增加1 kg/m2:RR=1.20,95%CI:1.14~1.26)[23]。鉴于到2030年中国肥胖患病率预计达到70.5%[24],且目前临床上对NAFLD尚无有效的针对性药物,NAFLD的防治面临巨大挑战,故通过健康的生活方式减重无疑是肥胖NAFLD者低成本的治疗方式,且可以进一步减少全身炎症、脂质毒性及胰岛素抵抗(IR),进而改善NAFLD。
本研究男女性年龄中位数存在差异,受传统文化习惯及社会角色认知的影响,男性现在吸烟者比例、静坐时间均高于女性;生化检测指标中男性血糖、血压等水平也高于女性。提示关注性别在慢性病发病、共患及与NAFLD关联探索中的差异作用。按性别、年龄分层后,发现代谢相关慢性病组合与NAFLD患病的关联在男女性、< 60和≥60岁人群中关联强度有一定差异,关联强度的排序顺位也有不同。这种“性别年龄效应”可能归因于行为模式、生理特征和致病机制的差异。相较于绝经前女性,男性比女性更容易罹患NAFLD,且男性患者群体表现出更严重的代谢功能障碍,例如更高的血糖和血压水平,更严重的内脏脂肪和肝损伤;而绝经后女性NAFLD患病率反超男性[25],有研究活检证实晚期纤维化在绝经后女性(36.1%)中的患病率明显高于男性(17.7%)和绝经前女性(13.5%)[26]。NAFLD患病与年龄之间的相关性因性别而异,很大程度上是由于女性更年期导致的荷尔蒙变化,有研究在卵巢切除的动物中发现,雌激素缺乏与NAFLD及NASH易感性增加存在因果关联[27]。未来的研究还需进一步探索性别差异背后社会文化、遗传背景和生理特征中的具体影响因素和相关作用机制,如激素及其调控网络机制等,从而帮助明确NAFLD发生机制、寻找用药靶点,开发精准化预防与治疗,最终减轻NAFLD的疾病负担。
分层后肥胖+高脂血症+痛风+糖尿病始终是NAFLD患病的高危组合,同时合并代谢相关慢性病数越多关联强度越大,这提示代谢相关慢性病患者是防治NAFLD的重点人群。NAFLD与多种代谢相关慢性病共患的原因可能是具有相同或类似的危险因素和发病机制。IR和高胰岛素水平、炎症反应、肠道菌群紊乱等是代谢相关慢性病和NAFLD的共同发病基础[28],这些发病机制相互作用、相互影响,共同促进代谢相关慢性病和NAFLD的发生发展,而IR则是其中较为关键的一环。由于IR,胰岛素对脂肪动员的限速酶抑制作用减弱,TG大量分解,释放更多游离脂肪酸至血循环,导致胰岛素失活而引发高胰岛素血症,而持续高胰岛素血症造成可逆性IR,大量脂肪酸堆积于肝脏进而引发脂肪肝[29]。另一方面,IR、肝脏脂肪沉积、氧化应激、线粒体功能障碍、脂质过氧化和内质网应激等都会导致肝脏产生炎症反应进而刺激库普弗细胞释放和合成炎症因子,使肝星状细胞转为肌成纤维细胞,促进肝纤维化[30]。国内外多项研究均证明高脂血症、痛风、糖尿病和NAFLD彼此加重及加速疾病的进展[31-33],严重影响患者生命质量,这提示NAFLD患者应积极完善全身检查,发现可能存在的代谢相关慢性病并采取综合干预措施,而对于代谢相关慢性病患者,应充分利用社区慢性病随访,监测血压、血糖、血脂、SUA等生化指标,加强对居民的健康教育,有助于提高患者的生存质量,同时延缓NAFLD的疾病进展,降低NAFLD患者死亡率。
本研究使用以人群为基础的队列研究基线数据,样本量较大,质量控制措施较为严格;对于NAFLD的诊断结合敏感性和特异性较高的B超及饮酒史,能较为全面、真实地反映上海市居民NAFLD患病情况。本研究存在局限性。首先,代谢相关慢性病信息源自基线自报和生化检测数据,没有同步查询上海市各区慢性病登记系统,可能对代谢相关慢性病的患病率有所低估;其次,无法获得NAFLD严重程度相关数据,缺少代谢相关慢性病与NAFLD严重程度关联的研究;最后,本研究为横断面设计,尚不足以证明代谢相关慢性病模式与NAFLD发病的因果关系,后期需开展队列随访,利用随访数据探究NAFLD的发病率及其与代谢相关慢性病模式之间的关联。
综上,上海市社区居民NAFLD患病率较高,需及早发现肥胖+高血压+高脂血症+痛风+糖尿病高危模式者并加强社区健康教育,及时减重并纠正SUA、血糖、血脂、血压等指标的异常,以降低NAFLD的风险。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王优一:研究选题、数据整理/分析、论文撰写/修改;赵琦、陈波、王娜、张铁军:现场沟通培训、数据采集/整理;姜永根、吴毅凌:项目管理、行政和技术支持;何纳、赵根明:项目设计、论文指导;刘星:数据采集/整理、研究设计、论文指导
| [1] |
Nseir W, Hellou E, Assy N. Role of diet and lifestyle changes in nonalcoholic fatty liver disease[J]. World J Gastroenterol, 2014, 20(28): 9338-9344. DOI:10.3748/wjg.v20.i28.9338 |
| [2] |
Wang FS, Fan JG, Zhang Z, et al. The global burden of liver disease: the major impact of China[J]. Hepatology, 2014, 60(6): 2099-2108. DOI:10.1002/hep.27406 |
| [3] |
Vuppalanchi R, Chalasani N. Nonalcoholic fatty liver disease and nonalcoholic steatohepatitis: selected practical issues in their evaluation and management[J]. Hepatology, 2009, 49(1): 306-317. DOI:10.1002/hep.22603 |
| [4] |
Bian H, Zhu XP, Xia MF, et al. Impact of type 2 diabetes on nonalcoholic steatohepatitis and advanced fibrosis in patients with nonalcoholic fatty liver disease[J]. Endocr Pract, 2020, 26(4): 444-453. DOI:10.4158/EP-2019-0342 |
| [5] |
Wild SH, Walker JJ, Morling JR, et al. Cardiovascular disease, cancer, and mortality among people with type 2 diabetes and alcoholic or nonalcoholic fatty liver disease hospital admission[J]. Diabetes Care, 2018, 41(2): 341-347. DOI:10.2337/dc17-1590 |
| [6] |
Zhang QQ, Lu LG. Nonalcoholic fatty liver disease: dyslipidemia, risk for cardiovascular complications, and treatment strategy[J]. J Clin Transl Hepatol, 2015, 3(1): 78-84. DOI:10.14218/JCTH.2014.00037 |
| [7] |
Lonardo A, Nascimbeni F, Mantovani A, et al. Hypertension, diabetes, atherosclerosis and NASH: cause or consequence?[J]. J Hepatol, 2018, 68(2): 335-352. DOI:10.1016/j.jhep.2017.09.021 |
| [8] |
Mantovani A, Dauriz M, Byrne CD, et al. Association between nonalcoholic fatty liver disease and colorectal tumours in asymptomatic adults undergoing screening colonoscopy: a systematic review and meta-analysis[J]. Metabolism, 2018, 87: 1-12. DOI:10.1016/j.metabol.2018.06.004 |
| [9] |
中华人民共和国国家卫生和计划生育委员会. 中国疾病预防控制工作进展(2015年)[J]. 首都公共卫生, 2015, 9(3): 97-101. DOI:10.16760/j.cnki.sdggws.2015.03.001 National Health and Family Planning Commission of the PRC. Progress of disease prevention and control in China (2015)[J]. Capital J Public Health, 2015, 9(3): 97-101. DOI:10.16760/j.cnki.sdggws.2015.03.001 |
| [10] |
中华医学会肝病学分会脂肪肝和酒精性肝病学组, 中国医师协会脂肪性肝病专家委员会. 非酒精性脂肪性肝病防治指南(2018年更新版)[J]. 实用肝脏病杂志, 2018, 21(2): 177-186. DOI:10.3969/j.issn.1672-5069.2018.02.007 National Workshop on Fatty Liver and Alcoholic Liver Disease, Chinese Society of Hepatology, Chinese Medical Association Fatty Liver Expert Committee, Chinese Medical Doctor Association. Guidelines of prevention and treatment for nonalcoholic fatty liver disease: a 2018 update[J]. J Pract Hepatol, 2018, 21(2): 177-186. DOI:10.3969/j.issn.1672-5069.2018.02.007 |
| [11] |
Zhou BF, Cooperative Meta-Analysis Group of the Working Group on Obesity in China. Predictive values of body mass index and waist circumference for risk factors of certain related diseases in Chinese adults-study on optimal cut-off points of body mass index and waist circumference in Chinese adults[J]. Biomed Environ Sci, 2002, 15(1): 83-96. |
| [12] |
《中国高血压防治指南》修订委员会. 中国高血压防治指南2018年修订版[J]. 心脑血管病防治, 2019, 19(1): 1-44. DOI:10.3969/j.issn.1007-5410.2019.01.002 Revision Committee of Guidelines for the Prevention and Treatment of Hypertension in China. The 2018 revison of China's guidelines for the prevention and treatment of hypertension[J]. Prev Treat Cardio-Cereb-Vasc Dis, 2019, 19(1): 1-44. DOI:10.3969/j.issn.1007-5410.2019.01.002 |
| [13] |
中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2020年版)[J]. 国际内分泌代谢杂志, 2021, 41(5): 482-548. DOI:10.3760/cma.j.cn121383-20210825-08063 Diabetes Branch of Chinese Medical Association. Guidelines of the prevention and treatment for Type 2 diabetes mellitus in China (2020 edition)[J]. Int J Endocrinol Metab, 2021, 41(5): 482-548. DOI:10.3760/cma.j.cn121383-20210825-08063 |
| [14] |
中国成人血脂异常防治指南修订联合委员会. 中国成人血脂异常防治指南(2016年修订版)[J]. 中国循环杂志, 2016, 31(10): 937-950. DOI:10.3969/j.issn.1000-3614.2016.10.001 China Joint Committee for the Revision of the Guidelines for the Prevention and Treatment of Adult Blood Lipid Disorders. Chinese guidelines on prevention and treatment of dyslipidemia in adults (the 2016 revison)[J]. Chin Circ J, 2016, 31(10): 937-950. DOI:10.3969/j.issn.1000-3614.2016.10.001 |
| [15] |
Borghi C, Domienik-Karlowicz J, Tykarski A, et al. Expert consensus for the diagnosis and treatment of patient with hyperuricemia and high cardiovascular risk: 2021 update[J]. Cardiol J, 2021, 28(1): 1-14. DOI:10.5603/CJ.a2021.0001 |
| [16] |
Ainsworth BE, Haskell WL, Herrmann SD, et al. 2011 compendium of physical activities: a second update of codes and MET values[J]. Med Sci Sports Exerc, 2011, 43(8): 1575-1581. DOI:10.1249/MSS.0b013e31821ece12 |
| [17] |
Fan JH, Luo SY, Ye YX, et al. Prevalence and risk factors of metabolic associated fatty liver disease in the contemporary South China population[J]. Nutr Metab (Lond), 2021, 18(1): 82. DOI:10.1186/s12986-021-00611-x |
| [18] |
Zhang XY, Zhou XH, Han XY, et al. The morbidity and comorbidity of nonalcoholic fatty liver disease and different glucose intolerance strata in a community-based Chinese population[J]. Metab Syndr Relat Disord, 2020, 18(6): 284-290. DOI:10.1089/met.2019.0107 |
| [19] |
Wei FJ, Li JX, Chen C, et al. Higher serum uric acid level predicts non-alcoholic fatty liver disease: a 4-year prospective cohort study[J]. Front Endocrinol (Lausanne), 2020, 11: 179. DOI:10.3389/fendo.2020.00179 |
| [20] |
章雅南, 刘奕婷. 沈阳市健康体检人群非酒精性脂肪肝患病情况及影响因素[J]. 公共卫生与预防医学, 2019, 30(3): 67-70. DOI:10.3969/j.issn.1006-2483.2019.03.015 Zhang YN, Liu YT. Prevalence of nonalcoholic fatty liver disease and related influencing factors in health examination population in Shenyang[J]. J Public Health Prev Med, 2019, 30(3): 67-70. DOI:10.3969/j.issn.1006-2483.2019.03.015 |
| [21] |
Zhou F, Zhou JH, Wang WX, et al. Unexpected rapid increase in the burden of NAFLD in China from 2008 to 2018: a systematic review and meta-analysis[J]. Hepatology, 2019, 70(4): 1119-1133. DOI:10.1002/hep.30702 |
| [22] |
Xu J, Dai LY, Zhang YJ, et al. Severity of nonalcoholic fatty liver disease and risk of future ischemic stroke events[J]. Stroke, 2021, 52(1): 103-110. DOI:10.1161/STROKEAHA.120.030433 |
| [23] |
Li L, Liu DW, Yan HY, et al. Obesity is an independent risk factor for non-alcoholic fatty liver disease: evidence from a meta-analysis of 21 cohort studies[J]. Obes Rev, 2016, 17(6): 510-519. DOI:10.1111/obr.12407 |
| [24] |
Sun XM, Yan AF, Shi ZM, et al. Health consequences of obesity and projected future obesity health burden in China[J]. Obesity (Silver Spring), 2022, 30(9): 1724-1751. DOI:10.1002/oby.23472 |
| [25] |
Distefano JK. NAFLD and NASH in postmenopausal women: implications for diagnosis and treatment[J]. Endocrinology, 2020, 161(10): bqaa134. DOI:10.1210/endocr/bqaa134 |
| [26] |
Suzuki A, Abdelmalek MF, Unalp-Arida A, et al. Regional anthropometric measures and hepatic fibrosis in patients with nonalcoholic Fatty liver disease[J]. Clin Gastroenterol Hepatol, 2010, 8(12): 1062-1069. DOI:10.1016/j.cgh.2010.08.005 |
| [27] |
Kamada Y, Kiso S, Yoshida Y, et al. Estrogen deficiency worsens steatohepatitis in mice fed high-fat and high-cholesterol diet[J]. Am J Physiol Gastrointest Liver Physiol, 2011, 301(6): G1031-G1043. DOI:10.1152/ajpgi.00211.2011 |
| [28] |
Tilg H, Adolph TE, Dudek M, et al. Non-alcoholic fatty liver disease: the interplay between metabolism, microbes and immunity[J]. Nat Metab, 2021, 3(12): 1596-1607. DOI:10.1038/s42255-021-00501-9 |
| [29] |
李婷婷, 白秀平. 非酒精性脂肪性肝病与2型糖尿病的双向关系及发病机制[J]. 医学综述, 2021, 27(1): 158-162, 168. DOI:10.3969/j.issn.1006-2084.2021.01.030 Li TT, Bai XP. Two-way relationship and pathogenesis of nonalcoholic fatty liver disease and type 2 diabetes mellitus[J]. Med Recapit, 2021, 27(1): 158-162, 168. DOI:10.3969/j.issn.1006-2084.2021.01.030 |
| [30] |
关桥伟, 姜慧玲, 盘强文. 非酒精性脂肪肝发生发展的分子机制及治疗方法的研究进展[J]. 西南军医, 2016, 18(5): 467-470. DOI:10.3969/j.issn.1672-7193.2016.05.023 Guan QW, Jiang HL, Pan QW. Advances in molecular mechanism and treatment of nonalcoholic fatty liver disease[J]. J Mil Surg Southwest China, 2016, 18(5): 467-470. DOI:10.3969/j.issn.1672-7193.2016.05.023 |
| [31] |
黄珂, 石守森, 张艳芳. 非酒精性脂肪肝病与老年2型糖尿病性微血管病变相关性研究[J]. 中国老年保健医学, 2021, 19(6): 18-21. DOI:10.3969/j.issn.1672-2671.2021.06.006 Huang K, Shi SS, Zhang YF. Correlation between non-alcoholic fatty liver disease and microvascular complications in type 2 diabetic patients in the elderly[J]. Chin J Geriatr Care, 2021, 19(6): 18-21. DOI:10.3969/j.issn.1672-2671.2021.06.006 |
| [32] |
Phan J, Ng V, Sheinbaum A, et al. Hyperlipidemia and nonalcoholic steatohepatitis predispose to hepatocellular carcinoma development without cirrhosis[J]. J Clin Gastroenterol, 2019, 53(4): 309-313. DOI:10.1097/MCG.0000000000001062 |
| [33] |
Xu CF, Yu CH, Xu L, et al. Hypouricemic therapy: a novel potential therapeutic option for nonalcoholic fatty liver disease[J]. Hepatology, 2010, 52(5): 1865-1866. DOI:10.1002/hep.23798 |
 2023, Vol. 44
2023, Vol. 44