文章信息
- 柴扬帆, 林鸿波, 丁国辉, 王晋伟, 王怀玉, 彭苏元, 高碧霞, 邓心未, 孔桂兰, 包蓓艳, 张路霞.
- Chai Yangfan, Lin Hongbo, Ding Guohui, Wang Jinwei, Wang Huaiyu, Peng Suyuan, Gao Bixia, Deng Xinwei, Kong Guilan, Bao Beiyan, Zhang Luxia
- 基于区域医疗大数据的慢性肾脏病患者贫血患病及治疗情况调查
- Prevalence and treatment of anemia in chronic kidney disease patients based on regional medical big data
- 中华流行病学杂志, 2023, 44(7): 1046-1053
- Chinese Journal of Epidemiology, 2023, 44(7): 1046-1053
- http://dx.doi.org/10.3760/cma.j.cn112338-20221201-01028
-
文章历史
收稿日期: 2022-12-01
2. 北京大学健康医疗大数据国家研究院, 北京 100191;
3. 宁波市鄞州区疾病预防控制中心, 宁波 315199;
4. 沈阳航空航天大学计算机学院, 沈阳 110136;
5. 北京大学第一医院肾内科, 北京 100034;
6. 宁波市泌尿肾病医院, 宁波 315100
2. National Institute of Health Data Science, Peking University, Beijing 100191, China;
3. Yinzhou District Center for Disease Control and Prevention of Ningbo, Ningbo 315199, China;
4. School of Computer Science, Shenyang Aerospace University, Shenyang 110136, China;
5. Department of Nephrology, Peking University First Hospital, Beijing 100034, China;
6. Ningbo Urology and Nephrology Hospital, Ningbo 315100, China
慢性肾脏病(CKD)已成为全球公共卫生问题,1990-2017年由CKD导致的疾病死亡人数已从第27位上升至第12位[1]。截至2017年,全球CKD患者人数达6.975亿,中国患病人数达1.323亿[1],其中99%以上的CKD患者为非透析CKD患者[2]。贫血是CKD患者常见并发症,2012年一项调查显示,我国CKD患者贫血患病率为51.5%[3]。
贫血将降低CKD患者的生活质量,增加心血管疾病及死亡风险,加快肾衰竭进展[4]。可靠的CKD贫血流行病学数据对于制定相关卫生政策、延缓CKD进展、预防贫血相关不良事件的发生至关重要。本研究利用宁波市鄞州区域健康信息平台(YRHIP),分析2012-2018年CKD患者的贫血患病、影响因素及治疗情况,为我国CKD患者的贫血管理及治疗提供证据参考。
对象与方法1. 数据来源: YRHIP是在浙江省宁波市鄞州区、经过了十余年发展的、较为成熟的电子健康档案(EHR)系统。截至2019年鄞州区共有102.7万居民在该EHR系统中建档,占当地总人口的95.09%[5]。本研究数据来自基于YRHIP构建的CKD专病数据库。依据国际肾脏病学会改善全球肾脏病预后组织(KDIGO)临床指南[6],该专病数据库识别CKD患者的标准为至少存在两种情况之一:①EHR系统内存在至少两次(且两次记录相隔至少3个月)的肾小球滤过率(eGFR)估计值< 60 ml·min-1·(1.73 m2)-1记录或尿白蛋白与肌酐比 > 30 mg/g记录(或等效尿蛋白与肌酐比值、24 h尿蛋白和试纸蛋白尿记录);②《国际疾病分类》第十版(ICD-10)诊断代码中包含CKD疾病编码(参见文献[7])。本研究涉及的所有患者个人信息均进行了脱敏处理,已通过北京大学医学部伦理委员会审查(批准文号:IRB00001052-20092)。
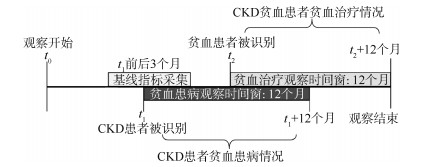
2. 研究设计: 提取2012-2018年CKD专病数据库中未接受肾脏替代治疗的新发成年CKD患者(根据CKD识别标准首次被识别的CKD病例,并非基于疾病自然史概念的新发生病例),自CKD患者被识别时间起,以12个月为观察时间窗,根据时间窗内EHR系统中的血红蛋白检查记录识别贫血患病情况。在计算贫血患病率时,以CKD患者数为分母,以观察时间窗内发现的贫血患者数为分子,描述CKD患者的贫血患病率,并分析贫血患病的影响因素。最后,基于上述贫血人群,分析贫血发现后12个月内的贫血治疗情况,以EHR系统内处方记录中存在至少一次CKD贫血治疗药物,包括红细胞生成刺激剂(ESA)、口服铁剂和静脉铁剂记录来判断接受贫血治疗的患者。见图 1。
|
| 注:CKD:慢性肾脏病 图 1 研究设计 |
3. 标准界定:
(1) CKD贫血判断标准:依据KDIGO 2012年颁布的CKD贫血临床指南[6]及2021年发布的《中国肾性贫血诊治临床实践指南》的贫血诊断标准[8]:男性血红蛋白 < 130 g/L,非妊娠女性血红蛋白 < 120 g/L,并排除其他可能导致贫血的遗传代谢性血液系统疾病及血管炎。
(2) 排除标准:①观察期内无任何血红蛋白检测记录的患者;②在识别前后12个月内无肌酐检测记录的患者;③在分析贫血患病情况及贫血治疗情况时,分别排除患病观察期内死亡的患者及治疗观察期内死亡的患者。
4. 统计学分析:
(1) 分组指标:①CKD患者基本特征:包括年龄、性别、城乡(依据EHR系统中登记的户籍类别)、BMI及腰围(以CKD被识别时间点前后3个月内最近一次记录为准);②CKD患者所患合并症:主要考虑6种疾病:心力衰竭、心肌梗死、脑血管病、周围血管病、慢性阻塞性肺疾病(COPD)和恶性肿瘤,根据EHR系统内诊断记录中出现过相关疾病的ICD-10编码进行判断;③CKD分期:使用CKD流行病学协作组公式,以CKD被识别时间点前后12个月内最近的一次血肌酐检测值估算eGFR,并根据KDIGO临床指南的划分标准进行分期[6]:1期[≥90 ml·min-1·(1.73 m2)-1]、2期[60~89 ml·min-1·(1.73 m2)-1]、3期[30~59 ml·min-1·(1.73 m2)-1]、4期[15~29 ml·min-1·(1.73 m2)-1]和5期[< 15 ml·min-1·(1.73 m2)-1];④CKD患者识别及诊断情况:包括识别时的诊断情况(是否依据CKD特异性诊断ICD-10编码)及识别时就诊的医疗机构,其中,对医疗机构的分层分析考虑了不同医疗机构的诊断能力,分为当地有肾内科的综合医院(3所),无肾内科的综合医院(39所)及社区卫生服务中心/站点。
(2) 分析方法:①采用描述性统计分析,描述CKD患者的贫血患病及治疗情况:连续型变量报告x±s,分类变量报告频数(%)。分类变量组间比较采用χ2检验,等级资料的组间比较采用趋势χ2检验;分析贫血患病的时间分布时,计算了年度的粗患病率,并以总研究人群作为标准人群,计算了根据年龄组及性别分层调整后的标化患病率,最后采用对数线性模型分别对贫血粗患病率及标化患病率进行趋势分析,计算患病率的年度变化百分比(APC),并对其进行t检验;②CKD贫血患病的影响因素分析,采用单因素及多因素logistic回归,计算OR值(95%CI),选取单因素分析有意义的变量作为多因素分析的自变量,计算aOR值(95%CI)。双侧检验,检验水准α=0.05。统计分析使用R 4.1.3软件。
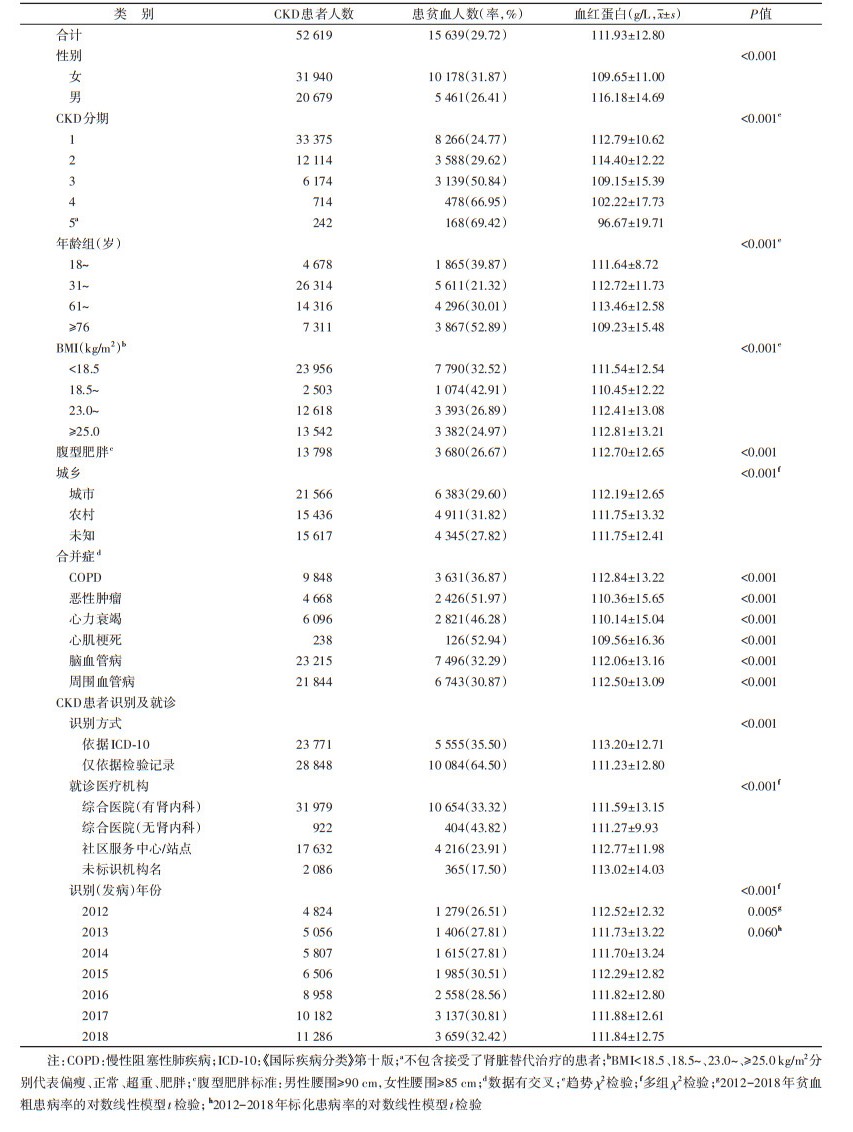
结果1. 新发CKD患者贫血患病整体情况: 共纳入52 619例新发CKD患者,年龄18~102(56.00±16.85)岁,其中60.70%的患者为女性。以CKD被识别后12个月为观察时间窗,有15 639例CKD患者存在至少一次符合贫血诊断标准的血红蛋白记录,其中11 253例CKD患者的贫血在基线时期发现。新发CKD患者观察期有15 639例(29.72%)存在贫血,其中女性贫血患者10 178例(31.87%),男性贫血患者5 461例(26.41%),差异有统计学意义(P < 0.001)。1~5期CKD患者贫血患病率分别为24.77%、29.62%、50.84%、66.95%、69.42%,贫血患病率随着CKD分期的进展而增加(趋势检验P < 0.001)。所有贫血患者首次贫血记录的血红蛋白为(111.93±12.80) g/L,女性(109.65±11.00) g/L,男性(116.18±14.69) g/L。2012-2018年,CKD患者的粗贫血患病率呈上升趋势(对数线性回归分析,APC=3.11%,P=0.005),而经调整的贫血标化患病率不存在时间趋势(P=0.060)。新发CKD患者贫血患病情况见表 1。
2. 新发CKD患者贫血患病的影响因素: 经单因素回归分析显示,性别、CKD分期、年龄、BMI、腹型肥胖、合并症(COPD、恶性肿瘤、心力衰竭、心肌梗死、脑血管病、周围血管病)是CKD患者发生贫血的影响因素。多因素logistic回归分析显示,CKD患者患贫血的独立影响因素有性别(女性:aOR=1.57,95%CI:1.50~1.63)、CKD分期(2期:aOR=1.10,95%CI:1.04~1.16;3期:aOR=2.28,95%CI:2.12~2.44;4期:aOR=4.49,95%CI:3.79~5.32;5期:aOR=6.31,95%CI:4.74~8.39)、年龄(18~30岁:aOR=2.40,95%CI:2.24~2.57;61~75岁:aOR=1.35,95%CI:1.28~1.42;≥76岁:aOR=2.37,95%CI:2.20~2.55)、BMI(< 18.5 kg/m2:aOR=1.29,95%CI:1.18~1.41;23.0~24.9 kg/m2:aOR=0.79,95%CI:0.75~0.83;≥25.0 kg/m2:aOR=0.70,95%CI:0.66~0.74)、腹型肥胖(aOR=0.91,95%CI:0.86~0.96)、COPD(aOR=1.15,95%CI:1.09~1.22)、恶性肿瘤(aOR=3.03,95%CI:2.84~3.23)、心力衰竭(aOR=1.44,95%CI:1.35~1.54)及心肌梗死(aOR=1.54,95%CI:1.16~2.04)。见表 2。
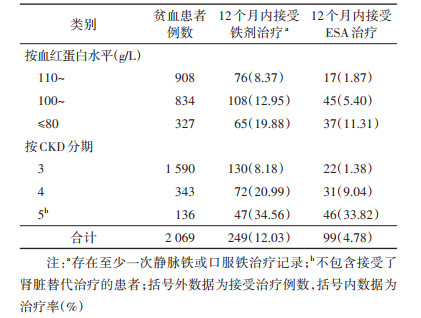
3. CKD患者中贫血者铁剂及ESA治疗情况: 本研究使用2012-2018年中国鄞州CKD人群的数据,治疗实践更多参考国内相关指南标准,依据《肾性贫血诊断与治疗中国专家共识》(2014年修订版)[9]及《中国肾性贫血诊治临床实践指南》(2021年)[8],一般情况下CKD贫血患者推荐的血红蛋白靶目标值> 110 g/L,因此分析血红蛋白≤110 g/L的贫血患者的后续治疗情况比较具有参考价值。排除观察期死亡的患者后,本研究纳入了2 069例血红蛋白≤110 g/L的CKD 3~5期贫血患者的ESA及铁剂治疗情况进行了分析。在出现贫血记录后的12个月内,249例(12.03%)患者接受了铁剂治疗,99例(4.78%)患者接受了ESA治疗。见表 3。
本研究对2012-2018年宁波市鄞州区的52 619例CKD患者贫血患病、影响因素及治疗情况进行了调查,区别于传统的流行病调查研究,本研究通过EHR系统中的检查检验记录以及ICD-10编码来识别CKD患者,根据血红蛋白记录识别贫血患者并根据处方记录判断其治疗情况。
本研究结果显示,新发CKD患者贫血患病率为29.72%,显著高于一般人群。1~5期CKD患者贫血患病率分别为24.77%、29.62%、50.84%、66.95%和69.42%,类似设计的EHR研究中,日本2014年的研究结果中4期和5期患者贫血患病率为60.70%和73.50%[10],与本研究结果差距不大。在不同研究中,患者数据的收集方式以及研究设计的差异可能会造成分析结果的不同。现有的大部分国内外CKD贫血患病情况的流行病学研究的数据源自于医院肾内科的CKD患者[3, 11-14],结果显示CKD患者的贫血患病率在32.30%~55.90%之间。由于真实世界中有超过50%的CKD患者并未及时接受肾内科医生的诊疗[7, 15-18],基于医院肾内科CKD患者数据的研究可能难以代表真实世界全人群中CKD患者的贫血患病及治疗情况,本研究补充了我国真实世界CKD患者的贫血相关证据。
本研究结果显示,随着CKD严重程度的增加,CKD患者的贫血患病率增加。这与既往CKD贫血研究结论一致[2, 18],也与CKD已知发病机制一致,即红细胞生成随着肾功能下降而减少。
既往研究表明,贫血患病率会随着年龄的增加而增加,然而本研究结果显示,18~29岁的CKD患者贫血患病率高于30~75岁人群,这一现象在另一项日本的基于EHR的肾性贫血研究中也有类似发现[10]。一方面,这可能与年轻患者疾病管理意识较强、随访频率较高,贫血检出率更高有关;另一方面,年轻CKD患者的原发病疾病谱与老年患者存在差异,年轻CKD患者中原发性肾脏病和自身免疫病继发性肾脏病比例相对更高[19],可能导致青年和老年CKD患者的疾病进展速度各异,青年CKD患者贫血患病率更高。
由于本研究的CKD病例涉及的时间跨度较长,因此对CKD贫血患病情况的时间分布进行了分析,结果显示2012-2018年CKD患者的贫血粗患病率逐渐上升,而经性别及年龄调整后的贫血标化患病率不存在时间趋势。提示贫血患病率表现出的时间趋势可能受到人口构成变化的影响。
贫血是CKD的重要并发症,为临床工作者提供CKD贫血患病的影响因素信息以便及时进行健康管理很有必要。本研究对CKD患者贫血患病的影响因素进行了探索。结果显示,女性CKD患者贫血患病风险高于男性,与既往研究一致[18]。患COPD的CKD患者贫血患病风险高于未患COPD者,有心肌梗死史的CKD患者贫血患病风险高于无心肌梗死史者。这一结果提示,患有COPD和有心肌梗死史的CKD患者应注意监测血红蛋白。同时还发现,有恶性肿瘤史的CKD患者贫血患病风险高于无恶性肿瘤史者,这可能与恶性肿瘤本身增加营养物质流失风险有关。此外,BMI偏低的CKD患者贫血患病风险高于正常人群,超重、肥胖、腹型肥胖患者贫血患病风险降低,这也反映出营养对贫血发生发展的重要作用。
为CKD患者提供更可及的药物治疗方案有利于贫血治疗的持续性和稳定性。为了既能够尽量全面描述CKD贫血患者治疗情况,又同时避免随访时间的延长随着CKD患者病情进展对结果产生影响,本研究选择了12个月作为治疗情况的随访观察期,分析了3~5期CKD贫血患者的铁剂及ESA药物治疗情况。仅有4.78%的CKD患者在12个月内接受了ESA治疗。这与2012年上海市横断面研究中的问卷调查显示的ESA治疗率(39%)差异较大[3],需要考虑到研究设计、研究人群以及时间上的差异。多项研究表明,CKD患者是否经由肾病科医生诊断是影响贫血治疗率的重要影响因素[15, 20-21],上海市横断面研究结果来自于25家医院肾内科接诊的CKD患者的问卷自报数据,而本研究结果来自基于EHR识别的CKD患者,其中大部分并未经肾病科医生诊断[7]。此外,在过去10年间,考虑到ESA造成的心血管事件死亡风险增加,越来越多的临床医生倾向于慎重使用ESA治疗CKD贫血,ESA使用率持续降低[22];且较严重的贫血患者或晚期CKD患者可能接受了个性化的贫血治疗与护理,例如依据具体的红细胞指标对患者进行输血等,这些治疗与护理方案可能未被本研究使用的EHR系统捕获。目前我国尚无基于EHR的CKD贫血治疗率的研究,但其他国家的此类研究同样显示了较低的ESA治疗率。2012-2018年美国一项EHR调查结果显示3~5期血红蛋白≤100 g/L的CKD贫血患者中仅有1.90%接受了ESA治疗[23];2014年日本一项EHR研究显示4期和5期CKD贫血患者ESA治疗比例分别为7.90%和22.40%[10],低于本研究结果。
本研究存在局限性。第一,本研究数据来源于EHR系统,并非CKD患者肾科专病数据。因此本研究结果体现的是真实世界全CKD人群的贫血患病与诊疗情况,不能反映肾脏病专科的贫血诊疗情况。第二,EHR系统中铁动力学指标、输血、贫血相关症状(例如疲劳等)及生活习惯等数据缺失,使本研究在评价治疗情况及贫血影响因素时可能不够全面。第三,由于EHR系统中的数据源于医疗实践,患者就诊频率和检测情况会直接影响到获取的信息。由于大部分CKD患者缺乏完整的基线血红蛋白数据,本研究聚焦分析了观察期内CKD患者贫血患病情况而非发病情况,而且患者就诊频率和就诊时的血红蛋白检测频率也会影响贫血患病率的计算。这类由于EHR本身性质造成的选择偏倚很难避免。第四,受限于区域医疗卫生数据,无法确定研究对象是否在其他地区的医疗机构接受过检查及治疗,但考虑到异地转诊行为主要是低医疗资源配置地区到高配置地区,而宁波市鄞州区医疗资源丰富,其二级以上医保定点医疗机构体量居宁波市首位,此外参考宁波市区人口异地就诊比例仅为0.8%,估计异地就诊情况对本研究结果的影响不大[5, 24]。
综上所述,CKD患者的贫血患病率较高,且受到CKD分期、COPD、恶性肿瘤、心力衰竭及心肌梗死等因素的影响;贫血患者中,铁剂和ESA治疗率偏低,提示当地CKD贫血人群的药物治疗需求尚未得到满足。
利益冲突 所有作者声明无利益冲突
作者贡献声明 柴扬帆:研究设计、实施研究、整理数据、统计分析、论文撰写;林鸿波:论文审阅、行政/技术支持;丁国辉:数据整理、技术支持;王晋伟、王怀玉、彭苏元、高碧霞、邓心未:论文审阅;孔桂兰:研究设计、研究指导、论文撰写、经费支持;包蓓艳、张路霞:论文审阅、研究指导、论文撰写
志谢 感谢万达技术公司提供的技术支持,感谢北京朝阳医院李登科医师在疾病编码筛选过程中提供的知识支持
| [1] |
Bikbov B, Purcell CA, Levey AS, et al. Global, regional, and national burden of chronic kidney disease, 1990-2017: a systematic analysis for the global burden of disease study 2017[J]. Lancet, 2020, 395(10225): 709-733. DOI:10.1016/S0140-6736(20)30045-3 |
| [2] |
Zhang LX, Wang F, Wang L, et al. Prevalence of chronic kidney disease in China: a cross-sectional survey[J]. Lancet, 2012, 379(9818): 815-822. DOI:10.1016/S0140-6736(12)60033-6 |
| [3] |
Li Y, Shi H, Wang WM, et al. Prevalence, awareness, and treatment of anemia in Chinese patients with nondialysis chronic kidney disease: first multicenter, cross-sectional study[J]. Medicine, 2016, 95(24): e3872. DOI:10.1097/MD.0000000000003872 |
| [4] |
Shen Y, Wang JW, Yuan J, et al. Anemia among Chinese patients with chronic kidney disease and its association with quality of life - results from the Chinese cohort study of chronic kidney disease (C-STRIDE)[J]. BMC Nephrol, 2021, 22(1): 64. DOI:10.1186/s12882-021-02247-8 |
| [5] |
Lin HB, Tang X, Shen P, et al. Using big data to improve cardiovascular care and outcomes in China: a protocol for the Chinese electronic health records research in Yinzhou (CHERRY) study[J]. BMJ Open, 2018, 8(2): e019698. DOI:10.1136/bmjopen-2017-019698 |
| [6] |
McMurray JJV, Parfrey PS, Adamson JW, et al. Kidney disease: improving global outcomes (KDIGO) anemia work group. KDIGO clinical practice guideline for anemia in chronic kidney disease[J]. Kidney Int Suppl, 2012, 2(4): 279-335. DOI:10.1038/kisup.2012.37 |
| [7] |
Wang HY, Ding GH, Lin HB, et al. Influence of doctors' perception on the diagnostic status of chronic kidney disease: results from 976 409 individuals with electronic health records in China[J]. Clin Kidney J, 2021, 14(11): 2428-2436. DOI:10.1093/ckj/sfab089 |
| [8] |
中国医师协会肾脏内科医师分会肾性贫血指南工作组. 中国肾性贫血诊治临床实践指南[J]. 中华医学杂志, 2021, 101(20): 1463-1502. DOI:10.3760/cma.j.cn112137-20210201-00309 Guidelines Working Group of Chinese Nephrologist Association of Chinese. Clinical practice guideline for anemia in chronic kidney disease[J]. Natl Med J China, 2021, 101(20): 1463-1502. DOI:10.3760/cma.j.cn112137-20210201-00309 |
| [9] |
中国医师协会肾内科医师分会肾性贫血诊断和治疗共识专家组. 肾性贫血诊断与治疗中国专家共识(2014年修订版)[J]. 中华肾脏病杂志, 2014, 30(9): 712-716. DOI:10.3760/cma.j.issn.1001-7097.2014.09.015 Expert Committee of Chinese Nephrologist Association on the the Diagnosis and Management of Renal Anemia. Chinese expert consensus on the diagnosis and management of renal anemia[J]. Chin J Nephrol, 2014, 30(9): 712-716. DOI:10.3760/cma.j.issn.1001-7097.2014.09.015 |
| [10] |
Sofue T, Nakagawa N, Kanda E, et al. Prevalence of anemia in patients with chronic kidney disease in Japan: a nationwide, cross-sectional cohort study using data from the Japan chronic kidney disease database (J-CKD-DB)[J]. PLoS One, 2020, 15(7): e0236132. DOI:10.1371/journal.pone.0236132 |
| [11] |
Ryu SR, Park SK, Jung JY, et al. The prevalence and management of anemia in chronic kidney disease patients: result from the Korean cohort study for outcomes in patients with chronic kidney disease (KNOW-CKD)[J]. J Korean Med Sci, 2017, 32(2): 249-256. DOI:10.3346/jkms.2017.32.2.249 |
| [12] |
Alagoz S, Dincer MT, Eren N, et al. Prevalence of anemia in predialysis chronic kidney disease: is the study center a significant factor?[J]. PLoS One, 2020, 15(4): e0230980. DOI:10.1371/journal.pone.0230980 |
| [13] |
Akizawa T, Makino H, Matsuo S, et al. Management of anemia in chronic kidney disease patients: baseline findings from chronic kidney disease Japan cohort study[J]. Clin Exp Nephrol, 2011, 15(2): 248-257. DOI:10.1007/s10157-010-0396-7 |
| [14] |
Wong MMY, Tu C, Li Y, et al. Anemia and iron deficiency among chronic kidney disease stages 3-5 ND patients in the chronic kidney disease outcomes and practice patterns study: often unmeasured, variably treated[J]. Clin Kidney J, 2020, 13(4): 613-624. DOI:10.1093/ckj/sfz091 |
| [15] |
Lawler EV, Gagnon DR, Fink J, et al. Initiation of anaemia management in patients with chronic kidney disease not on dialysis in the veterans health administration[J]. Nephrol Dial Transplant, 2010, 25(7): 2237-2244. DOI:10.1093/ndt/gfp758 |
| [16] |
Kern EFO, Maney M, Miller DR, et al. Failure of ICD-9-CM codes to identify patients with comorbid chronic kidney disease in diabetes[J]. Health Serv Res, 2006, 41(2): 564-580. DOI:10.1111/j.1475-6773.2005.00482.x |
| [17] |
John R, Webb M, Young A, et al. Unreferred chronic kidney disease: a longitudinal study[J]. Am J Kidney Dis, 2004, 43(5): 825-835. DOI:10.1053/j.ajkd.2003.12.046 |
| [18] |
McClellan W, Aronoff SL, Bolton WK, et al. The prevalence of anemia in patients with chronic kidney disease[J]. Curr Med Res Opin, 2004, 20(9): 1501-1510. DOI:10.1185/030079904X2763 |
| [19] |
Mahmood U, Healy HG, Kark A, et al. Spectrum (characteristics) of patients with chronic kidney disease (CKD) with increasing age in a major metropolitan renal service[J]. BMC Nephrol, 2017, 18(1): 372. DOI:10.1186/s12882-017-0781-5 |
| [20] |
Rasu RS, Manley HJ, Crawford T, et al. Undertreatment of anemia in patients with chronic kidney disease in the United States: analysis of national outpatient survey data[J]. Clin Ther, 2007, 29(7): 1524-1534. DOI:10.1016/j.clinthera.2007.07.016 |
| [21] |
Baldwin MD. The primary care physician/nephrologist partnership in treating chronic kidney disease[J]. Prim Care, 2014, 41(4): 837-856. DOI:10.1016/j.pop.2014.08.004 |
| [22] |
Park H, Liu XY, Henry L, et al. Trends in anemia care in non-dialysis-dependent chronic kidney disease (CKD) patients in the United States (2006-2015)[J]. BMC Nephrol, 2018, 19(1): 318. DOI:10.1186/s12882-018-1119-7 |
| [23] |
Wittbrodt ET, James G, Kumar S, et al. Contemporary outcomes of anemia in US patients with chronic kidney disease[J]. Clin Kidney J, 2022, 15(2): 244-252. DOI:10.1093/ckj/sfab195 |
| [24] |
傅松涛. 宁波市区统筹异地就医情况浅析[J]. 卫生经济研究, 2011(9): 21-23. DOI:10.14055/j.cnki.33-1056/f.2011.09.021 Fu ST. Research on cross-regional medical treatment in the urban area of Ningbo[J]. Health Econ Res, 2011(9): 21-23. DOI:10.14055/j.cnki.33-1056/f.2011.09.021 |
 2023, Vol. 44
2023, Vol. 44