文章信息
- 王鑫钰, 张梦迪, 朱文龙, 刘芷希, 王伟炳.
- Wang Xinyu, Zhang Mengdi, Zhu Wenlong, Liu Zhixi, Wang Weibing
- 疫情防控策略优化后上海市新型冠状病毒感染疫情的预测和估计
- Estimation of COVID-19 incidence in Shanghai under optimized epidemic prevention and control strategies
- 中华流行病学杂志, 2023, 44(4): 552-560
- Chinese Journal of Epidemiology, 2023, 44(4): 552-560
- http://dx.doi.org/10.3760/cma.j.cn112338-20221208-01051
-
文章历史
收稿日期: 2022-12-08
2. 中国疾病预防控制中心流行病学办公室, 北京 102206
2. Office of Epidemiology, Chinese Center for Disease Control and Prevention, Beijing 102206, China
截至2023年1月23日,新型冠状病毒(新冠病毒)感染的全球大流行已累计导致6.64余亿确诊病例,671.61万死亡病例[1]。新冠病毒变异株的不断出现为疫情防控和卫生资源供给带来挑战。采取新冠病毒疫苗接种和非药物干预措施(NPIs)是遏制新冠病毒扩散的有效手段,尤其是关闭学校和工作场所的措施有效性较好[2-4]。依据我国的疫情防控经验和国内外对新冠病毒的相关研究,我国针对疫情防控政策进行调整,将新冠病毒感染由“乙类甲管”调整成为“乙类乙管”[5]。自2023年1月8日起,对于入境人员仅需提供行程前48 h核酸结果,取消入境后的核酸检测和集中隔离[5]。上海市作为我国重要的国际化口岸城市,2019年口岸出入境人员达4 569.46万人次[6]。在取消入境后的核酸检测和集中隔离之后,上海市疫情防控工作和医疗卫生体系面临严峻挑战。SEIR传染病动力学模型(SEIR模型)被广泛应用于预测和研判新冠病毒感染疫情的流行趋势[7-8]。中国香港地区与澳大利亚均有研究应用SEIR模型分析入境开放后的新冠病毒感染疫情的发展趋势[9-10],澳大利亚的研究结果显示,一旦恢复国际旅行,即使新冠病毒疫苗接种率达到80%,仍可能面临疫情暴发的风险,当病毒传播能力提高到基本再生数(R0)为7.0,感染和住院人数均会大幅增加。已有较多研究在模型构建时纳入更多的考量因素,如增加年龄结构以提高模型预测的准确性[11-12],模拟不同等级的NPIs对于疫情发展的影响[13]。本研究以2022年12月1日作为模型模拟起点的当日实际情况,基于新冠病毒的自然史、上海市3-6月疫情数据、防控措施和新冠病毒疫苗接种实际情况,构建按照年龄分层的SEIR模型,模拟估计了不同新冠病毒疫苗接种情况、NPIs等级、居家隔离意愿和入境情况对于上海市新冠病毒感染疫情的发展规模和医疗卫生资源需求的影响,为我国公共卫生决策的制定和上海市医疗卫生资源的配置提供参考依据。
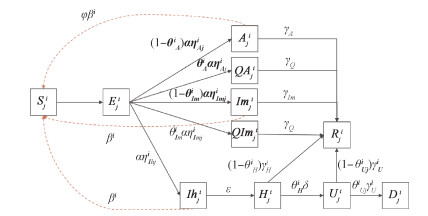
资料与方法 (1) 构建SEIR模型扩展传统的SEIR模型(图 1):根据新冠病毒疫苗接种情况和年龄组进行人群划分,分为易感人群(susceptible,Sji)、暴露人群(exposed,Eji)和感染人群。由于不同年龄组人群接触的异质性,分为10个年龄组(0~、3~、12~、18~、30~、40~、50~、60~、70~和≥80岁)人群,3个疫苗接种状态(U代表未接种疫苗或仅接种1剂次疫苗,F代表完成全程接种,B代表完成加强针接种),i代表不同年龄组,j代表不同疫苗接种情况。感染人群分为无症状感染者(asymptomatic infected,Aji)和临床病例(symptomatic infected,Iji);根据是否住院治疗将临床病例分为轻型病例(Imji)和中/重/危重型病例(Ihji)。是否接种疫苗会影响易感人群的感染风险与感染后的无症状感染者、轻型病例和中/重/危重型病例的比例。无症状感染者和轻型病例自愿进行居家隔离(quarantined,Q)并最终康复(recovered,Rji)。中/重/危重型病例则需要住院(hospitalized,Hji),甚至转入重症加强护理病房[intensive care unit(ICU),Uji]治疗,直至康复或死亡(dead,Dji)。
|
| 图 1 上海市新型冠状病毒感染疫情预测的SEIR传染病动力学模型流程 |
模型的构建基于前提假设:①忽略人口自然出生和死亡的影响;②基于2019年上海市口岸入境数据估计入境人数,入境人员不再进行核酸检测或隔离;③疫情防控策略优化调整后,不再对新冠病毒感染者进行隔离,无症状感染者和轻型病例自愿居家隔离,保留戴口罩和保持社交距离等干预措施;④潜伏期人群属于无症状感染者,无症状感染者具有传染性;⑤暴露人群不具有传染性,隔离后的人群也不再具有传染性;⑥人群接种新冠病毒疫苗后可产生免疫保护,降低患病风险、减少重症和死亡率。
微分方程组见公式:

式中完成全程或加强针接种的人群的感染风险更低,为未接种疫苗人群的(1-VEji)倍。CM为基于上海市3-6月疫情数据估计的不同年龄组之间的接触矩阵。人群NPIs在模型中表现为传播系数(β)的影响。疫苗对人群的保护则通过感染后无症状感染者、轻型病例、中/重/危重型病例的比例参数η体现。通过微分方程可计算得到每日新增感染人数、有住院需求的感染人数和死亡人数等数据分析疫情规模发展。
(2) 参数设置结合参考文献和疫情数据等信息,模型的参数设置见表 1。根据下一代矩阵方法[14]和Omicron变异株的R0值为9.5[15],计算预测模型的β。
(3) 不同场景模拟假设对疫情发展规模和医疗卫生资源需求的影响① 新冠病毒疫苗接种情况:基于上海市疫情防控措施的实际情况(即无严格NPIs,保留戴口罩和维持社交距离等干预措施),针对新冠病毒疫苗接种情况,分别模拟实际情况(人群的全程接种率和加强针接种率分别为90%和45%)[23]和理想情况(人群的全程接种率及加强针接种率为90%)。②不同NPIs等级:假设在普通床位占用率达到30%时实施NPIs,模拟3个等级NPIs(无严格NPIs、仅关闭学校、关闭学校和工作场所)。③不同居家隔离意愿:假设居家隔离意愿较高是实际情况(≥70%的感染者愿意居家隔离),分别比较30%和60%的居家隔离意愿。④不同入境情况:基于疫情防控措施的实际情况,在研究期限内,模拟设置入境人数恢复至2019年水平的不同恢复时间,入境人数设置为2019年入境人数的50%、100%和150%的情况。
采用R 4.1.2软件,基于deSolve软件包进行模型构建和场景模拟,基于ggplot2软件包绘制不同场景下医疗卫生资源需求-时间曲线。
(5) 敏感性分析针对NPIs实施的不同阈值进行敏感性分析,模拟在普通床位占用率达到10%~90%时实施NPIs对新冠病毒感染疫情的发展规模和医疗资源需求变化的影响。针对不同参数设置值包括无症状感染者相比于临床病例的传播能力(φ)、普通病房病例转入ICU的概率(θH)、普通病房病例从住院到康复的速率(γH)和ICU病例从入住到康复/死亡的速率(γU)分别加/减50%进行敏感性分析。
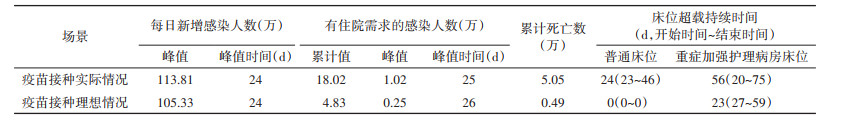
结果1. 上海市疫情发展规模和医疗卫生资源需求的模拟基本情况:在100 d的模拟期内,累计有住院需求的感染人数为18.02万人,每日新增感染人数的峰值时间为第24天(113.81万人);每日新增有住院需求的感染人数峰值为1.02万人。死亡人数占上海市人口总数的0.20%(5.05万)。普通床位与ICU床位均出现超载情况,超载时间分别为24 d和56 d,其中普通床位实时需求数的峰值超过5万张。见图 2,表 2。
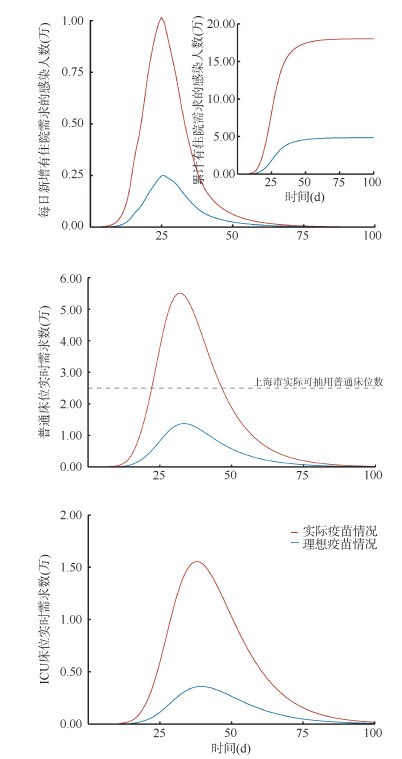
|
| 注:ICU: 重症加强护理病房每日新增感染人数和卫生资源需求的影响 图 2 上海市不同新型冠状病毒疫苗接种情况对 |
如果人群加强针接种率达到疫苗接种的理想情况(90%),相比于疫苗接种的实际情况,累计有住院需求的感染人数下降73.20%,死亡人数降低至0.49万人。普通床位不再出现超载现象,但是ICU床位的超载时间为23 d。见表 2。
本研究假设当普通床位占用率达到30%时,开始实施NPIs。与无严格NPIs相比,不同等级的NPIs如仅关闭学校或关闭学校和工作场所,可有效降低有住院需求感染人数,关闭学校和工作场所可将累计有住院需求的感染人数降至无严格NPIs的71.96%。见图 3。与无严格NPIs相比,仅关闭学校、关闭学校和工作场所可分别将普通床位需求数的峰值降低24.04%、37.73%,ICU床位需求数的峰值分别降低21.41%和34.59%,但仍不能避免床位需求数的超载情况。
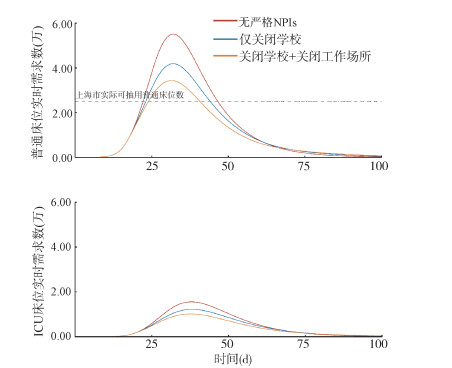
|
| 注:NPIs:非药物干预措施;ICU:重症加强护理病房 图 3 上海市非药物干预措施对每日新增新型冠状病毒感染人数和卫生资源需求的影响 |
实施NPIs的阈值的敏感性分析结果显示,在普通床位占用率较低时开始实施NPIs,每日新增感染人数、普通床位和ICU床位需求数的峰值均较低(图 4),随着NPIs实施时间的延后,则每日新增感染人数峰值和床位需求数均逐渐增加。
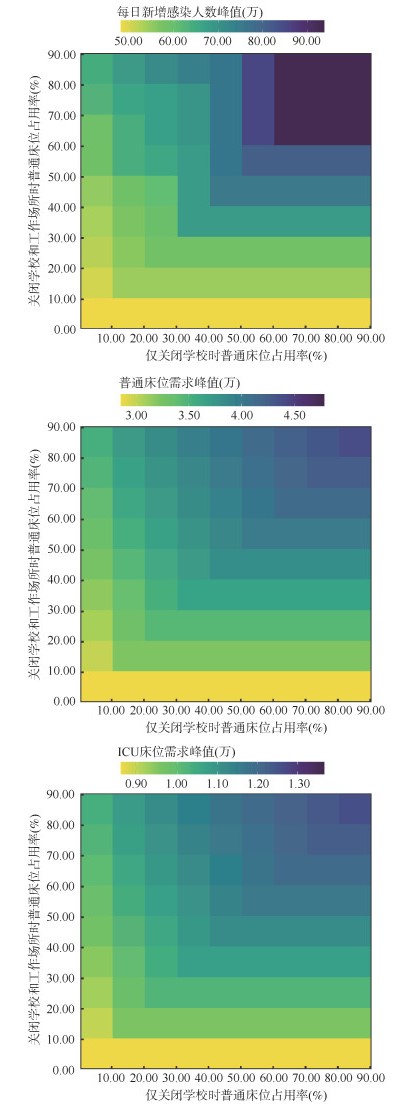
|
| 注:ICU:重症加强护理病房 图 4 上海市不同非药物干预措施实施阈值敏感性分析 |
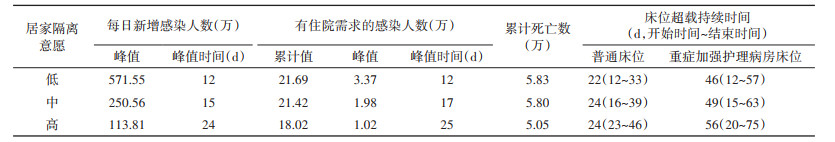
对于无症状感染者和轻型病例,若居家隔离意愿较高,则可降低每日新增感染人数和有住院需求感染人数及其峰值,并将高峰出现的时间推后,累计死亡人数由5.83万降低至5.05万,但若居家隔离意愿提高,则床位超载的持续时间增加(表 3)。
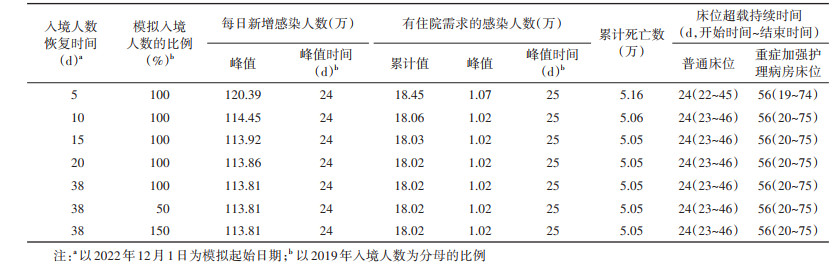
不同的入境人数恢复时间和模拟入境人数的比例(不同入境情况)对疫情发展规模及医疗卫生资源需求的影响较小。随着入境人数恢复时间的延后,每日新增感染人数峰值和累计有住院需求的感染人数降低,峰值时间和床位超载持续时间均无明显变化;在模拟起始日期第10~38天,入境人数恢复至2019年入境人数水平,每日新增感染人数峰值和累计有住院需求的感染人数的变化不明显;随着入境人数的增加,累计有住院需求的感染人数和峰值时间及床位超载持续时间均无明显变化。见表 4。
模拟φ、θH、γH和γU对新冠病毒传播和医疗资源需求变化的影响(图 5)可得,当φ减小50%,累计感染人数减少88.15%,当φ增加50%,累计感染人数增加27.48%;累计感染人数对θH、γH、γU的变化不敏感。普通床位需求数的峰值对γU和θH的变化不敏感,但是随着φ的增加而增加,随着γH的增加(住院时间缩短)而减小。ICU床位需求数的峰值随着φ、θH的增加而增加,随着γH、γU的增加(住院时间缩短)而减小。
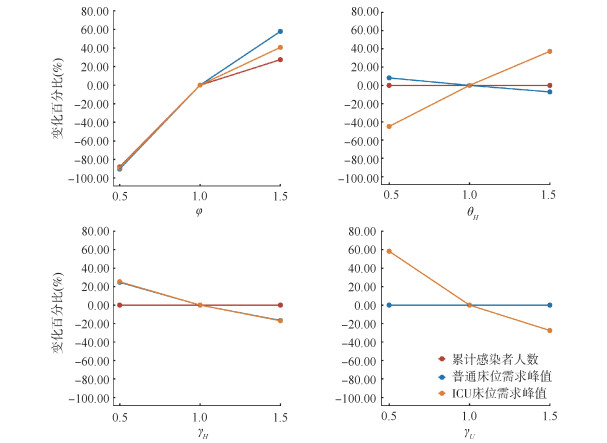
|
| 注:φ:无症状感染者相比于临床病例的传播能力;θH:中/重/危重型病例从普通病房转入重症加强护理病房的概率;γH:普通病房病例从住院到康复的速率;γU:重症加强护理病房病例从入住到康复/死亡的速率 图 5 重要参数对上海市累计新型冠状病毒感染人数和床位需求的敏感性分析 |
本研究构建的SEIR模型基于上海市新冠病毒流行特征,在新冠病毒疫苗接种和无严格NPIs的实际情况下,预测上海市疫情的发展规模和医疗卫生资源的需求。在100 d的模拟期内,累计有住院需求的感染人数为18.02万,新冠病毒感染病例的普通床位实时需求数的峰值超过5万张,普通床位实时需求数的峰值约占上海市卫生机构总床位数的34.16%(5.52万/16.15万)[24]。普通床位与ICU床位的超载时间分别为24 d和56 d。虽然预测的住院人数低于上海市卫生机构的总床位数,但2020年的统计数据显示,上海市的病床使用率达到82.83%[24]。因此,在新冠病毒疫苗接种和NPIs的实际情况下,上海市仍有可能出现医疗系统的资源过载。
本研究还分析了不同因素对新冠病毒感染疫情发展规模的影响。结果表明,提高新冠病毒疫苗接种率可显著降低有住院需求的感染人数和死亡人数,避免普通床位的超载,印证了新冠病毒疫苗对于因新冠病毒感染住院的良好保护效果[25-26],应继续推进新冠病毒疫苗加强针的接种工作。与不实施NPIs相比,仅关闭学校、关闭学校和工作场所可显著降低普通床位和ICU床位的需求数。不同NPIs实施阈值对于新冠病毒感染疫情的发展规模和医疗资源需求影响较大,应在普通床位占用率较低时开始实施NPIs,将感染人数和床位需求数控制在较低水平。提高居家隔离意愿可有效降低每日新增感染人数、死亡人数和床位需求数,推迟感染的高峰时间,但床位超载时间稍有增加。本研究还模拟了不同入境情况对疫情发展规模的影响,结果表明,新冠病毒感染疫情以本土传播为主,境外输入的感染人数和入境人数恢复的时间对疫情的发展规模和医疗卫生资源需求的影响较小。澳大利亚的研究表明,恢复国际旅行会导致本土传播感染者的增加[10],本研究与该研究结果不一致,可能由于相比上海市总人口数量,输入的感染人数较少,故引起的变化并不明显,并且入境人数恢复时间若处于感染人数的峰值之后,则对于整体疫情发展规模的影响也较小。
本研究基于不同年龄组的接触矩阵进行模型构建及参数估计,较好地考虑到了不同年龄组人群的易感程度、感染后的疾病进展和结局的差异。敏感性分析结果显示,φ对于累计感染人数和床位需求数的峰值影响较大,感染人数与床位需求数的峰值均随着φ的增加而增加。床位需求数的峰值主要与住院时长有关,普通床位需求数的峰值随着γH的增加,即住院时间缩短而减少,而ICU床位需求数的峰值同样随着住院时间缩短而减小。与其他研究相比,γH、γU的设置值处于平均水平[18, 27]。由于我国调整后的疫情防控措施实施时间较短,与英国相关研究相比,本研究设置的自愿居家隔离概率较高(均≥70%)[28],而且居家隔离意愿的提高可降低感染人数及床位需求数。
本研究存在局限性:①研究假设所有的死亡病例都发生在医院内,且死亡率保持不变,但当医疗系统不堪重负时,死亡率会升高;②模型尚未考虑疫情发展过程中部分参数的时依性特点,现实情况可能随实时传染系数波动,随疫苗保护效力衰减可能导致感染人数及床位需求数的增加;③模型数据有限,未能进行病床周转情况的估计;④模型所考虑的床位数均基于市级水平,假设所有医院对于新冠病毒感染病例收治能力相同,未精确到具体医院分级的情况,无法反映上海市医疗资源具体情况;⑤部分模型参数证据不足,新冠病毒的自然史等仍需进一步研究,且会随着新冠病毒的传代和变异而改变。
利益冲突 所有作者声明无利益冲突
作者贡献声明 王鑫钰:研究设计、论文撰写、数据分析、论文修改;张梦迪:研究设计、论文撰写、数据分析;朱文龙:研究设计、数据分析、审阅文章;刘芷希:研究设计、数据分析;王伟炳:审阅文章、指导、经费支持
| [1] |
World Health Organization. WHO coronavirus (COVID-19) dashboard [EB/OL]. (2023-01-24)[2023-01-25]. https://covid19.who.int/.
|
| [2] |
Jara A, Undurraga EA, González C, et al. Effectiveness of an inactivated SARS-CoV-2 vaccine in Chile[J]. N Engl J Med, 2021, 385(10): 875-884. DOI:10.1056/NEJMoa2107715 |
| [3] |
Atmar RL, Lyke KE, Deming ME, et al. Homologous and heterologous Covid-19 booster vaccinations[J]. N Engl J Med, 2022, 386(11): 1046-1057. DOI:10.1056/NEJMoa2116414 |
| [4] |
Mendez-Brito A, El Bcheraoui C, Pozo-Martin F. Systematic review of empirical studies comparing the effectiveness of non-pharmaceutical interventions against COVID-19[J]. J Infect, 2021, 83(3): 281-293. DOI:10.1016/j.jinf.2021.06.018 |
| [5] |
国务院应对新型冠状病毒感染疫情联防联控机制综合组. 关于印发对新型冠状病毒感染实施"乙类乙管"总体方案的通知[EB/OL]. (2022-12-26)[2023-01-24]. http://www.nhc.gov.cn/xcs/zhengcwj/202212/e97e4c449d7a475794624b8ea12123c6.shtml.
|
| [6] |
上海市口岸服务办公室. 2019年上海口岸主要数据统计表[EB/OL]. (2020-02-13)[2023-01-24]. https://kab.sww.sh.gov.cn/kafw/004009/004009001/20200213/ff27dcce-4dfe-49a4-827a-9b817098a2bd.html.
|
| [7] |
Wang K, Lu ZZ, Wang XM, et al. Current trends and future prediction of novel coronavirus disease (COVID-19) epidemic in China: a dynamical modeling analysis[J]. Math Biosci Eng, 2020, 17(4): 3052-3061. DOI:10.3934/mbe.2020173 |
| [8] |
魏永越, 卢珍珍, 杜志成, 等. 基于改进的SEIR+CAQ传染病动力学模型进行新型冠状病毒肺炎疫情趋势分析[J]. 中华流行病学杂志, 2020, 41(4): 470-475. Wei YY, Lu ZZ, Du ZC, et al. Fitting and forecasting the trend of COVID-19 by SEIR+CAQ dynamic model[J]. Chin J Epidemiol, 2020, 41(4): 470-475. DOI:10.3760/cma.j.cn112338-20200216-00106 |
| [9] |
Yu ZD, Zhu XL, Liu XT, et al. Reopening international borders without quarantine: contact tracing integrated policy against COVID-19[J]. Int J Environ Res Public Health, 2021, 18(14): 7494. DOI:10.3390/ijerph18147494 |
| [10] |
Hanly MJ, Churches T, Fitzgerald O, et al. The impact of re-opening the international border on COVID-19 hospitalisations in Australia: a modelling study[J]. Med J Aust, 2022, 216(1): 39-42. DOI:10.5694/mja2.51291 |
| [11] |
Jaouimaa FZ, Dempsey D, van Osch S, et al. An age-structured SEIR model for COVID-19 incidence in Dublin, Ireland with framework for evaluating health intervention cost[J]. PLoS One, 2021, 16(12): e0260632. DOI:10.1371/journal.pone.0260632 |
| [12] |
Kimathi M, Mwalili S, Ojiambo V, et al. Age-structured model for COVID-19: effectiveness of social distancing and contact reduction in Kenya[J]. Infect Dis Model, 2021, 6: 15-23. DOI:10.1016/j.idm.2020.10.012 |
| [13] |
Lee T, Kwon HD, Lee J. The effect of control measures on COVID-19 transmission in South Korea[J]. PLoS One, 2021, 16(3): e0249262. DOI:10.1371/journal.pone.0249262 |
| [14] |
Diekmann O, Heesterbeek JAP, Roberts MG. The construction of next-generation matrices for compartmental epidemic models[J]. J Roy Soc Interface, 2010, 7(47): 873-885. DOI:10.1098/rsif.2009.0386 |
| [15] |
Liu Y, Rocklöv J. The effective reproductive number of the Omicron variant of SARS-CoV-2 is several times relative to Delta[J]. J Travel Med, 2022, 29(3): taac037. DOI:10.1093/jtm/taac037 |
| [16] |
上海市统计局. 上海市第七次全国人口普查主要数据发布[EB/OL]. (2021-05-19)[2022-01-24]. https://tjj.sh.gov.cn/7rp-pcyw/20210519/1968a0983be04311b607deccf6c2988c.html.
|
| [17] |
Huang ZY, Xu SF, Liu JC, et al. Effectiveness of inactivated and Ad5-nCoV COVID-19 vaccines against SARS-CoV-2 Omicron BA. 2 variant infection, severe illness, and death[J]. BMC Med, 2022, 20(1): 400. DOI:10.1186/s12916-022-02606-8 |
| [18] |
Cai J, Deng XW, Yang J, et al. Modeling transmission of SARS-CoV-2 Omicron in China[J]. Nat Med, 2022, 28(7): 1468-1475. DOI:10.1038/s41591-022-01855-7 |
| [19] |
Deng XW, Yang J, Wang W, et al. Case fatality risk of the first pandemic wave of coronavirus disease 2019 (COVID-19) in China[J]. Clin Infect Dis, 2021, 73(1): e79-85. DOI:10.1093/cid/ciaa578 |
| [20] |
Ye LY, Li WF, Shao JS, et al. Fighting Omicron epidemic in China: real-world big data from Fangcang shelter hospital during the outbreak in Shanghai 2022[J]. J Infect, 2022, 85(4): 436-480. DOI:10.1016/j.jinf.2022.07.006 |
| [21] |
Takahashi K, Ishikane M, Ujiie M, et al. Duration of infectious virus shedding by SARS-CoV-2 Omicron variant-infected vaccinees[J]. Emerg Infect Dis, 2022, 28(5): 998-1001. DOI:10.3201/eid2805.220197 |
| [22] |
Ferguson NM, Laydon D, Nedjati-Gilani G, et al. Impact of non-pharmaceutical interventions (NPIs) to reduce COVID-19 mortality and healthcare demand[R]. London: Imperial College London, 2020. DOI: 10.25561/77482.
|
| [23] |
上海市人民政府新闻办公室. 上海举行新冠肺炎疫情防控工作新闻发布会(第113场)[EB/OL]. (2022-03-02)[2023-01-24]. http://www.scio.gov.cn/xwfbh/gssxwfbh/xwfbh/shanghai/Document/1721696/1721696.htm.
|
| [24] |
上海市统计局. 上海统计年鉴2021[M]. 北京: 中国统计出版社, 2021.
|
| [25] |
Tenforde MW, Patel MM, Ginde AA, et al. Effectiveness of severe acute respiratory syndrome coronavirus 2 messenger RNA vaccines for preventing coronavirus disease 2019 hospitalizations in the United States[J]. Clin Infect Dis, 2022, 74(9): 1515-1524. DOI:10.1093/cid/ciab687 |
| [26] |
Sheikh A, McMenamin J, Taylor B, et al. SARS-CoV-2 Delta VOC in Scotland: demographics, risk of hospital admission, and vaccine effectiveness[J]. Lancet, 2021, 397(10293): 2461-2462. DOI:10.1016/S0140-6736(21)01358-1 |
| [27] |
Abernethy GM, Glass DH. Optimal COVID-19 lockdown strategies in an age-structured SEIR model of Northern Ireland[J]. J Roy Soc Interface, 2022, 19(188): 20210896. DOI:10.1098/rsif.2021.0896 |
| [28] |
Moore S, Hill EM, Tildesley MJ, et al. Vaccination and non-pharmaceutical interventions for COVID-19: a mathematical modelling study[J]. Lancet Infect Dis, 2021, 21(6): 793-802. DOI:10.1016/S1473-3099(21)00143-2 |
 2023, Vol. 44
2023, Vol. 44