文章信息
- 樊诗琦, 严双琴, 朱贝贝, 李小真, 童娟, 李春刚, 曹慧, 伍晓艳, 谢亮亮, 魏兆莲, 陶芳标.
- Fan Shiqi, Yan Shuangqin, Zhu Beibei, Li Xiaozhen, Tong Juan, Li Chungang, Cao Hui, Wu Xiaoyan, Xie Liangliang, Wei Zhaolian, Tao Fangbiao
- 孕前BMI和妊娠期糖尿病对儿童脂肪重积聚时相提前的独立和联合效应
- Independent and combined effects of pre-pregnancy BMI and gestational diabetes on early adiposity rebound timing in children
- 中华流行病学杂志, 2022, 43(10): 1626-1631
- Chinese Journal of Epidemiology, 2022, 43(10): 1626-1631
- http://dx.doi.org/10.3760/cma.j.cn112338-20220429-00364
-
文章历史
收稿日期: 2022-04-29
2. 马鞍山市妇幼保健院, 马鞍山 243000
2. Maternal and Child Health Care Center of Ma'anshan, Ma'anshan 243000, China
脂肪重积聚(adiposity rebound,AR)是人类早期发育的生物学现象之一[1],通常儿童出生后BMI在1岁左右迅速增加,然后逐渐降低,在3~8岁期间出现最低值后发生第二次增长,这种BMI再次增长的现象称为AR。AR发生时的年龄称为AR时相,研究发现AR时相提前与肥胖[2]、女童月经初潮提前[3]、糖脂代谢异常[4]乃至其他重大健康问题[5]相关联。胎儿在妊娠期暴露于不良宫内环境可能会导致AR时相提前的发生,有证据显示孕前母亲体重状况[6]、妊娠期糖尿病[7](GDM)与儿童AR时相提前密切相关。本研究基于马鞍山优生优育队列,探讨孕前BMI、GDM与儿童AR时相提前的关联效应。
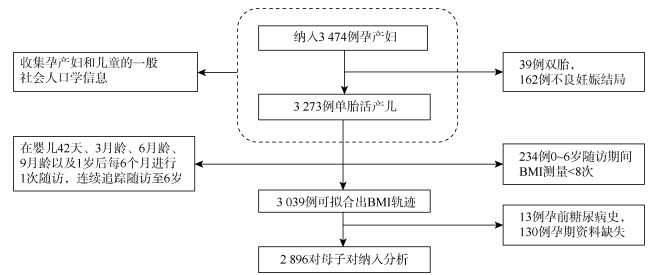
对象与方法1. 研究对象:将2013年5月至2014年9月在马鞍山市妇幼保健院建卡并计划在该医院产检及分娩的孕妇作为研究人群,纳入标准参见文献[8]。该队列共纳入3 474例孕产妇,排除标准见图 1,最终纳入2 896对母子对为研究对象。
|
| 图 1 研究对象纳入排除流程 |
2. 研究方法:采用问卷调查、体格检查及实验室检测等方法,获得孕妇人口学特征、孕前BMI、孕期血糖水平、孕期增重、儿童出生情况,在婴儿42天、3月龄、6月龄、9月龄以及1岁后每6个月进行一次随访,连续追踪随访至6岁,获得其身长/高和体重等信息。纳入研究的对象均签署知情同意书,本研究通过安徽医科大学伦理委员会审查(批准文号:20160082)。
3. 诊断标准:
(1)超重、肥胖判定标准:参照WS/T 428-2013成人体重判定[9]:将母亲孕前BMI分为体重不足(BMI < 18.5 kg/m2)、体重正常(18.5 kg/m2≤BMI < 24.0 kg/m2)、超重(24.0 kg/m2≤BMI < 28.0 kg/m2)以及肥胖(BMI≥28.0 kg/m2)。
(2)孕期增重诊断标准:根据2009年美国医学研究所新修订的孕期增重推荐值[10]:孕前BMI过低、正常、超重、肥胖相应的孕期适宜增重范围分别为12.5~18.0、11.5~16.0、7.0~11.5和5.0~9.0 kg,将孕期增重分为增重不足、增重适宜以及增重过度。
(3)GDM诊断标准:参照《妊娠合并糖尿病诊治指南(2014)》[11],服糖前及服糖后1、2 h,3项血糖诊断界值分别5.1、10.0、8.5 mmol/L,任何一项血糖值达到或超过上述界值即诊断为GDM。
(4)AR年龄的评价及判定标准:采用具有分式多项式函数的混合效应模型拟合每个儿童的BMI生长轨迹[12],使用分式多项式混合模型时,每个模型都有一个固定效应和一个随机效应,固定效应用以反映人口的平均趋势,随机效应反映个体异质性;赤池信息准则(Akaike information criterion,AIC)和贝叶斯信息准则(Bayesian information criterion,BIC)用来选择拟合最优的模型,AIC和BIC绝对值越小拟合效果越好;另外,似然比检验有统计学意义(P < 0.05)表明k类模型较k+1类模型优[13]。根据选择的最优模型,拟合每名儿童的BMI生长轨迹,采用分割的方法确定BMI函数曲线的最低点(即AR)。为了减小偏倚,规定BMI最小值与随后一次BMI差值≥0.1 kg/m2,若BMI最小值(Y1)与随后一次BMI值(Y2)的差值< 0.1 kg/m2,则将Y2作为最小值,比较Y2与随后一次BMI值Y3的差值,以此类推。本研究以AR发生年龄≤4岁作为AR时相提前的判定标准[14]。
4. 统计学分析:采用EpiData 3.1软件进行数据双录入,采用Stata 13.0软件绘制研究对象的BMI变化轨迹,采用SPSS 23.0软件进行统计学分析。基本特征比较中定量资料使用方差分析,定性资料采用χ2检验。调整母亲怀孕年龄、孕期增重、孕周、产次、儿童性别、出生体重、6月龄母乳喂养、文化程度和家庭人均月收入等混杂因素后,采用多因素logistic回归模型分析孕前BMI与妊娠期糖尿病对AR时相提前的影响。采用Andersson等[15]编制的Excel软件分析相加交互作用,将相乘模型、相加模型和回归模型结合分析孕前BMI与妊娠期糖尿病对AR时相提前影响是否存在交互作用。以P < 0.05为差异有统计学意义。
结果1. 基本情况:随访到的2 896名母亲中,怀孕年龄(26.66±3.63)岁,孕前体重不足、体重正常、超重和肥胖者分别占23.2%(672例)、66.4%(1 923例)、8.7%(251例)和1.7%(50例);GDM患病率为12.4%(360例)。随访到有身长/高和体重等资料的2 896名儿童中,男童占50.8%(1 470例)、女童占49.2%(1 426例),儿童AR年龄为(4.38±1.08)岁,AR时相提前的儿童占39.3%。本研究纳入与未纳入对象性别、母亲怀孕年龄、孕期增重、文化程度、家庭人均月收入之间均差异无统计学意义(P > 0.05)。
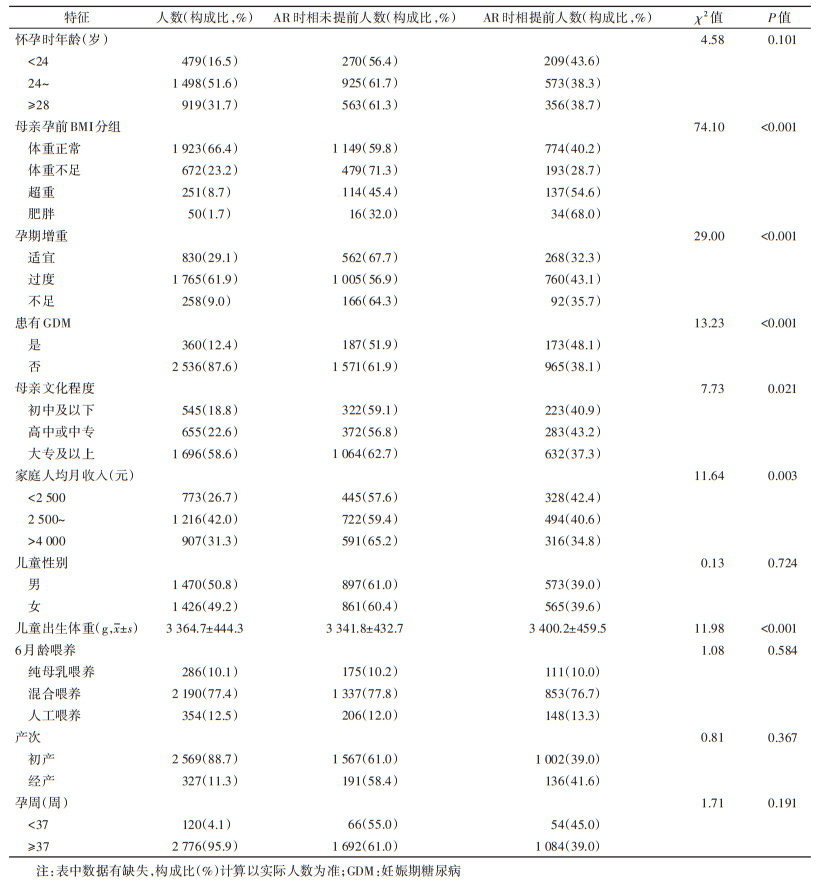
2. AR时相提前组与未提前组的基本特征比较:母亲孕前体重正常组、体重不足组、超重组和肥胖组中AR时相提前检出率分别为40.2%、28.7%、54.6%和68.0%;孕期患和未患有GDM组中AR时相提前检出率分别为48.1%、38.1%,均差异有统计学意义(P < 0.05)。儿童AR时相提前与母亲孕前BMI、孕期增重、患有GDM、母亲文化程度、家庭人均月收入、儿童出生体重以及有关(P < 0.05),而与母亲怀孕时年龄、儿童性别、6月龄母乳喂养、产次、孕周无统计学关联(P > 0.05)。见表 1。
3. 母亲孕前BMI和GDM与儿童AR时相提前的多因素logistic回归分析:控制母亲怀孕年龄、孕期增重、孕周、产次、儿童性别、出生体重、6月龄喂养、文化程度和家庭人均月收入混杂因素后,logistic回归分析结果显示,孕前超重(OR=1.67,95%CI:1.27~2.19)、孕前肥胖(OR=3.05,95%CI:1.66~5.56)以及孕期患有GDM(OR=1.40,95%CI:1.11~1.76)是儿童AR时相提前发生的危险因素,而孕前体重不足(OR=0.60,95%CI:0.49~0.73)则是儿童AR时相提前发生的保护因素。见表 2。
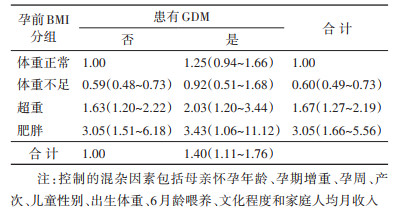
4. 母亲孕前BMI合并GDM与儿童AR时相提前的多因素logistic回归分析:控制母亲怀孕年龄、孕期增重、孕周、产次、儿童性别、出生体重、6月龄喂养、文化程度和家庭人均月收入混杂因素后,logistic回归分析结果显示,与母亲孕前超重/肥胖和孕期患有GDM的单独作用相比,母亲孕前超重合并GDM和母亲孕前肥胖合并GDM导致儿童AR时相提前的风险更高。见表 3。
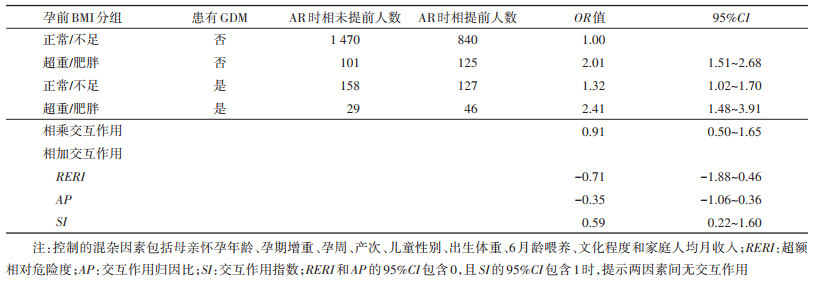
5. 母亲孕前BMI与GDM对儿童AR时相提前影响的交互作用:控制母亲怀孕年龄、孕期增重、孕周、产次、儿童性别、出生体重、6月龄喂养、文化程度和家庭人均月收入混杂因素后,相乘模型分析结果显示,孕前体重正常/不足与孕期患有GDM之间无交互作用,孕前超重/肥胖与孕期患有GDM之间无交互作用;相加模型分析结果显示,孕前体重正常/不足与孕期患有GDM之间无交互作用,孕前超重/肥胖与孕期患有GDM之间无交互作用。见表 4。
6. 敏感性分析:为使模型更加稳定,在剔除妊娠期高血压、子痫前期、妊娠期高血糖,调整早产史、流产史、父亲BMI及文化程度等协变量后,进行敏感性分析,结果与本研究结论一致。
讨论随着社会的发展和生活水平的提升,超重和肥胖的高流行率已经成为影响健康的重要因素。美国的一项大型人群队列研究显示母亲孕前超重、肥胖的检出率分别为26.25%、25.60%[16],加拿大的一项前瞻性社区妊娠队列研究显示育龄妇女超重、肥胖的检出率分别为23.6%、10.6%[17],韩国的一项调查研究显示,母亲孕前超重、肥胖的检出率分别为9.8%、8.5%[18]。而本研究孕前超重、肥胖发生率分别为8.7%、1.7%,远低于全球流行状况。本研究中,12.4%的妊娠期妇女患有GDM,略低于中国GDM总患病率为14.8%的Meta分析结果[19]。
本研究显示,孕前超重/肥胖、孕期患有GDM与AR时相提前密切相关,与母亲孕前体重正常且无GDM的儿童相比,孕前超重/肥胖、孕期患有GDM母亲的儿童发生AR时相提前的风险更高,这与国外相关研究结果一致。2016年,智利的一项队列研究发现,孕前较高的BMI是AR时相提前的独立危险因素(OR=1.07,95%CI:1.02~1.11)[6]。Hakanen等[7]对来自芬兰的6个出生队列研究进行分析,共获得6 906名从出生至12岁的儿童随访资料,研究显示与未患有GDM的母亲相比,孕期患有GDM母亲所生后代体重较高且AR发生年龄更早。
既往研究显示,孕前超重/肥胖妇女发生GDM的风险较正常体重妇女更高,孕期患有GDM的风险随着孕前BMI的增加而增加[20]。本研究中也发现,孕前超重、肥胖母亲患有GDM的风险高于体重正常组,母亲孕前超重/肥胖合并GDM较两者独立存在时子代发生AR时相提前的风险更大。然而本研究利用相乘模型和相加模型进一步研究发现,孕前BMI与孕期患有GDM对于儿童AR时相提前的发生均不存在交互作用,提示在统计学上,两者为儿童AR时相提前的独立影响因素,应同时干预这两个因素以降低儿童AR时相提前的发生。有研究表明,母亲肥胖和孕期患有GDM都可独立地影响与胎盘脂肪酸摄取和代谢相关的mRNA表达[21],从而可能影响儿童AR时相的发生。而孕前BMI与孕期患有GDM对于儿童AR时相提前的生物学交互作用,仍需要进一步探讨。从疾病预防和健康促进的角度来看,控制孕前BMI在合理范围,是减少孕期患有GDM和延缓儿童AR发生年龄的可预防因素。本研究突出了在生命早期针对可改变的因素来延缓AR的时机的必要性,尤其是受孕前超重/肥胖、GDM等不良妊娠暴露影响的高危人群。
本研究存在局限性。孕妇的孕前BMI是自我报告的,可能会与实际情况有一定差异。
利益冲突 所有作者声明无利益冲突
作者贡献声明 樊诗琦:数据整理、统计学分析、论文撰写;严双琴:研究指导、论文修改;朱贝贝、谢亮亮、魏兆莲:实验操作、采集数据;李小真:数据整理、统计学分析;童娟、曹慧:采集数据、数据整理;李春刚:统计学分析;伍晓艳:实验操作、数据整理;陶芳标:研究指导、论文修改、经费支持
| [1] |
Rolland-Cachera MF, Deheeger M, Bellisle F, et al. Adiposity rebound in children: a simple indicator for predicting obesity[J]. Am J Clin Nutr, 1984, 39(1): 129-135. DOI:10.1093/ajcn/39.1.129 |
| [2] |
Roche J, Quinart S, Thivel D, et al. Comparison between type A and type B early adiposity rebound in predicting overweight and obesity in children: a longitudinal study[J]. Br J Nutr, 2020, 124(5): 501-512. DOI:10.1017/S0007114520000987 |
| [3] |
Williams S, Dickson N. Early growth, menarche, and adiposity rebound[J]. Lancet, 2002, 359(9306): 580-581. DOI:10.1016/S0140-6736(02)07715-2 |
| [4] |
González L, Corvalán C, Pereira A, et al. Early adiposity rebound is associated with metabolic risk in 7-year-old children[J]. Int J Obes, 2014, 38(10): 1299-1304. DOI:10.1038/ijo.2014.97 |
| [5] |
Fonseca MJ, Moreira C, Santos AC. Adiposity rebound and cardiometabolic health in childhood: results from the Generation XXI birth cohort[J]. Int J Epidemiol, 2021, 50(4): 1260-1271. DOI:10.1093/ije/dyab002 |
| [6] |
Linares J, Corvalán C, Galleguillos B, et al. The effects of pre-pregnancy BMI and maternal factors on the timing of adiposity rebound in offspring[J]. Obesity, 2016, 24(6): 1313-1319. DOI:10.1002/oby.21490 |
| [7] |
Hakanen T, Saha MT, Salo MK, et al. Mothers with gestational diabetes are more likely to give birth to children who experience early weight problems[J]. Acta Paediatr, 2016, 105(10): 1166-1172. DOI:10.1111/apa.13468 |
| [8] |
葛星, 徐叶清, 黄三唤, 等. 妊娠期肝内胆汁淤积症对分娩结局影响的出生队列研究[J]. 中华流行病学杂志, 2016, 37(2): 187-191. Ge X, Xu YQ, Huang SH, et al. Intrahepatic cholestasis of pregnancy and fetal outcomes: a prospective birth cohort study[J]. Chin J Epidemiol, 2016, 37(2): 187-191. DOI:10.3760/cma.j.issn.0254-6450.2016.02.007 |
| [9] |
国家卫生和计划生育委员会. WS/T 428-2013成人体重判定[S]. 北京: 中国标准出版社, 2013. National Health Commission of the People's Republic of China. WS/T 428-2013 Criteria of weight for adults[S]. Beijing: Standards Press of China, 2013. |
| [10] |
Johnson J, Clifton RG, Roberts JM, et al. Pregnancy outcomes with weight gain above or below the 2009 institute of medicine guidelines[J]. Obstet Gynecol, 2013, 121(5): 969-975. DOI:10.1097/AOG.0b013e31828aea03 |
| [11] |
中华医学会妇产科学分会产科学组, 中华医学会围产医学分会妊娠合并糖尿病协作组. 妊娠合并糖尿病诊治指南(2014)[J]. 中华妇产科杂志, 2014, 49(8): 561-569. Obstetrics and Gynecology Group of Chinese Medical Association, Association of Diabetic Pregnancy Study Group of Perinatal Medicine of Chinese Medical Association. Diagnosis and treatment of gestational diabetes mellitus (2014)[J]. Chin J Obstet Gynecol, 2014, 49(8): 561-569. DOI:10.3760/cma.j.issn.0529-567x.2014.08.001 |
| [12] |
Wen XZ, Kleinman K, Gillman MW, et al. Childhood body mass index trajectories: modeling, characterizing, pairwise correlations and socio-demographic predictors of trajectory characteristics[J]. BMC Med Res Methodol, 2012, 12: 38. DOI:10.1186/1471-2288-12-38 |
| [13] |
Feng ZD, McCulloch CE. On the likelihood ratio test statistic for the number of components in a normal mixture with unequal variances[J]. Biometrics, 1994, 50(4): 1158-1162. DOI:10.2307/2533453 |
| [14] |
Koyama S, Ichikawa G, Kojima M, et al. Adiposity rebound and the development of metabolic syndrome[J]. Pediatrics, 2014, 133(1): e114-119. DOI:10.1542/peds.2013-0966 |
| [15] |
Andersson T, Alfredsson L, Källberg H, et al. Calculating measures of biological interaction[J]. Eur J Epidemiol, 2005, 20(7): 575-579. DOI:10.1007/s10654-005-7835-x |
| [16] |
Liu BY, Xu GF, Sun YB, et al. Association between maternal pre-pregnancy obesity and preterm birth according to maternal age and race or ethnicity: a population-based study[J]. Lancet Diabetes Endocrinol, 2019, 7(9): 707-714. DOI:10.1016/S2213-8587(19)30193-7 |
| [17] |
Vinturache A, Moledina N, McDonald S, et al. Pre-pregnancy Body Mass Index (BMI) and delivery outcomes in a Canadian population[J]. BMC Pregnancy Childbirth, 2014, 14: 422. DOI:10.1186/s12884-014-0422-y |
| [18] |
Choi SK, Park IY, Shin JC. The effects of pre-pregnancy body mass index and gestational weight gain on perinatal outcomes in Korean women: a retrospective cohort study[J]. Reprod Biol Endocrinol, 2011, 9: 6. DOI:10.1186/1477-7827-9-6 |
| [19] |
Gao CH, Sun X, Lu L, et al. Prevalence of gestational diabetes mellitus in mainland China: a systematic review and meta-analysis[J]. J Diabetes Investig, 2019, 10(1): 154-162. DOI:10.1111/jdi.12854 |
| [20] |
Kim SY, Hong SY, Kim Y, et al. Maternal pre-pregnancy body mass index and the risk for gestational diabetes mellitus in women with twin pregnancy in South Korea[J]. Taiwan J Obstet Gynecol, 2021, 60(5): 863-868. DOI:10.1016/j.tjog.2021.07.014 |
| [21] |
Segura MT, Demmelmair H, Krauss-Etschmann S, et al. Maternal BMI and gestational diabetes alter placental lipid transporters and fatty acid composition[J]. Placenta, 2017, 57: 144-151. DOI:10.1016/j.placenta.2017.07.001.4-014-0422-y |
 2022, Vol. 43
2022, Vol. 43