文章信息
- 江河, 唐凯玲, 黄精华, 李剑军, 梁淑家, 刘玄华, 庞贤武, 朱秋映, 陈欢欢, 周月姣, 蓝光华.
- Jiang He, Tang Kailing, Huang Jinghua, Li Jianjun, Liang Shujia, Liu Xuanhua, Pang Xianwu, Zhu Qiuying, Chen Huanhuan, Zhou Yuejiao, Lan Guanghua
- 基于分子网络的广西壮族自治区HIV传播热点和跨地区传播特征分析
- Analysis of HIV transmission hotspots and characteristics of cross-regional transmission in Guangxi Zhuang Autonomous Region based on molecular network
- 中华流行病学杂志, 2022, 43(9): 1423-1429
- Chinese Journal of Epidemiology, 2022, 43(9): 1423-1429
- http://dx.doi.org/10.3760/cma.j.cn112338-20220424-00339
-
文章历史
收稿日期: 2022-04-24
人口流动是促进HIV传播的重要因素[1],我国跨省流动的HIV感染者数量逐年增加[2]。有研究报道,HIV可能通过暗娼和注射吸毒者经中国云南省和越南北部传入我国广西壮族自治区(广西)[3]。2006年,异性性传播超过注射吸毒传播成为广西主要的HIV传播途径,男男性传播比例也快速增加[4]。目前,广西HIV感染者数量和病死率均位居全国前列。虽然精准干预和源头治理是减少HIV二代传播的关键,但快捷的交通和便利的社交软件导致高风险人群的社交圈越来越隐匿,驱动HIV快速传播的热点和关键人群难以被及时发现[5]。近年来,分子网络广泛应用于推断跨时空和人群的传播关系[6]。本研究尽可能地收集HIV pol区序列,构建分子网络,推断传播热点和关键人群,为开展深入的社会网络调查和制订精准干预策略提供依据。
资料与方法1. 资料来源:
(1)HIV pol区序列:①广西CDC于1997- 2020年开展的HIV分子流行病学调查;②洛斯阿拉莫斯实验室HIV数据库(LANL HIV database,https://www.hiv.lanl.gov/)中发表的全球HIV pol区序列。纳入标准:①位于HIV HXB2CG标准参考毒株(Accession:K03455)相对位置2 253~3 554 nt;②长度≥1 000 nt;③混合碱基比例 < 5%;④有采样时间和采样地点。排除标准:①LANL HIV database标注“存在疑问”(problematic);②1例HIV感染者存在多条不同时间点检测的序列时,保留最早的一条;③可疑污染序列。最终获得5 996条广西序列和165 534条非广西序列。
(2)流行病学资料:①现场调查;②中国疾病预防控制信息系统艾滋病防治基本信息系统。
2. 构建分子网络:从LANL HIV database下载HIV主要亚型参考株序列,与样本序列合并。使用MAFFT 7软件自动比对序列并使用BioEdit 7.1.9软件检查和微调。使用IQ-Tree 1.6.12软件拟合GTR+G模型以最大似然法构建系统进化树。使用FigTree 1.4.3软件分析分子簇和校验值,若样本序列与参考株序列聚集成簇且校验值≥85.0%,判断样本序列与参考株序列亚型一致。使用HIV-TRACE工具以Tamura-Nei 93模型计算成对基因距离(GD)。以0.5% 作为GD阈值,首先使用广西序列构建广西分子网络,推断近期出现的快速传播关系[7]。然后从165 534条非广西序列中筛选出与广西序列GD < 0.5%者作为背景序列,加入广西序列中,构建HIV跨地区传播分子网络。
3. 相关定义:将HIV跨地区传播分子网络中广西序列间的连接定义为省内连接,背景序列与广西序列的连接定义为跨地区连接。根据2条序列只能产生1条连接,但1条序列可与另外2条序列生2条连接的原则计算连接数。广西外某地区与广西的连接比例为该地区与广西的累积连接数除以广西外全部地区与广西的合计连接数。连接单位用边数表示。
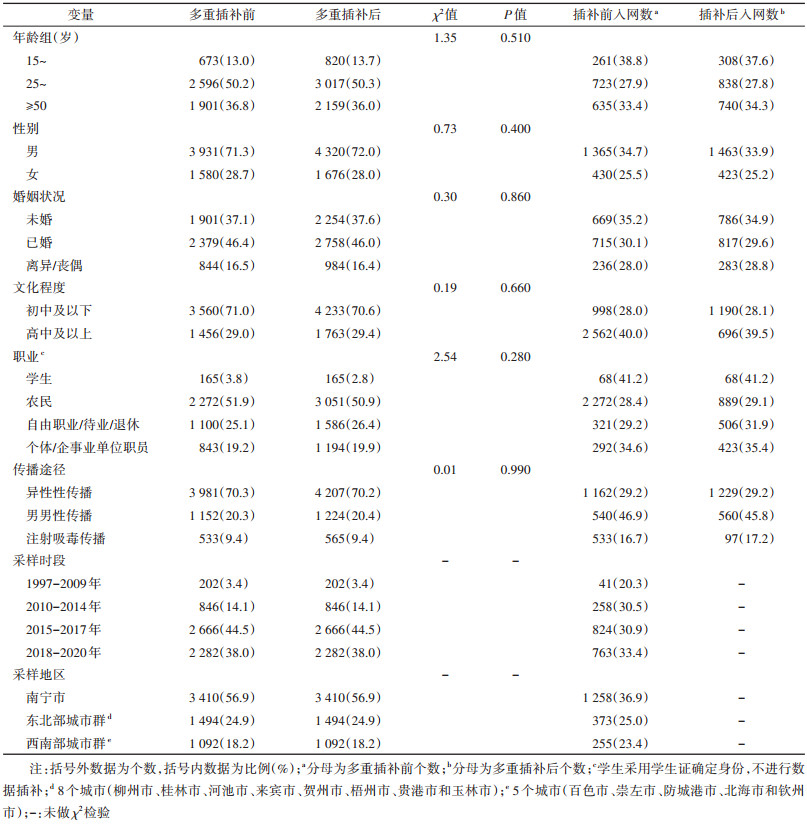
4. 统计学分析:采用logistic回归模型用于分析进入广西分子网络和跨地区连接的影响因素。为避免缺失值导致回归系数的95%CI过大,首先借助R 4.0.3“mice”包拟合链式方程多重插补[8],再对插补后的数据集进行敏感性分析,保证插补前后各自变量的分布差异无统计学意义。以P < 0.05为差异有统计学意义。
结果1. 基本特征:获得5 996条广西HIV pol区序列,每条序列代表 1名HIV感染者。敏感性分析显示插补前后各自变量的分布差异无统计学意义。多重插补后,研究对象以25~49岁(50.3%)、男性(72.0%)、已婚(46.0%)、初中及以下文化程度(70.6%)、农民(50.9%)和异性性传播(70.2%)为主(表 1)。CRF01_AE为广西主要的HIV亚型(3 104,51.8%)、其他为CRF07_BC(1 221,20.4%)、CRF08_BC(979,16.3%)、独特重组型(442,7.3%)、CRF55_01B(221,3.7%)和B型(25,0.4%)和C型(4,0.1%)。进入广西HIV传播热点分子网络的序列比例为31.5%(1 886/5 996)。
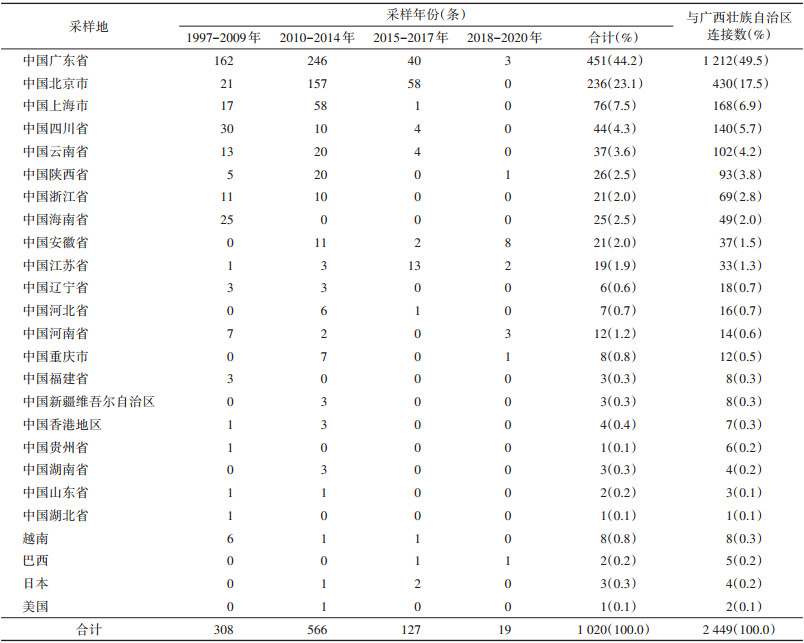
2. 分子网络结构特征:广西HIV传播热点分子网络由1 886条广西序列组成,共形成531个分子簇,包含序列的M(Q1,Q3)为2(2,3)条。最大的分子簇由76条CRF07_BC序列组成,分别来自南宁市(66,86.9%),梧州市(4,5.3%),柳州市(2,2.6%),桂林市、玉林市、百色市、贺州市(各1,分别占1.3%)。在165 534条非广西序列中,共有1 020条序列与广西序列GD < 0.5%。加入这些序列后,进入HIV跨地区传播分子网络的广西序列增加至2 009条,分子簇增加至595个,包含序列M(Q1,Q3)为2(2,3)条。最大的分子簇由694条CRF07_BC序列组成,分别来自我国的广东省(262,37.8%)、广西(124,17.9%)、北京市(123,17.7%)、上海市(60,8.6%)、四川省(30,4.3%)、陕西省(21,3.0%)、云南省(16,2.3%)、安徽省(11,1.6%)、江苏省(10,1.5%)、重庆市(8,1.2%)、浙江省(8,1.2%)、河北省(4,0.6%)、辽宁省(4,0.6%)、河南省(3,0.4%)、新疆维吾尔自治区(2,0.3%)、贵州省(1,0.1%)、香港特别行政区(1,0.1%)和山东省(1,0.1%),日本(3,0.4%)和巴西(2,0.3%)。
3. 跨地区连接特征:在HIV跨地区传播分子网络中,合计连接数为5 062条边,省内连接占51.6%(2 613/5 062)、国内连接占48.0%(2 430/5 062),国际连接占0.4%(19/5 062)。
与广西跨地区连接的主要省份为广东省(49.5%)、北京市(17.5%)、上海市(6.9%)、四川省(5.7%)、云南省(4.2%)、陕西省(3.8%)、浙江省(2.8%)、海南省(2.0%)、安徽省(1.5%)、江苏省(1.3%),其余地区与广西连接比例均 < 1.0%。仅4个国家与我国广西连接:越南(0.3%)、巴西(0.2%)、日本(0.2%)和美国(0.1%)(表 2)。
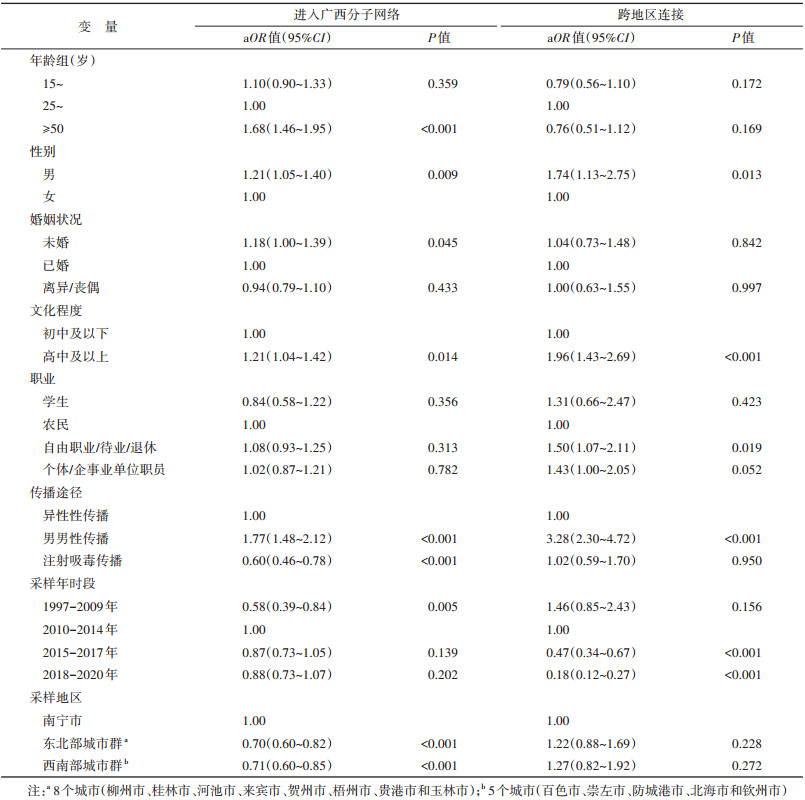
4. 进入广西HIV传播热点分子网络和跨地区连接的影响因素:进入广西HIV传播热点分子网络风险较高的影响因素包括≥50岁(相比于25~49岁,aOR=1.68,95%CI:1.46~1.95)、男性(相比于女性,aOR=1.21,95%CI:1.05~1.40)、未婚(相比于已婚,aOR=1.18,95%CI:1.00~1.39)、高中及以上文化程度(相比于初中及以下,aOR=1.21,95%CI:1.04~1.42)和男男性传播(相比于异性性传播,aOR=1.77,95%CI:1.48~2.12)。跨地区连接风险较高的影响因素包括男性(相比于女性:aOR=1.74,95%CI:1.13~2.75),高中及以上文化程度(相比于初中及以下,aOR=1.96,95%CI:1.43~2.69)、自由职业/待业/退休(相比于农民,aOR=1.50,95%CI:1.07~2.11)、男男性传播(相比于异性性传播,aOR=3.28,95%CI:2.30~4.72)。见表 3。
本研究收集了广西HIV pol区序列及其相应的流行病学信息,并纳入已发表的全球序列,较全面地推断广西HIV传播热点和跨地区传播特征。根据HIV的突变速率,使用GD阈值为1.5%、1.0%和0.5%构建HIV分子网络可分别推断7~9年、4~6年和2~3年的传播关系。1.5%GD阈值适合于使用小样本寻找潜在传染源[9],0.5%GD阈值适合于在较全面的样本中推断近期出现的快速传播簇[7]。我国推荐使用0.5%GD阈值预警HIV快速传播。全国层面的研究表明,0.5%GD阈值能准确识别跨省分子网络中的关键分子簇[10]。另外,我国HIV流行重组型数量繁多[11],重组易产生独特重组型。0.5%GD阈值有利于避免错误连接[12]。
本研究发现,CRF01_AE为广西主要的HIV亚型。先前的研究认为,CRF01_AE于1990年代从泰国、越南等地区传入我国[13-14]。且东南亚国家与我国广西交流密切,可能与广西HIV传播热点密切关联。在本研究中,国际连接仅占0.4%。由于本研究从公共数据库检索到的境外序列有限,加上使用0.5%GD阈值构建分子网络,在一定程度上低估了长期的跨境传播风险。但近期在我国广西和越南北部开展现场调查和采集序列构建系统进化树的研究显示,两地仅异性性传播和注射吸毒传播人群存在少量传播关系[15]。目前,异性性传播为广西HIV的主要传播途径,且广西各市间以及广西与国内地区交通更便捷。Li等[16]使用贝叶斯离散地理学分析的研究显示,在2012-2013年使用BED捕获酶联免疫法检测发现的229名新近感染者中,93%感染的HIV来源于本地流行毒株。这表明近期快速传播的热点位于广西境内。多因素分析显示,≥50岁、男性、高中及以上文化程度和男男性传播进入广西HIV传播热点分子网络的风险较高。近年来的HIV疫情报告显示,上述人群新报告比例呈上升趋势[4],他们是防控HIV本地传播的重点人群。
在HIV跨地区传播分子网络中,与广西连接的3个主要地区分别是广东省、北京市和上海市。多因素分析结果显示,相比于进入广西HIV传播热点分子网络,男性(aOR值为1.21比1.74)、高中及以上文化程度(aOR值为1.21比1.96)和男男性传播(aOR值为1.77比3.28)的跨地区连接风险较大。虽然分子网络能推断传播关系,却无法判断个体感染方向。先前全国层面的分析显示,HIV感染者首次随访后从广东省流出的比例高于其他地区,且广西是广东省的主要流出地[17]。另外,男性、文化程度较高、男男性传播人群较易发生跨省流动[17]。Chen等[18]对广西220例男男性传播人群开展的贝叶斯离散地理学分析结果显示,76.8%感染来源于本地流行毒株,7.7%来源于广东省,2.7%来源于上海市。本研究还发现,自由职业/待业/退休人群跨地区连接的风险是农民的1.50倍。由于跨地区流动的HIV感染者接受随访、CD4+T淋巴细胞检测、抗病毒治疗和实现病毒抑制的比例均低于非流动HIV感染者[17, 19],建议加强该人群及其同伴的HIV检测和抗病毒治疗关怀协调机制。
本研究存在局限性。依据HIV进化亲缘性构建分子网络推断的结果可能与真实世界存在偏差。乌干达拉卡伊区开展的随访研究通过分析流动人口HIV感染率和地区特征推断传播热点[1]。我国基于首次和后续随访数据推断HIV感染者跨省流动特征[18]。因此,精准推断传播热点和传播特征需要上述两种来源数据的分析结果相互验证。
综上所述,广西存在HIV传播热点,与国内地区组成复杂的跨地区传播网络。后续研究应针对分子网络分析推断的高风险人群开展社会网络调查,及时识别隐匿传播链,减少HIV二代传播。
利益冲突 所有作者声明无利益冲突
作者贡献声明 江河:研究设计、采集数据、统计分析、论文撰写;唐凯玲:采集数据、统计分析、论文撰写;黄精华、李剑军、梁淑家、刘玄华、庞贤武、朱秋映、陈欢欢、周月姣:采集数据、统计分析;蓝光华:研究设计、论文修改、经费支持
| [1] |
Kate Grabowski M, Lessler J, Bazaale J, et al. Migration, hotspots, and dispersal of HIV infection in Rakai, Uganda[J]. Nat Commun, 2020, 11(1): 976. DOI:10.1038/s41467-020-14636-y |
| [2] |
甘秀敏, 马烨, 豆智慧, 等. 中国2011-2015年跨省流动HIV/AIDS免费抗病毒治疗现状及影响因素分析[J]. 中华流行病学杂志, 2018, 39(9): 1234-1238. Gan XM, Ma Y, Dou ZH, et al. Current status of national free antiretroviral therapy in interprovincial migrating people living with HIV/AIDS and influencing factors, China, 2011-2015[J]. Chin J Epidemiol, 2018, 39(9): 1234-1238. DOI:10.3760/cma.j.issn.0254-6450.2018.09.017 |
| [3] |
Chen HH, Luo LH, Pan SW, et al. HIV epidemiology and prevention in Southwestern China: trends from 1996-2017[J]. Curr HIV Res, 2019, 17(2): 85-93. DOI:10.2174/1570162x17666190703163838 |
| [4] |
蓝光华, 沈智勇, 葛宪民, 等. 广西艾滋病综合防控与管理工作回顾与展望[J]. 中国临床新医学, 2021, 14(10): 951-955. Lan GH, Shen ZY, Ge XM, et al. Review and prospect of comprehensive prevention, control and management of acquired immune deficiency syndrome in Guangxi[J]. Chin J New Clin Med, 2021, 14(10): 951-955. DOI:10.3969/j.issn.1674-3806.2021.10.01 |
| [5] |
江河, 冯毅, 邵一鸣. HIV传播网络分析方法及测量指标研究进展[J]. 中华流行病学杂志, 2022, 43(1): 123-127. Jiang H, Feng Y, Shao YM. Progress in research of HIV transmission network analysis methods and metrics[J]. Chin J Epidemiol, 2022, 43(1): 123-127. DOI:10.3760/cma.j.cn112338-20211116-00888 |
| [6] |
Han XX, Zhao B, An MH, et al. Molecular network-based intervention brings us closer to ending the HIV pandemic[J]. Front Med, 2020, 14(2): 136-148. DOI:10.1007/s11684-020-0756-y |
| [7] |
Oster AM, France AM, Panneer N, et al. Identifying clusters of recent and rapid HIV transmission through analysis of molecular surveillance data[J]. J Acquir Immune Defic Syndr, 2018, 79(5): 543-550. DOI:10.1097/qai.0000000000001856 |
| [8] |
Austin PC, White IR, Lee DS, et al. Missing data in clinical research: a tutorial on multiple imputation[J]. Can J Cardiol, 2020, 37(9): 1322-1331. DOI:10.1016/j.cjca.2020.11.010 |
| [9] |
Rhee SY, Magalis BR, Hurley L, et al. National and international dimensions of human immunodeficiency virus-1 sequence clusters in a northern California clinical cohort[J]. Open Forum Infect Dis, 2019, 6(4): ofz135. DOI:10.1093/ofid/ofz135 |
| [10] |
Gan MZ, Zheng S, Hao JJ, et al. Spatiotemporal patterns of CRF07_BC in China: a population-based study of the HIV strain with the highest infection rates[J]. Front Immunol, 2022, 13: 824178. DOI:10.3389/fimmu.2022.824178 |
| [11] |
Hao JJ, Zheng S, Gan MZ, et al. Changing proportions of HIV-1 subtypes and transmitted drug resistance among newly diagnosed HIV/AIDS individuals-China, 2015 and 2018[J]. China CDC Wkly, 2021, 3(53): 1133-1138. DOI:10.46234/ccdcw2021.251 |
| [12] |
Jiang H, Lan GH, Zhu QY, et al. Nonstudent young men put students at high risk of HIV acquisition in Guangxi, China: a phylogenetic analysis of surveillance data[J]. Open Forum Infect Dis, 2022, 9(3): ofac042. DOI:10.1093/ofid/ofac042 |
| [13] |
Feng Y, He X, Hsi JH, et al. The rapidly expanding CRF01_AE epidemic in China is driven by multiple lineages of HIV-1 viruses introduced in the 1990s[J]. AIDS, 2013, 27(11): 1793-1802. DOI:10.1097/QAD.0b013e328360db2d |
| [14] |
Li XG, Liu HZ, Liu L, et al. Tracing the epidemic history of HIV-1 CRF01_AE clusters using near-complete genome sequences[J]. Sci Rep, 2017, 7(1): 4024. DOI:10.1038/s41598-017-03820-8 |
| [15] |
梁冰玉. 广西和越南北部HIV-1分子流行病学及耐药研究[D]. 南宁: 广西医科大学, 2018. Liang BY. HIV-1 molecular epidemiology and drug resistance in Guangxi and Northern Vietnam[D]. Nanning: Guangxi Medical University, 2018. |
| [16] |
Li JJ, Feng Y, Shen ZY, et al. HIV-1 transmissions among recently infected individuals in southwest china are predominantly derived from circulating local strains[J]. Sci Rep, 2018, 8(1): 12831. DOI:10.1038/s41598-018-29201-3 |
| [17] |
韩晶, 李健, 臧春鹏, 等. 我国2016-2018年报告HIV/AIDS首次随访后的跨省流动情况和抗病毒治疗效果分析[J]. 中华流行病学杂志, 2021, 42(1): 126-130. Han J, Li J, Zang CP, et al. Analysis of inter-provincial movement and the effect of antiretroviral therapy of HIV/AIDS cases after first follow up in China, 2016-2018[J]. Chin J Epidemiol, 2021, 42(1): 126-130. DOI:10.3760/cma.j.cn112338-20200603-00805 |
| [18] |
Chen Y, Shen ZY, Feng Y, et al. HIV-1 subtype diversity and transmission strain source among men who have sex with men in Guangxi, China[J]. Sci Rep, 2021, 11(1): 8319. DOI:10.1038/s41598-021-87745-3 |
| [19] |
韩晶, 汤后林, 李健, 等. 中国2011-2015年艾滋病病毒感染者及艾滋病患者随访检测及其流动情况分析[J]. 中华流行病学杂志, 2018, 39(6): 732-738. Han J, Tang HL, Li J, et al. Programs on mobility, status of follow-up and CD4+T cell testing among people living with HIV/AIDS, in China 2011-2015[J]. Chin J Epidemiol, 2018, 39(6): 732-738. DOI:10.3760/cma.j.issn.0254-6450.2018.06.008 |
 2022, Vol. 43
2022, Vol. 43