文章信息
- 晋聪, 郝海昀, 陈文鑫, 王婷, 李雁笛, 扆琳珠, 冯永亮, 王素萍.
- Jin Cong, Hao Haiyun, Chen Wenxin, Wang Ting, Li Yandi, Yi Linzhu, Feng Yongliang, Wang Suping
- 外周血单个核细胞TLR3信号通路活化在重组乙型肝炎表面抗原免疫应答中的作用
- Effect of activation of Toll-like receptor signaling pathway of peripheral blood mononuclear cell in recombinant hepatitis B surface antigen immune response
- 中华流行病学杂志, 2022, 43(4): 560-565
- Chinese Journal of Epidemiology, 2022, 43(4): 560-565
- http://dx.doi.org/10.3760/cma.j.cn112338-20210714-00547
-
文章历史
收稿日期: 2021-07-14
全球约有2.57亿慢性HBV感染者[1]。预防HBV感染的重要措施是接种乙型肝炎(乙肝)疫苗,但仍有5%~10%的个体免疫后体内HBsAb达不到保护性水平[2-3]。Toll样受体3(TLR3)是一种常见的与天然免疫密切相关的病原模式识别受体,其与配体双链RNA(dsRNA)结合后,可激活天然免疫并诱导特异性免疫,增强机体的免疫水平[4-8]。聚肌苷酸-聚胞苷酸(Poly Ⅰ:C)是一种人工合成的dsRNA,作为TLR3激动剂已广泛应用于体内外研究。既往研究发现,Poly Ⅰ:C联合治疗性乙肝疫苗可通过活化TLR3进而有效地清除小鼠体内的HBV DNA[9],其与铝佐剂联合后可提高小鼠腺病毒载体乙肝疫苗特异性抗体的产生[10]。本课题组前期研究显示,乙肝疫苗免疫强应答婴儿TLR3蛋白表达量高于无/弱应答婴儿,体外实验显示活化脐血单个核细胞中TLR3可改善其乙肝疫苗免疫应答效果[11]。以上研究均提示TLR3在乙肝疫苗免疫应答过程中发挥重要作用。外周血单个核细胞(PBMC)是免疫细胞的集合体,可以反映机体的免疫功能,且PBMC中树突状细胞(DC)、T淋巴细胞广泛表达TLR3信号通路相关蛋白。因此本研究以健康献血者的PBMC为研究对象,用Poly Ⅰ:C活化PBMC中TLR3信号通路后,用高纯度重组HBsAg(rHBsAg)处理PBMC模拟重组乙肝疫苗接种,通过分析DC及T、B淋巴细胞亚群比例变化反映机体对rHBsAg的免疫应答,结合典型相关分析研究TLR3信号通路在rHBsAg免疫应答中作用的分子机制,为乙肝疫苗无/弱应答机制研究提供新思路。
材料与方法1. 细胞来源:收集13名健康献血者的新鲜外周血,将制备血液制品中滤除的白细胞回收,经密度梯度离心法获得PBMC。研究对象均签署知情同意书,本研究经山西医科大学伦理委员会批准(批准文号:2015LL073)。
2. PBMC培养、分组及Poly Ⅰ:C、rHBsAg处理:调整PBMC浓度为1.2×106个/ml,用含10%胎牛血清、1%青霉素和链霉素、1%谷氨酰胺和88%的RPMI 1640培养基于37 ℃、5% CO2细胞培养箱中常规培养18 h后,将健康献血者的PBMC分为两组,每组设3个平行样,分别给予56 μl终浓度为40 µg/ml的Poly Ⅰ:C(Sigma-Alorich公司)(Poly Ⅰ:C组)及等量PBS(对照组)处理,48 h后收集部分细胞检测PBMC TLR3信号通路活化状态,在活化(Poly Ⅰ:C组)/未活化(对照组)TLR3信号通路后,采用26 μl终浓度为2 µg/ml的rHBsAg(Abcam公司)处理两组PBMC 72 h,检测PBMC中各免疫细胞比例,评估PBMC rHBsAg免疫应答情况。
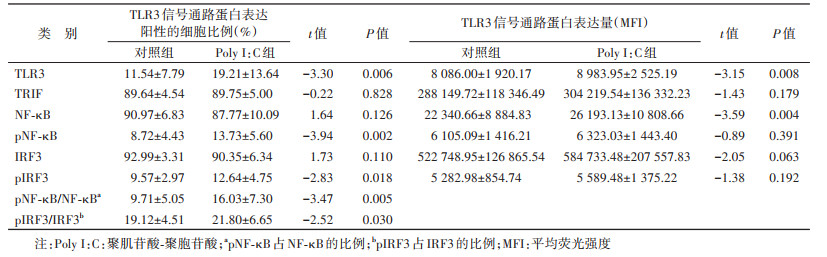
3. TLR3信号通路的活化状态:采用流式细胞术检测TLR3信号通路中TLR3、TRIF、NF-κB和磷酸化NF-κB(pNF-κB)、IRF3和磷酸化IRF3(pIRF3)6个蛋白的表达,包括蛋白阳性细胞百分比和蛋白表达量,后者用平均荧光强度(mean fluorescence intensity,MFI)表示,反映TLR3信号通路的活化情况。
(1)TLR3、TRIF蛋白检测:各管细胞加100 μl IC Fixation Buffer,室温避光孵育30 min,1 ml 1×Permeabilization Buffer洗2次,重悬细胞后各管分别加入TLR3-PE(eBioscience公司)、TRIF-PE(BD公司)及同型抗体,室温避光孵育30 min,1 ml 1×Permeabilization Buffer洗2次后重悬上机。
(2)NF-κB和pNF-κB、IRF3和pIRF3蛋白检测:每管细胞加0.5 ml 4%的多聚甲醛,室温孵育10 min,PBS洗2次,630 μl -20 ℃甲醇重悬细胞后4 ℃孵育30 min,PBS洗2次,重悬细胞后各管分别加NF-κB-APC、IRF3-APC(R & D公司)、pNF-κB- PE、pIRF3-PE(CST公司)及同型抗体,室温避光孵育30 min,PBS洗2次后重悬上机。
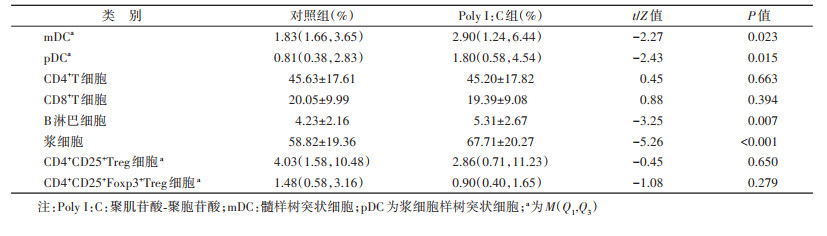
4. PBMC rHBsAg免疫应答情况:采用流式细胞术检测PBMC中髓样树突状细胞(mDC)和浆细胞样树突状细胞(pDC)、CD4+T细胞和CD8+T细胞、B细胞和浆细胞、CD4+CD25+Treg细胞和CD4+ CD25+foxp3+Treg细胞所占比例,反映PBMC对rHBsAg的免疫应答相关免疫细胞活化情况。
(1)DC细胞、T细胞、B细胞检测:各管细胞加入相应抗体(DC抗体:Lin-FITC、HLA-DR- PerCP-Cyanine5.5、CD123-APC、CD11c-PE;T细胞抗体:CD3-FITC、CD4-PE、CD8-APC;B细胞抗体:CD3-FITC、CD19-PerCP-Cyanine5.5、CD27-PE、CD38-APC及同型抗体,eBioscience公司),室温避光孵育30 min,PBS洗2次后重悬上机。DC细胞及其亚型的鉴别:首先根据Lin鉴别出Lin-细胞,再根据HLADR/CD11c鉴别mDC细胞、根据HLA-DR/CD123鉴别pDC细胞;T细胞及其亚型的鉴别:根据CD3/CD4鉴别CD3+CD4+T细胞、根据CD3/CD8鉴别CD3+CD8+T细胞;B细胞及其亚型鉴别:根据CD3/CD19鉴别B细胞,再根据CD27/CD38鉴别B细胞中的浆细胞。
(2)Treg细胞检测:各管细胞分别加入CD4-FITC、CD25-PE及同型抗体(eBioscience公司),室温避光孵育30 min,PBS洗2次,重悬细胞后加1 ml Foxp3 Fixation/Permeabilization working solution,室温避光孵育30 min,1 ml 1×Permeabilization Buffer洗2次,重悬细胞后各管分别加入Foxp3-APC及同型抗体(eBioscience公司),室温避光孵育30 min,1 ml 1×Permeabilization Buffer洗2次后重悬上机。Treg细胞的鉴别:首先根据CD4鉴别出CD4+细胞,再根据CD4/CD25鉴别出CD4+CD25+Treg、根据CD4/CD25/Foxp3鉴别出CD4+CD25+Foxp3+Treg。
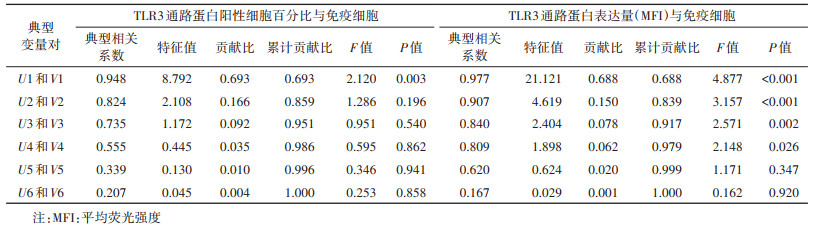
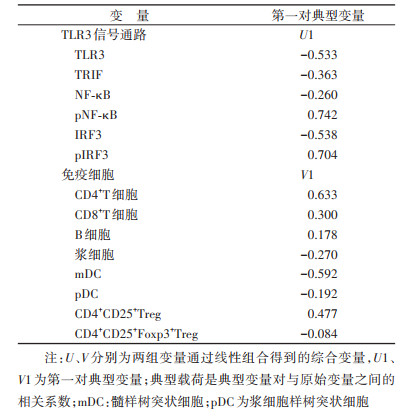
5. 统计学分析:流式细胞术数据采用CytExpert软件分析,采用Excel 2016软件建立数据库,采用SPSS 23.0软件分析数据,服从正态分布的定量资料采用x±s描述,不服从正态分布的定量资料采用M(Q1,Q3)描述。采用配对t检验对服从正态分布的定量资料进行组间比较,不服从正态分布时采用配对资料的符号秩和检验。采用典型相关分析,以PBMC rHBsAg免疫应答相关细胞作为典型相关分析的一组原始变量,TLR3信号通路蛋白阳性细胞百分比、蛋白表达量分别作为典型相关分析的另一组原始变量,分别分析两组原始变量间的相关性。两组原始变量通过线性组合,得到单个综合变量U和V,U1和V1为第一对典型变量,相关程度最大,R1为第一典型相关系数,用来表示两组变量的相关性,以此类推。典型载荷是原始变量与典型变量对之间的相关系数,是反映原始变量提供信息量多少的指标,其绝对值越大说明该原始变量与典型变量之间的相关关系越强,在典型变量中的代表程度越大。以P < 0.05为差异有统计学意义。
结果1. Poly Ⅰ:C活化PBMC TLR3信号通路蛋白情况:Poly Ⅰ:C组TLR3蛋白阳性细胞百分比(19.21%)、pNF-κB阳性细胞百分比(13.73%)及其占NF-κB的比例(16.03%)、pIRF3阳性细胞百分比(12.64%)及其占IRF3的比例(21.80%)均显著高于对照组(分别为11.54%、8.72%、9.71%、9.57%、19.12%)(P < 0.05);TLR3蛋白表达量及NF-κB的表达量(MFI分别为8 983.95和26 193.13)均显著高于对照组(MFI分别为8 086.00和22 340.66)(P < 0.05),TRIF、pNF-κB、IRF3、pIRF3的表达量高于对照组(P > 0.05)。见表 1。以上结果提示Poly Ⅰ:C可以活化PBMC中TLR3/TRIF/NF-κB和TLR3/TRIF/IRF3信号通路。
2. TLR3信号通路活化促进PBMC rHBsAg免疫应答:经rHBsAg处理后,Poly Ⅰ:C组PBMC中mDC(2.90%)、pDC(1.80%)、B淋巴细胞(5.31%)和B细胞中浆细胞(67.71%)比例均高于对照组(分别为1.83%、0.81%、4.23%、58.82%),差异有统计学意义(P < 0.05);CD4+T细胞、CD8+T细胞、CD4+CD25+Treg细胞和CD4+CD25+Foxp3+Treg细胞比例在两组间的差异无统计学意义(P > 0.05)。见表 2。提示活化TLR3信号通路可以促进PBMC中DC和B淋巴细胞的成熟活化,促进PBMC rHBsAg的免疫应答。
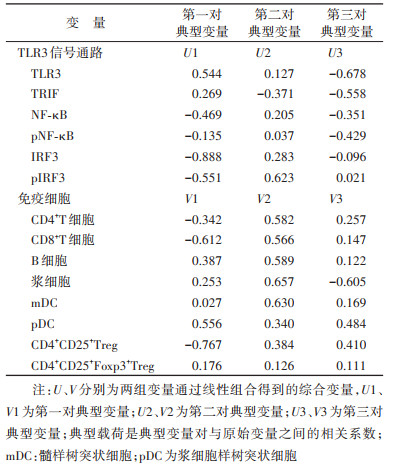
3. TLR3信号通路蛋白与PBMC rHBsAg免疫应答相关免疫细胞间存在典型相关:TLR3信号通路蛋白与PBMC rHBsAg免疫应答相关免疫细胞之间的关系错综复杂,为了更加全面地反映两组指标之间的相关性,使两组变量的信息更加充分地表达,本研究对两组指标进行了典型相关分析。结果显示,TLR3信号通路蛋白阳性细胞百分比和蛋白表达量与免疫细胞之间均存在典型相关。在蛋白阳性细胞百分比上,TLR3信号通路与免疫细胞的第一典型相关系数为0.948,P=0.003,特征值的贡献比为0.693。见表 3。进一步典型载荷分析结果显示,TLR3信号通路蛋白阳性细胞百分比与免疫细胞相关主要表现在pNF-κB、pIRF3和CD4+T细胞的相关,即pNF-κB和pIRF3升高可能会引起CD4+T细胞比例升高。见表 4。在蛋白表达水平上,TLR3信号通路与免疫细胞的第一、二、三典型相关系数分别为0.977、0.907、0.840(P < 0.05);且前3对典型变量的特征值累计贡献比达到0.917。见表 3。对前3对典型变量的典型载荷进行分析,第1对典型变量的典型载荷分析结果显示,IRF3蛋白表达量与CD4+CD25+Treg细胞正相关,第2对典型变量的典型载荷分析结果显示,pIRF3蛋白表达量与浆细胞和mDC正相关;第3对典型变量的典型载荷分析结果显示,TLR3蛋白表达量与浆细胞比例正相关。见表 5。以上结果提示,TLR3信号通路相关蛋白与mDC、浆细胞、CD4+T细胞、CD4+CD25+Treg细胞比例相关。
乙肝疫苗接种是预防HBV感染的重要措施,TLR3是连接天然免疫和特异性免疫的桥梁,既往研究显示,TLR3在乙肝疫苗免疫应答中发挥重要作用,但TLR3及其下游信号通路在乙肝疫苗免疫应答中的作用机制尚不清楚。本研究发现,Poly Ⅰ:C处理PBMC后活化TLR3/TRIF/NF-κB和TLR3/TRIF/IRF3信号通路,进而促进DC的成熟,诱导CD4+T细胞免疫反应,促进B细胞的成熟分化,增强PBMC对rHBsAg的免疫应答,提示TLR3信号通路在乙肝疫苗免疫应答过程中发挥重要作用,Poly Ⅰ:C可能作为乙肝疫苗的佐剂,促进抗原提呈细胞发挥功能,诱导细胞免疫和体液免疫,提高乙肝疫苗免疫应答水平。
TLR3由细胞外dsRNA激活,既往研究表明,TLR3与配体dsRNA结合后可募集下游含TIR结构域诱导的TRIF,促进TLR3与TRIF的结合,诱导IFN-β的分泌[12-13],TRIF激活后可促进下游的NF-κB和IRF3磷酸化进而发挥作用,NF-κB磷酸化后可上调细胞因子和趋化因子等基因的转录和表达,诱发炎症反应和抗病毒反应等[14];IRF3磷酸化后诱导IFN-β及IFN调控基因的表达,从而增强免疫细胞的募集和激活[15]。Poly Ⅰ:C是一种体外合成的dsRNA,可作为TLR3激动剂应用于体内外研究。在本研究中,使用Poly Ⅰ:C处理PBMC后,TLR3、TRIF和pNF-κB、pIRF3蛋白阳性细胞百分比及其表达量均有不同程度升高,表明Poly Ⅰ:C作为TLR3激动剂,可活化TLR3/TRIF/NF-κB和TLR3/TRIF/IRF3信号通路。因此,本研究采用Poly Ⅰ:C活化PBMC中TLR3信号通路,进一步分析TLR3信号通路活化后在rHBsAg免疫应答中的作用。
目前,关于TLR3活化在乙肝疫苗免疫应答中的研究多集中于治疗性乙肝疫苗,Poly Ⅰ:C联合治疗性乙肝疫苗可通过活化TLR3进而有效地清除HBV DNA[9, 16]。而关于TLR3在健康者乙肝疫苗免疫应答中的研究较少,一项针对广西壮族自治区汉族儿童的研究发现,TLR3基因rs13126816位点等位基因A可能是汉族儿童初次乙肝疫苗免疫低应答的影响因素[17];Chuai等[10]在动物实验中发现,Poly Ⅰ:C与铝佐剂联合后可增强CD4+T细胞和CD8+T细胞应答,提高小鼠腺病毒载体乙肝疫苗特异性抗体的产生。另外,有研究者发现,活化TLR3可以增强HIV疫苗和流感疫苗等疫苗的免疫应答,Longhi等[18]在体外及动物实验中发现,活化TLR3可刺激Ⅰ型干扰素的分泌,促进DC成熟和CD4+T细胞反应,从而增强机体对HIV Gag蛋白疫苗的免疫应答;一项体外实验结果显示,活化TLR3可以增强T细胞依赖性B细胞激活,从而增强B细胞功能并促进其向浆细胞分化,增强对流感疫苗的免疫应答[19]。rHBsAg是重组乙肝疫苗的主要成分,是一种胸腺依赖性抗原,被DC摄取并处理后以p-MHC复合物的形式表达于表面,再与特异性CD4+T细胞结合,从而激活MHCⅡ类限制性T细胞,然后分化为Th1和Th2类辅助性T细胞,激活特异性B细胞并诱导其分化为浆细胞分泌HBsAb[20]。本研究中在Poly Ⅰ:C活化TLR3信号通路后使用rHBsAg处理PBMC,结果显示,mDC、pDC、B细胞及B细胞中浆细胞比例升高,且典型相关分析结果显示,TLR3信号通路相关蛋白不仅与mDC、浆细胞比例相关,还与CD4+T细胞比例相关,说明TLR3信号通路活化能够提高DC比例,促进CD4+T细胞的激活,提高B细胞及浆细胞比例,使PBMC对rHBsAg免疫应答水平有所升高。
综上所述,Poly Ⅰ:C能够活化TLR3/TRIF/NF-κB和TLR3/TRIF/IRF3信号通路,促进NF-κB和IRF3磷酸化,进而促进DC的成熟,诱导CD4+T细胞免疫反应,促进B细胞成熟并分化为浆细胞,增强PBMC对rHBsAg的免疫应答。初步阐释了TLR3信号通路活化后增强PBMC rHBsAg免疫应答的分子机制,为改善乙肝疫苗的免疫效果提供了新视角,也为Poly Ⅰ:C用作乙肝疫苗佐剂提供了新思路。
利益冲突 所有作者声明无利益冲突
作者贡献声明 晋聪:分析/解释数据、统计学分析、论文撰写;郝海昀:酝酿和设计实验、实施研究;陈文鑫、王婷:采集数据;李雁笛、扆琳珠:实施研究;冯永亮:酝酿和设计实验、研究指导、论文修改;王素萍:酝酿和设计实验、研究指导、论文修改、经费支持
| [1] |
Naggie S, Lok AS. New therapeutics for Hepatitis B: the road to cure[J]. Annu Rev Med, 2021, 72: 93-105. DOI:10.1146/annurev-med-080119-103356 |
| [2] |
Cardell K, Akerlind B, Sällberg M, et al. Excellent response rate to a double dose of the combined hepatitis A and B vaccine in previous nonresponders to hepatitis B vaccine[J]. J Infect Dis, 2008, 198(3): 299-304. DOI:10.1086/589722 |
| [3] |
王斌, 许喜喜, 温海秀, 等. HBsAg阳性母亲所生婴儿乙型肝炎疫苗无/弱应答的影响因素研究[J]. 中华流行病学杂志, 2017, 38(7): 911-915. Wang B, Xu XX, Wen HX, et al. Influencing factors for non/low-response to hepatitis-B vaccine in infants of HBsAg positive mothers[J]. Chin J Epidemiol, 2017, 38(7): 911-915. DOI:10.3760/cma.j.issn.0254-6450.2017.07.013 |
| [4] |
Akira S, Takeda K, Kaisho T. Toll-like receptors: critical proteins linking innate and acquired immunity[J]. Nat Immunol, 2001, 2(8): 675-680. DOI:10.1038/90609 |
| [5] |
Pifferi C, Fuentes R, Fernández-Tejada A. Natural and synthetic carbohydrate-based vaccine adjuvants and their mechanisms of action[J]. Nat Rev Chem, 2021, 5(3): 197-216. DOI:10.1038/s41570-020-00244-3 |
| [6] |
Sharma S, Tenoever BR, Grandvaux N, et al. Triggering the interferon antiviral response through an IKK-related pathway[J]. Science, 2003, 300(5622): 1148-1151. DOI:10.1126/science.1081315 |
| [7] |
Zang R, Lian H, Zhong X, et al. ZCCHC3 modulates TLR3-mediated signaling by promoting recruitment of TRIF to TLR3[J]. J Mol Cell Biol, 2020, 12(4): 251-262. DOI:10.1093/jmcb/mjaa004 |
| [8] |
Tjwa ETTL, van Oord GW, Biesta PJ, et al. Restoration of TLR3-activated myeloid dendritic cell activity leads to improved natural killer cell function in chronic hepatitis B virus infection[J]. J Virol, 2012, 86(8): 4102-4109. DOI:10.1128/JVI.07000-11 |
| [9] |
Zhao HJ, Han QJ, Wang G, et al. Poly Ⅰ: C-based rHBVvac therapeutic vaccine eliminates HBV via generation of HBV-specific CD8+ effector memory T cells[J]. Gut, 2019, 68(11): 2032-2043. DOI:10.1136/gutjnl-2017-315588 |
| [10] |
Chuai X, Chen H, Wang W, et al. Poly(Ⅰ: C)/alum mixed adjuvant priming enhances HBV subunit vaccine-induced immunity in mice when combined with recombinant adenoviral-based HBV vaccine boosting[J]. PLoS One, 2013, 8(1): e54126. DOI:10.1371/journal.pone.0054126 |
| [11] |
张睿君, 扆琳珠, 武佳欣, 等. TLR3对乙型肝炎疫苗无弱应答婴儿脐血单个核细胞Th1/Th2型细胞因子的影响[J]. 中华疾病控制杂志, 2020, 24(6): 711-715, 722. Zhang RJ, Yi LZ, Wu JX, et al. The effects of TLR3 up-regulation on Th1/Th2 cytokines in CBMCs of infants with non/hypo response to hepatitis B vaccine[J]. Chin J Dis Control Prev, 2020, 24(6): 711-715, 722. DOI:10.16462/j.cnki.zhjbkz.2020.06.018 |
| [12] |
Glavan TM, Pavelic J. The exploitation of Toll-like receptor 3 signaling in cancer therapy[J]. Curr Pharm Des, 2014, 20(42): 6555-6564. DOI:10.2174/1381612820666140826153347 |
| [13] |
Matsumoto M, Seya T. TLR3:interferon induction by double-stranded RNA including poly(Ⅰ: C)[J]. Adv Drug Deliv Rev, 2008, 60(7): 805-812. DOI:10.1016/j.addr.2007.11.005 |
| [14] |
D'Atri LP, Etulain J, Rivadeneyra L, et al. Expression and functionality of Toll-like receptor 3 in the megakaryocytic lineage[J]. J Thromb Haemost, 2015, 13(5): 839-850. DOI:10.1111/jth.12842 |
| [15] |
Hu JX, Song DL, Luo GH, et al. Activation of Toll like receptor 3 induces spermatogonial stem cell apoptosis[J]. Cell Biochem Funct, 2015, 33(6): 415-422. DOI:10.1002/cbf.3133 |
| [16] |
Wu J, Huang SM, Zhao XL, et al. Poly(Ⅰ: C) treatment leads to interferon-dependent clearance of hepatitis B virus in a hydrodynamic injection mouse model[J]. J Virol, 2014, 88(18): 10421-10431. DOI:10.1128/JVI.00996-14 |
| [17] |
李海, 吕应楠, 杨庆利, 等. TLR基因多态性对广西汉族儿童乙型肝炎疫苗初次免疫应答水平的影响[J]. 中华疾病控制杂志, 2019, 23(4): 397-401, 411. Li H, Lv YN, Yang QL, et al. Effect of TLR gene polymorphisms on primary immune response to hepatitis B vaccine in Han children of Guangxi[J]. Chin J Dis Control Prev, 2019, 23(4): 397-401, 411. DOI:10.16462/j.cnki.zhjbkz.2019.04.006 |
| [18] |
Longhi MP, Trumpfheller C, Idoyaga J, et al. Dendritic cells require a systemic type Ⅰ interferon response to mature and induce CD4+ Th1 immunity with poly Ⅰ: C as adjuvant[J]. J Exp Med, 2009, 206(7): 1589-1602. DOI:10.1084/jem.20090247 |
| [19] |
Weir GM, Karkada M, Hoskin D, et al. Combination of Poly Ⅰ: C and Pam3CSK4 enhances activation of B cells in vitro and boosts antibody responses to protein vaccines in vivo[J]. PLoS One, 2017, 12(6): e0180073. DOI:10.1371/journal.pone.0180073 |
| [20] |
Moser M, Leo O. Key concepts in immunology[J]. Vaccine, 2010, 28 Suppl 3: C2-13. DOI:10.1016/j.vaccine.2010.07.022 |
 2022, Vol. 43
2022, Vol. 43