文章信息
- 吴双胜, 张姣姣, 孙瑛, 任正勇, 窦相峰, 张莉, 段玮, 马春娜, 杨鹏, 庞星火.
- Wu Shuangsheng, Zhang Jiaojiao, Sun Ying, Ren Zhengyong, Dou Xiangfeng, Zhang Li, Duan Wei, Ma Chunna, Yang Peng, Pang Xinghuo
- 一起可能经气溶胶传播的新型冠状病毒Delta变异株聚集性疫情调查
- Survey of possible aerosol transmission of a COVID-19 epidemic caused by 2019-nCoV Delta variant
- 中华流行病学杂志, 2022, 43(3): 305-309
- Chinese Journal of Epidemiology, 2022, 43(3): 305-309
- http://dx.doi.org/10.3760/cma.j.cn112338-20211208-00961
-
文章历史
收稿日期: 2021-12-08
2. 北京市疾病预防控制中心全球健康中心办公室/北京市预防医学研究中心,北京 100013;
3. 北京市疾病预防控制中心办公室/北京市预防医学研究中心,北京 100013
2. Office of Global Health Center, Beijing Center for Disease Prevention and Control/Beijing Research Center for Preventive Medicine, Beijing 100013, China;
3. Central Office, Beijing Center for Disease Prevention and Control/Beijing Research Center for Preventive Medicine, Beijing 100013, China
新型冠状病毒(新冠病毒)不断发生进化和变异,产生多种病毒变异株,如Alpha(B.1.1.7)、Beta(B.1.351)、Gamma(P.1)、Delta(B.1.617.2)和Omicron(B.1.1.529)等[1]。其中Delta变异株于2020年10月在印度发现,2021年4月在全球范围迅速传播和流行,7月已成为全球主导毒株[2]。由于该毒株载量高、传播力强、代际间隔短、传播速度快等流行病学特征[3],与既往其他毒株相比,Delta变异株更易发生气溶胶传播,给新型冠状病毒肺炎(新冠肺炎)疫情防控带来诸多挑战[4]。本研究旨在对一起可能经气溶胶传播的Delta变异株聚集性疫情进行感染来源调查,分析其流行特征和传播链,为今后新冠肺炎疫情防控提供参考依据。
对象与方法1. 研究对象:2021年11月1日,北京市昌平区报告一起新冠病毒Delta变异株导致的家庭聚集性疫情,感染来源不明确。研究对象为该家庭聚集性疫情的全部5例新冠病毒感染者,对其进行感染来源调查。
2. 研究方法:
(1)相关定义:①确诊病例、无症状感染者、密切接触者(密接)、密接的密接(次密)及临床分型:见《新型冠状病毒肺炎防控方案(第八版)》[5];②风险点位:确诊病例发病前14 d至隔离治疗前、无症状感染者核酸检测阳性前14 d至隔离治疗前到访的地点。
(2)流行病学调查:通过流行病学调查和大数据技术,对5例新冠病毒感染者进行活动轨迹核查,对活动轨迹涉及的风险点位进行密接判定,并对全部密接和环境进行采样检测。流行病学调查方法依据《新型冠状病毒肺炎防控方案(第八版)》[5]。
(3)实验室检测:①应用实时荧光PCR进行新冠病毒核酸检测(双试剂检测),主要针对新冠病毒基因组中开放读码框1ab(ORF1ab)和核壳蛋白N。Ct值常用于新冠病毒载量的定量,Ct值越高载量越低,Ct值越低载量越高,根据Ct值高低和发病日期可提示病程[6]。②应用全基因组测序技术对阳性人员和环境标本进行测序,测序结果与近期输入病例和本土病例序列进行比对。实验室检测流程和结果判定依据《新型冠状病毒肺炎防控方案(第八版)》[5]。
(4)感染来源:考虑病例发病时间、排毒周期、接触时间、接触方式、接触地点,对流行病学调查、大数据分析比对和基因测序结果进行分析,明确该起疫情的感染来源,梳理病例之间的传播链。感染来源调查技术路线与北京市顺义区、大兴区局部地区等其他新冠肺炎聚集性疫情近似[7-8]。
3. 统计学分析:使用WPS Office软件进行数据录入、整理和绘图。采用描述性流行病学方法,对本起聚集性疫情相关病例的时间、地区和人群分布、流行病学史、风险点位涉及的密接和环境核酸检测结果、阳性标本基因序列进行描述,进而确定疫情的感染来源和传播链。
结果1. 疫情概况:2021年10月31日,北京市昌平区某社区在风险人群主动筛查标本中,发现1份10混1口咽拭子标本为新冠病毒核酸阳性,当日采集10人及其同住人员鼻咽拭子。11月1日,检出其中1人及其家庭成员4人为核酸阳性,其余均为阴性,随即对病例所在社区进行封控管理、全员核酸检测。11月2日,病例所在社区升级为中风险地区。11月16日,病例所在社区14 d内无新增病例,降为低风险地区,按管控区继续7 d管控。11月23日,全员核酸检测均为阴性,全部管控措施解除。
此次聚集性疫情未发生社区续发病例,共报告5例新冠病毒感染者,均通过人群主动筛查发现,分别为病例A(首发病例,为某外省病例的次密)、A的妻子(B)、A的母亲(C)、A的女儿(D)、A的儿子(E)。病例A~C均接种2剂新冠肺炎灭活疫苗,病例D、E未接种疫苗。临床分型为普通型2例,轻型3例,无重型、危重型和死亡病例。
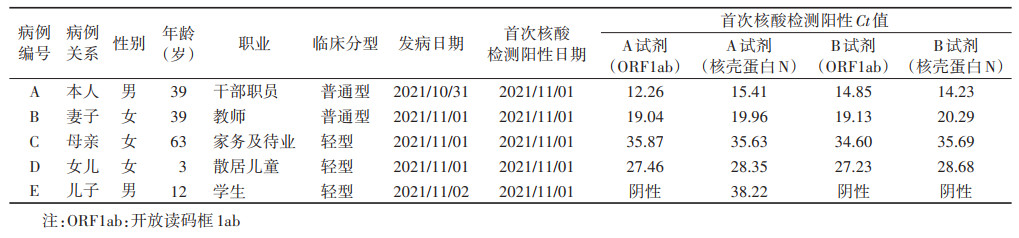
2. 流行病学特征:5例新冠病毒感染者来自同一家庭,家庭成员全部发病,病例A为指示病例和首发病例,病例B~E为续发病例。病例A~E发病时间分别为2021年10月31日、11月1日、11月1日、11月1日和11月2日,首次检出阳性时间均为11月1日,报告时间均为11月2日。综合分析首次核酸检测阳性Ct值和发病时间,推测病例A发病时间最早,B其次,C~E发病时间较晚。见表 1。
3. 感染来源:
(1)指示病例、首发病例:病例A,确诊病例,男,39岁,在京居住地为昌平区某社区,某公司干部职员,与病例B~E共同居住。2021年4月1日和4月22日完成第一和第二剂次新冠肺炎灭活疫苗接种。自述于10月31日出现咳嗽、发热37.3 ℃等症状。11月1日新冠病毒核酸检测阳性,当日转至定点医院。11月2日,定点医疗机构确诊其为新冠肺炎普通型。
病例A近14 d内无出京史。由于其同事T为某外省病例的密接,病例A被作为次密于10月22-27日在同一隔离酒店单间集中隔离。10月23-27日,采集病例A鼻咽拭子核酸检测结果均为阴性。同事T未感染新冠病毒,10月21-30日鼻咽拭子的核酸检测结果均为阴性,排除同事T传播给病例A的可能。
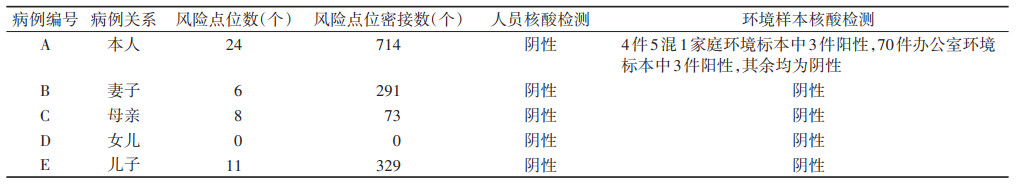
(2)风险点位排查:对病例A~E进行流行病学调查,活动轨迹分别涉及风险点位24、6、8、0和11个,密接分别为714、291、73、0和329个。对所有风险点位的密接和环境标本进行新冠病毒核酸检测,4件5混1家庭环境标本中3件为阳性,70件病例A办公室环境标本中3件为阳性(均为病例A直接接触的物品),其余环境标本和所有人员标本均为阴性,排除在上述风险点位造成首发病例A或其家庭成员B~E引入该疫情的可能。见表 2。
(3)大数据比对:对病例A~E发病前14 d至隔离治疗前的活动轨迹与既往病例进行大数据比对分析,发现病例A与昌平区其他病例O、M和N在同一隔离酒店有同时空交集。病例A于2021年10月22-27日在B210房间集中隔离,病例O、M和N均为2021年10月北京市昌平区报告的内蒙古自治区额济纳旗输入疫情相关病例,当时作为密接,分别于10月22-27日(住B110房间)、10月22-27日(住B106房间)、10月22-31日(住B106房间,病例M检出核酸阳性后病例N于10月27日转至B115房间)在同一酒店集中隔离。无其他有公共卫生学意义的同时空交集。
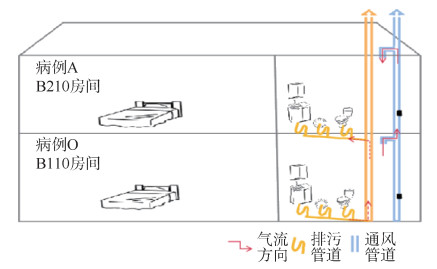
(4)隔离酒店调查:该隔离酒店共2层,除上述病例外未检出其他病例,监控视频查看入住、送餐、清运垃圾、消毒和采样等环节,未发现首发病例A与O、M和N有接触。病例O于10月22-27日在B110房间集中隔离,10月25日发病,10月27日检出新冠病毒核酸阳性;11月1日采集B110房间30件环境标本,7件核酸阳性。病例A居住在B210房间,在B110房间正上方,2个房间的卫生间均没有排风扇,只有一个开口的通风管道上下相通,楼顶没有强排设施。见图 1。11月1日采集B210房间31件环境标本,均为阴性;11月2日采集B210、B110房间卫生间通风、排污管道20件环境标本,其中B110房间卫生间通风管道内壁深部2件核酸阳性(Ct值:阳性标本1:ORF1ab为25.80、核壳蛋白N为28.38;阳性标本2:ORF1ab为32.83、核壳蛋白N为35.65),其余均为阴性。
|
| 图 1 隔离酒店建筑物通风、排污管道及气流方向示意图 |
(5)基因测序:经序列测定,共获得9条新冠病毒全基因组序列。序列比对结果显示,病例A~E、O的病毒核苷酸相似度为100%,均属于Delta变异株(B.1.617.2),为同一传播链。同时与病例O所住B110房间卫生间的1件通风管道内壁深部环境标本的病毒核苷酸相似度也为100%。但与病例M、N的病毒核苷酸相似度为99.997%,存在1个核苷酸突变位点差异。
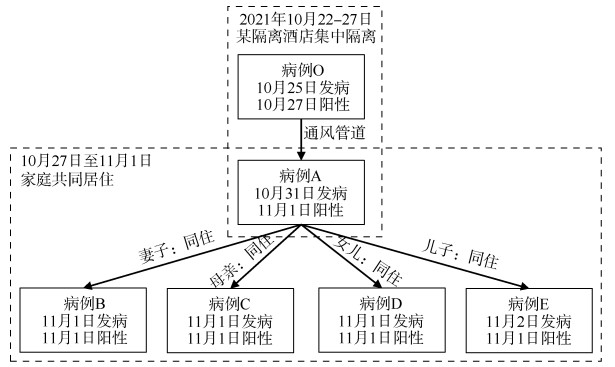
(6)传播链:此次疫情为单一传播链,感染来源为病例O。2021年10月22-27日,病例O(住B110房间)隔离期间可能通过上下楼层通风管道气溶胶传播,造成病例A(住同一隔离酒店B210房间)感染。10月27日病例A解除隔离回家,11月1日首次检出核酸阳性并隔离治疗。10月27日至11月1日病例A与家庭成员B~E共同居住,期间造成4名家庭成员续发感染,传播链见图 2。
|
| 图 2 北京市昌平区一起家庭聚集性新型冠状病毒肺炎疫情的传播链 |
新冠病毒的传播途径主要包括飞沫传播、接触传播和气溶胶传播,其中关于气溶胶传播的研究较少。本研究发现气溶胶传播是新冠病毒重要的传播途径之一,首发病例A可能通过隔离酒店卫生间的通风管道造成气溶胶传播,主要依据:第一,病例A在酒店隔离期间与感染来源病例O所住房间为上下楼层,公用通风管道,2个隔离房间的卫生间通风管道存在气流流动;第二,2个隔离房间卫生间的通风、排污管道20件环境标本中,2件通风管道内壁深部环境标本核酸阳性,且与病例A、O的病毒核苷酸相似度为100%;第三,病例O于10月25日发病,居住房间30件环境标本7件核酸阳性,病例A房间31件环境标本均阴性,提示病例O产生的气溶胶造成通风管道内壁环境污染;第四,监控视频查看隔离酒店入住、送餐、清运垃圾、环境消杀和采样环节,未发现其他交叉传播可能;同时,流行病学调查和大数据比对分析均排除病例A及其家庭成员B~E在其他地点引入该疫情的可能。
由于新冠病毒气溶胶传播的隐匿性,首发病例A在与感染来源没有直接接触的情况下通过气溶胶传播而感染,解除隔离后导致其他4名家庭成员在共同居住期间感染。研究表明,气溶胶传播距离远超过飞沫传播的1~2 m,甚至可达8 m[9];气溶胶中新冠病毒可存活3 h,提示可以导致3 h内同密闭空间的非直接接触人员感染[10];室内密闭空间可能导致超级传播事件,如中国吉林省通化市“1传141”传播事件[11]、“钻石公主号”传播事件[12]和美国斯卡吉特山谷合唱团传播事件[13]。可见气溶胶传播距离远、影响时间长、感染人数多,疫情防控难度大。
由于病毒气溶胶检测难度大,气溶胶传播的案例报道较少。既往研究发现通过排污管道造成上下楼层传播、公共交通工具传播、餐馆内部传播和建筑物内部传播等气溶胶传播事件[14-20]。中国广州市[14]、韩国[15]等地区均发现由于排污管道口封闭性差,通过卫生间排污管道造成上层住户感染。中国广州市Delta变异株聚集性疫情期间发现通过“握手楼”门窗造成气溶胶传播,模拟实验显示只要隔离病房的门打开,“握手楼”外墙距离仅为0.51 m的走廊内颗粒物浓度迅速升高[16]。新冠病毒传播主要与病例病程、排毒活动、通风情况、人员密集程度、接触时间以及个人防护等因素相关[17],餐馆、出租车、教堂等室内密闭空间在特定条件下容易造成气溶胶传播[18-20]。当前主要流行毒株为Delta变异株,该变异株病毒载量高,气溶胶传播的风险大大增加[5]。因此,提示应加强对密闭场所的疫情防控措施。
本研究发现该隔离酒店老旧,通风管道上下相通,通风管道口敞开,在病例离开5 d后仍能在通风管道内壁深部检出2件环境阳性标本,其中1件阳性标本Ct值较低,ORF1ab为25.80、核壳蛋白N为28.38。有研究显示,Ct值越低提示病毒载量越高,传染性越强[6]。这些结果表明,病例O在隔离酒店期间通过呼吸、说话、咳嗽、排泄等过程产生气溶胶[21],并在通风管道内部沉降富集,在阴冷潮湿的通风管道内存活时间较长。因此,要加强对隔离酒店、病例同单元住户的管理,通过工程改造、优化流程和加强监测降低建筑物内部气溶胶传播风险。
本研究存在局限性。由于发现此次家庭聚集性疫情的时间距离首发病例解除隔离时间已有5 d,未能采集到隔离酒店房间的气溶胶标本,导致本研究缺乏气溶胶标本的直接结果。不过本研究取得关键间接证据,即隔离房间卫生间的2件通风管道内壁深部环境涂抹标本阳性,且与首发病例A、感染来源病例O的病毒核苷酸相似度为100%。
利益冲突 所有作者声明无利益冲突
作者贡献声明 吴双胜:实施研究、数据收集、论文撰写;张姣姣、孙瑛、任正勇、窦相峰、张莉、段玮、马春娜:实施研究、数据整理、统计学分析;杨鹏、庞星火:研究指导、论文修改、经费支持
志谢 感谢北京市疾病预防控制中心和昌平区疾病预防控制中心现场调查组和检测组,北京市市级流调队
| [1] |
Torjesen I. Covid-19:omicron may be more transmissible than other variants and partly resistant to existing vaccines, scientists fear[J]. BMJ, 2021, 375: n2943. DOI:10.1136/bmj.n2943 |
| [2] |
杜敏, 刘民, 刘珏. 新型冠状病毒Delta变异株的流行病学特征及防控研究进展[J]. 中华流行病学杂志, 2021, 42(10): 1774-1779. Du M, Liu M, Liu J. Progress in research of epidemiologic feature and control of SARS-CoV-2 Delta variant[J]. Chin J Epidemiol, 2021, 42(10): 1774-1779. DOI:10.3760/cma.j.cn112338-20210808-00619 |
| [3] |
Zhang M, Xiao JP, Deng AP, et al. Transmission dynamics of an outbreak of the COVID-19 delta variant B.1.617.2- Guangdong province, China, May-June 2021[J]. China CDC Wkly, 2021, 3(27): 584-586. DOI:10.46234/ccdcw2021.148 |
| [4] |
Mikszewski A, Stabile L, Buonanno G, et al. Increased close proximity airborne transmission of the SARS-CoV-2 Delta variant[J/OL]. Sci Total Environ, 2021: 151499. DOI: 10.1016/j.scitotenv.2021.151499.(publishedonlineaheadofprint).
|
| [5] |
国务院应对新型冠状病毒肺炎疫情联防联控机制综合组. 关于印发新型冠状病毒肺炎防控方案(第八版)的通知[EB/OL]. (2021-05-14)[2022-01-05]. http://www.nhc.gov.cn/jkj/s3577/202105/6f1e8ec6c4a540d99fafef52fc86d0f8.shtml.
|
| [6] |
吴双胜, 潘阳, 孙瑛, 等. 新型冠状病毒肺炎病例呼吸道病毒载量与密切接触者续发风险的关系[J]. 中华流行病学杂志, 2021, 42(6): 1008-1011. Wu SS, Pan Y, Sun Y, et al. Relationship between respiratory viral load of cases of COVID-19 and secondary attack risk in close contacts[J]. Chin J Epidemiol, 2021, 42(6): 1008-1011. DOI:10.3760/cma.j.cn112338-20210224-00141 |
| [7] |
吴双胜, 潘阳, 段玮, 等. 北京市一起境外输入无症状感染者相关新冠肺炎聚集性疫情的溯源调查[J]. 国际病毒学杂志, 2021, 28(3): 187-191. Wu SS, Pan Y, Duan W, et al. Tracing infection source of an outbreak in Beijing caused by an imported asymptomatic case of COVID-19[J]. Int J Virol, 2021, 28(3): 187-191. DOI:10.3760/cma.j.issn.1673-4092.2021.03.003 |
| [8] |
吴双胜, 马春娜, 张莉, 等. 全国首起新型冠状病毒Alpha变异毒株相关本地疫情的溯源调查[J]. 中华预防医学杂志, 2021, 55(11): 1311-1315. Wu SS, Ma CN, Zhang L, et al. Survey on source of infection of the first local outbreak caused by SARS-CoV-2 Alpha variant in China[J]. Chin J Prev Med, 2021, 55(11): 1311-1315. DOI:10.3760/cma.j.cn112150-20210727-00710 |
| [9] |
Bahl P, Doolan C, de Silva C, et al. Airborne or droplet precautions for health workers treating coronavirus disease 2019?[J/OL]. J Infect Dis, 2020: jiaa189. DOI: 10.1093/infdis/jiaa189.(publishedonlineaheadofprint).
|
| [10] |
van Doremalen N, Bushmaker T, Morris DH, et al. Aerosol and surface stability of SARS-CoV-2 as compared with SARS-CoV-1[J]. N Engl J Med, 2020, 382(16): 1564-1567. DOI:10.1056/NEJMc2004973 |
| [11] |
Yao LS, Luo MY, Jia TW, et al. COVID-19 super spreading event amongst elderly individuals-Jilin province, China, January 2021[J]. China CDC Wkly, 2021, 3(10): 211-213. DOI:10.46234/ccdcw2021.050 |
| [12] |
Azimi P, Keshavarz Z, Laurent JG, et al. Mechanistic transmission modeling of COVID-19 on the Diamond Princess cruise ship demonstrates the importance of aerosol transmission[J]. Proc Natl Acad Sci USA, 2021, 118(8): e2015482118. DOI:10.1073/pnas.2015482118 |
| [13] |
Miller SL, Nazaroff WW, Jimenez JL, et al. Transmission of SARS-CoV-2 by inhalation of respiratory aerosol in the Skagit Valley Chorale superspreading event[J]. Indoor Air, 2021, 31(2): 314-323. DOI:10.1111/ina.12751 |
| [14] |
Kang M, Wei JJ, Yuan J, et al. Probable evidence of fecal aerosol transmission of SARS-CoV-2 in a high-rise building[J]. Ann Intern Med, 2020, 173(12): 974-980. DOI:10.7326/M20-0928 |
| [15] |
Hwang SE, Chang JH, Oh B, et al. Possible aerosol transmission of COVID-19 associated with an outbreak in an apartment in Seoul, South Korea, 2020[J]. Int J Infect Dis, 2021, 104: 73-76. DOI:10.1016/j.ijid.2020.12.035 |
| [16] |
Zhang ZN, Li X, Wang Q, et al. Field simulation of aerosol transmission of SARS-CoV-2 in a special building layout- Guangdong province, China, 2021[J]. China CDC Wkly, 2021, 3(34): 711-715. DOI:10.46234/ccdcw2021.176 |
| [17] |
Jones NR, Qureshi ZU, Temple RJ, et al. Two metres or one: what is the evidence for physical distancing in COVID-19?[J]. BMJ, 2020, 370: m3223. DOI:10.1136/bmj.m3223 |
| [18] |
Li YG, Qian H, Hang J, et al. Probable airborne transmission of SARS-CoV-2 in a poorly ventilated restaurant[J]. Build Environ, 2021, 196: 107788. DOI:10.1016/j.buildenv.2021.107788 |
| [19] |
Lednicky JA, Lauzardo M, Alam MM, et al. Isolation of SARS-CoV-2 from the air in a car driven by a COVID patient with mild illness[J]. Int J Infect Dis, 2021, 108: 212-216. DOI:10.1016/j.ijid.2021.04.063 |
| [20] |
Katelaris AL, Wells J, Clark P, et al. Epidemiologic evidence for airborne transmission of SARS-CoV-2 during church singing, Australia, 2020[J]. Emerg Infect Dis, 2021, 27(6): 1677-1680. DOI:10.3201/eid2706.210465 |
| [21] |
Wang CC, Prather KA, Sznitman J, et al. Airborne transmission of respiratory viruses[J]. Science, 2021, 373(6558): eabd9149. DOI:10.1126/science.abd9149 |
 2022, Vol. 43
2022, Vol. 43