文章信息
- 高书瑜, 李靖欣, 金鹏飞, 朱凤才.
- Gao Shuyu, Li Jingxin, Jin Pengfei, Zhu Fengcai
- 整群随机设计在疫苗临床试验中的应用
- Application of cluster randomization design in vaccine clinical trials
- 中华流行病学杂志, 2021, 42(12): 2221-2225
- Chinese Journal of Epidemiology, 2021, 42(12): 2221-2225
- http://dx.doi.org/10.3760/cma.j.cn112338-20210622-00491
-
文章历史
收稿日期: 2021-06-22
2. 江苏省疾病预防控制中心疫苗临床评价所, 南京 210009;
3. 江苏省疾病预防控制中心国家卫生健康委员会肠道病原微生物重点实验室, 南京 210009
2. Department of Vaccine Clinical Evaluation, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China;
3. National Health Commission Key Laboratory of Enteric Pathogenic Microbiology, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China
与其他医学干预措施相比,接种疫苗能够带来更多的健康、经济以及社会效益[1-2]。全面评价疫苗效果包括对直接效应、间接效应、总体效应以及整体效应的评价,将有助于确定疫苗带给人类的益处,从而可以为旨在降低疾病负担的公共卫生政策给出更准确的指引。而疫苗的公共卫生意义除了保护接种疫苗的个体以外,还体现在其间接影响上,即群体保护效应。群体保护效应,即随着免疫接种覆盖面扩大,可同时保护未接种疫苗或免疫失败的易感人群免受感染。因此,产生群体保护效应也是疫苗产生的附加价值[3]。在某些传染病疫情中,评估间接保护效应可以了解疫苗是否可以有效地控制疫情;其次,良好的间接保护使得某些疫苗成本效益更高,如肺炎疫苗、人乳头瘤病毒疫苗等[4-6]。
传统的疫苗临床试验通常是个体随机设计的研究(individual randomization trials,IRTs),将试验个体随机分配至试验组或对照组,通过比较两组免疫一段时间后的发病率,从而计算出疫苗的直接保护效力[7]。但传统的个体随机设计,无法评估疫苗给人群带来的间接影响。有研究于1991年开始建议采用整群随机试验(cluster randomization trials,CRTs)用于评估疫苗对人群的直接、间接影响[8]。国外采用整群随机设计的疫苗临床试验日益增多,如评估疫苗在人群中预防埃博拉病毒感染所致疾病的效力,或是评估三价流感疫苗对预防发热性急性呼吸道疾病的总效力和对未接种疫苗的家庭成员的间接保护效果等[9-10]。但在我国,采用整群随机设计以评估疫苗群体效应的临床研究报道较少。因此,本文结合整群随机疫苗临床试验实例对疫苗临床试验中的整群随机设计做简要介绍。
1. 基本定义:整群随机设计是指将具有相似特征的个体构成的多个群体作为随机化单位,分配至试验组和对照组,然后比较两组的发病率、感染率或其他临床指标,进而评价试验疫苗的总体保护效力。常见于在群体水平上实施的医疗卫生干预,例如针对社区人群的健康教育、行为干预研究等难以在个体水平上实施的研究。
在疫苗的实际应用中,常能观察到当某疫苗的接种率在某区域人群中达到一定比例时,疫苗对已接种人群产生保护的同时也能在一定程度上保护未接种疫苗的人群,使该区域中无论是否接种疫苗的人群发病率或感染率均下降,这种效果被称为疫苗产生的群体保护,如流感疫苗、霍乱疫苗、肺炎球菌疫苗等[11-13]。这种因减少疾病传播而产生的群体水平上的效应被称为群体效应。疫苗的群体效应包括群体保护和群体免疫。群体免疫是减毒活疫苗中的病毒或细菌株被排出人体,进而感染未免疫的个体而产生免疫力,如口服脊髓灰质炎病毒疫苗、口服轮状病毒疫苗等;群体保护是指在不诱发免疫反应的情况下,通过阻断感染的传播或减少易感者与感染者接触的机会,进而保护未接种疫苗的个体,减毒活疫苗以及灭活疫苗均可通过接种率的增加,减少病毒的传播途径,降低易感人群的感染风险,进而产生群体保护,如白喉疫苗、麻疹疫苗等[14]。疫苗的群体免疫,这一定义适用于活疫苗,对应的感染传播不只发生在人与人之间,还包括其他传播途径;而疫苗的群体保护适用于只发生“人传人”传播的目标感染中。传统的个体随机疫苗临床试验只关注疫苗接种者和未接种者发病或感染率的差别(直接效应),当对照人群也受到来自疫苗接种人群接种疫苗的间接保护影响,会使得两组别之间的结果差异被稀释,疫苗的整体效应被低估[8, 15-16]。因此,采用整群随机设计可以更好地评价疫苗对人群的实际效果。群体可以是一些具有相同或相似特征个体组成的完整的社会单位或以地区划分的单位,如社区、家庭、学校、医院等。相对于整群随机化,出于伦理学考虑,在疫苗临床试验中,对照组人群通常分配接种与目标疾病无关的其他疫苗(通常是没有针对目标感染的保护作用的疫苗)。
2. 评价指标:疫苗接种对人群的整体影响取决于对未接种疫苗个体的间接影响和对接种疫苗个体的总影响,从4个方面评估疫苗在人群水平中的效果会更加的全面,包括直接效应(direct effect)、间接效应(indirect effect)、总效应(total effect)以及整体效应(overall effect)[7, 17-18]。与个体随机设计相比,采用了整群随机设计的疫苗试验由于群内个体之间的非独立性,则在统计分析时更加复杂。为了评估包括间接效应在内的各种效应,需要在试验组(包括了接种疫苗和未接种疫苗的人群)和对照组(包括了接种无关疫苗和未接种疫苗的人群)之间进行结局指标的比较及计算,通常包括发病率、感染率等。
传统的采用个体随机设计的疫苗临床试验中,疫苗效力(vaccine effect,VE)的计算,通常是1-试验组与对照组相比的相对危险度(RR)得出的,也可以说是疫苗的直接效应[7]:

疫苗接种中的产生的间接效应,即包含接种个体的群体中其他未接种个体,与未接种群体中的个体之间的结果差异[19]。间接效应计算的是试验组群体中未接种或是接种失败的人群,因接种者带来的保护效果:

总效应是指因为疫苗产生的间接保护作用可以同时为人群中接种疫苗者提供额外的保护,即同时获得疫苗的直接和间接保护:

整体效应是指总人群获得的群体保护,包括接种与未接种人群:

例如,2004年,在伤寒高发地印度加尔各答,Choi等[20]开展的一项伤寒Vi疫苗的整群随机对照Ⅳ期临床试验,用以评估伤寒Vi多糖结合疫苗的群体保护效应。该试验根据人口普查结果和地理特征,定义了80个地理位置上邻近的群,随机分配至试验组和对照组,分别接种伤寒Vi多糖结合疫苗和灭活甲型肝炎疫苗。试验组和对照组各40个群,每个群的总人口数x±s分别为(777±136)人和(792±142)人。主要研究目的是通过比较伤寒疫苗组和甲型肝炎疫苗对照组的伤寒发病率,进而计算Vi疫苗的总效力,即计算伤寒Vi疫苗的整体效应。次要目的是通过比较伤寒Vi疫苗组中与甲型肝炎疫苗组中未接种疫苗者的伤寒发病率,计算Vi疫苗的间接效应,以及通过比较Vi疫苗组中所有居民与甲型肝炎疫苗组中所有居民的伤寒发病率计算的整体疫苗保护水平。该试验中,群体内的个体未按照随机化分配疫苗,故不考虑计算直接效应。伤寒Vi疫苗组内各群的平均疫苗覆盖率为61%,甲肝疫苗组内各群的平均疫苗覆盖率为60%。该试验结果表明,伤寒Vi疫苗具有良好的保护效果,同时也可以为未接种人群提供间接保护。
3. 设计要素:
(1)群体选择:设计整群随机试验之前,研究人员需要选择参与研究的群体。临床研究中,群体的大小以及类型会根据试验需求和实际情况进行选择和调整。群体选择通常包括3种类型:地理群体(例如社区、行政单位或者任意地理区域);机构群体(例如学校、医院或工作场所);关系群体(例如家庭、伴侣关系等)。确定了群体的类型后,在选择群体时,应考虑以下特征[17, 21-22]:①因为研究是以群体为随机的单位,因此群体一般不宜过大以确保有充足数量的群体被纳入,从而确保足够的研究效力;②群体相对稳定,如果试验组和对照组之间相互作用,即人口的大量迁移出入,出现跨群体的“污染”,可能会稀释对疫苗的直接、间接和整体效应的评估;③要保证试验组和对照组之间足够的距离,尽量避免接种者排出体外的减毒疫苗株污染对照组;如果存在此类毒株污染,尽量控制其发生在试验组内部。
在对疫苗进行干预实施计划时,有时会涉及人数较多的大群体,如整个村庄或整个社区。但以小型群体为随机化单位更适于群随机的临床研究,被称为小群体随机设计。小群体被认为是个体之间可以充分接触,进而传播病毒的小范围群体,包括家庭、工作场所、性关系伴侣等。考虑到群体稳定性,以及便于研究随访,家庭是最常见的随机化单位[23]。
当研究流感、霍乱或肺炎等易于在家庭这种小型传播单位内传播的疾病时,小群体试验是一种经济有效的研究方法。如在印度北部进行的三价灭活流感疫苗整群随机试验,定义的群体为村庄内的单个家庭,其主要研究终点为评估三价流感疫苗在儿童中预防发热性急性呼吸道疾病的总体效力,其次要终点为评价灭活三价疫苗对未接种家庭成员的间接保护效果[10]。
群体还可以是确诊病例的密切接触者(密接者),将确诊病例周围的密接者作为小群体进行分析。例如2015年在塞拉利昂等国家评估rVSV-ZEBOV埃博拉疫苗预防埃博拉病毒感染的效果时,考虑到尽管这项研究是在埃博拉病毒高发地区进行的,但由于总体发病率的不断下降,若是采用传统的随机对照疫苗临床试验,最终的病例数可能不足。因此,研究人员采用“环状接种”(ring vaccination)设计。其中的小群体,即“环”,为确诊病例的密接者以及密接者的接触者。密接者包括病例的家庭成员、探病者或确诊后进行过密切接触的人员,密接者的接触者包含地理位置上的邻居以及密接者的家庭成员。试验中首先确定新发确诊病例,确定群体,将群体按照1∶1分配至立即接种组和延迟21 d接种组。每个群体中包括符合条件且接种者、符合条件但未接种者、不符合接种条件者。考虑到埃博拉病毒的潜伏期约为10 d,所以主要研究目的为评估接种至少10 d后,该疫苗预防实验室确诊埃博拉病毒感染的效力。研究结果显示,rVSV-ZEBOV疫苗对预防埃博拉病毒感染可提供良好的保护[9]。
当然,在选择群体大小时,要充分考虑试验结果的外推性。由于不同的群体中人口的混合模式以及传播强度不同,小群体的特征可能影响到结果推论到其他环境或其他规模人群。此外,更小的群体意味着更小的群内相关系数,有效样本量可能更小[23]。一般来说,小群体的设计效果会更小。然而,在较大的群体中,群内相关性可能很小,因此在某些情况下,将少数的大群体随机化可能会更有效。无论是大群体还是小群体,针对疫苗间接效果的评价,几乎都依赖于特定的当地背景,例如当地的传播强度、人口混合模式等,故还需要根据具体情况而定[23]。
(2)样本量估计:估算试验样本量对于整群随机试验至关重要[24]。作为一个重要步骤,整群随机设计的样本估计不仅需要确定集群的数量,也需要估计每个集群的受试者数量[25]。由于群集中个体之间存在一定的相关关系,导致整群随机设计的计算中涉及方差膨胀,故整群随机设计的统计效率是低于个体随机设计的。为了解决统计效率低下的问题,与个体随机试验相比,整群随机试验需要更大的样本量。
当进行个体的随机试验时,可以将个体视为相互独立,即认为个体之间无关系,而进行整群随机试验时,群体体内个体之间会有相似或/和相同的特征,这时引进群内相关系数(intraclass correlation coefficient,ICC),用来反映群内个体的相似程度,或可以解释为群间变异占总变异的百分比,通常用ρ表示[24, 26]。
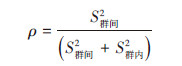
当ρ=0时,可认为群内的个体相互独立,ρ=1时,群内所有个体相关。通常是将标准随机对照试验的样本量估计值乘以一个被称为设计效果(design effect,DE)的校正因子,进而扩大试验样本量,用于计算使用该随机设计引起的方差增加,弥补统计效力低下的缺陷[27]。

其中n表示每个群体的受试者数量。估计整群随机设计的样本例数时,需要保证与完全随机设计相同的检验效能,则可以将简单随机抽样计算出的样本例数乘以DE[28]。在CRT中,假设每个群体中有y人年的随访,那么每个组别需要的群体数N由下式给出:

这里N是指不同组别的群体数,Zα/2和Zβ分别表示标准正态分布值,λ0和λ1分别表示试验组和对照组的发病率,k2表示群间变异系数。
例如,在有关于SSM-VIMT疟疾疫苗的Ⅲ期疫苗临床试验设计研究中,为评估该疫苗的间接效应,研究人员认为必须使用整群随机设计[29]。通过比较SSM-VIMT疫苗接种群和对照群的哨兵人群的疟疾感染率,评估SSM-VIMT疫苗的预防疟疾的效果。哨兵群体应由从每个群体内随机选择的个体组成。假设该疫苗对降低感染率的保护率为50%,群间变异系数在0.5~0.7之间变化,疟疾的平均发病率为0.6例/人年,群组间相关系数为0.5的情况下,预计试验组和对照组分别需要16个群组,每个群组应分别包括400名哨兵组及非哨兵组受试者。
4. 整群随机设计的优点及局限性:
(1)优点:由于试验水平是群体,在针对某些难以实施到个体水平的问题,如健康政策、疫苗推广等,利用整群随机设计可以达到研究者想要更好地评估群体效应的目的;群内的个体会一致接受相同的干预,减少了受不同干预措施个体的影响,可以更好地避免不同干预组之间的沾染;在针对某些传染性疾病的疫苗研究中,目的是阻止疾病传播、控制疫情扩散等,则疫苗对个体的间接保护效应尤为重要;故采用整群随机设计,可以更全面地评估接种疫苗的群体效应。
(2)局限性:整群随机试验的统计分析更为复杂,由于群内个体的相关性,使得统计效能低于经典的个体随机对照设计,为了保证统计检验的把握度往往需要更大的研究样本量。此外,群体随机设计不能用传统个体随机的方法计算样本量,需要将DE考虑在内,否则会导致样本量计算不足,研究效能不足,难以达到与个体随机试验相同的效能[30-31];与个体随机试验相比,整群随机试验需要进行群体水平和个体水平的推论[32]。在数据分析过程中,研究人员可能会忽略该事实,采用传统的个体随机设计进行个体水平的数据分析,忽略了群内个体的相关性,会导致P值偏小的分析结果,导致Ⅰ类错误的增大[30]。
5. 讨论:即使现在的疫苗覆盖率较高,但总有一部分人群未接种疫苗,除自身接种意愿不强外,还包括免疫失败人群或不宜接种疫苗的高危人群,比如早产儿、高过敏体质人群、免疫缺陷患者等。群体保护通过在群体内接种疫苗建立有效的免疫屏障,减少传播途径,降低这些未接种疫苗人群的患病率或感染率。评估疫苗的群体保护效应,对于全面评价疫苗的公共卫生效果以及成本效益十分关键。如今,将新疫苗引入市场的标准变得越来越严格,特别是对于某些价格昂贵的新型疫苗来说,若是能够提供额外的群体保护效果,将可以作为支持该疫苗纳入公共卫生计划免疫决策的依据。
相较于个体随机试验,整群随机试验统计效能更低,更加耗费人力物力,实施难度更大,统计分析也更加复杂,但是整群随机试验的优势在于可以评估一般个体随机临床试验所不能反映的目标疫苗的群体保护效应,也突显出了疫苗的公共卫生意义。
另一种常见的观察性研究以评估群体效应的方式是将各群体内目标人群的发病率和各群体目标人群的疫苗覆盖率相比较,以评估群体发病率的下降是否超过了根据疫苗覆盖率所预估的直接保护效果水平。例如,一项关于美国引进七价肺炎多糖疫苗后侵袭性肺炎球菌感染疾病负担变化的研究中,显示目标接种组的发病率下降远超过疫苗覆盖率所预期的下降水平,且成年人(非接种人群)的发病率下降也可归因于接种肺炎多糖疫苗的儿童[33]。在评估群体效应时,选择整群随机试验相对会更加的节省人力物力及时间[17]。但在试验设计、群体选择、统计分析等步骤上,研究人员必须充分考虑试验的可行性以及注意事项,才能更好的评估疫苗在人群水平中的影响。
为更准确地做出公共卫生免疫决策,国家需要全面了解疫苗的效力、安全性以及群体保护效应,对保障公众健康、预防控制疾病以及疫苗的社会效应有着重大意义。总而言之,整群随机设计作为一种评估群体效应的理想设计,是疫苗临床试验中重要的方法之一。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Jit M, Hutubessy R, Png ME, et al. The broader economic impact of vaccination: reviewing and appraising the strength of evidence[J]. BMC Med, 2015, 13(1): 209. DOI:10.1186/s12916-015-0446-9 |
| [2] |
Rodrigues CMC, Plotkin SA. Impact of vaccines; health, economic and social perspectives[J]. Front Microbiol, 2020, 11: 1526. DOI:10.3389/fmicb.2020.01526 |
| [3] |
Anderson EJ, Daugherty MA, Pickering LK, et al. Protecting the community through child vaccination[J]. Clin Infect Dis, 2018, 67(3): 464-471. DOI:10.1093/cid/ciy142 |
| [4] |
Markowitz LE, Naleway AL, Lewis RM, et al. Declines in HPV vaccine type prevalence in women screened for cervical cancer in the United States: evidence of direct and herd effects of vaccination[J]. Vaccine, 2019, 37(29): 3918-3924. DOI:10.1016/j.vaccine.2019.04.099 |
| [5] |
van Werkhoven CH, Hollingsworth RC, Huijts SM, et al. Pneumococcal conjugate vaccine herd effects on non-invasive pneumococcal pneumonia in elderly[J]. Vaccine, 2016, 34(28): 3275-3282. DOI:10.1016/j.vaccine.2016.05.002 |
| [6] |
Bollerup S, Baldur-Felskov B, Blomberg M, et al. Significant reduction in the incidence of genital warts in young men 5 years into the Danish human papillomavirus vaccination program for girls and women[J]. Sex Transm Dis, 2016, 43(4): 238-242. DOI:10.1097/olq.0000000000000418 |
| [7] |
Halloran ME, Struchiner CJ, Longini IM. Study designs for evaluating different efficacy and effectiveness aspects of vaccines[J]. Am J Epidemiol, 1997, 146(10): 789-803. DOI:10.1093/oxfordjournals.aje.a009196 |
| [8] |
Halloran ME, Haber M, Longini IM, et al. Direct and indirect effects in vaccine efficacy and effectiveness[J]. Am J Epidemiol, 1991, 133(4): 323-331. DOI:10.1093/oxfordjournals.aje.a115884 |
| [9] |
Henao-Restrepo AM, Camacho A, Longini IM, et al. Efficacy and effectiveness of an rVSV-vectored vaccine in preventing Ebola virus disease: final results from the Guinea ring vaccination, open-label, cluster-randomised trial (Ebola Ça Suffit!)[J]. Lancet, 2017, 389(10068): 505-518. DOI:10.1016/S0140-6736(16)32621-6 |
| [10] |
Sullender WM, Fowler KB, Gupta V, et al. Efficacy of inactivated trivalent influenza vaccine in rural India: a 3-year cluster-randomised controlled trial[J]. Lancet Glob Health, 2019, 7(7): e940-950. DOI:10.1016/s2214-109x(19)30079-8 |
| [11] |
Mertz D, Fadel SA, Lam PP, et al. Herd effect from influenza vaccination in non-healthcare settings: a systematic review of randomised controlled trials and observational studies[J]. Euro Surveill, 2016, 21(42): 30378. DOI:10.2807/1560-7917.ES.2016.21.42.30378 |
| [12] |
Khatib AM, Ali M, von Seidlein L, et al. Effectiveness of an oral cholera vaccine in Zanzibar: findings from a mass vaccination campaign and observational cohort study[J]. Lancet Infect Dis, 2012, 12(11): 837-844. DOI:10.1016/s1473-3099(12)70196-2 |
| [13] |
Miller E, Andrews NJ, Waight PA, et al. Herd immunity and serotype replacement 4 years after seven-valent pneumococcal conjugate vaccination in England and Wales: an observational cohort study[J]. Lancet Infect Dis, 2011, 11(10): 760-768. DOI:10.1016/s1473-3099(11)70090-1 |
| [14] |
Paul Y. Herd immunity and herd protection[J]. Vaccine, 2004, 22(3/4): 301-302. DOI:10.1016/j.vaccine.2003.07.016 |
| [15] |
Vaucher P. Designing phase Ⅲ or Ⅳ trials for vaccines: choosing between individual or cluster randomised trial designs[J]. Vaccine, 2009, 27(13): 1928-1931. DOI:10.1016/j.vaccine.2009.01.107 |
| [16] |
Moulton LH, O'Brien KL, Kohberger R, et al. Design of a group-randomized Streptococcus pneumoniae vaccine trial[J]. Control Clin Trials, 2001, 22(4): 438-452. DOI:10.1016/s0197-2456(01)00132-5 |
| [17] |
Clemens J, Shin S, Ali M. New approaches to the assessment of vaccine herd protection in clinical trials[J]. Lancet Infect Dis, 2011, 11(6): 482-487. DOI:10.1016/s1473-3099(10)70318-2 |
| [18] |
Halloran ME, Struchiner CJ. Study designs for dependent happenings[J]. Epidemiology, 1991, 2(5): 331-338. DOI:10.1097/00001648-199109000-00004 |
| [19] |
Doherty M, Buchy P, Standaert B, et al. Vaccine impact: benefits for human health[J]. Vaccine, 2016, 34(52): 6707-6714. DOI:10.1016/j.vaccine.2016.10.025 |
| [20] |
Sur D, Ochiai RL, Bhattacharya SK, et al. A cluster-randomized effectiveness trial of Vi typhoid vaccine in India[J]. N Engl J Med, 2009, 361(4): 335-344. DOI:10.1056/NEJMoa0807521 |
| [21] |
Gessner BD, Halloran ME, Khan I. The case for a typhoid vaccine probe study and overview of design elements[J]. Vaccine, 2015, 33(Suppl 3): C30-35. DOI:10.1016/j.vaccine.2015.03.085 |
| [22] |
Ali M, Clemens J. Assessing vaccine herd protection by killed whole-cell oral cholera vaccines using different study designs[J]. Front Public Health, 2019, 7: 211. DOI:10.3389/fpubh.2019.00211 |
| [23] |
Halloran ME. The minicommunity design to assess indirect effects of vaccination[J]. Epidemiol Methods, 2012, 1(1): 83-105. DOI:10.1515/2161-962x.1008 |
| [24] |
Rutterford C, Copas A, Eldridge S. Methods for sample size determination in cluster randomized trials[J]. Int J Epidemiol, 2015, 44(3): 1051-1067. DOI:10.1093/ije/dyv113 |
| [25] |
van Breukelen GJP, Candel MJJM. Calculating sample sizes for cluster randomized trials: we can keep it simple and efficient![J]. J Clin Epidemiol, 2012, 65(11): 1212-1218. DOI:10.1016/j.jclinepi.2012.06.002 |
| [26] |
Killip S, Mahfoud Z, Pearce K. What is an intracluster correlation coefficient? crucial concepts for primary care researchers[J]. Ann Fam Med, 2004, 2(3): 204-208. DOI:10.1370/afm.141 |
| [27] |
Donner A, Birkett N, Buck C. Randomization by cluster: sample size requirements and analysis[J]. Am J Epidemiol, 1981, 114(6): 906-914. DOI:10.1093/oxfordjournals.aje.a113261 |
| [28] |
郭静, 金水高. 整群随机化试验设计样本例数估计[J]. 中国卫生统计, 2008, 25(2): 117-119. Guo J, Jin SG. Sample size estimation in cluster randomization trial[J]. Chin J Health Stat, 2008, 25(2): 117-119. DOI:10.3969/j.issn.1002-3674.2008.02.002 |
| [29] |
Delrieu I, Leboulleux D, Ivinson K, et al. Design of a Phase Ⅲ cluster randomized trial to assess the efficacy and safety of a malaria transmission blocking vaccine[J]. Vaccine, 2015, 33(13): 1518-1526. DOI:10.1016/j.vaccine.2015.01.050 |
| [30] |
Borm GF, Melis RJF, Teerenstra S, et al. Pseudo cluster randomization: a treatment allocation method to minimize contamination and selection bias[J]. Stat Med, 2005, 24(23): 3535-3547. DOI:10.1002/sim.2200 |
| [31] |
Eldridge SM, Ashby D, Kerry S. Sample size for cluster randomized trials: effect of coefficient of variation of cluster size and analysis method[J]. Int J Epidemiol, 2006, 35(5): 1292-1300. DOI:10.1093/ije/dyl129 |
| [32] |
Atienza AA, King AC. Community-based health intervention trials: an overview of methodological issues[J]. Epidemiol Rev, 2002, 24(1): 72-79. DOI:10.1093/epirev/24.1.72 |
| [33] |
Whitney CG, Farley MM, Hadler J, et al. Decline in invasive pneumococcal disease after the introduction of protein-polysaccharide conjugate vaccine[J]. N Engl J Med, 2003, 348(18): 1737-1746. DOI:10.1056/NEJMoa022823 |
 2021, Vol. 42
2021, Vol. 42


