文章信息
- 岳勇, 梁娴, 毛毅, 胡敏, 韩德琳, 速丽媛, 陈恒, 范双凤, 张晓春, 杨非, 袁齐武, 刘竹.
- Yue Yong, Liang Xian, Mao Yi, Hu Min, Han Delin, Su Liyuan, Chen Heng, Fan Shuangfeng, Zhang Xiaochun, Yang Fei, Yuan Qiwu, Liu Zhu
- 新型冠状病毒疫苗接种对成都市境外输入病例流行病学及临床特征的影响分析
- Influence of SARS-CoV-2 vaccination on the epidemiological and clinical characteristics of imported COVID-19 cases in Chengdu
- 中华流行病学杂志, 2021, 42(8): 1365-1370
- Chinese Journal of Epidemiology, 2021, 42(8): 1365-1370
- http://dx.doi.org/10.3760/cma.j.cn112338-20210330-00261
-
文章历史
收稿日期: 2021-03-30
2. 成都市疾病预防控制中心 610041;
3. 成都市公共卫生临床医疗中心应急病区 610011;
4. 成都市疾病预防控制中心传染病防制科 610041;
5. 成都市疾病预防控制中心性病与艾滋病防制科 610041;
6. 成都市疾病预防控制中心微生物检验科 610041;
7. 成都市疾病预防控制中心职业病防制科 610041
2. Chengdu Center for Disease Control and Prevention, Chengdu 610041, China;
3. Emergency Ward, Public Health Clinical Center of Chengdu, Chengdu 610011, China;
4. Department of Infectious Disease Prevention and Control, Chengdu Center for Disease Control and Prevention, Chengdu 610041, China;
5. Department of AIDS and STD Control and Prevention, Chengdu Center for Disease Control and Prevention, Chengdu 610041, China;
6. Department of Microbiological Laboratory, Chengdu Center for Disease Control and Prevention, Chengdu 610041, China;
7. Department of Occupational Disease Prevention and Control, Chengdu Center for Disease Control and Prevention, Chengdu 610041, China
2019年12月出现的新型冠状病毒肺炎(新冠肺炎)被WHO定义为全球大流行,截至2021年3月1日全球已累计报告新冠肺炎确诊病例1.138亿余例,死亡252万余例[1]。目前全球尚无治疗新冠肺炎的特效药,新型冠状病毒(新冠病毒)疫苗在遏制疫情蔓延和防控中发挥着重要作用。据WHO统计,截至2021年4月23日,全球开展疫苗研究累计200余项,进入临床试验90余项[2]。我国最先进入临床试验的是腺病毒载体疫苗和灭活疫苗,2020年7月起,灭活疫苗在国内外部分地区开始重点人群应急接种。2020年12月成都市境外输入新冠病毒感染病例中,陆续发现部分病例有新冠病毒疫苗接种史。本研究调查和分析新冠病毒疫苗接种对成都市境外输入病例流行病学及临床特征的影响,为新冠肺炎疫情防控提供参考依据。
对象与方法1. 研究对象:2020年12月1日至2021年4月15日成都市入境的新冠病毒感染病例,根据新冠病毒疫苗接种史,将病例分为疫苗接种组(有新冠病毒疫苗接种史,且在境外暴露后感染)和疫苗未接种(无新冠病毒疫苗接种史,且与疫苗接种组在同一境外国家暴露后感染)。
2. 研究内容[3]:开展现场流行病学调查,收集病例的流行病学资料和入院后首次检测的临床资料。流行病学资料包括性别、年龄、身高、体重、吸烟史、境外输入地、出入境时间、疫苗接种时间、接种方式、发病日期、诊断日期等。临床指标包括感染性指标(C反应蛋白、血清淀粉样蛋白A和降钙素原)、淋巴细胞亚群[CD4+T淋巴细胞(CD4)、CD8+T淋巴细胞(CD8)、CD3+T淋巴细胞(CD3)、CD4/CD8比值、淋巴细胞计数];检测抗新冠病毒特异性抗体IgG、IgM和总抗体。
3. 诊断标准:新冠肺炎确诊病例、临床诊断分型和无症状感染者定义见文献[4];境外输入病例指病例在发病前或无症状感染者核酸检测阳性前14 d有境外疫情国家的旅居史,且流行病学调查发现无明确国内感染来源,入境后新冠病毒核酸检测阳性的病例[3]。
4. 实验室检测:
(1)新冠病毒核酸检测[4]:采集病例的咽拭子、鼻拭子或鼻咽拭子标本后,采用磁珠法和病毒核酸提取试剂盒(江苏硕世生物科技股份有限公司生产)提取核酸;采用实时荧光RT-PCR法和新冠病毒核酸检测试剂盒(中山大学达安基因股份有限公司生产)进行核酸检测,针对新冠病毒基因组2个靶标即开放读码框1ab基因(ORF1ab)和N基因,手动调整阈值线读取2个靶标Ct值,作为病毒载量参考依据。
(2)血清抗体滴度检测:采集病例血标本后,采用磁微粒化学发光法和i3000全自动化学发光免疫分析仪(迈克生物股份有限公司生产)进行血清抗体检测,结果以样本光子数/Cutoff光子数(COI)表示,COI≥1.0为阳性,COI < 1.0为阴性。
(3)临床指标检测:病例入院后采集空腹外周血检测实验室指标,采用贝克曼流式细胞仪(美国贝克曼库尔特有限公司生产)检测外周血CD4和CD8。采用全自动Astep特定蛋白分析仪(深圳市国赛生物技术有限公司生产)检测C反应蛋白和血清淀粉样蛋白A。采用EVERESYS A1800系列化学发光测定仪(苏州长光华医生物医学工程有限公司生产)检测降钙素原。
5. 统计学分析:采用WPS 2019软件录入和管理数据,R 4.0.3软件进行数据分析。计数资料采用频数和构成比(%)描述,当格子的理论频数均 > 5时,组间比较采用Pearson χ2检验,当格子的理论频数≥1且 < 5时,组间比较采用连续性校正χ2检验,当格子的理论频数 < 1时,组间比较采用Fisher确切概率法;正态分布且方差齐的计量资料采用x±s描述,组间比较采用t检验,偏态分布或方差不齐则采用M(P25,P75)描述,组间比较采用Wilcoxon秩和检验。双侧检验,检验水准α=0.05。
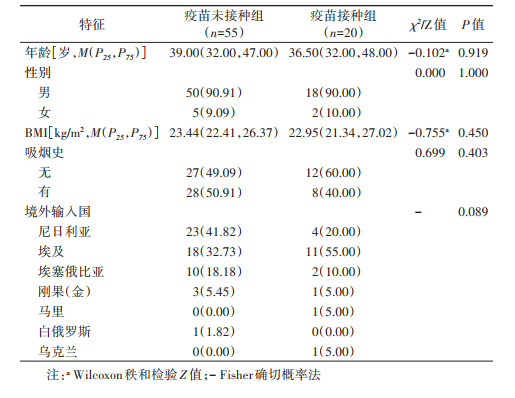
结果1. 基本情况:疫苗接种组和疫苗未接种组的新冠病毒感染病例分别为20例和55例,均为中国籍,境外输入国主要来自尼日利亚、埃及、埃塞俄比亚等非洲国家。疫苗接种组有19例新冠病毒核酸阳性,1例血清抗体IgM和IgG阳性;疫苗未接种组有54例新冠病毒核酸阳性,1例新冠病毒血清抗体IgM和IgG阳性。两组病例年龄、性别、BMI、吸烟史和境外输入国的差异均无统计学意义(P > 0.05)。见表 1。
2. 疫苗接种组病例的疫苗接种及发病/检出情况:疫苗接种组病例20例中,首针接种时间分布为2020年7-11月,其中接种灭活疫苗17例,不详3例;境内接种14例,境外接种6例;2剂次疫苗采取一次性接种方式有10例,采取2次间隔接种方式有10例,间隔时间14~57 d,中位数为26.50 d,间隔28 d接种2例(20.00%);病例的发病/检出时间范围2020年12月11日至2021年4月13日,从完成接种疫苗到发病/检出的时间间隔87~224 d,中位时间间隔为163.50 d。
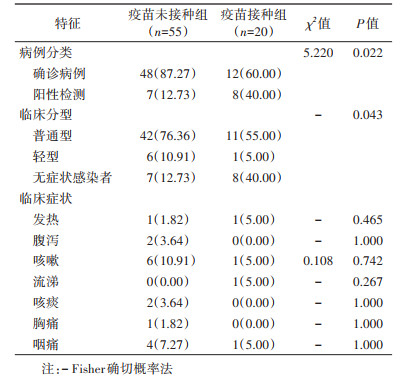
3. 临床特征:疫苗接种组和疫苗未接种组的病例分类和临床分型的差异有统计学意义(P < 0.05)。疫苗接种组中无症状感染者占比较多(40.00%,8/20),疫苗未接种组中确诊病例占比较多(87.27%,48/55),临床分型以普通型占比较多(76.36%,42/55)。疫苗接种组出现临床症状4例,疫苗未接种组出现临床症状16例,以咳嗽和咽痛略多见。见表 2。
4. 病原学检测:
(1)新冠病毒核酸检测:疫苗接种组和疫苗未接种组病例中,新冠病毒基因组2个靶标(ORF1ab和N基因)Ct值比较,疫苗未接种组略高于疫苗接种组,差异无统计学意义(P > 0.05)。见图 1。
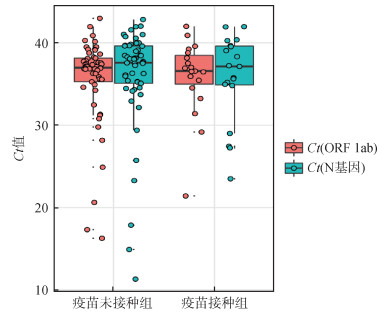
|
| 注:Ct值:每个反应管内的荧光信号到达设定的域值时所经历的循环数 图 1 成都市境外输入病例中新型冠状病毒疫苗接种组和疫苗未接种组的核酸Ct值比较 |
(2)新冠病毒核酸动态检测:疫苗接种组和疫苗未接种组入院后,进行新冠病毒核酸动态检测发现,疫苗接种组中,有11例入院后一直未检出阳性(11/20,55.00%),疫苗未接种组中,有35例入院后一直未检出阳性(35/55,63.64%),差异无统计学意义(P > 0.05)。见图 2。
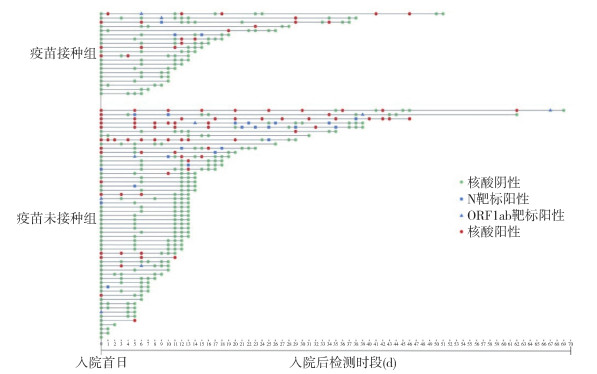
|
| 图 2 成都市境外输入病例中新型冠状病毒疫苗接种组和疫苗未接种组病例入院后新冠病毒核酸动态检测 |
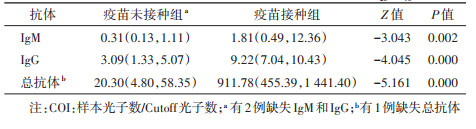
5. 血清抗体检测:新冠病毒血清抗体IgM、IgG和总抗体比较,疫苗接种组均明显高于疫苗未接种组,差异有统计学意义(P < 0.05)。见表 3。
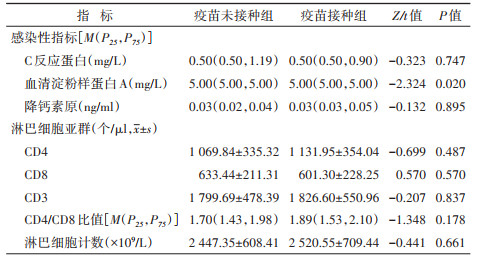
6. 临床指标比较:疫苗接种组和疫苗未接种组中,血清淀粉样蛋白A的中位数均为5.00 mg/L,但两组病例在血清淀粉样蛋白A的差异存在统计学意义(P < 0.05)。见表 4。
2020年1月10日新冠病毒基因序列发布之后,我国及国外多个国家立即开展新冠病毒疫苗研发[5-6]。WHO和美国食品药品监督管理局均指出,控制新冠病毒大流行要求疫苗的最低有效性为50.00%,前期研究发现,各类疫苗有效性介于55.10%~95.00%[7-11],因此,目前接种任何一种新冠病毒疫苗,对防控新冠病毒均是有效的。Amit等[7]、Polack等[8]研究发现,新冠病毒疫苗接种者中,仍然有新冠病毒感染病例,但感染率均低于对照组。本研究20例疫苗接种病例,也证实接种新冠病毒疫苗后仍存在感染风险。
Pawlowski等[11]、Ella等[12]研究分别发现,新冠病毒疫苗接种后的感染病例14 d住院率、重症加强护理病房(ICU)入院率和14 d死亡率均低于疫苗未接种组。Voysey等[9]研究发现,新冠病毒疫苗可减轻感染后的疾病严重程度。本研究发现,疫苗接种组仅4例有临床症状(发热、咳嗽、咽痛和流涕),且无症状感染者的比例较高(40.00%),而疫苗未接种组以普通型为主(76.36%),说明疫苗接种组的临床严重程度低于疫苗未接种组。
《新冠病毒疫苗接种技术指南(第一版)》对新冠病毒灭活疫苗的推荐接种程序为接种2剂,接种间隔建议≥3周,第2剂在8周内尽早完成;对在14 d内完成2剂新冠病毒灭活疫苗接种者,在第2剂接种3周后尽早补种1剂灭活疫苗。对在14~21 d完成2剂接种的,无需补种[13]。本研究中,疫苗接种组20例病例中,有10例(50.00%)一次性接种2剂,且补种间隔未达到≥3周;另有10例(50.00%)未按推荐接种程序分2次接种2剂,仅有5例的2剂间隔时间3~8周。
Xia等[5]研究发现,第1剂次疫苗接种后7 d只有26%的个体产生中和抗体,且间隔接种产生的保护性优于一次大剂量接种。Mulligan等[14]研究发现,单次大剂量接种疫苗会增加疫苗反应原性,但不能增加疫苗免疫原性,也即不能增加疫苗保护力。Zhang等[6]研究发现,间隔28 d接种组的抗体滴度和血清转换率均高于间隔14 d接种组,说明其免疫反应优于间隔14 d接种组。
Bleier等[15]研究发现,部分人即使产生体液免疫,但该免疫反应是暂时和不完全的,随着抗体效价降低,个体可能面临再次感染的风险。Voysey等[9]研究发现,新冠病毒疫苗接种后28 d抗体滴度达到高峰,但在第90天下降34%,到180 d时下降64%。本研究中,疫苗接种组病例发病/检出发生在新冠病毒疫苗接种后87~224 d,可能与抗体效价降低或抗体衰减有关。
另有相关研究发现,新冠病毒感染后第9天的IgM抗体达峰值,并在感染后约14 d消失,IgG抗体在感染后第2周开始出现[16]。大多数恢复期病例的体液免疫反应会产生中和抗体,当再次暴露于新冠病毒时,记忆T细胞被刺激可迅速增殖分化并产生抗体,防止再感染[17]。疫苗接种组病例的新冠病毒血清抗体IgM、IgG和总抗体水平明显高于疫苗未接种组,说明接种疫苗后,人体再次暴露于新冠病毒环境,能迅速产生保护作用。
本研究存在不足。研究对象范围仅限于境外输入病例的调查,疫苗接种组样本量较小,有待进一步收集病例做深入研究。
综上所述,新冠病毒疫苗接种后,仍存在感染新冠病毒的风险,但新冠病毒侵入人体后,体内可迅速产生特异性IgM和IgG抗体,对感染者产生一定保护作用,已接种新冠病毒疫苗的病例分类以无症状感染者为主。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. WHO Coronavirus (COVID-19) Dashboard[EB/OL]. (2021-03-01)[2021-03-11]. https://covid19.who.int/.
|
| [2] |
World Health Organization. Draft landscape and tracker of COVID-19 candidate vaccines[EB/OL]. (2021-02-14)[2021-03-11]. https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines.
|
| [3] |
国家卫生健康委员会办公厅. 新型冠状病毒肺炎防控方案(第七版)[EB/OL]. (2020-09-15)[2021-03-11]. http://www.nhc.gov.cn/jkj/s3577/202009/318683cbfaee4191aee29cd774b19d8d.shtml. General Office of National Health Commission. Protocol of prevention and control for COVID-19(version 7)[EB/OL]. (2020-09-15)[2021-01-01]. http://www.nhc.gov.cn/jkj/s3577/202009/318683cbfaee4191aee29cd774b19d8d.shtml. |
| [4] |
国家卫生健康委员会办公厅, 国家中医药管理局办公室. 新型冠状病毒肺炎诊疗方案(试行第八版)[EB/OL]. (2020-08-18)[2021-03-11]. http://www.nhc.gov.cn/yzygj/s7653p/202008/0a7bdf12bd4b46e5bd28ca7f9a7f5e5a.shtml. General Office of National Health Commission, Office of the State Administration of Traditional Chinese Medicine. Protocol of diagnosis and treatment for COVID-19(trial version 8)[EB/OL]. (2020-08-18)[2021-01-01]. http://www.nhc.gov.cn/yzygj/s7653p/202008/0a7bdf12bd4b46e5bd28ca7f9a7f5e5a.shtml. |
| [5] |
Xia S, Zhang Y, Wang Y, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBIBP-CorV: a randomized, double-blind, placebo-controlled, phase 1/2 trial[J]. Lancet Infect Dis, 2021, 21(1): 39-51. DOI:10.1016/S1473-3099(20)30831-8 |
| [6] |
Zhang Y, Zeng G, Pan H, et al. Safety, tolerability, and immunogenicity of an inactivated SARS-CoV-2 vaccine in healthy adults aged 18-59 years: a randomised, double-blind, placebo-controlled, phase 1/2 clinical trial[J]. Lancet Infect Dis, 2021, 21(2): 181-192. DOI:10.1016/S1473-3099(20)30843-4 |
| [7] |
Amit S, Regev-Yochay G, Afek A, et al. Early rate reductions of SARS-CoV-2 infection and COVID-19 in BNT162b2 vaccine recipients[J]. Lancet, 2021, 397(10277): 875-877. DOI:10.1016/S0140-6736(21)00448-7 |
| [8] |
Polack FP, Thomas SJ, Kitchin N, et al. Safety and Efficacy of the BNT162b2 mRNA COVID-19 Vaccine[J]. N Engl J Med, 2020, 383(27): 2603-2615. DOI:10.1056/NEJMoa2034577 |
| [9] |
Voysey M, Costa Clemens SA, Madhi SA, et al. Single-dose administration and the influence of the timing of the booster dose on immunogenicity and efficacy of ChAdOx1 nCoV-19(AZD1222) vaccine: a pooled analysis of four randomised trials[J]. Lancet, 2021, 397(10277): 881-891. DOI:10.1016/S0140-6736(21)00432-3 |
| [10] |
Voysey M, Clemens SAC, Madhi SA, et al. Safety and efficacy of the ChAdOx1 nCoV-19 vaccine (AZD1222) against SARS-CoV-2:an interim analysis of four randomised controlled trials in Brazil, South Africa, and the UK[J]. Lancet, 2021, 397(10269): 99-111. DOI:10.1016/S0140-6736(20)32661-1 |
| [11] |
Pawlowski C, Lenehan P, Puranik A, et al. FDA-authorized COVID-19 vaccines are effective per real-world evidence synthesized across a multi-state health system[J]. medRxiv, 2021, 2021. DOI:10.1101/2021.02.15.21251623 |
| [12] |
Ella R, Vadrevu KM, Jogdand H, et al. Safety and immunogenicity of an inactivated SARS-CoV-2 vaccine, BBV152:a double-blind, randomised, phase 1 trial[J]. Lancet Infect Dis, 2021, S1473-3099(20): 30942-7. DOI:10.1016/S1473-3099(20)30942-7 |
| [13] |
国家卫生健康委员会. 新冠病毒疫苗接种技术指南(第一版)[EB/OL]. (2021-03-29)[2021-03-30]. http://www.nhc.gov.cn/jkj/s3582/202103/c2febfd04fc5498f916b1be080905771.shtml. National Health Commission. Technical Guidelines for COVID-19 Vaccination (version 1)[EB/OL]. (2021-03-29)[2021-03-30]. http://www.nhc.gov.cn/jkj/s3582/202103/c2febfd04fc5498f916b1be080905771.shtml. |
| [14] |
Mulligan MJ, Lyke KE, Kitchin N, et al. Phase Ⅰ/Ⅱ study of COVID-19 RNA vaccine BNT162b1 in adults[J]. Nature, 2020, 586(7830): 589-593. DOI:10.1038/s41586-020-2639-4 |
| [15] |
Bleier BS, Ramanathan M, Lane AP. COVID-19 Vaccines May Not Prevent Nasal SARS-CoV-2 Infection and Asymptomatic Transmission[J]. Otolaryngol Head Neck Surg, 2021, 164(2): 305-307. DOI:10.1177/0194599820982633 |
| [16] |
Zhou P, Yang XL, Wang XG, et al. A pneumonia outbreak associated with a new coronavirus of probable bat origin[J]. Nature, 2020, 579(7798): 270-273. DOI:10.1038/s41586-020-2012-7 |
| [17] |
Liu WJ, Zhao M, Liu K, et al. T-cell immunity of SARS-CoV: Implications for vaccine development against MERS-CoV[J]. Antiviral Res, 2017, 137: 82-92. DOI:10.1016/j.antiviral.2016.11.006 |
 2021, Vol. 42
2021, Vol. 42