文章信息
- 中华预防医学会.
- Chinese Preventive Medicine Association
- 艰难梭菌感染诊断(T/CPMA 008-2020)
- Diagnosis of Clostridioides difficile infection (T/CPMA 008-2020)
- 中华流行病学杂志, 2021, 42(1): 58-63
- Chinese Journal of Epidemiology, 2021, 42(1): 58-63
- http://dx.doi.org/10.3760/cma.j.cn112338-20201026-01273
-
文章历史
收稿日期: 2020-10-26
本标准按照GB/T 1.1-2009给出的规则起草。
本标准由中华预防医学会归口。
本标准起草单位:中国疾病预防控制中心传染病预防控制所、中国人民解放军总医院、云南省疾病预防控制中心、中国医学科学院北京协和医院、中南大学湘雅医院、复旦大学附属华山医院、四川大学华西医院、杭州医学院、河北医科大学第二医院、南方医科大学南方医院、内蒙古自治区人民医院、山东省立医院。
本标准主要起草人:吴媛、卢金星、闫中强、刘运喜、古文鹏、伏晓庆、徐英春、吴安华、黄海辉、宗志勇、金大智、赵建宏、陈烨、刘卫平、李卫光。
引言艰难梭菌,即难辨梭状芽孢杆菌,是引起抗生素相关性腹泻的重要病原,艰难梭菌感染成为医院获得性腹泻的主要病因,已在欧美国家引起多起暴发流行。美国疾病预防控制中心2017年数据显示,美国每年艰难梭菌感染患者近23万,其中死亡人数超1.2万,产生超10亿美元的疾病负担,因此被列为紧迫的公共卫生威胁之一。近10年来调查研究显示,我国艰难梭菌感染呈快速增长趋势。然而,由于缺乏统一的诊断原则和检测技术规范,我国艰难梭菌感染率和疾病负担尚不明确。为了规范艰难梭菌感染流行病学调查,提高艰难梭菌诊断的准确性,本标准遵循科学性和实用性原则,对艰难梭菌感染诊断所需的诊断依据、诊断原则、诊断和鉴别诊断进行明确规定。
艰难梭菌感染诊断 1 范围本标准规定了艰难梭菌感染的诊断依据、诊断原则、诊断及鉴别诊断。
本标准适用于医疗卫生机构开展艰难梭菌感染的诊断和流行病学调查。
2 术语和定义下列术语和定义适用于本文件。
2.1 腹泻diarrhea24 h内排便次数在3次或以上,不成形便,且伴有粪便性状异常。
2.2 伪膜性肠炎pseudomembranous colitis主要发生在结肠和小肠的急性纤维素渗出性炎症,多是在应用抗菌药物后导致正常肠道菌群失调,艰难梭菌大量繁殖,产生毒素而致。
3 缩略语下列缩略语适用于本文件。
BHI:脑心浸液(Brain heart infusion)
CDI:艰难梭菌感染(Clostridioides difficile infection)
CCTA:细胞毒性试验(Cell cytotoxicity assay)
CCFA:环丝氨酸-头孢西丁-果糖琼脂(Cycloserine-cefoxitin-fructose agar)
CDMN:艰难梭菌拉氧头孢诺氟沙星琼脂(Clostridium difficile Moxalactam Norfloxacin agar)
EIA:酶免疫分析(Enzyme immunoassay)
GDH:谷氨酸脱氢酶(Glutamate dehydrogenase)
MLST:多位点序列分型(Multi-locus sequencing typing)
NAAT:核酸扩增检测(Nucleic acid amplification testing)
TCD:产毒艰难梭菌(Toxingenic Clostridioides difficile)
RT:核糖体分型(Ribo-typing)
4 诊断依据 4.1 危险因素使用抗菌药物、住院史、老年(大于65岁)、使用质子泵抑制剂、化疗、患有慢性肾脏疾病、管饲或其他免疫功能缺陷等。
4.2 临床表现症状可由单一腹泻到发热、腹痛、腹胀、恶心和呕吐等全身性感染症状,重症患者出现伪膜性肠炎,严重的并发症有中毒性巨结肠、肠梗阻、肠穿孔和休克等。
分为轻中度、重度和重度伴并发症:
a)轻中度:腹泻无全身感染表现(白细胞计数 < 15×109/L,血肌酐 < 基线1.5倍);
b)重度:腹泻合并全身感染表现(白细胞计数≥15×109/L,血肌酐≥基线1.5倍),出现伪膜性肠炎;
c)重度伴并发症:腹泻合并全身性感染症状,同时出现并发症包括中毒性巨结肠、低血压或肠梗阻。
4.3 内镜检查下消化道内镜检查提示伪膜性肠炎,主要表现为直肠和乙状结肠黏膜表面多发性、隆起的灰绿色或黄褐色斑片。
4.4 实验室检查 4.4.1 生物安全要求根据原卫生部《人间传染的病原微生物名录》(卫科教发[2006]15号),艰难梭菌的危害程度属于第三类,涉及样本检测和活菌的实验操作在BSL-2级实验室中进行,采用B类(UN3373)包装运输。
4.4.2 粪便样本采集、运输患者在干燥清洁便盆内自然排便(避免使用坐式或蹲式马桶),用无菌采便管/盒挑取粪便中异常的部分(有黏液、脓液或血液的部分)4 g~6 g;液体粪便≥5 ml。
采集的样本需尽快送检培养;4 ℃保存,24 h内完成免疫学检测。
4.4.3 样本的快速检测腹泻样本无须培养,可直接采用商品化的试剂盒对样本中的谷氨酸脱氢酶(GDH)抗原和毒素A/B同时进行检测,如果二者结果不一致,需结合PCR检测tcdB基因,判断样本中有无产毒艰难梭菌。结果判读:
a)GDH+/毒素+:样本中存在产毒艰难梭菌;
b)GDH+/毒素-:PCR检测tcdB基因,tcdB+则样本中存在产毒艰难梭菌,tcdB-则样本中无产毒艰难梭菌;
c)GDH-/毒素+:PCR检测tcdB基因,tcdB+则样本中存在产毒艰难梭菌,tcdB-则样本中无产毒艰难梭菌;
d)GDH-/毒素-:样本中无艰难梭菌。
4.4.4 样本的核酸检测疑似CDI的腹泻样本,无须培养,提取样本DNA进行艰难梭菌特异的细胞毒素基因tcdB核酸片段检测,如果阳性,说明样本中存在产毒艰难梭菌。详细的试验流程参见附录A。
或采用商品化的试剂盒进行tcdB基因的荧光定量PCR检测。
4.4.5 细胞毒性试验(CCTA)将不成形粪便样本,1 500 g离心5 min~10 min,上清液经0.45 μm滤膜过滤,将粪便滤液与Vero细胞共孵育,分别加入抗A和抗B毒素的中和抗体,同时设置阴性对照组(即不加入抗体),37 ℃ 5% CO2培养,24 h、48 h显微镜下观察细胞病变效应(CPE),加入特异性抗体的能阻止该细胞病变,说明样本中存在产毒艰难梭菌。
4.4.6 样本中艰难梭菌的分离培养鉴定腹泻样本中分离培养鉴定获得产毒艰难梭菌。
详细的试验操作规范见附录B。
4.4.7 高毒株RT027型和RT078型艰难梭菌的鉴定高毒株RT027型是引起全球暴发感染的重要型别,具有较高致死率和氟喹诺酮耐药的特征;RT078型是近年来被广泛报道的型别,主要来源于养殖经济类动物,与社区获得性艰难梭菌感染相关。
样本中分离获得的艰难梭菌毒素A、B以及二元毒素(CDT)均阳性,MLST分别为ST1和ST11,RT分别为027型和078型。
详细的试验操作流程见附录C。
5 诊断原则根据危险因素、临床表现、内镜检查和实验室检查进行诊断。
注:2岁以下婴幼儿出现腹泻,不推荐进行艰难梭菌感染的相关检查。
6 诊断 6.1 临床诊断病例符合4.1和4.2的病例。
注:排除有腹泻症状的其他常见肠道疾病,如肠易激综合征、炎症性肠病等。
6.2 确诊病例符合临床诊断病例,同时4.3和4.4.3~4.4.7任一结果阳性的病例。
7 鉴别诊断艰难梭菌感染应与细菌性痢疾、肠侵袭性大肠埃希菌腹泻、沙门菌腹泻、轮状病毒腹泻和诺如病毒感染腹泻等相鉴别。
附录A(资料性附录)样本的核酸检测 A.1 核酸提取取体积约1 ml的粪便样本,试剂盒提取基因组DNA,具体流程参照产品说明书,考虑到艰难梭菌为革兰阳性菌,需溶菌酶前处理30~60 min。
A.2艰难梭菌毒素编码基因的核酸检测 A.2.1检测靶标:tcdB基因 A.2.2检测方案 A.2.2.1普通PCR产物大小203 bp
引物序列:
NK104:GTG TAG CAA TGA AAG TCC AAG TTT ACG C
NK105:CAC TTA GCT CTT TGA TTG CTG CAC CT
反应条件:95 ℃ 5 min;95 ℃ 20 s,55 ℃ 30 s,72 ℃ 60 s,35个循环;延伸72 ℃ 5 min
反应体系(50 μl):
结果判读:1.5%琼脂糖凝胶电泳,203 bp处出现条带,为阳性;否则为阴性。
A.2.2.2实时荧光定量PCR产物大小103 bp
引物和探针序列见表 A.1
反应体系(25 μl):
反应条件:采用两步法PCR扩增标准程序:预变性95 ℃ 30 s 1个循环;PCR反应95 ℃ 3 s,50 ℃ 30 s,40个循环。
结果判读:Ct≤33为阳性,Ct > 35为阴性,33 < Ct≤35为可疑阳性,需重新采集样本重复试验一次。
注:此处列的引物和探针分别为日本kato和加拿大Simon学者报道,国内外多家实验室都在应用,开展流行病学调查和检测。如为临床诊断,可使用批准的商品化试剂盒进行tcdB荧光定量PCR检测。
附录B(规范性附录)艰难梭菌的分离培养和鉴定 B.1培养基的配制 B.1.1环丝氨酸-头孢西丁-果糖琼脂(CCFA):500 ml水加入34.5 g艰难梭菌培养基,121 ℃ 15 min高压灭菌。取1支艰难梭菌选择性添加剂(环丝氨酸-头孢西丁),加入2 ml 0.85%的生理盐水,充分混匀。将混合液加入已冷却至约50 ℃的培养基中,同时加入5%~8%(体积比)的卵黄乳液,轻轻摇匀。倾倒至直径为90 mm平板。4 ℃可保存1个月左右,但推荐使用新鲜配制的培养基进行分离培养。使用前,应先在厌氧环境预还原过夜。
B.1.2艰难梭菌拉氧头孢诺氟沙星(CDMN)培养基:同上,添加比例按照产品说明书。
B.1.3血平板:脑心浸液(BHI),121 ℃ 15 min高压灭菌,添加5%~8%的脱纤维羊血,倾倒至直径为90 mm平板。
B.2样本的预处理和厌氧培养取腹泻粪便样本直接接种,或80 ℃加热10 min后,又或者先与无水乙醇等体积混合,室温放置30 min~60 min后,3 000 r/min离心10 min,取沉淀再接种于预还原的CCFA/CDMN、CHROMID®C. difficile或CHROMagarTM C. difficile等其他选择性平板上,厌氧环境,37 ℃培养24 h~48 h,观察有无可疑菌落。
厌氧环境(任选其一):自封塑料袋/盒+厌氧产气袋+厌氧指示剂;
厌氧罐+催化剂(80% N2,10% H2和10% CO2);
厌氧箱(80%N2,10%H2和10%CO2)。
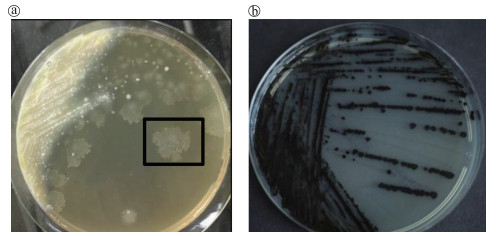
可疑菌落:粪便样本中艰难梭菌在CCFA上菌落呈扁平状,白色或淡黄色不透明的“摊鸡蛋样”,见图 B.1(a)。在CHROMID®C. difficile上,艰难梭菌呈黑色,不规则克隆,见图 B.1(b)。
|
| 图 B.1 粪便样本中艰难梭菌在CCFA(a)和CHROMID®C. difficile(b)上可疑菌落形态 |
将可疑菌落接种于BHI血平板上进行纯化,纯化的典型菌落接种于BHI中,厌氧培养48 h,0.45 μm滤膜过滤培养液,进行CCTA。
B.3.2生化鉴定艰难梭菌能发酵葡萄糖、果糖和甘露醇产酸,不发酵乳糖、麦芽糖和蔗糖,水解七叶苷,液化明胶。不产生吲哚和硫化氢,不产生卵磷脂酶及脂酶,不凝固牛奶。亦可用商品化的试剂来检测,如API20A、Vitek2 Compact或脯氨酸纸片法等商品化检测试剂盒等。
B.3.3酶免疫分析(EIA)鉴定针对艰难梭菌的GDH抗原和毒素A/B进行检测,有多种商品化的试剂盒可供选择,结果判读同正文4.4.3部分。
B.3.4核酸检测鉴定 B.3.4.1针对16S rDNA,扩增产物测序比对将可疑艰难梭菌的单个菌落接种于BHI培养基上,37 ℃厌氧培养24 h,按照细菌基因组DNA提取试剂盒的说明书操作,提取细菌DNA。
16S rDNA基因的扩增:目的条带大小为1 465 bp。
引物序列:27F:5'-AGA GTT TGA TCC TGG CTC AG-3'
1492R:5'-TAC GGT TAC CTT GTT ACG ACT T-3'
反应体系(50 μl)
PCR循环参数:95 ℃ 3 min;94 ℃ 30 s,50 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 6 min。
扩增产物由1.5%琼脂糖凝胶电泳鉴定。
序列比对:扩增产物纯化后,进行DNA序列测定,将测序结果进行拼接,并输入NCBI(https://blast.ncbi.nlm.nih.gov/Blast.cgi)进行比对,确定是否为艰难梭菌。
B.3.4.2针对tpi基因进行普通PCR,1.5%琼脂糖凝胶电泳检测引物序列:tpi-F:AAA GAA GCT ACT AAG GGT ACA AA
tpi-R:CAT AAT ATT GGG TCT ATT CCT AC
产物大小230 bp;
反应体系(25 μl):
反应条件:95 ℃ 3 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,40个循环;72 ℃ 5 min。
结果判读:230 bp处有唯一条带。
B.3.4.3艰难梭菌细胞毒素编码基因(tcdB)的核酸检测应用细菌DNA提取试剂盒,提取纯培养艰难梭菌基因组DNA后,其余操作详见附录A。
或采用商品化的试剂盒进行检测。
B.3.5质谱鉴定应用基质辅助激光解吸电离飞行时间质谱(MALDI-TOF MS),通过获得菌株的蛋白谱图,并与标准数据库进行比对,完成种属鉴定。
附录C(规范性附录)高毒株RT027型和RT078型艰难梭菌的鉴定 C.1多位点序列分型(MLST) C.1.1 DNA提取同(附录B)中的核酸检测,针对艰难梭菌的7个管家基因位点(adk、atpA、dxr、glyA、recA、sodA和tpi)进行扩增,引物序列见表 C.1。
反应体系(50 μl):Premix Taq酶(TAKARA)25 μl,ddH2O 20 μl,上/下游引物(25 pmol/μl)1/1 μl,DNA模板(20~80 ng/μl)3 μl。
PCR循环参数:95 ℃15 min;94 ℃ 30 s,50 ℃ 40 s,72 ℃ 70 s,35个循环;72 ℃ 5 min。
C.1.2测序比对进行双向测序,拼接DNA序列,与数据库(http://pubmlst.org/cdifficile/)进行比对,得到所测得基因位点的特定等位基因值,并形成相应的由7个基因值组成的等位基因谱,判断其序列型(ST)以及clade群。
C.1.3 RT027型和RT078型的基因组合及clade群具体基因组合见表 C.2。
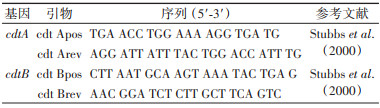
DNA提取同附录B.3.3,针对艰难梭菌的tcdA、tcdB、cdtA、cdtB进行PCR扩增检测。
其中tcdB基因的引物,扩增条件和体系见附录A。tcdA、cdtA和cdtB的扩增引物和条件如下(表 C.3~C.6)。
扩增产物由1.5%琼脂糖凝胶电泳检测。
C.3核糖体分型 C.3.1核酸提取5% chelex-100提取DNA,步骤如下:
a)5% chelex-100(4 ℃保存)制备:取2.5 g chelex-100溶于50 ml已高压的超纯水;磁力搅拌,至树脂均匀分布;使用宽口枪头吸取100 μl chelex溶液移至1.5 ml离心管。
b)用小接种环(1 μl)收集1平环的细菌转移至上述100 μl chelex溶液中,金属浴100 ℃,12 min;14 000 r/min。离心12 min,吸取50 μl上清液存于1.5 ml EP管。
c)用NanoDrop测DNA浓度,可存于-20 ℃,备用。
C.3.2 PCR扩增针对16 s~23 s rDNA基因间隔区(Intergenic Spacer,ITS)进行PCR扩增,根据其产物DNA片段的数量以及大小不同从而进行分型。
PCR引物:Cd16 s:5'-CTG GGG TGA AGT CGT AAC AAG G-3'
Cd23 s:5'-GCG CCC TTT GTA GCT TGA CC-3'
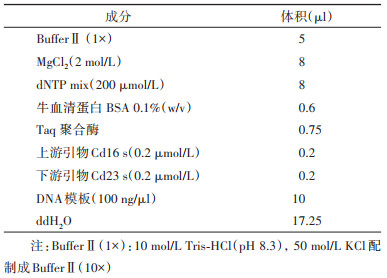
PCR反应体系(50 μl):
每次试验需设置阴性和阳性对照。
PCR循环参数:95 ℃10 min;94 ℃1 min,58 ℃ 1 min,72 ℃ 2 min,25个循环;72 ℃ 7 min。
PCR产物纯化:使用MinElute PCR试剂盒进行纯化,操作步骤遵产品说明书。测PCR纯化产物浓度,稀释至终浓度为10 ng/μl~100 ng/μl(推荐30 ng/μl)。PCR纯化产物可存于-20 ℃,备用。
C.3.3毛细管电泳全自动DNA/RNA分析系统,进行毛细管电泳检测。
参数:选择DNA high resolution卡夹、alignment marker(15 bp~1 kb)、DNA size marker(50 bp~800 bp),选择方法OM500,自动运行,反应终止后,导出结果,使用BioNumerics7.6的QIAxcel模块,结合已建立的核糖体型别库(含ATCC和欧洲艰难梭菌参比实验室的RT027和RT078标准株),通过比对分析是否含有暴发流行株RT027和RT078。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
McDonald LC, Gerding DN, Johnson S, et al. Clinical practice guidelines for Clostridium difficile infection in adults and children:2017 update by the infectious disease society of American (IDSA) and society for healthcare epidemiology of American (SHEA)[J]. Clin Infect Dis, 2018, 66(7): e1-48. DOI:10.1093/cid/cix1085 |
| [2] |
European surveillance of Clostridium difficile infections-Surveillance protocol version 2.3. ECDC, 2018.
|
| [3] |
Laboratory procedures for diagnosis and typing of human Clostridium difficile infection. ECDC, 2018.
|
| [4] |
Crobach MJ, Planche T, Eckert C, et al. European society of clinical microbiology and infectious diseases (ESCMID):update of the diagnostic guidance document for Clostridium difficile infection[J]. Clin Microbiol Infect, 2016, 22(Suppl 4): S63-81. DOI:10.1016/j.cmi.2016.03.010 |
| [5] |
Bagdasarian N, Rao K, Malani PN. Diagnosis and treatment of Clostridium difficile in adults a systematic review[J]. JAMA, 2015, 313(4): 398-408. DOI:10.1001/jama.2014.17103 |
| [6] |
中华人民共和国国家卫生和计划生育委员会.WS/T 498-2017细菌性腹泻临床实验室诊断操作指南[EB/OL].(2017-01-15)[2020-06-25].http://www.nhc.gov.cn/ewebeditor/uploadfile/2017/02/20170209182821983.pdf. National Health and Family Planning Commission of the People's Republic of China.WS/T 498-2017 Performance guideline for clinical laboratory diagnosis of bacterial diarrhea[EB/OL].(2017-01-15)[2020-06-25]. http://www.nhc.gov.cn/ewebeditor/uploadfile/2017/02/20170209182821983.pdf. |
| [7] |
Wu Y, Liu C, Li WG, et al. Independent microevolution mediated by mobile genetic elements of individual Clostridium difficile from clade 4 revealed by whole-genome sequencing[J]. mSystems, 2019, 4(2): e00252-18. DOI:10.1128/mSystems.00252-18 |
| [8] |
Liu XS, Li WG, Zhang WZ, et al. Molecular characterization of Clostridium difficile Isolates in China from 2010 to 2015[J]. Front Microbiol, 2018, 9: 845. DOI:10.3389/fmicb.2018.00845 |
 2021, Vol. 42
2021, Vol. 42