文章信息
- 中华预防医学会.
- Chinese Preventive Medicine Association
- 儿童轮状病毒胃肠炎免疫预防专家共识(2020版)
- Expert consensus on immunoprophylaxis of childhood rotavirus gastroenteritis (2020 version)
- 中华流行病学杂志, 2021, 42(1): 44-57
- Chinese Journal of Epidemiology, 2021, 42(1): 44-57
- http://dx.doi.org/10.3760/cma.j.cn112338-20201103-01298
-
文章历史
收稿日期: 2020-11-03
A组轮状病毒(rotavirus,RV)是全球 < 5岁儿童重度胃肠炎和死亡的主要病原,几乎每名儿童在5岁之前均感染过≥1次RV[1]。轮状病毒胃肠炎(rotavirus gastroenteritis,RVGE)住院患者多为 < 2岁婴幼儿,重症或死亡病例主要为 < 1岁婴儿[1-2]。中国 < 5岁儿童腹泻死亡中RVGE导致的死亡占35%[3]。RVGE尚无特效治疗药物,卫生条件的改善不能有效控制RV的传播,接种疫苗是预防RVGE的最有效措施[1, 4-5]。2013年WHO提出了“肺炎和腹泻综合全球行动计划”,该计划的目标之一是至2025年全球可预防的重度腹泻比2010年降低75%[6]。
目前在中国上市使用的RV疫苗包括2001年上市的口服RV活疫苗(Lanzhou lamp rotavirus vaccine,LLR)和2018年上市的口服五价重配RV减毒活疫苗(pentavalent human-bovine reassortant rotavirus vaccine,RV5)。两种疫苗现均未纳入国家免疫规划(national immunization program,NIP)。2019年,中华预防医学会组织流行病学、病毒学、免疫学、儿科学、卫生管理等专家研讨中国儿童RVGE免疫预防策略。本共识通过检索PubMed、Medline、EBSCO、中国维普、中国知网等期刊数据库,收集和分析RVGE疾病负担、RV疫苗保护效力和效果、RV疫苗安全性等已发表文献,结合中国RV疾病监测数据、WHO关于RV疫苗立场文件和专家研讨意见编写而成,旨在为中国儿童RV疫苗使用提供相关科学信息,供专业技术人员在相关工作中参考使用。
二、病毒基本特征RV属于呼肠孤病毒科(Reoviridae)轮状病毒属,是无包膜双链RNA病毒。病毒颗粒分为外层衣壳、内层衣壳和核心三层,内含11个双链RNA片段组成的病毒基因组,编码6个结构蛋白和6个非结构蛋白[7]。不同RV在感染同一宿主细胞时,11个RNA片段可能会在病毒增殖过程中发生重配(reassortment),这也是自然界中大量不同RV株出现和存在的重要原因之一。根据内层衣壳蛋白VP6抗原特征将RV分为10个组群(group)(A~J组)[8]。A组RV可感染人和多数哺乳动物,也是 < 5岁儿童急性胃肠炎(腹泻)最为常见的病原体[9]。外层衣壳蛋白VP7和VP4分别决定RV不同的G血清(基因)型(G型)和P血清(基因)型(P型)。由于G型与P型的变化可以是独立的,通常采用G和P双命名系统来确定毒株类型[7]。全球最常见感染人类的A组RV有6个G型(G1、G2、G3、G4、G9、G12)和3个P型(P[4]、P[6]、P[8])。在G和P组合中,G1P[8]、G2P[4]、G3P[8]、G4P[8]、G9P[8]和G12P[8]约占所有人类RV毒株的90%以上[7]。不同的毒株可以同时在自然界中循环,优势流行毒株也可以因地理区域和流行季节的变化而不同或改变[10]。
RV抵抗力较强,可通过胃酸屏障进入小肠造成感染。RV在外环境中相当稳定,在饮用水和生活用水中可存活数日至数周,在人手上可存活≥4 h,约50%湿度条件有利于RV在空气和物体表面存活,其感染性可保持数天[11]。含氯消毒剂(游离氯 > 20 000 ppm)、含碘消毒剂(游离碘 > 10 000 ppm)、含70%乙醇的0.5%w/v葡萄糖酸氯己定或含 > 40%异丙醇的季铵化合物、高浓度(95%)的乙醇、紫外线、高温(潮湿100 ℃或干燥60 ℃)对病毒具有较好的杀灭作用[12]。RV感染剂量低,< 100个病毒粒子即可感染[13]。感染RV的患者发病第2~5天粪便中病毒量最大,初次感染的患者其粪便排毒量很高(每克含1012个病毒粒子)[1]。RV感染主要影响小肠绒毛顶端的成熟肠道细胞,细胞被破坏后,会影响营养物质的消化吸收,引起分泌性腹泻[1]。通常认为RV型别与感染后的临床严重程度无关[1]。
三、免疫保护1.免疫保护性机制:RV感染可诱导体液免疫和细胞免疫。RV的VP4(P型)和VP7(G型)蛋白对机体免疫力有重要作用,可诱导型特异性和型交叉性中和抗体[14]。RV疫苗可诱导异型免疫,这可能是由于诱导了针对VP4或VP7上异型表位的保护性抗体反应,针对VP6或NSP1上共同抗原产生的抗体保护作用,或者是诱导了交叉反应的保护性T细胞反应[15]。病毒感染后血清中RV特异性IgG抗体水平升高,具有中和病毒的作用[16]。血清中RV特异性IgA具有中和抗体活性,对感染后的病毒及时清除以及预防再次感染起着至关重要的作用[17]。肠道内RV特异性分泌性IgA也在长期抵御RV感染中发挥主效应[18]。粪便中RV特异性IgA水平与抗RV感染有关。细胞介导的免疫反应很可能与保护力和疾病恢复有关[19]。
2.初次感染与重复感染的保护效力:在墨西哥、几内亚比绍及印度等进行的队列研究发现,RV初次感染引起的RVGE严重程度明显重于重复感染,初次感染可以减少后续感染的次数及严重程度,且随着感染次数的增加保护率增强[20-22]。这表明RV的重复感染可诱导长期的免疫保护,提示开发和应用疫苗预防RV感染的可行性及预防初次感染的重要性。墨西哥、几内亚比绍的研究显示,初次感染对后续RVGE的保护效力为70%~77%,二次感染后对后续中度到重度RVGE的保护效力为100%[20-21];而印度的研究显示,婴幼儿在初次感染后对后续RVGE的保护效力为43%,重复感染3次以后才会对后续的中度到重度RVGE保护效力达到79%[22]。其原因在于印度儿童相较于墨西哥、几内亚比绍儿童首次感染RV的时间较早,印度6月龄儿童中有56%已感染RV[22],而墨西哥、几内亚比绍这一比例只有34%和26%[20-21]。儿童早期感染比例高与当地全年RVGE流行强度和环境中RV高病毒载量有关。鉴于诱导RV中和抗体的能力取决于年龄,儿童的早期感染可能不会诱导有效的保护性免疫应答。因此,亚洲和非洲地区最贫穷国家儿童的早期感染会影响疫苗保护效力,导致自然感染和疫苗接种的效果减弱[22]。
3.交叉保护:RV不同型间具有不完全的交叉保护作用,但自然感染或者接种疫苗后所产生的RV不同型别交叉反应的机制尚不完全清楚[16, 23]。墨西哥随访两年的研究显示,初次感染后所产生抗体可针对同型反应和不同型别交叉反应,但针对同型反应更强烈,重复感染可诱导更广泛的血清型抗体反应[20]。而印度研究显示,第2次或第3次RV感染后对后续的感染可产生同型和不同型别的交叉保护[22]。
国际上广泛使用的单价RV疫苗(Rotarix,RV1,GlaxoSmithKline)的毒株型别为G1P[8],相较于五价RV疫苗(RotaTeq,RV5,Merck & Co.,Inc.)包含的毒株型别(G1~G4、P[8])较少,但在全球上市后使用的结果显示,RV5与RV1的保护效果相似,在亚洲及非洲的研究也显示RV1对于非疫苗株型别有较好的保护作用,说明疫苗的使用可以在儿童中引发广泛的异型保护性免疫[24]。
四、临床表现和诊疗1. RVGE:典型病例的潜伏期为1~3 d,平均2 d(95%CI:1.4~2.4 d)[25]。主要临床表现为腹泻、呕吐、发热等,因腹泻和呕吐导致不同程度脱水,进而引起电解质紊乱,严重者出现休克、死亡。重度RVGE占腹泻住院患儿的40%~60%[26]。< 2岁的RVGE患儿出现重度腹泻的比例高于 > 2岁患儿,可发生多次感染。
妊娠32周以前出生的早产儿,由于胎盘母传抗体被动转移不足、减少或受损,可增加发生严重RVGE和住院的风险。低出生体重(1 500~2 499 g)和极低出生体重(1 500 g)的婴儿,可因RVGE住院的风险最高[27]。先天性免疫功能低下或因器官移植而进行抗排异反应治疗的儿童或成年人都易发生重型的迁延性RVGE[2]。
2.并发症:RV可进入血液引起全身感染。约90%的RV感染儿童可在症状出现后的5 d内发生抗原血症[28],在RVGE患儿血浆以及死于RV感染的患儿脑脊液、腹水、肺组织中可检测到RV抗原[29]。部分RVGE患儿可并发肺炎、神经系统以及自身免疫性疾病,如良性发热性惊厥、其他癫痫发作(发热或无发热)、急性脑膜炎、急性小脑炎、脑白质病变、急性出血性脑水肿、新生儿坏死性小肠结肠炎、Ⅰ型糖尿病、乳糜泻等[30-31]。
3.诊断与治疗:根据病例的流行病学特征、临床表现和实验室检测结果进行诊断。实验室检测可采用酶免疫试验(enzyme immunoassay,EIA)检测粪便标本中RV抗原,或应用反转录聚合酶链式反应(reverse transcription polymerase chain reaction,RT-PCR)等方法检测病例粪便/呕吐物中RV核酸,或进行RV分离培养并用中和试验鉴定病毒。
目前尚无针对RV的特异药物,临床上主要针对脱水和电解质紊乱等进行对症治疗[1]。补锌、母乳喂养也是必要的。补锌有助于缩短病程,降低腹泻严重程度,减少腹泻粪便量,进而改善患者的预后,减少腹泻病复发[32]。抗菌素对RV无效,但可用于RVGE合并细菌感染的控制。
五、流行病学特征1.传染源和传播方式:RV患者和隐性感染者(无症状的病毒感染者)是主要传染源。隐性感染者在新生儿、儿童和成人中常见[33],包括卫生保健工作者。RV主要通过粪-口途径直接传播,也可通过接触被粪便(或呕吐物)及其飞沫污染的物品、手、用具等间接传播,进食被病毒污染的水和食物也可能引起感染[13]。通常感染者从发病前2 d和出现症状后4~8 d内通过粪便排出大量病毒[13],免疫缺陷的RV感染者的排毒时间会更长。
2.人群易感性:RV的VP4蛋白裂解后的VP8*在受体识别中发挥着重要功能。早期研究显示唾液酸是某些动物RV结合的受体,而后来发现人和多数动物RVs是唾液酸不敏感的[34]。近来研究表明,组织血型抗原(histo-blood group antigen,HBGA)和黏蛋白核心(mucin core)等可以与某些P型VP8*蛋白结合,是RV的潜在受体[35-36]。RV与糖受体的结合与P型有关,具有型别特异性。人群中广泛流行的P[4]、P[6]、P[8]型RV可以与不同类型的HBGA和黏蛋白核心相互作用,其中P[6]只结合H1型HBGA,P[8]/P[4]既与H1型HBGA相互作用,也可以与黏蛋白核心2/4/6及lewis b血型抗原结合;不常见的人P[9]、P[14]、P[25]型RV特异性结合A型HBGA;感染新生儿的P[11]型RV结合Ⅰ型和Ⅱ型HBGA前体[36-37]。流行病学研究显示,P[8]和P[4]RV倾向感染分泌型血型个体,P[6]RV感染lewis阴性血型个体而与分泌型血型无关[38-39]。分泌型和lewis型取决于机体糖基转移酶FUT2和FUT3基因表达,FUT2等糖基转移酶负责调控个体HBGA的表达[40]。HBGA等型别在不同地区和人群中的分布会影响全球RV型别的流行以及人体对疫苗毒株的敏感性,从而影响RV疫苗的保护效力[40]。
3.发病人群:RV感染以 < 5岁儿童为主,几乎所有儿童在5岁之前都感染过≥1次RV。17%的RVGE住院发生于出生后6个月内婴儿,40%和75%分别发生于 < 1岁和 < 2岁的儿童[41]。RV感染导致的死亡主要发生在 < 1岁儿童[1]。2008- 2016年全球RV监测网络(global rotavirus surveillance network,GRSN)数据显示,国际上疫苗使用之前RVGE的中位年龄为12月龄,而在疫苗使用之后,RVGE的中位年龄为15月龄。在未使用RV疫苗的情况下,RVGE的患儿中0~5月龄占18%,6~11月龄占39%,12~23月龄占29%;而RV疫苗接种后,0~5月龄和6~11月龄所占比例下降(13%,32%),12~23月龄占比上升(36%)[42]。
中国2009-2016年哨点医院 < 5岁RVGE住院患儿中,年龄分布接近未使用RV疫苗的情况,0~5月龄占16%,6~11月龄占37%,11~23月龄占38%;重度RVGE多见于6~24月龄儿童[43]。2014年全国报告法定传染病“其他感染性腹泻”病例中,RVGE确诊病例以 < 5岁儿童为主,占RVGE确诊病例总数的92.2%;≤1岁婴幼儿占总确诊病例的79.8%,提示≤1岁的婴幼儿是RV感染的主要人群[44]。中国传染病报告数据和哨点监测结果均显示 < 2岁儿童发病人数多,重症比例高,是RVGE防控的重点人群。由于RVGE重症病例中0~5月龄所占比例超过15%,因此要有效预防RVGE,应尽早接种RV疫苗。
4.流行季节:RVGE全年均可发生。全球各地区RV流行的模式差别较大。在四季分明的地区RV感染主要发生在秋冬季节,但在季节性不明显的热带地区,RV全年流行强度相差不大,不具有明显季节性流行特征。在非洲、南亚和亚洲某些地区,RV的高发季节检出率为31%~48%;低发月份为15%~23%;而在北美、欧洲地区和澳大利亚,RV秋冬季高发月份的检出率为17%~60%,夏季低发月份检出率为4%~11%[45]。RV疫苗的使用不仅可显著降低RV流行高峰,且可推迟RV流行的高峰季节。美国2006年将RV疫苗纳入NIP后,2007-2008年监测数据显示RV季节性流行高峰相较于RV疫苗使用前时间推迟,分别推迟15周和8周[46]。因此RV疫苗的使用可改变RV流行的季节性特征,连续监测十分必要。
2008-2016中国RV哨点监测显示,中国RV流行具有明显的季节性,RVGE发病人数一般从10-11月开始增多,12月至次年1月达高峰,高峰月份RV检出率为60%~70%;6-7月为RV流行低发季节,检出率为5%~10%;南方流行高峰可晚于北方1~2个月[43]。
5.流行地区:RVGE在全球广泛流行。RV检出率有地区性差异。2008-2016年GRSN监测发现,在尚未将RV疫苗纳入NIP的地区,急性胃肠炎(acute gastroenteritis,AGE)住院患儿中RV检出率为38.0%(95%CI:4.8%~73.4%),其中非洲地区为38.2%、美洲地区37.5%、东地中海地区35.7%、欧洲地区36.3%、东南亚地区37.2%和西太地区42.3%;在将RV疫苗纳入NIP的地区,AGE住院患儿中RV检出率下降为23%;纳入疫苗后RV总体检出率相对降低了39.6%(95%CI:35.4%~43.8%),其中非洲地区下降幅度为34.5%(95%CI:27.0%~42.0%)、美洲地区为39.6%(95%CI:29.7%~49.4%)、东地中海地区为26.4%(95%CI:15.0%~37.8%)、欧洲地区为55.2%(95%CI:43.0%~67.4%)[42]。
2009-2016年中国RV监测网络数据显示,AGE病例中RV总检出率为29%,不同省份AGE住院儿童检出率变化范围较大(10%~55%);东部地区检出率(30%)显著低于中西部地区(40%);2012-2016年 < 5岁AGE病例中RV检出率从40%下降至30%[43]。
6. RV流行毒株:中国RV监测的数据显示,2012年后中国主要流行的RV毒株为G9P[8]、G3P[8]、G1P[8]、G2P[4]和G4P[8][43],在每个时间段内均未观察到中国不同地区之间存在优势基因型差异。1998-2000年中国 < 5岁儿童腹泻病例中RV流行株主要是G1型(72.7%),其次为G3型(14.2%)和G2型(12.1%)[47],2003年8月至2007年7月G3型变为优势流行株,构成比超过50%[48]。2009-2010年G3型仍然是中国主要的RV流行毒株,但G1型和G9型的比例增加[43]。2012-2017年G9P[8]取代G3P[8]成为优势毒株,占比达78%,至2018年G9P[8]占91.56%[43]。
7.疾病负担:2016年全球超过2.58亿 < 5岁儿童感染RV,发病率为0.42例/人年,重度RVGE发病率为29.4/1 000人年,约18 882 800例。1990- 2016年间,< 5岁儿童RVGE死亡率下降48.2%,但2016年全球 < 5岁儿童仍因RVGE死亡12.85万例。2016年接种RV疫苗挽救了2.8万名 < 5岁儿童的生命[49]。亚洲地区2000-2011年荟萃分析发现,每年 < 5岁儿童RVGE住院率为2.1‰~20.0‰,每年导致约14.5万人死亡;每年治疗RVGE总成本(包括直接医疗费用、直接非医疗费用和间接费用)最高的国家是中国(3.65亿美元)、日本(2.54亿美元)和印度(0.14亿~0.72亿美元)[50]。
中国农村2011-2013年以人群为基础的研究显示,北方和南方 < 5岁儿童RVGE年发病率分别为54.7‰和45.6‰[51]。基于中国儿童死亡监测网、全国RV监测网数据,采用WHO推荐的死亡估计方法进行估计,2003-2012年中国 < 5岁儿童因RVGE死亡总计约为53 559例,其中92.7%(49 649例)的RVGE相关死亡发生在农村;2012年农村 < 5岁儿童RV年死亡率为0.33‰,是城市儿童同期死亡率(0.03‰)的11倍[52]。2006-2007年基于医院的调查显示,华东地区5个海滨城市的RVGE病例门诊诊治费约为40.73美元/次、住院诊治费用为559.48美元/次;估算中国RVGE年就诊300万人,经济负担直接成本约20亿元,总成本约27亿元[53]。
RV也可造成院内感染,常发生在3~36月龄儿童,也可以造成新生儿和老年人感染[54]。院内感染的儿童因延长了住院时间,每人额外增加住院费用为500~2 500美元[54]。
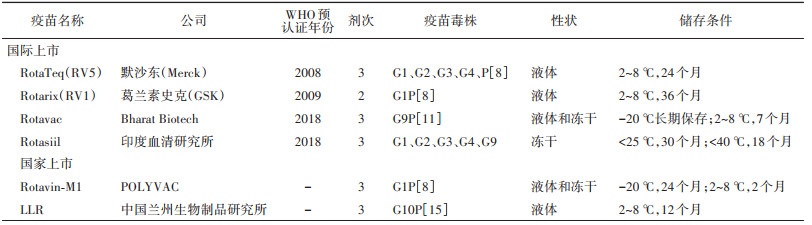
六、RV疫苗的有效性和安全性1. RV疫苗:目前全球6个上市使用的RV疫苗均为口服减毒活疫苗,其中4个通过WHO预认证,包括RotaTeq(RV5,默沙东公司,2008年预认证)、Rotarix(RV1,葛兰素史克公司,2009年预认证)、Rotavac(Bharat Biotech,2018年预认证)和Rotasiil(印度血清研究所,2018年预认证)。其中最近完成WHO预认证的2个疫苗Rotavac和Rotasiil仅在印度和巴勒斯坦使用。另外2个疫苗仅在生产国使用(Rotavin-M1在越南,LLR在中国)。6个RV疫苗的基本特点[55],见表 1。
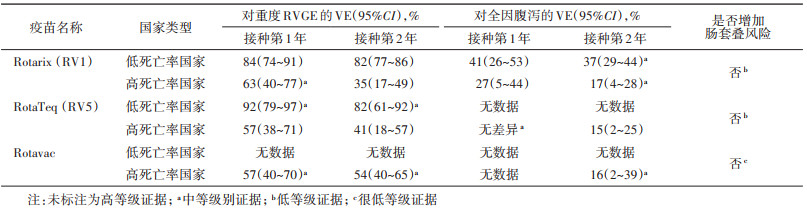
根据Cochrane对截至2018年4月发表文献的综述研究显示[56],RotaTeq、Rotarix和Rotavac三种疫苗具有良好的安全性,对重度RVGE和所有原因所致胃肠炎的保护效力良好,且在低死亡率国家的保护效力优于高死亡率国家,未发现RV疫苗接种会增加肠套叠的发病风险(表 2)。
有研究表明,2006-2019年全球49个国家在 < 5岁儿童中RVGE住院率降低59%(46%~74%),AGE住院率降低36%(23%~47%),AGE死亡率降低36%(28%~46%)[57]。在较小年龄组实施RV疫苗接种的低儿童死亡率国家和在RV疫苗覆盖率较高的国家,RVGE住院率降低的幅度较大[57]。在因腹泻住院的 < 5岁儿童中,RV疫苗引入前的平均RV阳性率为40%(28%~45%),实施RV疫苗接种4年后平均RV阳性率为20%(20%~20%)[57]。总体上RV疫苗对RVGE所致的住院和死亡产生持续影响[57]。此结果对仍在考虑实施RV疫苗接种推广的国家提供了支持证据。
中国截至2020年11月前批准上市使用的RV疫苗包括2018年上市的口服五价重配RV减毒活疫苗(RV5)和2001年上市的LLR。此外,兰州生物制品研究所的三价人-羊重配口服减毒活疫苗(LLR3)包含3种人-羊RV重配株,分别为G2、G3、G4血清型,在2012-2014年完成了Ⅲ期临床试验,结果显示对重度RVGE的保护效力良好,且具有较好的安全性[58];武汉生物制品研究所的口服六价重配RV活疫苗包含6种人-牛RV重配株,为G1、G2、G3、G4、G8和G9血清型,目前正在进行Ⅲ期临床试验。
2. RV5:
(1)疫苗简介:RV5由来自人-牛(WC3)毒株重配的G1、G2、G3、G4和P1A[8]5种型别RV重配株组成,每剂2 ml。RV5疫苗说明书接种程序为:接种对象为6~32周龄婴儿,全程需服用3剂,出生后6~12周龄口服第1剂,每剂间隔4-10周,第3剂次不应晚于32周龄[59]。
(2)免疫原性:在临床试验中,A组RV特异性血清IgA抗体滴度的升高被用作测定RV5免疫原性的指标之一。在接种疫苗前和第3剂次接种后的2~6周收集血清,定义抗体效价比基线升高3倍或更高为阳转。试验结果发现,疫苗接种组IgA抗体血清阳转率为93%~100%,而安慰剂组血清阳转率为12%~20%,两组具有显著性差异[59]。这表明RV5的免疫原性良好。
(3)保护效力和效果:RV疫苗的保护效力最主要是针对RVGE导致的重症和死亡。一般国际上使用2种评分方法作为重度RVGE的判断标准,包括Clark评分≥17和Vesikari评分≥11可判断为重度RVGE病例。Ⅲ期临床试验从疫苗对重度RVGE和对任何程度RVGE保护效力来衡量RV疫苗的效果。
RV5上市前在国际上和中国进行的Ⅲ期临床试验均显示,RV5对重度RVGE有良好的保护效力。在11个国家和地区近7万名婴儿中开展的随机、双盲、安慰剂对照研究显示,RV5对任何血清型所致重度RVGE的保护效力为98.0%(95%CI:88.3%~99.9%)(Clark评分≥17)[59-60]。对G1~G4血清型导致的任何程度RVGE的保护效力为74.0%(95%CI:66.8%~79.9%)[60]。疫苗对住院和急诊RVGE保护效力分别为:G1型95.1%(95%CI:91.6%~97.1%)、G2型87.6%(95%CI:0%~98.5%)、G3型93.4%(95%CI:49.4%~99.1%)、G4型89.1%(95%CI:52.0%~97.5%)、G9型100%(95%CI:67.4%~ 100.0%)和G12型100%(95%CI:0%~100.0%)[60]。在中国广西壮族自治区4 040名6~12周龄健康婴儿中的随机、双盲、安慰剂对照研究显示,该疫苗对预防任何血清型重度RVGE的保护效力为95.5%(95%CI:71.9%~99.9%)(Clark评分≥17)和78.9%(95%CI:59.1%~90.1%)(Vesikari评分≥11),预防任何血清型导致的任何程度RVGE的保护效力为69.9%(95%CI:55.2%~80.3%)[61]。针对G9血清型导致的任何程度和重度RVGE的保护效力分别为67.4%(95%CI:45.2%~81.4%)和88.3%(95%CI:67.1%~97.0%)(Vesikari评分≥11)[61]。
RV5于2006年在国外上市后的保护效果研究较多,而RV5在中国于2018年上市,目前缺乏中国上市后保护效果的数据。美国2006年将RV5纳入NIP,RV5疫苗的保护效果分析显示,接种1剂疫苗对预防RVGE住院和急诊的保护效果为69%(95%CI:13%~89%),2剂次为81%(95%CI:13%~96%),3剂次为88%(95%CI:68%~96%)[62]。表明接种3剂次保护效果最好,但没有完成完整3剂次接种仍可获得一定程度的早期保护。而且与疫苗引入前(2001-2006年)相比,疫苗引入后(2007-2016年)美国接种RV疫苗的0~4岁儿童RVGE住院风险降低了95%[63]。2009年芬兰将RV疫苗纳入NIP后,与2006-2008年相比,2012-2014年的RVGE门诊患者和住院治疗者减少90%;此外,RVGE在所有全因腹泻病例中的占比从52%下降至12%[64]。在法国布雷斯特和7个郊区开展的上市后注册研究显示,完成RV5免疫程序使RVGE住院的相对危险度降低98%(95%CI:83%~100%)[65]。奥地利2008年将RV疫苗纳入NIP,1年后儿童RVGE住院率下降75%,并对其他年龄组有一定的间接保护作用,2010年和2011年15岁以下儿童RVGE住院率分别下降了70%和64%[66]。日本6~12周龄健康婴儿接种RV5的研究显示,对任何程度RVGE的保护效果为74.5%(95%CI:39.9%~90.6%),对中重度RVGE的保护效果为80.2%(95%CI:47.4%~94.1%),对重度RVGE的保护效果为100%(95%CI:55.4%~100.0%)[67]。RV5在拉丁美洲地区12个低收入和中高收入国家引入后的研究显示,对重度RVGE的保护效果为74%(95%CI:69.0%~78.0%),对RVGE所致住院的保护效果为73%(95%CI:66.0%~78.0%)[68]。
从已发表的资料看,RV5对于重度RVGE的保护效果好,完成全程接种的保护效果为88%~100%。将RV5纳入NIP且接种率超过70%的国家,接种儿童中RVGE的住院率和急诊率均有明显的下降。
(4)安全性:国外Ⅲ期临床试验69 625名受试者在任何一剂接种后42 d之内,RV5受试者和安慰剂受试者发热(40.9% vs. 43.0%)、呕吐(12.8% vs. 13.4%)、腹泻(19.7% vs. 19.1%)和便血(0.6% vs. 0.6%)的发生率均相似,RV5受试者和安慰剂受试者肠套叠发生率(1.7/万vs. 1.4/万)无显著性差异[60]。表明疫苗安全性良好。
中国Ⅲ期临床试验4 040名婴儿在任何一剂接种30 d内,RV5受试者和安慰剂受试者发热(21.84% vs. 22.83%)、呕吐(2.68% vs. 3.52%)、腹泻(20.15% vs. 20.11%)的发生率相似,无显著性差异[61]。在第1剂接种后7 d内,5.31%(107/2 015)的RV5受试者和4.75%(96/2 019)的安慰剂受试者报告了腹泻,无显著性差异[61]。疫苗组报告2例肠套叠病例,1例于首剂接种后32 d发生,1例于第3剂接种后53 d发生,分析显示与疫苗接种无明显关联性[发生率差值为0.10%(95%CI:-0.09%~0.36%),P=0.157][61]。2例病例通过空气灌肠后2 d和7 d康复[61]。
RV5无论在国外还是国内的Ⅲ期临床试验均显示出良好的安全性,常见的不良反应包括发热、腹泻、呕吐等在疫苗组和安慰剂组无差异,并且接种后未发现肠套叠的风险增加[60-61]。
RV5的一系列上市后研究对接种后的一般反应和是否增加肠套叠的风险进行评估,不同来源与方法的数据所得结果不尽相同。美国通过疫苗不良事件报告系统(Vaccine Adverse Events Reporting System,VAERS)和疫苗安全性数据链接(Vaccine Safety Datalink,VSD)进行的上市后安全性监测显示,1 400万剂RV5接种后,未发现其他严重不良事件的风险增加,包括便血、脑膜炎、脑炎、癫痫、川崎病、心肌炎或革兰阴性脓毒症风险均未增加[69]。监测数据显示RV5接种后肠套叠的风险没有增加[69]。中国台湾地区RV5上市后,肠套叠总住院率平均为75.1/10万,较上市前更低(OR=0.84,95%CI:0.76~0.92),疫苗上市后6~14周龄婴儿肠套叠住院率没有增加[70]。
基于美国、德国、以色列、澳大利亚和日本的回顾性队列研究及自身对照病例系列(self-controlled case series,SCCS)研究芸萃分析结果显示,RV5在首剂接种后1~7 d有增加肠套叠风险的可能,相对风险(RR)为3.45~9.89,而第2剂和第3剂接种后则不增加肠套叠的风险。第1剂次RV疫苗接种年龄越小(< 3月龄),肠套叠增加的风险越低[71]。
全球疫苗安全咨询委员会(GACVS)在2011年和2013年对RV5安全性进行审核评估显示,总体上RV5接种后发生肠套叠的风险远低于1999年已退市的第一个RV疫苗(Rotashield),确信RV疫苗预防严重腹泻的效益大于潜在的薄弱的肠套叠风险[72-73]。
(5)免疫持久性和长期保护效果:RV5上市后观察显示其免疫持久性良好。2012-2013年美国一项病例对照研究观察完成3剂次RV5接种对预防RVGE住院和急诊风险,第1、2、3、4、5年和6~7年的保护效率分别为91%(95%CI:78%~96%)、82%(95%CI:69%~89%)、88%(95%CI:78%~93%)、76%(95%CI:51%~88%)、60%(95%CI:16%~81%)和69%(95%CI:43%~84%)[74]。表明在接种后第7年(7岁年龄组)仍可观察到显著的保护效果,RV5可提供≥7年的型别特异性保护[74]。这表明RV5在接种后有效保护持续时间较长,可保护儿童度过RVGE高风险时期。
3. LLR:
(1)疫苗简介:LLR由羔羊RV弱毒株G10P[15]型接种新生小牛肾细胞,经培养、收获病毒液、加稳定剂后制成,每剂3 ml。LLR疫苗说明书免疫程序为:主要用于2个月至3岁婴幼儿;每年应服1剂次[75]。
(2)免疫原性:对53名儿童接种1剂LLR,采集免疫前和免疫后4~5周血清,检测G1、G2、G3、G4和G10型RV中和抗体,结果显示免疫前阴性者的G1、G2、G3、G4、G10型各型抗体阳转率为63.16%~76.47%,抗体≥4倍增长率为45.28%~ 60.38%[76]。
(3)保护效力和效果:基于目前已发表文献,未见LLR上市前Ⅲ期临床试验保护效力的数据,只有对于上市后保护效果的评估。广州市、正定市和北京市进行的3项病例对照研究显示,接种≥1剂LLR对预防任何程度RVGE的保护效果为35%,对重度RVGE的保护效果为52%~88%[77-79]。对于G3型和G9型导致的重度RVGE具有一定的保护效果,分别为52%和40%[78-79]。另外,对广州市一项病例对照研究的进一步分析显示,2~6月龄和7~11月龄组接种1剂次LLR的保护效果分别为90%和73%,12~23月龄接种的保护效果无显著性[80]。这提示“早接种”LLR的保护效果优于晚接种。
关于LLR上市后保护效果的研究比较局限,上述研究显示LLR接种≥1剂次对于重度RVGE具有一定的保护效果,首剂接种的年龄越小则效果越好。LLR对于G3型和G9型所导致的重度RVGE具有一定的交叉保护作用。
(4)安全性:对广西壮族自治区2~24月龄儿童LLR服苗组(1 506例)和安慰剂组(1 583例)完成了疫苗安全性临床观察,服苗后72 h观察到LLR疫苗组和安慰剂组体温的弱反应发生率分别为5.64%和4.3%,中反应分别为1.13%和0.76%[81]。该结果表明疫苗安全性良好,未见严重不良反应发生率增加。
全国疑似预防接种异常反应(adverse events following immunization,AEFI)监测系统显示,2010-2017年LLR的AEFI报告发生率在8.15/10万剂~22.38/10万剂之间[82-89]。其中2014年报告AEFI发生率为17.95/10万剂,严重病例报告发生率为0.04/10万剂,AEFI非严重病例报告发生率为17.91/10万剂,一般反应报告发生率为15.76/10万剂,异常反应报告发生率为1.44/10万剂,在异常反应中过敏性皮疹62例、血小板减少性紫癜1例和其他疾病1例[86]。目前还缺乏针对LLR是否增加肠套叠风险的系列研究和数据。
七、RV疫苗免疫策略和免疫程序推荐1. WHO免疫策略推荐:2009年,WHO免疫策略咨询专家组(Strategic Advisory Group of Experts,SAGE)建议将婴儿接种口服RV减毒活疫苗纳入NIP[90]。2013年,WHO发布的RV疫苗立场文件明确建议所有国家应将RV疫苗纳入NIP,特别是RVGE相关死亡率较高的国家应优先纳入[1]。
WHO建议从6周龄起尽早接种口服RV疫苗,以确保在自然感染发生前获得疫苗保护,不推荐2岁以上儿童接种RV疫苗[1]。
WHO推荐口服RV疫苗可与灭活脊髓灰质炎疫苗(IPV)、口服脊髓灰质炎减毒活疫苗(OPV)、无细胞百白破联合疫苗(DTaP)、肺炎球菌结合疫苗(PCV)、流感嗜血杆菌疫苗(Hib)、乙型肝炎疫苗(HepB)同时接种[1]。此策略是提高婴儿出生早期RV疫苗接种及时率的关键。
2.部分国家RV疫苗免疫程序推荐:截至2019年9月RV5已在全球126个国家和地区获得上市许可。自2006年以来,全球已有111个国家和地区将RV疫苗(RV5和/或RV1)纳入NIP,占全球总国家或地区数的57%[91]。
各国关于RV5的免疫程序推荐略有不同。
美国[92]:2月龄、4月龄、6月龄;
德国[93]:6周龄、2月龄、3月龄;
芬兰[93]:2月龄、3月龄、5月龄;
挪威[93]:1.5月龄、3月龄、5月龄;
瑞典[93]:6~8周龄、3月龄、5月龄;
泰国[94]:2月龄、4月龄、6月龄;
韩国[95]:2月龄、4月龄、6月龄。
国际上推荐RV5可与同期接种的NIP疫苗如IPV、DTaP、PCV、Hib疫苗等同时接种[1, 41, 93]。2009年,美国免疫实践咨询委员会(Advisory Committee on Immunization Practices,ACIP)对RV5推荐作出更新,明确首剂接种年龄为出生后6~14周6 d(说明书中首剂接种年龄为6~12周龄),2剂次间隔≥4周(说明书中为2剂间隔4~10周),最后1剂次不晚于8月龄(说明书中为不晚于32周龄)[41]。建议RV5作为口服减毒活疫苗可与美国NIP同一时间范围内的任何其他疫苗同时接种或任意间隔接种,且无最小接种间隔要求[41]。此外,推荐使用含抗体血液制品在内的任何血液制品之前、同时或之后的任何时间都可以按照疫苗推荐的时间表接种RV5,因为不会影响RV疫苗全程接种的保护效果[41]。
3.中国RV疫苗的免疫策略和程序推荐:
(1)RV疫苗免疫策略:RV疫苗是预防控制RVGE的最有效手段,应在中国婴幼儿中推广RV疫苗接种。RV疫苗目前属于非国家免疫规划疫苗,应当遵守《中华人民共和国疫苗管理法》以及《预防接种工作规范》《国家免疫规划疫苗儿童免疫程序及说明》《非免疫规划疫苗使用指导原则》的相关规定,根据“自愿和知情同意”的原则开展接种。适龄儿童按照本共识所推荐的免疫程序尽早开始接种RV疫苗;按照相关法规或方案要求做好儿童接种RV后的预防接种信息登记、报告和AEFI监测工作;有条件的地区或RV疾病负担较重的地区可尽早将RV疫苗纳入免疫规划。
(2)免疫程序推荐:
① RV5:接种年龄为6~32周龄,全程免疫3剂。首剂接种年龄为出生后6~12周龄(42~90 d)。每剂次接种间隔时间≥4周;第3剂不得晚于32周龄(230 d)。
② LLR:接种年龄为2月龄~3岁。每年接种1剂;首剂应自2月龄起尽早接种。
八、RV疫苗使用经验及常见问题1.同时接种:
(1)RV5与其他疫苗同时接种:中国广西壮族自治区采用随机对照试验(RCT)的Ⅲ期临床试验显示,RV5与三价OPV(tOPV)、DTaP同时接种和任意时间间隔接种后,tOPV、DTaP和RV5的免疫原性和安全性良好[96]。中国上市RV5的疫苗说明书规定可以与OPV、DTaP同时接种或任意时间间隔接种[59]。
国际上对RV5与其他疫苗同时接种研究证实,RV5与其他儿童疫苗同时接种时不影响其他疫苗的免疫原性和安全性[97-98]。美国RCT研究显示,RV5与DTaP、IPV、Hib、HepB和七价PCV(PCV7)同时接种具有良好的免疫原性和安全性[98]。ACIP等国际疫苗专业委员会推荐RV5可以与任何同期接种的疫苗同时接种,也可以任意时间间隔接种[41, 99]。
文献综述研究显示,RV5与脑膜炎球菌疫苗及其联合疫苗同时接种,如b型流感嗜血杆菌-CY群脑膜炎球菌TT蛋白结合疫苗(Hib-MenCY-TT)、ACWY群脑膜炎球菌CRM蛋白结合疫苗(MenACWY-CRM)、C群脑膜炎球菌结合疫苗(MenCC)、A群脑膜炎球菌疫苗(MenAV)、C群脑膜炎球菌CRM蛋白结合疫苗(MenC-CRM)、4组分B群脑膜炎球菌结合疫苗(4CMenB),均不会影响RV5和脑膜炎球菌疫苗的免疫原性和安全性[100]。西班牙一项多中心RCT显示,RV5可以与13价PCV(PCV13)和5组分无细胞百白破-灭活脊髓灰质炎-b型流感嗜血杆菌联合疫苗(DTaP5-IPV-Hib-HepB)同时接种,具有良好的免疫原性和安全性[101]。
基于以上证据,RV5可以与IPV、DTaP、Hib、HepB、PCV13、OPV、脑膜炎球菌多糖结合疫苗、六联疫苗(DTaP5-IPV-Hib-HepB)和五联疫苗(DTaP5-IPV-Hib)同时接种或任意时间间隔接种。
(2)LLR与其他疫苗同时接种:中国上市LLR疫苗说明书规定,LLR与其他减毒活疫苗接种应最小间隔1个月[75]。
近几年开展的LLR与麻风联合减毒活疫苗(MR)同时接种的比较试验显示,各组间异常反应发生率无显著性差异,实验组(同时接种组)与对照组(单独接种组)免疫前、免疫后同种抗体几何平均滴度(GMT)/几何平均浓度(GMC)、阳性率,以及免疫后抗体阳转率均无显著性差异[102]。表明LLR与MR同时接种未发现严重异常反应和相互干扰免疫应,可以同时接种。此外,还开展了LLR与麻腮风联合减毒活疫苗(MMR)的同时接种观察,结果发现各接种组不良反应轻微,实验组与各对照组免疫前和免疫后同种抗体GMT/GMC、阳性率以及免疫后抗体阳转率均无显著性差异[103]。提示LLR与MR、MMR同时接种的免疫原性和安全性较好。以上研究为LLR同时接种积累了重要数据。
2.两种RV疫苗的替代接种:因缺少RV5和LLR替代接种的研究数据,仅推荐使用同种疫苗完成全程接种。接种3剂次RV5后免疫持久性可达7年[74],完成全程接种后不需再接种RV疫苗。
3. RV5两剂次接种间隔:国际上RV5的Ⅲ期临床试验大多数受试者两剂次间隔为4~10周,但实际有超过最大间隔10周接种的2 361名(1 185名接种RV5,1 176名接种安慰剂)研究对象,对两组保护效力分析显示,RV5对RVGE住院的保护效力为100%(95%CI:60%~100%)[104]。对其中接种3剂次的334名(177名RV5接种者和157名安慰剂接种者)进行了保护效力分析,对任何严重程度G1~G4型RVGE的保护效力为63%(95%CI:0%~94%),无重度RVGE病例发生[104]。表明两剂次最大间隔超过10周接种者与按时接种者相比,对任何程度的G1~G4型RVGE的保护效力相似[63%(95%CI:0%~94%)vs. 74%(95%CI:67%~79%)][104]。两剂次间隔≤10周和 > 10周接种RV5的两组婴儿,在接种3剂次后42 d内不良反应发生率无显著性差异[104]。依据以上多中心RCT研究结果,ACIP等国际疫苗专业委员会在2009年RV5接种推荐中作出更新,将原来的“两剂次间隔4~10周”改为“两剂次间隔至少4周”[41]。
4.特殊状态儿童接种:
(1)发热:RV5说明书建议,发热性疾病可能是延迟接种的原因,除非医生认为暂停接种会造成更大的风险[59]。ACIP等国际疫苗专业委员会建议,如果有轻度的呼吸道疾病或其他伴有或不伴有发烧的轻度急性疾病,不应推迟接种疫苗[41]。
(2)腹泻:RV5说明书建议,对于存在胃肠道功能紊乱史的婴儿,包括活动性急性胃肠道疾病、慢性腹泻、生长发育迟缓,以及先天性腹部异常和腹部手术史的婴儿,尚无相关的疫苗安全性或保护效力数据,需谨慎考虑对这些婴儿接种[59]。
ACIP等国际疫苗专业委员会建议,急性中度或重度胃肠炎的婴儿不应该接种RV5,直至病情好转[41]。患有轻度急性胃肠炎的婴儿可以接种疫苗,尤其当延迟接种可能会导致婴儿超过接种适宜年龄时[41]。
(3)早产儿:RV5的Ⅲ期临床研究中设立了对小样本健康状态的早产儿亚组,并按照出生后实际年龄6~12周龄接种RV5[105]。结果显示,与对照组相比,疫苗组住院和急诊就诊降低了100%(95%CI:74.2%~100.0%),且并未增加每一剂接种后7 d内发热、腹泻、呕吐、易激惹等不良事件的发生风险,研究表明健康状态的早产儿可以及时接种RV疫苗[105]。
国际疫苗专业委员会建议,早产儿接种RV疫苗的益处胜过不良事件风险,支持早产儿按照与足月儿相同的程序和注意事项接种RV疫苗[41]。2018年中国《特殊健康状态儿童预防接种专家共识》认为早产儿可以接种各类疫苗[106]。
(4)接受免疫球蛋白治疗的儿童:RV5说明书建议[59],尚未获得42 d内曾输血或血液制品,包括免疫球蛋白的婴儿服用RV5的临床试验数据。
ACIP等国际疫苗专业委员会建议,RV5可以在使用任何血液产品(包括含有抗体的产品)之前、同时或之后的任何时间接种,按常规推荐的RV5接种程序对适合接种的婴儿进行接种[41]。
LLR疫苗说明书建议接受注射免疫球蛋白者应至少间隔≥3个月服用本疫苗。
接受免疫球蛋白治疗的儿童具体是否可以接种RV疫苗,仍需要医疗卫生专业人士根据个体情况综合评估。
(5)接种期间RV感染儿童:RV5说明书建议,目前尚无暴露于自然感染RV后接种RV5的临床数据[59]。ACIP等国际疫苗专业委员会建议,在完成RV疫苗接种程序之前,患有RVGE的婴儿仍应根据推荐的年龄和时间间隔开始或完成接种程序,因为初始RV感染可能仅对后续RV疾病提供部分保护[41]。
5.接种禁忌:已患过RVGE的婴幼儿、已经出院且临床状况稳定并符合接种年龄的早产儿,可接种RV疫苗。对于存在胃肠道功能紊乱史以及先天性腹部异常和腹部手术史的婴幼儿、先天或者获得性免疫缺陷者等在医生建议下谨慎接种。禁止严重联合免疫缺陷疾病(SCID)患儿和具有肠套叠既往史婴幼儿接种本类疫苗。
RV5疫苗说明书中接种禁忌[59]:①超敏反应:对于RV5任何成分出现超敏反应者。接种1剂RV5后出现疑似超敏症状的婴儿,不应继续接种剩余剂次。②SCID:禁止SCID患儿接种RV5。上市后出现接种疫苗的婴儿发生胃肠炎的报告,包括严重腹泻和疫苗株排毒时间延长的情况,这些病例随后均被诊断患有SCID。③肠套叠既往史:禁止具有肠套叠既往史婴儿接种。
LLR疫苗说明书中:对疫苗任何组分包括辅料和硫酸庆大霉素过敏者、患急性疾病、严重慢性疾病、慢性疾病的急性发作期和发热者。
6.呕吐后补种、母乳喂养婴儿接种:如果因某种原因未能给予足够剂量(如疫苗被婴儿吐出),由于临床试验中未针对该情况进行过研究,不建议给予补充接种,应按照后续免疫程序完成剩余剂次的接种[59, 107]。无论在接种之前或之后,对于饮食没有限制,包括母乳喂养在内[59]。
7.不完全接种的效果、接种的季节性:RV5临床研究未对仅接种1剂或2剂疫苗提供的保护水平进行评估。另一方面,从疫苗机制上看,由于减毒活疫苗是通过模拟自然感染诱导的过程而产生免疫反应[108],而疾病保护会随着每次后续感染而提高,所以按照完整程序完成全程接种(3剂)才可以更好地保证婴儿获得足够抵御疾病的能力。此外,目前国际上RV5没有1剂或2剂接种程序的推荐。
RVGE全年均可发生[109]。RV疫苗的接种没有季节性要求,全年都可接种。
九、RV疫苗相关研究问题1.特殊儿童接种RV疫苗的安全性和有效性研究,尤其是针对特殊儿童接种后疫苗毒株长时间排毒的研究。虽然RV5似乎对早产儿安全有效,但进一步的研究是必要的,防止因潜在的疫苗毒株传播引发系列的问题。
2.口服RV减毒活疫苗免疫效力影响因素的研究。如母亲抗体、母乳喂养、其他肠道病原体的干扰、营养不良和慢性疾病(如人类免疫缺陷病毒感染)是否会降低RV疫苗的效力。
3. RV疫苗引入后对儿童RVGE住院和死亡总体影响研究。已有研究显示,在不同国家、不同年龄人群RV疫苗的保护效果存在一定差异,如在儿童死亡率低、中和高的国家,< 1岁儿童RVGE住院和急诊就诊数分别减少80%、78%和46%,在对不符合接种RV疫苗的年龄组人群中,RVGE和全因AGE住院率均有所减少[110]。中国也亟待开展疫苗接种后的主动监测评价。
4. RV疫苗引入后肠套叠发生率的监测和研究。肠套叠的病因及发病机制尚未完全清楚,可能与感染性因素、婴儿超重、混合喂养和6月龄前添加辅食有关。1998年全球第一个RV疫苗(rotashield)在美国获批上市,使用9个月后评估发现疫苗接种导致的肠套叠发生风险为每接种1万名儿童增加1例肠套叠病例,该疫苗最终退市[111]。因此后续新研制的RV口服减毒活疫苗在上市前后需严格开展疫苗接种与肠套叠发生风险的评估。
5.口服RV减毒活疫苗大范围接种导致潜在群体免疫的研究,以及所致自然流行的RV血清型变化的研究。这些均可能影响疫苗接种推荐计划,也将有助于理解除JVP4和VP7之外的其他蛋白在RV保护性免疫中的作用。
6. RV疫苗接种成本-效益评价研究,这是评估疫苗纳入NIP所需的关键数据之一,也是全球性疾病负担评估的需要。目前已有的相关研究几乎集中在疾病的直接和间接成本上,很少有研究考虑质量调整生命年(quality-adjusted life year,QALY)。
7. RV疫苗覆盖率调查及接种策略研究。由于中国RV疫苗尚未纳入NIP,亟需开展此类研究。国际上有研究提示,假设亚洲43个国家和地区均引入RV疫苗,会减少约71万例的住院和3.5万例死亡[112]。与未引入疫苗的预计住院和死亡人数相比,下降幅度高达40%[112]。其中中国如果将RV疫苗引入NIP,预期会减少211 742例(72%)RV相关住院,减少2 278例(72%)RV相关死亡[112]。
8.新型RV疫苗的开发和研究。目前使用的RV疫苗均为口服减毒活疫苗,存在一定局限性,研发出更加安全、有效且价格适宜的RV疫苗是控制RVGE流行重要基础。
利益冲突 所有作者均声明不存在利益冲突
编写人员 (按姓名笔画排序):刁连东(江苏省疾病预防控制中心)、王华庆(中国疾病预防控制中心)、吕华坤(浙江省疾病预防控制中心)、刘大卫(中国疾病预防控制中心)、刘娜(中国疾病预防控制中心)、孙立梅(广东省疾病预防控制中心)、吴疆(北京市疾病预防控制中心)、汪萱怡(复旦大学医学院)、张少白(陕西省疾病预防控制中心)、张延炀(河南省疾病预防控制中心)、张颖(天津市疾病预防控制中心)、张静(中国疾病预防控制中心)、段招军(中国疾病预防控制中心)、夏胜利(河南省疾病预防控制中心)、徐爱强(山东省疾病预防控制中心)
| [1] |
World Health Organization. Rotavirus vaccines. WHO position paper-January 2013[J]. Wkly Epidemiol Rec, 2013, 88(5): 49-64. |
| [2] |
Parashar UD, Nelson EA, Kang G. Diagnosis, management, and prevention of rotavirus gastroenteritis in children[J]. BMJ, 2013, 347: f7204. DOI:10.1136/bmj.f7204 |
| [3] |
World Health Organization. Child rotavirus deaths by country 2000-2013[EB/OL].[2020-11-01]. http://www.who.int/immunization/monitoring_surveillance/burden/estimates/rotavirus/en/
|
| [4] |
World Health Organization. Rotavirus vaccines in routine immunization. Pocket Guide[Z]. Switzerland. World Health Organization. 2012.
|
| [5] |
Stanley A. Plotkin, Walter A. Orenstein, Paul A. Offit, 著, 罗凤基等译.疫苗第6版(上册)[M].第2版, 北京: 人民卫生出版社. 2016 Plotkin AS, Orenstein AW, Offit PA, et al./Translate Luo FZ, et al. Vaccine, 6ed (vol.1)[M]. 2nd edition. Beijing: People's Health Publishing House. 2016 |
| [6] |
World Health Organization/The United Nations Children's Fund (UNICEF) 2013. Ending Preventable Child Deaths from Pneumonia and Diarrhoea by 2025. The integrated Global Action Plan for Pneumonia and Diarrhoea (GAPPD)[Z]. Switzerland: World Health Organization, 2013.
|
| [7] |
Sadiq A, Bostan N, Yinda KC, et al. Rotavirus:Genetics, pathogenesis and vaccine advances[J]. Rev Med Virol, 2018, 28(6): e2003. DOI:10.1002/rmv.2003 |
| [8] |
Crawford SE, Ramani S, Tate JE, et al. Rotavirus infection[J]. Nat Rev Dis Primers, 2017, 3: 17083. DOI:10.1038/nrdp.2017.83 |
| [9] |
Luchs A, Timenetsky M. Group A rotaviru gastroenteritis:post-vaccine era, genotypes and zoonotic transmission[J]. Einstein (Sao Paulo), 2016, 14(2): 278-287. DOI:10.1590/S1679-45082016RB3582 |
| [10] |
Santos N, Hoshino Y. Global distribution of rotavirus serotypes/genotypes and its implication for the development and implementation of an effective rotavirus vaccine[J]. Rev Med Virol, 2005, 15(1): 29-56. DOI:10.1002/rmv.448 |
| [11] |
Ansari SA, Springthorpe VS, Sattar SA. Survival and vehicular spread of human rotaviruses:possible relation to seasonality of outbreaks[J]. Rev Infect Dis, 1991, 13(3): 448-461. DOI:10.1093/clinids/13.3.448 |
| [12] |
Dennehy PH. Transmission of rotavirus and other enteric pathogens in the home[J]. Pediatr Infect Dis J, 2000, 19(10 Suppl): S103-105. DOI:10.1097/00006454-200010001-00003 |
| [13] |
Dennehy PH. Rotavirus Infection:A Disease of the Past?[J]. Infect Dis Clin North Am, 2015, 29(4): 617-635. DOI:10.1016/j.idc.2015.07.002 |
| [14] |
Knipe DM, Howley PM. Fields Virology[M]. 6th ed. Philadelphia: Wolters Kluwer Health/Lippincott Williams & Wilkins, 2013: 1347-1401.
|
| [15] |
Angel J, Franco MA, Greenberg HB. Rotavirus immune responses and correlates of protection[J]. Curr Opin Virol, 2012, 2(4): 419-425. DOI:10.1016/j.coviro.2012.05.003 |
| [16] |
Angel J, Franco MA, Greenberg HB. Rotavirus vaccines:recent developments and future considerations[J]. Nat Rev Microbiol, 2007, 5(7): 529-539. DOI:10.1038/nrmicro1692 |
| [17] |
Johansen K, Svensson L. Neutralization of rotavirus recognition of immunologically important epitopes on VP4 and VP7 by human IgA[J]. Arch Virol, 1997, 142(7): 1491-1498. DOI:10.1007/s007050050175 |
| [18] |
Franco MA, Angel J, Greenberg HB. Immunity and correlates of protection for rotavirus vaccines[J]. Vaccine, 2006, 24(15): 2718-2731. DOI:10.1016/j.vaccine.2005.12.048 |
| [19] |
Desselberger U, Huppertz HL. Immune responses to rotavirus infection and vaccination and associated correlates of protection[J]. J Infect Dis, 2011, 203(2): 188-195. DOI:10.1093/infdis/jiq031 |
| [20] |
Velazquez FR, Matson DO, Calva JJ, et al. Rotavirus infection in infants as protection against subsequent infections[J]. N Engl J Med, 1996, 335: 1022-1028. DOI:10.1056/NEJM199610033351404 |
| [21] |
Fischer TK, Valentiner-Branth P, Steinsland H, et al. Protective immunity after natural rotavirus infection:a community cohort study of newborn children in Guinea-Bissau, west Africa[J]. J Infect Dis, 2002, 186(5): 593-597. DOI:10.1086/342294 |
| [22] |
Gladstone BP, Ramani S, Mukhopadhya I. Protective effect of natural rotavirus infection in an Indian birth cohort[J]. N Engl J Med, 2011, 365: 337-346. DOI:10.1056/NEJMoa1006261 |
| [23] |
Ward RL, Clark HF, Offit PA. Influence of potential protective mechanisms on the development of live rotavirus vaccines[J]. J Infect Dis, 2010, 202(Suppl): S72-79. DOI:10.1086/653549 |
| [24] |
Clarke E, Desselberger U. Correlates of protection against human rotavirus disease and the factors influencing protection in low-income settings[J]. Mucosal Immunol, 2015, 8(1): 1-17. DOI:10.1038/mi.2014.114 |
| [25] |
Lee RM, Lessler J, Lee RA, et al. Incubation periods of viral gastroenteritis:a systematic review[J]. BMC Infect Dis, 2013, 13: 446. DOI:10.1186/1471-2334-13-446 |
| [26] |
Smiyan OI, Smiian-Horbunova KO, Bynda TP, et al. Optimization of the treatment of rotavirus infection in children by using bacillus clausii[J]. Wiad Lek, 2019, 72(7): 1320-1323. DOI:10.36740/WLek201907117 |
| [27] |
Newman RD, Grupp-Phelan J, Shay DK, et al. Perinatal risk factors for infant hospitalization with viral gastroenteritis[J]. Pediatrics, 1999, 103(1): E3. DOI:10.1542/peds.103.1.e3 |
| [28] |
Blutt SE, Matson DO, Crawford SE, et al. Rotavirus antigenemia in children is associated with viremia[J]. PLoS Med, 2007, 4: e121. DOI:10.1371/journal.pmed.0040121 |
| [29] |
Nakano I, Taniguchi K, Ishibashi-Ueda H, et al. Sudden Death from Systemic Rotavirus Infection and Detection of Nonstructural Rotavirus Proteins[J]. J Clin Microbiol, 2011, 49(12): 4382-4385. DOI:10.1128/JCM.01303-11 |
| [30] |
Rivero-Calle I, Gómez-Rial J, Martinón-Torres F. Systemic features of rotavirus infection[J]. J Infect, 2016, 72(Suppl): S98-105. DOI:10.1016/j.jinf.2016.04.029 |
| [31] |
Gómez-Rial J, Rivero-Calle I, Salas A, et al. Rotavirus and autoimmunity[J]. J Infect, 2020, 81(2): 183-189. DOI:10.1016/j.jinf.2020.04.041 |
| [32] |
Lukacik M, Thomas RL, Aranda JV. A meta-analysis of the effects of oral zinc in the treatment of acute and persistent diarrhea[J]. Pediatrics, 2008, 121(2): 326-236. DOI:10.1542/peds.2007-0921 |
| [33] |
Marcy SM, Partridge S. 9-Rotavirus Infection. Jong EC, Stevens DL, Netter's Infectious Diseases. W.B. Saunders. 2012, Pages 39-41
|
| [34] |
Isa P, Arias CF, López S. Role of sialic acids in rotavirus infection[J]. Glycoconj J, 2006, 23(1/2): 27-37. DOI:10.1007/s10719-006-5435-y |
| [35] |
Huang P, Xia M, Tan M, et al. Spike protein VP8a of human rotavirus recognizes histo-blood group antigens in a type-specific manner[J]. J Virol, 2012, 86(9): 4833-4843. DOI:10.1128/JVI.05507-11 |
| [36] |
Hu L, Sankaran B, Laucirica DR, et al. Glycan recognition in globally dominant human rotaviruses[J]. Nat Commun, 2018, 9(1): 2631. DOI:10.1038/s41467-018-05098-4 |
| [37] |
Gozalbo-Rovira R, Ciges-Tomas JR, Vila-Vicent S, et al. Unraveling the role of the secretor antigen in human rotavirus attachment to histo-blood group antigens[J]. PLoS Pathog, 2019, 15(6): e1007865. DOI:10.1371/journal.ppat.1007865 |
| [38] |
Trang NV, Vu HT, Le NT, et al. Association between norovirus and rotavirus infection and histo-blood group antigen types in Vietnamese children[J]. J Clin Microbiol, 2014, 52(5): 1366-1374. DOI:10.1128/JCM.02927-13 |
| [39] |
Khachou A, Moullac-Vaidye BL, Peltier C, et al. Host-range shift between emerging P[8] -4 rotavirus and common P[8] and P[4] strains[J]. J Infect Dis, 2020, 222(5): 836-839. DOI:10.1093/infdis/jiaa122 |
| [40] |
Sharma S, Hagbom M, Svensson L, et al. The Impact of Human Genetic Polymorphisms on Rotavirus Susceptibility, Epidemiology, and Vaccine Take[J]. Viruses, 2020, 12(3): 324. DOI:10.3390/v12030324 |
| [41] |
Cortese MM, Parashar UD, Centers for Disease Control and Prevention (CDC). Prevention of rotavirus gastroenteritis among infants and children:recommendations of the Advisory Committee on Immunization Practices (ACIP)[J]. MMWR Recomm Rep, 2009, 58(RR-2): 1-25. |
| [42] |
Aliabadi N, Antoni S, Mwenda JM, et al. Global impact of rotavirus vaccine introduction on rotavirus hospitalisations among children under 5 years of age, 2008-16:findings from the Global Rotavirus Surveillance Network[J]. Lancet Glob Health, 2019, 7(7): e893-903. DOI:10.1016/S2214-109X(19)30207-4 |
| [43] |
中国疾病预防控制中心.中国重点传染病和病媒生物监测报告(内部资料)[M]. 2016. Chinese Center for Disease Control and Prevention. Monitoring report of key infectious diseases and vector organisms in China (internal data)[M]. 2016. |
| [44] |
张平, 张静. 中国2014-2015年其他感染性腹泻监测现状分析[J]. 中华流行病学杂志, 2017, 38(4): 424-430. Zhang P, Zhang J. Surveillance on other infectious diarrheal diseases in China from 2014 to 2015[J]. Chin J Epidemiol, 2017, 38(4): 424-430. DOI:10.3760/cma.j.issn.0254-6450.2017.04.003 |
| [45] |
Patel MM, Pitzer VE, Alonso WJ, et al. Global seasonality of rotavirus disease[J]. Pediatr Infect Dis J, 2013, 32(4): e134-147. DOI:10.1097/INF.0b013e31827d3b68 |
| [46] |
Tate JE, Panozzo CA, Payne DC, et al. Decline and change in seasonality of US rotavirus activity after the introduction of rotavirus vaccine[J]. Pediatrics, 2009, 124(2): 465-471. DOI:10.1542/peds.2008-3528 |
| [47] |
Fang ZY, Yang H, Qi J, et al. Diversity of rotavirus strains among children with acute diarrhea in China:1998-2000 surveillance study[J]. J Clin Microbiol, 2002, 40(5): 1875-1878. DOI:10.1128/jcm.40.5.1875-1878.2002 |
| [48] |
Duan ZJ, Liu N, Yang SH, et al. Hospital-Based Surveillance of Rotavirus Diarrhea in the People's Republic of China, August 2003-July 2007[J]. J Infect Dis, 2009, 200(Suppl 1): S167-173. DOI:10.1086/605039 |
| [49] |
Troeger C, Khalil IA, Rao PC, et al. Rotavirus Vaccination and the Global Burden of Rotavirus Diarrhea Among Children Younger Than 5 Years[J]. JAMA Pediatr, 2018, 172(10): 958-965. DOI:10.1001/jamapediatrics.2018.1960 |
| [50] |
Kawai K, O'Brien MA, Goveia MG, et al. Burden of rotavirus gastroenteritis and distribution of rotavirus strains in Asia:a systematic review[J]. Vaccine, 2012, 30(7): 1244-1254. DOI:10.1016/j.vaccine.2011.12.092 |
| [51] |
Wang JX, Zhou HL, Mo ZJ, et al. Burden of viral gastroenteritis in children living in rural China:Population-based surveillance[J]. Int J Infect Dis, 2020, 90: 151-160. DOI:10.1016/j.ijid.2019.10.029 |
| [52] |
Zhang J, Duan ZJ, Payne DC, et al. Rotavirus-specific and Overall Diarrhea Mortality in Chinese Children Younger than 5 Years:2003 to 2012[J]. Pediatr Infect Dis J, 2015, 34(10): e233-237. DOI:10.1097/INF.0000000000000799 |
| [53] |
Jin H, Wang B, Fang Z, et al. Hospital-based study of the economic burden associated with rotavirus diarrhea in eastern China[J]. Vaccine, 2011, 29(44): 7801-7806. DOI:10.1016/j.vaccine.2011.07.104 |
| [54] |
Chandran A, Heinzen RR, Santosham M, et al. Nosocomial rotavirus infections:a systematic review[J]. J Pediatr, 2006, 149(4): 441-447. DOI:10.1016/j.jpeds.2006.04.054 |
| [55] |
Burke RM, Tate JE, Kirkwood CD, et al. Current and new rotavirus vaccines[J]. Curr Opin Infect Dis, 2019, 32(5): 435-444. DOI:10.1097/QCO.0000000000000572 |
| [56] |
Soares-Weiser K, Bergman H, Henschke N, et al. Vaccines for preventing rotavirus diarrhoea:vaccines in use[J]. Cochrane Database Syst Rev, 2019, 2019(10): CD008521. DOI:10.1002/14651858.CD008521.pub5 |
| [57] |
Burnett E, Parashar UD, Tate JE. Global Impact of Rotavirus Vaccination on Diarrhea Hospitalizations and Deaths Among Children < 5 Years Old:2006-2019[J]. J Infect Dis, 2020, 222(10): 1731-1739. DOI:10.1093/infdis/jiaa081 |
| [58] |
Xia S, Du J, Su J, et al. Efficacy, immunogenicity and safety of a trivalent live human-lamb reassortant rotavirus vaccine (LLR3) in healthy Chinese infants:A randomized, double-blind, placebo-controlled trial[J]. Vaccine, 2020, 38(46): 7393-7400. DOI:10.1016/j.vaccine.2020.04.038 |
| [59] |
口服五价重配轮状病毒减毒活疫苗(Vero细胞)中国大陆说明书[EB/OL].[2020-11-01]. http://yao.dxy.com/drug/153946.htm. Oral pentavalent live attenuated rotavirus vaccine (Vero cell) Chinese specification[EB/OL].[2020-11-01]. http://yao.dxy.com/drug/153946.htm. |
| [60] |
Vesikari T, Matson DO, Dennehy P, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine[J]. N Engl J Med, 2006, 354(1): 23-33. DOI:10.1056/NEJMoa052664 |
| [61] |
Mo Z, Mo Y, Li M, et al. Efficacy and safety of a pentavalent live human-bovine reassortant rotavirus vaccine (RV5) in healthy Chinese infants:A randomized, double-blind, placebo-controlled trial[J]. Vaccine, 2017, 35(43): 5897-5904. DOI:10.1016/j.vaccine.2017.08.081 |
| [62] |
Boom JA, Tate JE, Sahni LC, et al. Effectiveness of pentavalent rotavirus vaccine in a large urban population in the United States[J]. Pediatrics, 2010, 125(2): e199-207. DOI:10.1542/peds.2009-1021 |
| [63] |
Baker JM, Dahl RM, Cubilo J, et al. Effects of the rotavirus vaccine program across age groups in the United States:analysis of national claims data, 2001-2016[J]. BMC Infect Dis, 2019, 19(1): 186. DOI:10.1186/s12879-019-3816-7 |
| [64] |
Hemming-Harlo M, Markkula J, Huhti L, et al. Decrease of Rotavirus Gastroenteritis to a Low Level Without Resurgence for Five Years After Universal RotaTeq Vaccination in Finland[J]. Pediatr Infect Dis J, 2016, 35(12): 1304-1308. DOI:10.1097/INF.0000000000001305 |
| [65] |
Gagneur A, Nowak E, Lemaitre T, et al. Impact of rotavirus vaccination on hospitalizations for rotavirus diarrhea:the IVANHOE study[J]. Vaccine, 2011, 29(21): 3753-3759. DOI:10.1016/j.vaccine.2011.03.035 |
| [66] |
Paulke-Korinek M, Kollaritsch H, Aberle SW, et al. Sustained low hospitalization rates after four years of rotavirus mass vaccination in Austria[J]. Vaccine, 2013, 31(24): 2686-2691. DOI:10.1016/j.vaccine.2013.04.001 |
| [67] |
Iwata S, Nakata S, Ukae S, et al. Efficacy and safety of pentavalent rotavirus vaccine in Japan. A randomized, double-blind, placebo-controlled, multicenter trial[J]. Hum Vaccin Immunother, 2013, 9(8): 1626-1633. DOI:10.4161/hv.24846 |
| [68] |
Santos VS, Marques DP, Martins-Filho PRS, et al. Effectiveness of rotavirus vaccines against rotavirus infection and hospitalization in Latin America:systematic review and Meta-analysis[J]. Infect Dis Poverty, 2016, 5(1): 83. DOI:10.1186/s40249-016-0173-2 |
| [69] |
An Advisory Committee Statement (ACS) National Advisory Committee on Immunization (NACI). Updated Statement on the use of Rotavirus Vaccines[J]. Can Commun Dis Rep, 2010, 36(ACS-4): 1-37. DOI:10.14745/ccdr.v36i00a04 |
| [70] |
Yen C, Shih SM, Tate JE, et al. Intussusception-related Hospitalizations Among Infants Before and After Private Market Licensure of Rotavirus Vaccines in Taiwan, 2001-2013[J]. Pediatr Infect Dis J, 2017, 36(10): e252-257. DOI:10.1097/INF.0000000000001644 |
| [71] |
Koch J, Harder T, Kries R, et al. Risk of Intussusception After Rotavirus Vaccination[J]. Dtsch Arztebl Int, 2017, 114(15): 255-262. DOI:10.3238/arztebl.2017.0255 |
| [72] |
World Health Organization. Global Advisory Committee on Vaccine Safety, 11-12 December 2013[J/OL]. Wkly Epidemiol Rec, 2014, 89(7): 53-60.
|
| [73] |
World Health Organization. Global Advisory Committee on Vaccine Safety, December 2011[J/OL]. Wkly Epidemiol Rec, 2012, 87(6): 53-60.
|
| [74] |
Payne DC, Selvarangan R, Azimi PH, et al. Long-term Consistency in Rotavirus Vaccine Protection:RV5 and RV1 Vaccine Effectiveness in US Children, 2012-2013[J]. Clin Infect Dis, 2015, 61(12): 1792-1799. DOI:10.1093/cid/civ872 |
| [75] |
口服轮状病毒活疫苗说明书[EB/OL].[2020-11-01]. https://www.dayi.org.cn/drug/1156337?from=sg. Instructions for oral rotavirus live vaccine[EB/OL].[2020-11-01]. https://www.dayi.org.cn/drug/1156337?from=sg. |
| [76] |
刘东磊, 杨洁, 李安, 等. 轮状病毒疫苗免疫效果及人体反应观察[J]. 中国疫苗和免疫, 2002, 8(3): 138-140. Liu DL, Yang J, Li A, et al. Observation on immune effect and human reaction of rotavirus vaccine[J]. Chin J Vacc Immuni, 2002, 8(3): 138-140. |
| [77] |
Fu C, Wang M, Liang J, et al. Effectiveness of Lanzhou lamb rotavirus vaccine against rotavirus gastroenteritis requiring hospitalization:a matched case-control study[J]. Vaccine, 2007, 25(52): 8756-8761. DOI:10.1016/j.vaccine.2007.10.036 |
| [78] |
Zhen SS, Li Y, Wang SM, et al. Effectiveness of the live attenuated rotavirus vaccine produced by a domestic manufacturer in China studied using a population-based case-control design[J]. Emerg Microb Infect, 2015, 4: e64. DOI:10.1038/emi.2015.64 |
| [79] |
Li J, Zhang Y, Yang Y, et al. Effectiveness of Lanzhou lamb rotavirus vaccine in preventing gastroenteritis among children younger than 5 years of age[J]. Vaccine, 2019, 37(27): 3611-3616. DOI:10.1016/j.vaccine.2019.03.069 |
| [80] |
Fu C, Tate JE, Jiang B. Effectiveness of Lanzhou lamb rotavirus vaccine against hospitalized gastroenteritis:further analysis and update[J]. Hum Vaccines, 2010, 6(11): 953. DOI:10.4161/hv.6.11.12847 |
| [81] |
谢澎, 李青, 庞兴, 等. 口服轮状病毒活疫苗罗特威研究进展[J]. 中国新药杂志, 2012, 21(10): 1107-1109. Xie P, Li Q, Pang X, et al. Research progress of oral rotavirus live vaccine Rottweiler[J]. Chin J New Drugs, 2012, 21(10): 1107-1109. |
| [82] |
武文娣, 刘大卫, 李克莉, 等. 中国2010年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫, 2012, 18(5): 385-397. Wu WD, Liu DW, Li KL, et al. Analysis of monitoring data of suspected adverse reactions to vaccination in China in 2010[J]. Chin J Vacc Immuni, 2012, 18(5): 385-397. |
| [83] |
武文娣, 李克莉, 郑景山, 等. 中国2011年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫, 2013, 19(2): 97-109. Wu WD, Li KL, Zheng JS, et al. Analysis of monitoring data of suspected adverse reactions to vaccination in China in 2011[J]. Chin J Vacc Immuni, 2013, 19(2): 97-109. |
| [84] |
武文娣, 刘大卫, 李克莉, 等. 中国2012年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫, 2014, 20(1): 1-12. Wu WD, Liu DW, Li KL, et al. Analysis of monitoring data of suspected adverse reactions to vaccination in China in 2012[J]. Chin J Vacc Immuni, 2014, 20(1): 1-12. |
| [85] |
叶家楷, 李克莉, 许涤沙, 等. 中国2013年疑似预防接种异常反应信息管理系统数据分析[J]. 中国疫苗和免疫, 2015, 21(2): 121-131. Ye JK, Li KL, Xu DS, et al. Data Analysis of Information Management System for Suspected Adverse Reactions to Vaccination in China in 2013[J]. Chin J Vacc Immuni, 2015, 21(2): 121-131. |
| [86] |
叶家楷, 李克莉, 许涤沙, 等. 中国2014年疑似预防接种异常反应信息管理系统监测数据分析[J]. 中国疫苗和免疫, 2016, 22(2): 125-137. Ye JK, Li KL, Xu DS, et al. Data Analysis of Information Management System for Suspected Adverse Reactions to Vaccination in China in 2014[J]. Chin J Vacc Immuni, 2016, 22(2): 125-137. |
| [87] |
叶家楷, 李克莉, 许涤沙, 等. 中国2015年疑似预防接种异常反应监测分析[J]. 中国疫苗和免疫, 2017, 23(5): 481-492. Ye JK, Li KL, Xu DS, et al. Analysis of monitoring data of suspected adverse reactions to vaccination in China in 2015[J]. Chin J Vacc & Immuni, 2017, 23(5): 481-492. |
| [88] |
许涤沙, 李克莉, 武文娣, 等. 中国2016年疑似预防接种异常反应监测数据分析[J]. 中国疫苗和免疫, 2018, 24(3): 299-309. Xu DS, Li KL, Wu WD, et al. Analysis of monitoring data of suspected adverse reactions to vaccination in China in 2016[J]. Chin J Vacc Immuni, 2018, 24(3): 299-309. |
| [89] |
李克莉, 张丽娜, 叶家楷, 等. 中国2017年疑似预防接种异常反应监测[J]. 中国疫苗和免疫, 2020, 26(1): 9-19. Li KL, Zhang LN, Ye JK, et al. Monitoring of suspected adverse reactions to vaccination in China in 2017[J]. Chin J Vacc Immuni, 2020, 26(1): 9-19. |
| [90] |
World Health Organization. Meeting of the immunization Strategic Advisory Group of Experts, April 2009-conclusions and recommendations.[J/OL] Wkly Epidemiol Rec, 2009, 84(23): 220-236.
|
| [91] |
World Health Organization. Vaccine in National Immunization Programme update[EB/OL]. (2020-06) http://www.who.int/immunization/monitoring_surveillance/VaccineIntroStatus.pptx?ua=1.
|
| [92] |
Centers for Disease Control and Prevention. Recommended Child and Adolescent Immunization Schedule for ages 18 years or younger. United States. 2020.[EB/OL] https://www.cdc.gov/vaccines/schedules/downloads/child/0-18yrs-child-combined-schedule.pdf
|
| [93] |
European Centre for Disease Prevention and Control. ECDC Expert opinion on rotavirus vaccination in infancy[Z]. Stockholm: ECDC, 2017.
|
| [94] |
Immunization Schedule for Thai Children Recommended by The Pediatric Infectious Disease Society of Thailand 2017[EB/OL]. https://www.pidst.or.th/A573.html
|
| [95] |
Choi EH, Park SE, Kim YJ, et al. Recommended immunization schedule for children and adolescents:Committee on Infectious Diseases of the Korean Pediatric Society, 2018[J]. Korean J Pediatr, 2019, 62(7): 252-256. DOI:10.3345/kjp.2019.00227 |
| [96] |
Mo Z, Ma X, Luo P, et al. Immunogenicity of pentavalent rotavirus vaccine in Chinese infants[J]. Vaccine, 2019, 37(13): 1836-1843. DOI:10.1016/j.vaccine.2019.02.018 |
| [97] |
Ciarlet M, Sani-Grosso R, Yuan G, et al. Concomitant use of the oral pentavalent human-bovine reassortant rotavirus vaccine and oral poliovirus vaccine[J]. Pediatr Infect Dis J, 2008, 27(10): 874-880. DOI:10.1097/INF.0b013e3181782780 |
| [98] |
Rodriguez ZM, Goveia MG, Stek JE, et al. Concomitant use of an oral live pentavalent human-bovine reassortant rotavirus vaccine with licensed parenteral pediatric vaccines in the United States[J]. Pediatr Infect Dis J, 2007, 26(3): 221-7. DOI:10.1097/01.inf.0000254391.71103.e8 |
| [99] |
Kroger AT, Duchin J, Vázquez M. General Best Practice Guidelines for Immunization. Best Practices Guidance of the Advisory Committee on Immunization Practices (ACIP)[EB/OL]. https://www.cdc.gov/vaccines/hcp/acip-recs/general-recs/index.html
|
| [100] |
Pereira P, Benninghoff B, Moerman L. Systematic literature review on the safety and immunogenicity of rotavirus vaccines when co-administered with meningococcal vaccines[J]. Hum Vaccin Immunother, 2020, 1-12. DOI:10.1080/21645515.2020.1739485 |
| [101] |
Martinón-Torres F, Boisnard F, Thomas S, et al. Immunogenicity and safety of a new hexavalent vaccine (DTaP5-IPV-HB-Hib) administered in a mixed primary series schedule with a pentavalent vaccine (DTaP5-IPV-Hib)[J]. Vaccine, 2017, 35(30): 3764-3772. DOI:10.1016/j.vaccine.2017.05.043 |
| [102] |
唐伟, 甘霖, 黄毅, 等. 口服轮状病毒减毒活疫苗与麻疹-风疹联合减毒活疫苗联合接种的免疫原性和安全性研究[J]. 川北医学院学报, 2016, 31(5): 710-712. Tang W, Gan L, Huang Y, et al. Study on immunogenicity and safety of oral attenuated rotavirus vaccine and measles-rubella vaccine[J]. J North Sichuan Med College, 2016, 31(5): 710-712. DOI:10.3969/j.issn.1005-3697.2016.05.025 |
| [103] |
黄顺和, 唐伟, 王娟, 等. 口服轮状病毒减毒活疫苗与麻疹-风疹-流行性腮腺炎联合减毒活疫苗联合接种的免疫原性和安全性研究[J]. 预防医学情报杂志, 2016, 32(5): 472-475. Huang SH, Tang W, Wang J, et al. Study on immunogenicity and safety of oral attenuated rotavirus live vaccine and measles-rubella-mumps live vaccine[J]. Prev Med J Infor, 2016, 32(5): 472-475. |
| [104] |
Goveia MG, Suprun L, Itzler RF, et al. Efficacy and safety of pentavalent human-bovine reassortant rotavirus vaccine when administered with greater than 10 weeks between doses[J]. Pediatr Infect Dis J, 2010, 29(3): 263-5. DOI:10.1097/INF.0b013e3181be6257 |
| [105] |
Goveia MG, Rodriguez ZM, Dallas MJ, et al. Safety and efficacy of the pentavalent human-bovine (WC3) reassortant rotavirus vaccine in healthy premature infants[J]. Pediatr Infect Dis J, 2007, 26(12): 1099-104. DOI:10.1097/INF.0b013e31814521cb |
| [106] |
季钗. 特殊健康状态儿童预防接种专家共识之一——早产儿与预防接种[J]. 中国实用儿科杂志, 2018, 33(10): 737-738. Ji C. One of the consensus of experts on vaccination for children in special health state-premature infants and vaccination[J]. Chin J Appl Pediatrics, 2018, 33(10): 737-738. |
| [107] |
World Health Organization. Training modules for Health Care Workers. Module 4-Rotavirus vaccine administration.[EB/OL].[2020-11-01]. https://www.who.int/immunization/diseases/rotavirus/training_modules_HC_workers_no_age_restrictions_rotateq/en/
|
| [108] |
Marshall GS.周祖木, 译.疫苗手册: 临床医生实用指南: 第4版[M].北京: 北京大学医学出版社. 2014. Marshall GS/Translated by Zhou ZM. Vaccine Manual: Practical Guide for Clinicians: 4th Edition[M]. Beijing: Peking University Medical Press, 2014. |
| [109] |
耿启彬, 赖圣杰, 余建兴, 等. 中国26省(直辖市、自治区)2011-2014年5岁以下儿童腹泻病例轮状病毒流行特征分析[J]. 疾病监测, 2016, 31(6): 463-470. Geng QB, Lai SJ, Yu JX, et al. Epidemiological characteristics of rotavirus in diarrhea cases of children under 5 years old in 26 provinces (municipalities and autonomous regions) of China from 2011 to 2014[J]. Dis Surveill, 2016, 31(6): 463-470. |
| [110] |
Burnett E, Jonesteller CL, Tate JE, et al. Global Impact of Rotavirus Vaccination on Childhood Hospitalizations and Mortality From Diarrhea[J]. J Infect Dis, 2017, 215(11): 1666-1672. DOI:10.1093/infdis/jix186 |
| [111] |
Peter G, Myers MG, National Vaccine Advisory Committee; National Vaccine Program Office. Intussusception, rotavirus, and oral vaccines:summary of a workshop[J]. Pediatrics, 2002, 110(6): e67. DOI:10.1542/peds.110.6.e67 |
| [112] |
Burnett E, Tate JE, Kirkwood CD, et al. Estimated Impact of Rotavirus Vaccine on Hospitalizations and Deaths from Rotavirus Diarrhea among Children < 5 in Asia[J]. Expert Rev Vaccines, 2018, 17(5): 453-460. DOI:10.1080/14760584.2018.1443008 |
 2021, Vol. 42
2021, Vol. 42