文章信息
- 陶焱炀, 金鹏飞, 朱凤才.
- Tao Yanyang, Jin Pengfei, Zhu Fengcai
- 流感减毒活疫苗预防儿童季节性流感保护效果的Meta分析
- Meta-analysis on effectiveness of live attenuated influenza vaccine against seasonal influenza in children
- 中华流行病学杂志, 2020, 41(1): 103-110
- Chinese Journal of Epidemiology, 2020, 41(1): 103-110
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2020.01.019
-
文章历史
收稿日期: 2019-05-22
2. 江苏省疾病预防控制中心疫苗临床评价所, 南京 210009;
3. 江苏省疾病预防控制中心 国家卫生健康委员会肠道病原微生物重点实验室, 南京 210009
2. Department of Vaccine Clinical Evaluation, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China;
3. Key Laboratory of Enteric Pathogenic Microbiology of National Health Commission, Jiangsu Provincial Center for Disease Control and Prevention, Nanjing 210009, China
季节性流感是由流感病毒引起的急性呼吸道感染疾病,每年季节性流感的更替流行,是全球面临的一个重要公共问题。全球每年季节性流感可导致约300万~500万例重症病例,流感所致呼吸道疾病死亡人数约29万~65万例[1]。其中,儿童的流感发病率通常最高,平均每年约20%~30%的儿童因感染流感病毒而患病,流感是导致儿童就诊和住院的主要原因之一[2-5]。目前,疫苗接种是有效控制流感流行的主要方法。其中,流感减毒活疫苗(live attenuated influenza vaccine,LAIV)通过鼻内喷雾进行接种,易于使用,在儿童群体中具有较好的依从性。2003年,LAIV在美国注册上市,欧盟于2012年批准其投入使用[6]。自LAIV上市以来,关于评价其保护效力的随机对照临床试验的Meta分析较多,已为LAIV保护效力提供了充分的循证学证据。但对于LAIV在“实际接种环境”下的保护效果,各地区的研究结果存在一定的差异。因此,本文旨在对LAIV预防儿童季节性流感保护效果的研究进行Meta分析,以提供LAIV保护效果的循证学证据。
资料与方法1.文献收集:通过Web of Science、PubMed和ScienceDirect数据库,检索LAIV预防儿童季节性流感效果的相关英文文献,英文检索词分别为:“live attenuated influenza vaccine”“children”“efficacy”“effectiveness”。检索时间为2003年1月至2018年11月。
2.纳入和排除标准:纳入标准:①有关LAIV预防效果的病例对照研究;②研究对象为2~17岁儿童;③病例组为经医疗机构实验室检测确诊的流感病例,对照组为同一医疗机构就诊的急性呼吸道感染或流感样病例,经实验室检测后排除流感感染的,或在同一研究人群中未发病的健康儿童;④各文献研究结果均提供OR值(95%CI),或提供可以计算出相关数值的基础数据;⑤若文献同时提供调整及未调整OR值,则优先采用调整OR值(95%CI)计算。排除标准:①非病例对照研究;②综述类型文献;③针对同一人群发表的多篇文章,只选其中最新的或更全面的一篇报道;④针对特殊人群的研究,如获得性免疫缺陷病毒感染者和癌症患者等。
3.文献筛选和数据提取:根据纳入和排除标准,由2名研究者独立对检索数据库获得的文献进行筛选,如果对纳入和排除文献存在分歧意见时,经讨论后决定文献取舍。对最终纳入的文献,主要收集信息包括第一作者、研究时间、不同亚型的流行程度、研究地点、样本量、观察对象、研究设计、疫苗类型、对照来源以及结果变量。
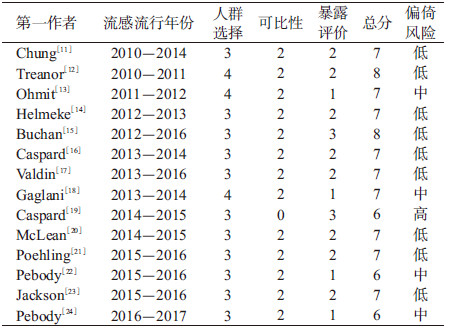
4.文献质量评价:根据Newcastle-Ottawa Scale(NOS)[7]对纳入文献进行质量评价,文献质量评价体系包括人群选择、可比性和暴露评价3部分。人群选择包含4个条目:①病例确定是否恰当;②病例的代表性;③对照的选择;④对照的确定。可比性包含1个条目即设计和统计分析时考虑病例和对照的可比性。暴露评价包含3个条目:①暴露因素的确定;②采用相同方法确定病例组和对照组的暴露因素;③无应答率。其中人群选择和暴露评价的每个条目计1分,可比性部分最多得2分,满分为9分,得分越高表明文献质量也越高。我们将在NOS任一部分中得分为0定义为文献存在高偏倚风险,在任一部分中得分为1定义为存在中度偏倚风险,在所有部分中得分≥2分定义为偏倚风险程度较低[8]。
5.统计学分析:采用Stata 13.1软件进行Meta分析。效应指标为OR,并根据OR值计算保护效果(Vaccine effectiveness,VE),VE=(1-OR)×100%。对纳入文献采用Q检验进行异质性检验,若P>0.10,则认为不存在异质性,按固定效应模型进行分析;若P≤0.10,则选用随机效应模型进行分析[9]。采用I2统计量对异质性进行定量分析,I2描述的是由于研究间所致的变异(而非抽样误差所引起的变异)占总变异的百分比,并按低、中、高三级进行分类,其对应的I2分别为25%~49%、50%~74%以及≥75%[10]。根据漏斗图对发表偏倚进行定性分析,采用Egger’s检验和Begg’s检验对发表偏倚进行定量分析。
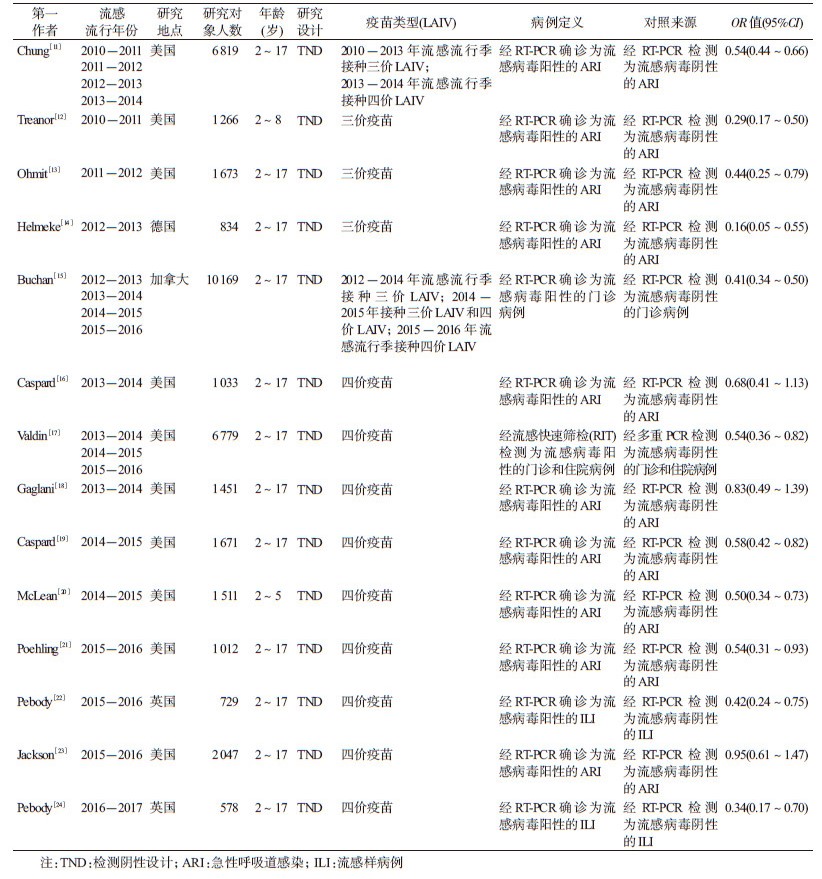
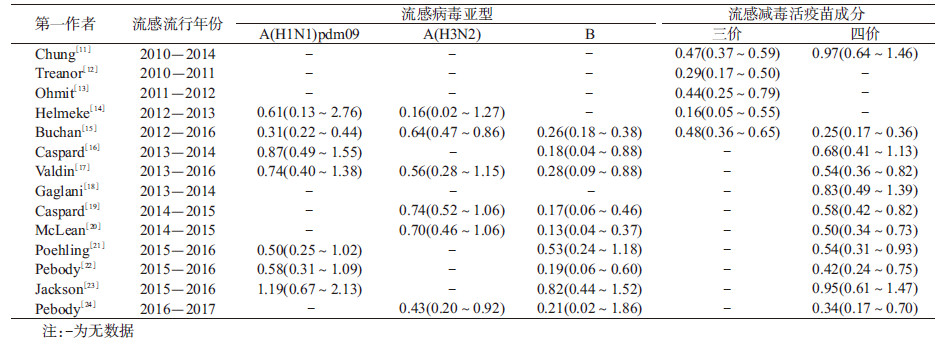
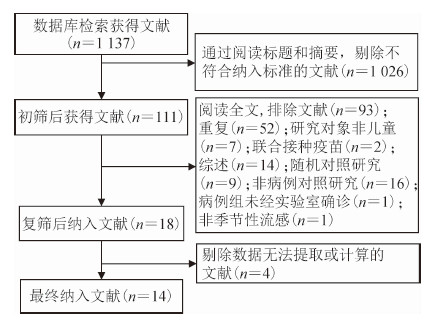
结果1.基本情况:共检索到相关文献1 137篇,包括Web of Science 552篇、PubMed 460篇以及ScienceDirect 125篇。根据纳入和排除标准,最终共纳入文献14篇(图 1),研究设计均为检测阴性设计(Test-negative design,TND)(表 1)[11-24]。本研究纳入14篇文献,涉及加拿大、美国、德国和英国4个国家,研究时间为2010-2017年流感流行季,总样本量为37 572例,总结了各研究预防不同流感亚型、以及三价/四价LAIV的VE(表 2)。纳入14篇文献的平均质量得分为6.9分,其中2篇为8分,9篇为7分,3篇为6分。见表 3。
|
| 图 1 文献检索与筛选流程 |
2.异质性检验:结果显示,各研究间存在异质性(P=0.009,I2=53.4%),因此采用随机效应模型进行Meta分析。
3. LAIV在儿童中的VE:合并效应值的结果为OR=0.51(95%CI:0.43~0.60),VE为49%(95%CI:40%~57%)。见图 2。

|
| 图 2 流感减毒活疫苗(LAIV)保护效果的Meta分析森林图 |
将LAIV预防A(H1N1)pdm09型、A(H3N2)型和B型流感的效果,三价和四价LAIV在儿童中的VE以及全球不同地区LAIV预防流感的效果作为分组因素进行亚组分析,见表 4。
(1)LAIV预防不同流感亚型的效果:分别对LAIV预防A(H1N1)pdm09型、A(H3N2)型和B型流感的效果研究进行异质性检验(图 3)。结果显示,按随机效应模型分析,A(H1N1)pdm09型流感和B型流感均有异质性(P=0.002,I2=69.5%;P=0.021,I2=55.7%);按固定效应模型分析,A(H3N2)型流感无异质性(P=0.556,I2=0.0%)。对于A(H1N1)pdm09型流感,合并效应值OR=0.65(95%CI:0.44~0.95),VE为35%(95%CI:5%~56%)。对于A(H3N2)型流感,合并效应值OR=0.65(95%CI:0.54~0.79),VE为35%(95%CI:21%~46%)。对于B型流感,合并效应值OR=0.29(95%CI:0.18~0.45),VE为71%(95%CI:55%~82%)。
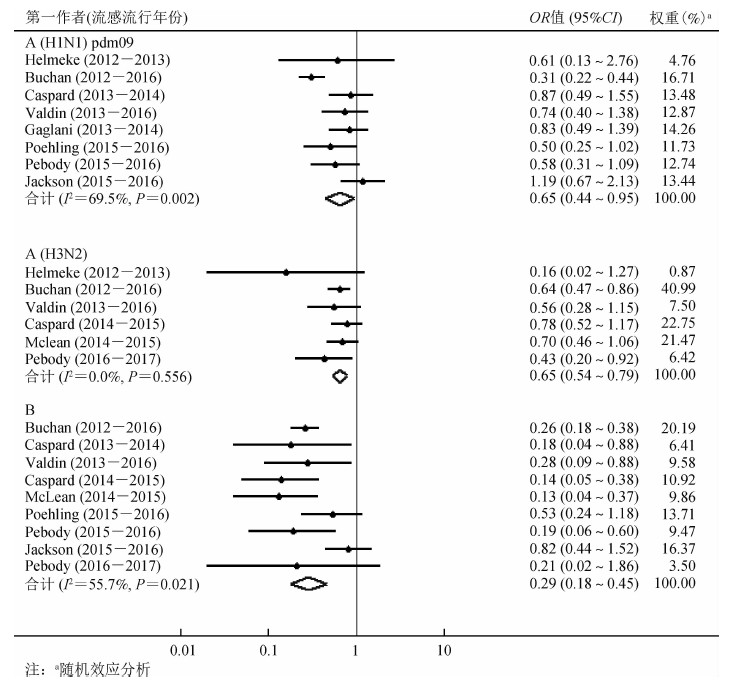
|
| 图 3 抗不同流感病毒亚型的流感减毒活疫苗保护效果的Meta分析森林图 |
(2)三价、四价LAIV在儿童中的VE:分别对三价和四价LAIV预防季节性流感的效果研究进行异质性检验。结果显示,按固定效应模型进行分析,三价LAIV无异性质(P=0.225,I2=29.4%);按随机效应模型进行分析,四价LAIV有异质性(P=0.001,I2=72.4%)。三价LAIV的合并效应值OR=0.44(95%CI:0.37~0.52),VE为56%(95%CI:48%~63%)。四价LAIV的合并效应值OR=0.56(95%CI:0.43~0.73),VE为44%(95%CI:27%~57%)。
(3)全球不同地区LAIV预防流感的效果:分别对全球不同地区LAIV的VE研究进行异质性检验。结果显示,按固定效应模型进行分析,欧洲地区组无异质性(P=0.361,I2=1.8%);按随机效应模型进行分析,北美洲地区组有异质性(P=0.012,I2=55.8%)。欧洲组的合并效应值OR=0.35(95%CI:0.23~0.53),VE为65%(95%CI:47%~77%)。北美洲组的合并效应值OR=0.54(95%CI:0.45~0.64),VE为46%(95%CI:36%~55%)。
4.敏感性分析:将偏倚风险最高的一篇文献剔除后,计算合并效应值OR=0.50(95%CI:0.42~0.60);Helmeke等[14]报道的效应指标最小(OR=0.16,VE=84%),剔除后合并效应值OR=0.52(95%CI:0.45~0.61);Jackson等[23]报道的效应指标最大(OR=0.95,VE=5%),剔除后合并效应值OR=0.49(95%CI:0.42~0.57)。以上合并OR值同剔除前相比基本一致,提示结果较稳定。
5.发表偏倚:漏斗图分析结果显示(图 4),纳入文献的效应值分布较分散,大部分围绕中心线呈左右对称排列。Egger’s检验(t=-0.06,P=0.957)和Begg’s检验(Z=1.09,P=0.274),提示本研究无明显偏倚。
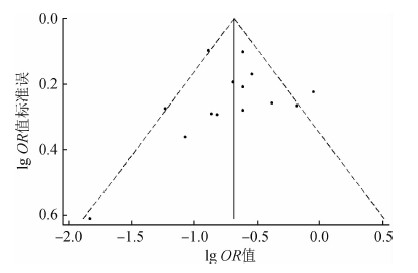
|
| 图 4 Meta分析漏斗图 |
疫苗上市前的临床试验研究是在“理想环境”下对疫苗的保护效力进行评价,随着疫苗上市后在目标人群接种,因受接种人群(包括接种人群特征、免疫前抗体水平等)、疾病流行模式(包括流行强度、流行株等)以及接种实施(包括接种针次、接种方法、冷链状况等)的影响,疫苗在“实际环境”下的保护效果与保护效力存在一定差异。在疫苗的公共卫生学和疫苗免疫策略方面,疫苗上市后的VE评估具有十分重要的实际指导意义。近年来,TND已成为估计流感疫苗VE的首选方法。该研究方法通过比较确诊流感病毒阳性的研究受试者(即检测阳性病例)与流感检测阴性者(即检测阴性对照)之间的疫苗接种情况,从而评价疫苗的VE[25]。本研究对2003-2018年公开发表的LAIV在2~17岁儿童中的VE进行Meta分析。共涉及4个国家,约3.75万名研究对象,纳入文献无明显发表偏倚。Meta分析结果表明,接种LAIV可以有效降低2~17岁儿童发生季节性流感,疫苗的VE为49%(95%CI:40%~57%)。
本研究的分析结果显示针对不同的流感流行株,LAIV在儿童中的VE存在一定差异,针对B型流感的VE(71%,95%CI:55%~82%)高于A(H1N1)pdm09型(35%,95%CI:5%~56%)和A(H3N2)型流感(35%,95%CI:21%~46%)。美国多个流感流行季观察得到的数据表明[26],LAIV预防A(H1N1)pdm09型流感的VE低于灭活流感疫苗(Inactivated influenza vaccine,IIV);对于A(H3N2)型季节性流感,LAIV和IIV在儿童中的VE相接近;然而,LAIV预防B型季节性流感的VE要高于A(H1N1)和A(H3N2)型季节性流感,与本次Meta分析结果一致。鉴于2015-2016年季节性流感流行期间LAIV不能有效预防A(H1N1)型季节性流感,美国预防接种咨询委员会(Advisory Committee on Immunization Practices,ACIP)不推荐在2016-2017年的流感流行季中应用LAIV。2016年美国CDC发表的《疫苗预防和控制季节性流感的建议》中显示[27],在美国LAIV上市前和上市后头几年,其保护效力/效果与IIV相当甚至更好,但最近LAIV表现不佳的原因尚不清楚。Ambrose等[28]在对8项随机对照临床试验的Meta分析显示,LAIV预防H1N1型(87%,95%CI:78%~93%)和H3N2型季节性流感(86%,95%CI:79%~91%)的保护效力要高于B型季节性流感(76%,95%CI:63%~84%),与LAIV在“实际环境”下的VE存在一定差异。
理论上四价LAIV对人群的VE要高于三价LAIV,但在本研究中,我们发现四价LAIV在接种人群中VE的点估计值要低于三价LAIV。导致本次结果的原因可能是由于存在混杂因素,例如研究当年疫苗株与流感流行株是否匹配、接种人群的免疫前抗体水平、当地卫生条件及宣传教育等,这些都会对结果产生影响。此外,我们还注意到这两组的95%CI存在部分重叠,故尚不能推断四价疫苗的VE低于三价疫苗。
从全球不同地区LAIV预防季节性流感的效果来看,可以发现其在欧洲地区儿童中的VE(65%,95%CI:47%~77%)要高于北美洲地区(46%,95%CI:36%~55%)。该现象可能与流感的原始抗原效应(Original antigenic sin,OAS)影响后续流感疫苗的免疫效应水平有关[29],即当机体连续暴露于流感病毒变异株时,体内的免疫系统会优先产生针对原始病毒株的抗体,导致先前感染过流感或接种过流感疫苗的人群,其免疫力较弱,从而造成疫苗的VE下降。这是因为美国儿童在2岁前至少接种过一剂IIV,2岁后再接种LAIV;而在欧洲地区,如英国的疫苗接种和免疫联合委员会(Joint Committee on Vaccination and Immunization,JCVI)建议儿童在2岁后再接种流感疫苗,接种的疫苗类型为四价LAIV[23]。
与传统的IIV不同,LAIV通过鼻内喷雾进行接种,操作简单,易于使用,依从率高,特别是在儿童中具有潜在优势[30-31]。经鼻内给予LAIV,可引起更加持久、广泛的体液和细胞免疫,更接近机体感染后的自然免疫过程[32-33]。研究表明[34-35],相对于肌肉注射疫苗,儿童及其父母和医护人员更倾向于鼻内接种LAIV,英国、芬兰等国推荐优先接种LAIV[36-37]。此外,相关的研究结果显示[28, 38-40],与传统的灭活疫苗相比,LAIV具有更高的效力。如Rhorer等[38]的研究结果显示当疫苗株与流感流行株相匹配时,接种两剂LAIV的儿童感染流感的病例数比接种两剂IIV的儿童要少43%,接种一剂LAIV的儿童与接种一剂IIV的儿童相比病例数减少35%。Lukšić等[41]对IIV在<18岁儿童中VE的Meta分析显示,利用随机效应模型和固定效应模型进行分析,IIV的VE分别为31.4%(95%CI:24.8%~39.6%)和44.3%(95%CI:42.6%~45.9%),均低于本研究得出的结论。
本研究存在不足。纳入的文献数量较少,故在部分亚组中,其异质性检验的P值较小,提示结果存在偏倚。此外,14篇文献均来自发达国家的报告,缺少发展中国家的相关研究数据,因此可能不适用于评价LAIV在发展中国家儿童中的VE。最后,由于纳入文献的研究对象均为医院就诊病例,所以将本研究结果外推到全人群时还需谨慎。
本次Meta分析结果表明,LAIV对2~17岁儿童季节性流感具有一定的预防作用,特别是针对乙型季节性流感。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
World Health Organization. Influenza (Seasonal)[EB/OL]. (2018-11-06)[2019-02-28]. https://www.who.int/en/news-room/fact-sheets/detail/influenza-(seasonal).
|
| [2] |
Fraaij PL, Heikkinen T. Seasonal influenza:the burden of disease in children[J]. Vaccine, 2011, 29(43): 7524-7528. DOI:10.1016/j.vaccine.2011.08.010 |
| [3] |
Rajaram S, Wiecek W, Lawson R, et al. Impact of increased influenza vaccination in 2-3-year-old children on disease burden within the general population:a Bayesian model-based approach[J]. PLoS One, 2017, 12(12): e0186739. DOI:10.1371/journal.pone.0186739 |
| [4] |
Poehling KA, Edwards KM, Weinberg GA. The underrecognized burden of influenza in young children[J]. N Engl J Med, 2006, 355(1): 31-40. DOI:10.1056/NEJMoa054869 |
| [5] |
Li-Kim-Moy J, Yin JK, Blyth CC, et al. Influenza hospitalizations in Australian children[J]. Epidemiol Infect, 2017, 145(7): 1451-1460. DOI:10.1017/s0950268816003381 |
| [6] |
Mohn KG, Smith I, Sjursen H, et al. Immune responses after live attenuated influenza vaccination[J]. Hum Vaccin Immunother, 2018, 14(3): 571-578. DOI:10.1080/21645515.2017.1377376 |
| [7] |
Wells GA, Shea B, O'Connell D, et al. The Newcastle-Ottawa Scale (NOS) for assessing the quality of nonrandomised studies in Meta-analyses[EB/OL].[2019-02-28]. http://www.ohri.ca/programs/clinical_epidemiology/oxford.asp.
|
| [8] |
Hungerford D, Smith K, Tucker A, et al. Population effectiveness of the pentavalent and monovalent rotavirus vaccines:a systematic review and Meta-analysis of observational studies[J]. BMC Infect Dis, 2017, 17(1): 569. DOI:10.1186/s12879-017-2613-4 |
| [9] |
Higgins J, Thompson S, Deeks J, et al. Statistical heterogeneity in systematic reviews of clinical trials:a critical appraisal of guidelines and practice[J]. J Health Serv Res Policy, 2002, 7(1): 51-61. DOI:10.1258/1355819021927674 |
| [10] |
Higgins JP, Thompson SG, Deeks JJ, et al. Measuring inconsistency in Meta-analyses[J]. BMJ, 2003, 327(7414): 557-560. DOI:10.1136/bmj.327.7414.557 |
| [11] |
Chung JR, Flannery B, Thompson MG, et al. Seasonal effectiveness of live attenuated and inactivated influenza vaccine[J]. Pediatrics, 2016, 137(2): e20153279. DOI:10.1542/peds.2015-3279 |
| [12] |
Treanor JJ, Talbot HK, Ohmit SE, et al. Effectiveness of seasonal influenza vaccines in the United States during a season with circulation of all three vaccine strains[J]. Clin Infect Dis, 2012, 55(7): 951-959. DOI:10.1093/cid/cis574 |
| [13] |
Ohmit SE, Thompson MG, Petrie JG, et al. Influenza vaccine effectiveness in the 2011-2012 season:protection against each circulating virus and the effect of prior vaccination on estimates[J]. Clin Infect Dis, 2014, 58(3): 319-327. DOI:10.1093/cid/cit736 |
| [14] |
Helmeke C, Gräfe L, Irmscher HM, et al. Effectiveness of the 2012/13 trivalent live and inactivated influenza vaccines in children and adolescents in Saxony-Anhalt, Germany:a test-negative case-control study[J]. PLoS One, 2015, 10(4): e0122910. DOI:10.1371/journal.pone.0122910 |
| [15] |
Buchan SA, Booth S, Scott AN, et al. Effectiveness of live attenuated vs inactivated influenza vaccines in children during the 2012-2013 through 2015-2016 influenza seasons in Alberta, Canada:a Canadian Immunization Research Network (CIRN) study[J]. JAMA Pediatr, 2018, 172(9): e181514. DOI:10.1001/jamapediatrics.2018.1514 |
| [16] |
Caspard H, Gaglani M, Clipper L, et al. Effectiveness of live attenuated influenza vaccine and inactivated influenza vaccine in children 2-17 years of age in 2013-2014 in the United States[J]. Vaccine, 2016, 34(1): 77-82. DOI:10.1016/j.vaccine.2015.11.010 |
| [17] |
Valdin HL, Bégué RE. Influenza vaccines effectiveness 2013-14 through 2015-16, a test-negative study in children[J]. Vaccine, 2017, 35(33): 4088-4093. DOI:10.1016/j.vaccine.2017.06.050 |
| [18] |
Gaglani M, Pruszynski J, Murthy K, et al. Influenza vaccine effectiveness against 2009 pandemic influenza A(H1N1) virus differed by vaccine type during 2013-2014 in the United States[J]. J Infect Dis, 2016, 213(10): 1546-1556. DOI:10.1093/infdis/jiv577 |
| [19] |
Caspard H, Gaglani M, Clipper L, et al. Multicenter study of live-attenuated influenza vaccine effectiveness in children, 2014-15[J]. Open Forum Infect Dis, 2015, 2(Suppl 1): 1352. DOI:10.1093/ofid/ofv131.143 |
| [20] |
McLean HQ, Caspard H, Griffin MR, et al. Effectiveness of live attenuated influenza vaccine and inactivated influenza vaccine in children during the 2014-2015 season[J]. Vaccine, 2017, 35(20): 2685-2693. DOI:10.1016/j.vaccine.2017.03.085 |
| [21] |
Poehling KA, Caspard H, Peters TR, et al. 2015-2016 vaccine effectiveness of live attenuated and inactivated influenza vaccines in children in the United States[J]. Clin Infect Dis, 2018, 66(5): 665-672. DOI:10.1093/cid/cix869 |
| [22] |
Pebody R, Warburton F, Ellis J, et al. Effectiveness of seasonal influenza vaccine for adults and children in preventing laboratory-confirmed influenza in primary care in the United Kingdom:2015/16 end-of-season results[J]. Euro Surveill, 2016, 21(38): 30348. DOI:10.2807/1560-7917.es.2016.21.38.30348 |
| [23] |
Jackson ML, Chung JR, Jackson LA, et al. Influenza vaccine effectiveness in the United States during the 2015-2016 season[J]. N Engl J Med, 2017, 377(6): 534-543. DOI:10.1056/NEJMoa1700153 |
| [24] |
Pebody R, Warburton F, Ellis J, et al. End-of-season influenza vaccine effectiveness in adults and children, United Kingdom, 2016/17[J]. Euro Surveill, 2017, 22(44): 17-00306. DOI:10.2807/1560-7917.es.2017.22.44.17-00306 |
| [25] |
Jackson ML, Nelson JC. The test-negative design for estimating influenza vaccine effectiveness[J]. Vaccine, 2013, 31(17): 2165-2168. DOI:10.1016/j.vaccine.2013.02.053 |
| [26] |
Grohskopf LA, Sokolow LZ, Broder KR, et al. Prevention and control of seasonal influenza with vaccines:recommendations of the advisory committee on immunization practices-United States, 2018-19 influenza season[J]. MMWR Recomm Rep, 2018, 67(3): 1-20. DOI:10.15585/mmwr.rr6703a1 |
| [27] |
Grohskopf LA, Sokolow LZ, Broder KR, et al. Prevention and control of seasonal influenza with vaccines:recommendations of the advisory committee on immunization practices-United States, 2016-17 influenza season[J]. MMWR Recomm Rep, 2016, 65(5): 1-54. DOI:10.15585/mmwr.rr6505a1 |
| [28] |
Ambrose CS, Wu XH, Knuf M, et al. The efficacy of intranasal live attenuated influenza vaccine in children 2 through 17 years of age:a Meta-analysis of 8 randomized controlled studies[J]. Vaccine, 2012, 30(5): 886-892. DOI:10.1016/j.vaccine.2011.11.104 |
| [29] |
Kim JH, Davis WG, Sambhara S, et al. Strategies to alleviate original antigenic sin responses to influenza viruses[J]. Proc Natl Acad Sci USA, 2012, 109(34): 13751-13756. DOI:10.1073/pnas.0912458109 |
| [30] |
周芳烨. 流感减毒活疫苗临床效率的研究进展[J]. 现代预防医学, 2012, 39(22): 5960-5962, 5965. Zhou FY. The clinical efficacy study of live attenuated influenza vaccines[J]. Mod Prev Med, 2012, 39(22): 5960-5962, 5965. |
| [31] |
Sridhar S, Brokstad KA, Cox RJ. Influenza vaccination strategies:comparing inactivated and live attenuated influenza vaccines[J]. Vaccines (Basel), 2015, 3(2): 373-389. DOI:10.3390/vaccines3020373 |
| [32] |
耿兴良. 流感病毒减毒活疫苗的研究进展[J]. 中国生物制品学杂志, 2017, 30(1): 103-105, 111. Geng XL. Progress in research on live attenuated influenza vaccine[J]. Chin J Biol, 2017, 30(1): 103-105, 111. DOI:10.13200/j.cnki.cjb.001623 |
| [33] |
何勇刚. 流感减毒活疫苗[J]. 国际生物制品学杂志, 2015, 38(5): 259-260. He YG. Live attenuated influenza vaccine[J]. Int J Biol, 2015, 38(5): 259-260. DOI:10.3760/cma.j.issn.1673-4211.2015.05.013 |
| [34] |
Fogel B, Hicks S. Influenza vaccination rates in children decline when the live attenuated influenza vaccine is not recommended[J]. Vaccine, 2017, 35(39): 5278-5282. DOI:10.1016/j.vaccine.2017.07.067 |
| [35] |
Rodgers L, Pabst LJ, Chaves SS. Increasing uptake of live attenuated influenza vaccine among children in the United States, 2008-2014[J]. Vaccine, 2015, 33(1): 22-24. DOI:10.1016/j.vaccine.2014.11.006 |
| [36] |
Pebody R, Sile B, Warburton F, et al. Live attenuated influenza vaccine effectiveness against hospitalisation due to laboratory-confirmed influenza in children two to six years of age in England in the 2015/16 season[J]. Euro Surveill, 2017, 22(4): 30450. DOI:10.2807/1560-7917.es.2017.22.4.30450 |
| [37] |
Nohynek H, Baum U, Syrjänen R, et al. Effectiveness of the live attenuated and the inactivated influenza vaccine in two-year-olds-a nationwide cohort study Finland, influenza season 2015/16[J]. Euro Surveill, 2016, 21(38): 30346. DOI:10.2807/1560-7917.es.2016.21.38.30346 |
| [38] |
Rhorer J, Ambrose CS, Dickinson S, et al. Efficacy of live attenuated influenza vaccine in children:a Meta-analysis of nine randomized clinical trials[J]. Vaccine, 2009, 27(7): 1101-1110. DOI:10.1016/j.vaccine.2008.11.093 |
| [39] |
Falkenhorst G, Harder T, Remschmidt C, et al. Background paper to the recommendation for the preferential use of live-attenuated influenza vaccine in children aged 2-6 years in Germany[J]. Bundesgesundheitsblatt Gesundheitsforschung Gesundheitsschutz, 2013, 56(11): 1557-1564. DOI:10.1007/s00103-013-1844-9 |
| [40] |
Negri E, Colombo C, Giordano L, et al. Influenza vaccine in healthy children:a Meta-analysis[J]. Vaccine, 2005, 23(22): 2851-2861. DOI:10.1016/j.vaccine.2004.11.053 |
| [41] |
Lukšić I, Clay S, Falconer R, et al. Effectiveness of seasonal influenza vaccines in children-a systematic review and Meta-analysis[J]. Croat Med J, 2013, 54(2): 135-145. DOI:10.3325/cmj.2013.54.135 |
 2020, Vol. 41
2020, Vol. 41