文章信息
- 韩磊, 崔平, 唐明霜, 张敏, 崔慧杰, 曾子倩, 陈思宇, 刘姗姗, 宋斌, 谷冬晴, 王新, 张本.
- Han Lei, Cui Ping, Tang Mingshuang, Zhang Min, Cui Huijie, Zeng Ziqian, Chen Siyu, Liu Shanshan, Song Bin, Gu Dongqing, Wang Xin, Zhang Ben.
- 胆道系统肿瘤患者生存预测模型的构建及验证研究
- Prediction model for survival in patients with biliary tract cancer: a development and validation study
- 中华流行病学杂志, 2019, 40(11): 1461-1469
- Chinese Journal of Epidemiology, 2019, 40(11): 1461-1469
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.11.022
-
文章历史
收稿日期: 2019-05-06
2. 济宁医学院公共卫生学院 272067;
3. 陆军军医大学第一附属医院流行病学中心, 重庆 400038
2. School of Public Health, Jining Medical College, Jining 272067, China;
3. Department of Epidemiology and Biostatistics, First Affiliated Hospital, Army Medical University, Chongqing 400038, China
胆道系统肿瘤(biliary tract cancer)是相对罕见但病死率极高的消化系统恶性肿瘤,根据解剖结构的不同可分为胆囊癌、肝外胆管癌和壶腹癌等亚型[1]。胆道系统肿瘤发病早期症状不明显,绝大多数患者在确诊时已处于晚期[2]。手术切除是目前唯一的治疗手段,但治疗效果多不理想,晚期患者5年生存率往往低于10%[3]。因此,如何准确预测患者的预后情况并开展个体化治疗,是提高患者生存率的重要手段。既往研究评估了多个与胆道系统肿瘤预后相关的潜在影响因素,为患者的生存预测提供基础[4-5]。但是由于样本量的限制以及不同的人群纳入标准的差异,目前研究结果尚不一致。本研究基于大样本人群队列调查胆道系统肿瘤的生存率和预后因素,拟构建预后风险预测模型并进行模型预测准确性验证,以期辅助临床医生准确预测患者预后并制定个体化治疗方案,实施胆道系统肿瘤的三级预防策略。
对象与方法1.研究对象:美国国家癌症研究所监测、流行病学和结果项目(Surveillance,Epidemiology,and End Results Program,SEER)于1973年启动,是世界上最大的公开可用的癌症数据库,其覆盖了美国约30%不同地理区域的人口,每年收集约450 000例恶性肿瘤与原发癌患者的发病与生存数据[6]。本研究选取SEER数据库收集的2010-2015年期间(≥3年随访)确诊的胆道系统肿瘤患者作为建模队列的研究对象。此外,选择SEER数据库收集的2004-2009年期间诊断的胆道系统肿瘤患者作为模型验证队列的研究对象。胆道系统肿瘤定义遵循国际疾病分类第10版定义,包括胆囊癌(C23.0)、肝外胆管癌(C24.0)和壶腹癌(C24.1)。排除非原发性肿瘤、年龄<18岁以及仅通过死亡登记和尸检诊断的患者。SEER是一个对全球研究者开放的数据库,癌症在美国的每个州都是一种可报告的疾病。因此,使用SEER项目的数据开展科学研究并发布研究报告不需要患者的知情同意[7]。
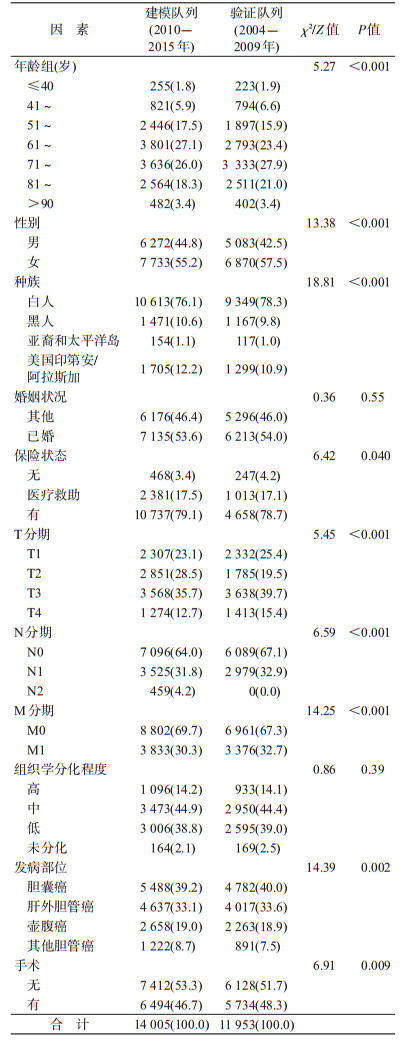
2.研究资料:本研究运用SEER*Stat version 8.3.5软件从SEER数据库中提取研究对象的数据。研究变量包括年龄、性别、种族、诊断年龄、婚姻状况、医疗保险、肿瘤TNM分期、肿瘤分化程度、手术、死亡状态和生存时间等。其中年龄分为<40、41~、51~、61~、71~、81~和>90岁;种族分为白人、黑人、印第安和阿拉斯加人以及亚裔和太平洋岛人;婚姻状况分为已婚及其他;医疗保险状态分为有保险、医疗救助和无保险;肿瘤T分期(肿瘤原发灶情况)分为T1~T4;肿瘤N分期(区域淋巴结受累情况)分为N0~N2;肿瘤M分期(远处转移情况)分为M0和M1;组织学分化程度分为高分化、中分化、低分化和未分化;原发部位手术分为有和无。
3.统计学分析:连续变量描述采用x±s,分类变量描述采用样本量及百分比(%),组间比较采用χ2检验或秩和检验。本研究的主要结局为总体生存时间(Overall survival),定义为从胆道系统肿瘤诊断时间到任何原因出现死亡所经历的时间。所有研究对象随访截止时间为2017年12月31日。运用单因素Cox回归分析评估胆道系统肿瘤预后因素,单因素分析有统计学(P<0.05)或临床意义的变量纳入多因素Cox回归模型,并运用后退法进行变量筛选。基于以上因素构建胆道系统肿瘤以及胆囊癌、肝外胆管癌和壶腹癌预后风险预测列线图,对患者1、3和5年总体生存概率进行预测。同时构建生存预测列线图并进行模型的内部和外部预测准确性验证。预测模型区分能力采用C统计量(Harrell’s Concordance-index,C index)进行评价[8]。C统计量波动于0.5~1.0之间,分值越高代表模型的区分能力越强。模型标定能力用于评价一定时期内胆道系统肿瘤预测的死亡概率和实际死亡概率的比例,运用1 000次随机重复抽样法评估预测和实际死亡概率的差异,具体结果采用标准曲线进行展示。较高标定能力的预后预测模型其标准曲线应与45°对角线接近或重叠。为了进一步评价预测列线图的外部适用性,运用SEER队列2004-2009年诊断的胆道系统肿瘤患者数据对列线图1、3和5年总体生存率进行验证。统计学分析使用R 3.4.1软件,所有检验均为双侧,以P<0.05为差异有统计学意义。
结果1.基本特征:建模队列共纳入胆道系统肿瘤患者14 005人(图 1),其中男性6 272人(44.8%),女性7 733人(55.2%),年龄(69.27±12.93)岁。胆囊癌、肝外胆管癌、壶腹癌和其他胆管癌患者人数分别为5 488人(39.2%)、4 637人(33.1%)、2 658人(19.0%)和1 222人(8.7%)。总体胆道系统肿瘤患者中位生存时间为(9.00±0.17)个月,其1、3和5年累计生存率分别为41.9%、20.4%和15.3%。其中,胆囊癌、肝外胆管癌和壶腹癌患者中位生存时间分别为(9.00±0.25)、(7.00±0.24)和(28.00±1.28)个月,5年累计生存率分别为15.2%、7.9%和34.7%,见图 2。

|
| 图 1 人群筛选流程图 |

|
| 图 2 单因素分析森林图 |
验证队列共纳入11 953名符合纳入标准的研究对象(图 1),其中男性5 083人(42.5%),女性6 870人(57.5%),年龄(69.99±13.27)岁,中位生存时间(8.00±0.17)个月。胆囊癌、肝外胆管癌、壶腹癌和其他胆管癌患者分别为4 782人(40.0%)、4 017人(33.6%)、2 263人(18.9%)和891人(7.5%),中位生存时间分别为(7.00±0.24)、(6.00±0.23)、(21.00±0.83)和(3.00±0.17)个月。建模队列和验证队列人群基本人口学因素分布及差异分析见表 1,两组患者各临床特征分布比例呈现一致的情况,但由于较大研究样本量的作用,除婚姻状况(χ2=0.36;P=0.55)和组织学分化程度(Z=0.86;P=0.39)在建模队列和验证队列分布无显著差别外,其他因素在两组之间分布均有显著差异。
2.胆道系统肿瘤患者预后因素分析:单因素Cox回归分析结果显示,年龄、婚姻状况、T分期、N分期、M分期(TMN分期)、组织学分化程度和原发部位手术因素均与总体胆道系统肿瘤以及胆囊癌、肝外胆管癌和壶腹癌死亡风险显著关联,而种族和保险状况与总体胆道系统肿瘤和壶腹癌预后显著相关(图 2)。多因素Cox回归分析结果显示年龄>50周岁、黑人和美国印第安和阿拉斯加人种(与白人相比)、较高的TNM分期及较差组织学分化程度是胆道系统肿瘤死亡的独立风险因素,而已婚状态、亚裔和太平洋岛人种(与白人相比)、有医疗保险和原发部位手术是预后的保护性因素,性别与总体胆道系统肿瘤预后无显著关联。亚组分析结果显示,年龄>70周岁、较高的TNM分期及较差组织学分化程度均与胆囊癌、肝外胆管癌和壶腹癌的死亡风险正向关联,而原发部位手术是胆囊癌、肝外胆管癌和壶腹癌的死亡的保护性因素。此外,女性和已婚状态均与胆囊癌和肝外胆管癌死亡风险呈负相关联。黑人和美国印第安和阿拉斯加人种(与白人相比)则是壶腹癌死亡的独立风险因素(图 3)。
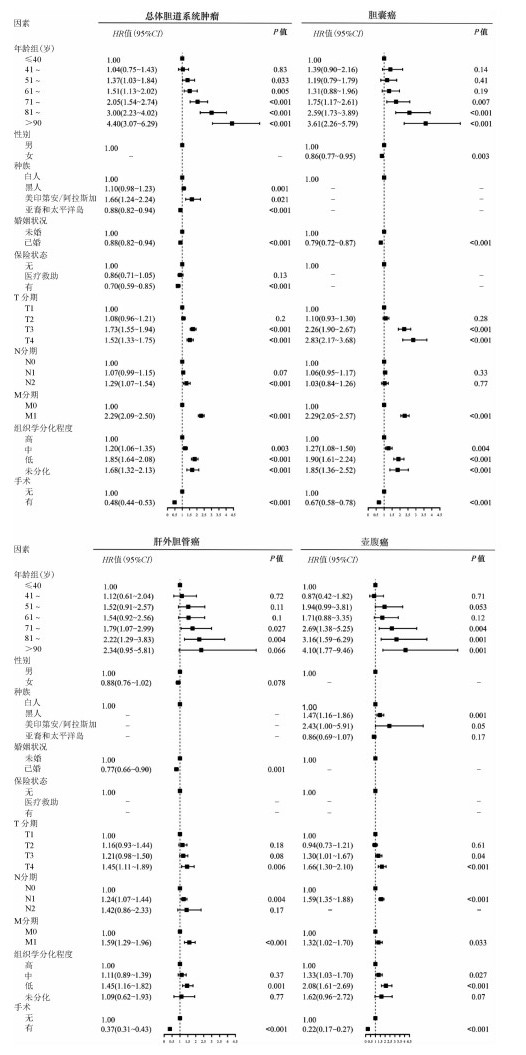
|
| 图 3 预后风险多因素分析森林图 |
3.胆道系统肿瘤预后风险预测模型的构建及验证:基于上述预后因素,分别构建总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌的预后风险预测列线图(图 4),对患者1、3和5年生存概率进行预测。内部验证结果显示,预测模型对总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌预后预测的区分能力C统计量分别为0.73(95%CI:0.72~0.74)、0.71(95%CI:0.69~0.72)、0.79(95%CI:0.77~0.81)和0.64(95%CI:0.62~0.66)。标准曲线结果显示总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌1、3和5年预测生存概率和实际生存概率交互曲线均与45°对角线接近(图 5),证明预测模型具有较高的预测准确性。

|
| 图 4 预后风险预测列线图 |
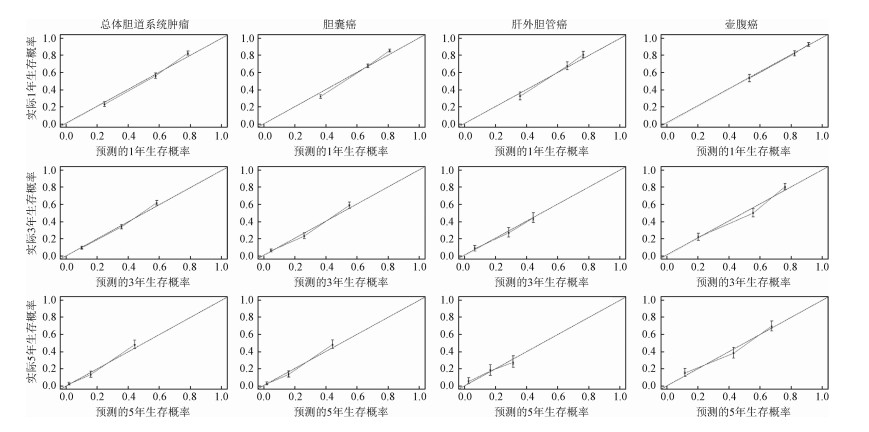
|
| 图 5 预测列线图对总体生存率预测准确性验证标准曲线 |
外部验证结果显示总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌的预后风险预测列线图预测的区分能力C统计量分别为0.70(95%CI:0.69~0.72)、0.72(95%CI:0.70~0.73)、0.68(95%CI:0.66~0.70)和0.65(95%CI:0.63~0.66)。标准曲线验证结果显示上述预测模型在外部验证队列中可以对总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌1、3和5年的生存概率进行准确预测(图 6)。
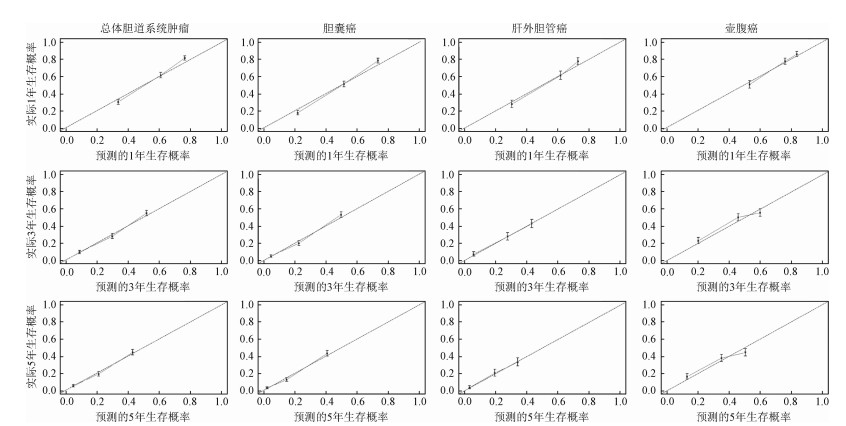
|
| 图 6 外部验证队列对总体生存率预测准确性验证标准曲线图 |
本研究基于大样本人群队列数据,系统评估了胆道系统肿瘤的生存概率及其影响因素,并以此为基础构建胆道系统肿瘤预后风险预测模型对患者生存概率进行预测。研究结果显示总体胆道系统肿瘤、胆囊癌和肝外胆管癌的5年总生存率均<20%,而壶腹癌5年生存率相对较高,约为35%,与既往研究结果一致[3, 9-11]。进一步分析发现,高龄、黑人和美国印第安和阿拉斯加人种、高TNM分期及低组织学分化程度是胆道系统肿瘤患者死亡的危险因素,已婚、亚裔和太平洋岛人种、有医疗保险及肿瘤原发部位手术是预后的保护因素。以此为基础构建的预测模型对总体胆道系统肿瘤、胆囊癌、肝外胆管癌和壶腹癌患者的预后均具有较好的预测能力。
既往研究显示,较高的TNM分期及较低的组织学分化程度是胆道系统肿瘤预后的独立危险因素,与本研究结果一致[4-5]。高TNM分期及低组织学分化程度同时也是多种恶性肿瘤预后的危险因素,这可能是由于较高分期和低分化的肿瘤具有较强的远处转移倾向,进而显著降低患者生存率[7]。胆道系统肿瘤缺乏有效的标准化疗方法,手术切除是目前唯一的临床治疗手段[12]。本研究证实,无论是在总体胆道系统肿瘤还是胆囊癌和其他胆道肿瘤患者中,肿瘤原发部位手术能显著提高患者中位生存时间近20个月;同时,已婚和有医疗保险状态是胆道系统肿瘤预后的保护因素,但具体机制尚不清楚。前期研究指出,已婚和有保险的恶性肿瘤患者发生远处转移风险显著低于未婚和无保险人群,这可能由于已婚和有保险患者也较倾向于接受标准化的癌症治疗[13-14]。同时,已婚和有医疗保险的患者在治疗过程中可能获得更多的经济支持所致,这可能促进癌症的早期诊断和进一步治疗,从而提高患者生存时间[15]。
患者预后情况是临床中决定患者后期治疗方案的重要决定因素。前期研究基于预后因素构建模型对胆道系统肿瘤生存状况进行预测,但因样本量较小且纳入的因素较少,预测效果不理想[16-17]。Song等[18]基于SEER队列开展的胆道系统肿瘤预测模型的预测C统计量为0.71,建模队列预测标定能力也相对较高,但是该预测模型显著高估验证队列患者1年和3年的生存时间,且预测区分能力C统计量仅为0.652,这可能是由于在预测模型构建过程中,对每个因素的各个等级均给予了平均的权重值,进而造成预测效果不佳结果。本项目充分整合基本人口学特征、临床特征和患者治疗信息等9个独立预后影响因素,并对每个因素各个等级赋予不同的权重值,再次构建胆道系统肿瘤预后风险预测列线图,同时对胆道系统肿瘤各个亚型分别构建模型,对患者1、3和5年生存概率进行准确预测。结果显示,预测模型无论在建模队列还是验证队列中,均能对患者生存概率进行准确预测且达到较高的区分能力。此外,Bai等[19]对我国142名术后胆囊癌患者开展研究,基于患者发生黄疸情况、肿瘤标志物CA19-9、肿瘤分期和手术情况对患者生存概率进行预测,模型具有较高的预测准确性,C统计量达到0.80。同时,Akazawa等[20]基于胆道肿瘤患者血液样本中的6个预后相关的microRNA构建预测风险评分,研究结果显示高风险评分患者总生存时间和无病生存时间均显著低于低风险评分的患者。因此,除患者的基本人口学特征和肿瘤特征因素外,患者的症状特征、肿瘤标志物及基因学因素也对生存预测准确性的提高具有重要价值。提示未来将加强模型的涵盖内容,全面纳入患者的特征信息,准确预测患者预后情况。
微观的基因和蛋白质模式的改变会在宏观影像学上有所表达,随着机器学习技术的不断发展,影像组学在胆道系统肿瘤生存预测中也将发挥重要作用[21]。Ji等[22]开展影像组学研究,基于术后胆道肿瘤患者的CT影像特征进行信息提取并构建预测列线图对患者肿瘤特异性死亡和无复发生存率进行了准确预测,预测C统计量达到0.81,且标准曲线也提示其较高的预测准确性。因此,未来还应进一步将患者临床特征和影像学特征进行融合,构建胆道系统肿瘤的多模态生存预测模型,进一步提高模型的预测准确性,并应用于临床实践当中。
本研究存在局限性。由于数据权限限制,无法获得研究对象具体治疗方案和并发症情况。同时,因无法获得随访过程中研究对象发生进展或转移的信息,本研究仅纳入研究对象初诊时的基本临床特征。这些研究局限在一定程度上可能会影响模型的预测准确性,尚需进一步研究全面探讨放疗和化疗等治疗方案与死亡风险的关联,并将其纳入预测模型,以提高诊断准确性。此外,由于较大研究样本量的影响,本项目中建模队列和验证队列人群多数临床特征分布呈现显著差异,但验证性结果显示,无论在建模队列还是验证队列,预测模型的标定能力和区分能力均达到较高水平,提示该预测模型可能适用于更加广泛和异质的人群中,但研究结果尚需进一步验证。
综上所述,胆道系统肿瘤患者生存率较差,高龄、黑人和美国印第安和阿拉斯加人种、较高的TNM分期及较差组织学分化程度是患者死亡的独立风险因素,而已婚状况、亚裔和太平洋岛人种、有保险和原发部位手术是预后的保护性因素。基于上述因素构建的生存预测模型能准确预测患者总体生存概率,并具有较高的外部适用性。未来需进一步扩展胆道系统肿瘤预后风险因素,充实预后风险预测模型的内容并积极结合影像组学研究内容,以期将该预测模型应用于临床,指导胆道系统肿瘤患者的个体化治疗。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
de Groen PC, Gores GJ, LaRusso NF, et al. Biliary tract cancers[J]. N Engl J Med, 1999, 341(18): 1368-1378. DOI:10.1056/NEJM199910283411807 |
| [2] |
Chan E, Berlin J. Biliary tract cancers:understudied and poorly understood[J]. J Clin Oncol, 2015, 33(16): 1845-1848. DOI:10.1200/JCO.2014.59.7591 |
| [3] |
Randi G, Malvezzi M, Levi F, et al. Epidemiology of biliary tract cancers:an update[J]. Ann Oncol, 2009, 20(1): 146-159. DOI:10.1093/annonc/mdn533 |
| [4] |
Fornaro L, Cereda S, Aprile G, et al. Multivariate prognostic factors analysis for second-line chemotherapy in advanced biliary tract cancer[J]. Br J Cancer, 2014, 110(9): 2165-2169. DOI:10.1038/bjc.2014.190 |
| [5] |
Bridgewater J, Lopes A, Wasan H, et al. Prognostic factors for progression-free and overall survival in advanced biliary tract cancer[J]. Ann Oncol, 2016, 27(1): 134-140. DOI:10.1093/annonc/mdv483 |
| [6] |
Cronin KA, Ries LA, Edwards BK. The surveillance, epidemiology, and end results (SEER) program of the national cancer institute[J]. Cancer, 2014, 120 Suppl 23: 3755-3757. DOI:10.1002/cncr.29049 |
| [7] |
Martin AM, Cagney DN, Catalano PJ, et al. Brain metastases in newly diagnosed breast cancer:a population-based study[J]. JAMA Oncol, 2017, 3(8): 1069-1077. DOI:10.1001/jamaoncol.2017.0001 |
| [8] |
Pencina MJ, D'Agostino RB. Overall C as a measure of discrimination in survival analysis:model specific population value and confidence interval estimation[J]. Stat Med, 2004, 23(13): 2109-2123. DOI:10.1002/sim.1802 |
| [9] |
Khan SA, Thomas HC, Davidson BR, et al. Cholangiocarcinoma[J]. Lancet, 2005, 366(9493): 1303-1314. DOI:10.1016/S0140-6736(05)67530-7 |
| [10] |
Misra S, Chaturvedi A, Misra NC, et al. Carcinoma of the gallbladder[J]. Lancet Oncol, 2003, 4(3): 167-176. DOI:10.1016/S1470-2045(03)01021-0 |
| [11] |
Kwon J, Kim BH, Kim K, et al. Survival benefit of adjuvant chemoradiotherapy in patients with ampulla of vater cancer:a systematic review and Meta-analysis[J]. Ann Surg, 2015, 262(1): 47-52. DOI:10.1097/SLA.0000000000001182 |
| [12] |
Horgan AM, Amir E, Walter T, et al. Adjuvant therapy in the treatment of biliary tract cancer:a systematic review and Meta-analysis[J]. J Clin Oncol, 2012, 30(16): 1934-1940. DOI:10.1200/JCO.2011.40.5381 |
| [13] |
Aizer AA, Chen MH, McCarthy EP, et al. Marital status and survival in patients with cancer[J]. J Clin Oncol, 2013, 31(31): 3869-3876. DOI:10.1200/JCO.2013.49.6489 |
| [14] |
Ellis L, Canchola AJ, Spiegel D, et al. Trends in cancer survival by health insurance status in california from 1997 to 2014[J]. JAMA Oncol, 2018, 4(3): 317-323. DOI:10.1001/jamaoncol.2017.3846 |
| [15] |
Walker GV, Grant SR, Guadagnolo BA, et al. Disparities in stage at diagnosis, treatment, and survival in nonelderly adult patients with cancer according to insurance status[J]. J Clin Oncol, 2014, 32(28): 3118-3125. DOI:10.1200/JCO.2014.55.6258 |
| [16] |
Park I, Lee JL, Ryu MH, et al. Prognostic factors and predictive model in patients with advanced biliary tract adenocarcinoma receiving first-line palliative chemotherapy[J]. Cancer, 2009, 115(18): 4148-4155. DOI:10.1002/cncr.24472 |
| [17] |
Neuzillet C, Casadei Gardini A, Brieau B, et al. Prediction of survival with second-line therapy in biliary tract cancer:actualisation of the AGEO CT2BIL cohort and European multicentre validations[J]. Eur J Cancer, 2019, 111: 94-106. DOI:10.1016/j.ejca.2019.01.019 |
| [18] |
Song W, Zhu ZG, Wu Q, et al. A nomogram to predict overall survival for biliary tract cancer[J]. Cancer Manag Res, 2018, 10: 1535-1541. DOI:10.2147/CMAR.S163291 |
| [19] |
Bai Y, Liu ZS, Xiong JP, et al. Nomogram to predict overall survival after gallbladder cancer resection in China[J]. World J Gastroenterol, 2018, 24(45): 5167-5178. DOI:10.3748/wjg.v24.i45.5167 |
| [20] |
Akazawa Y, Mizuno S, Fujinami N, et al. Usefulness of serum microRNA as a predictive marker of recurrence and prognosis in biliary tract cancer after radical surgery[J]. Sci Rep, 2019, 9(1): 5925. DOI:10.1038/s41598-019-42392-7 |
| [21] |
Lambin P, Leijenaar RTH, Deist TM, et al. Radiomics:the bridge between medical imaging and personalized medicine[J]. Nat Rev Clin Oncol, 2017, 14(12): 749-762. DOI:10.1038/nrclinonc.2017.141 |
| [22] |
Ji GW, Zhang YD, Zhang H, et al. Biliary tract cancer at CT:a radiomics-based model to predict lymph node metastasis and survival outcomes[J]. Radiology, 2019, 290(1): 90-98. DOI:10.1148/radiol.2018181408 |
 2019, Vol. 40
2019, Vol. 40