文章信息
- 刘志国, 王妙, 湛志飞, 崔步云, 李振军.
- Liu Zhiguo, Wang Miao, Zhan Zhifei, Cui Buyun, Li Zhenjun.
- 湖南省人间布鲁氏菌病流行特征及布鲁氏菌溯源调查
- Epidemiology of human brucellosis and source of Brucella isolates in Hunan province
- 中华流行病学杂志, 2019, 40(9): 1150-1154
- Chinese Journal of Epidemiology, 2019, 40(9): 1150-1154
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2019.09.025
-
文章历史
收稿日期: 2019-03-03
2. 内蒙古自治区综合疾病预防控制中心, 呼和浩特 010031;
3. 乌兰察布市地方病防治中心 012000;
4. 湖南省疾病预防控制中心, 长沙 410000;
5. 内蒙古自治区布鲁氏菌病防治工程技术研究中心, 通辽 028000
2. Inner Mongolia Autonomous Region Center for Comprehensive Disease Control and Prevention, Huhhot 010031, China;
3. Ulanqab Prefectural Center for Endemic Disease Control and Prevention, Ulanqab 012000, China;
4. Hunan Provincial Center for Disease Control and Prevention, Changsha 410000, China;
5. Engineering Technology Research Center for Brucellosis Control and Prevention of Inner Mongolia Autonomous Region, Tongliao 028000, China
布鲁氏菌病(布病)是由布鲁氏菌感染引起的人兽共患传染病,是我国法定报告的乙类传染病。布鲁氏菌通常分为6个经典的种型,分别为牛、羊、猪、犬、沙林鼠和绵羊附睾种。牛种、羊种和猪种布鲁氏菌对多种动物和人群有致病性[1]。因菌株的毒力和患者个体差异,其病症表现各异。人群感染后主要表现为发热、多汗、乏力以及全身肌肉关节游走性疼痛等[2]。母畜感染后可引发流产、死胎等,公畜主要表现为睾丸炎和附睾炎[3]。布病不仅对人群健康和公共卫生具有重要影响,并因动物流产等造成巨大的经济损失。湖南省人间布病发病率长期处于较低水平。2010年后人间布病发病率逐年升高,全省14个地州市均有人间布病病例报道。为阐述该地区人间布病的流行特征,查明该地区人间布病的感染来源,本研究对2010-2018年湖南省人间布病流行病学特征进行分析,并对一起家庭内布病疫情中分离的2株病原菌进行鉴定和溯源调查,为该地区人间布病防控提供参考。
资料与方法1.资料来源:①湖南省布病监测信息来源于中国疾病预防控制信息系统的传染病报告信息管理系统,按发病时间、地区、年龄、职业分布等下载数据。②湖南省人口基础数据资料来自国家统计局,地理数据采用湖南省区(县)界行政区划矢量地图(1:1 000 000),经纬度来源于“谷歌地图”。③定义:2010-2018年平均发病率=总发病例数/总人口数×100 000。
2.菌株来源:2株布鲁氏菌分离自湖南省安化县布病患者的血液样本,菌株编号为HuN001和HuN002。羊种菌16M、牛种菌544、猪种菌1330标准参考菌株为对照菌株,来自中国CDC传染病预防控制所布病室。菌株鉴定、培养及DNA提取(德国Qiagen公司)在生物安全三级实验室进行。
3.研究方法:
(1) 常规鉴别:布鲁氏菌生物型常规鉴别方法参照文献[4],常规鉴定试剂及标准品均由中国CDC传染病预防控制所布病室提供。
(2) UTS-PCR:UTS-PCR的正向引物为5′-GGCTATCGGCTGGGAAAGG-3′,反向引物为5′-CCTTCCGAAGAAAATACCCCT-3′,牛种布鲁氏菌的扩增产物为99 bp,羊种布鲁氏菌的扩增产物为84 bp[5]。采用20 μl扩增体系,正、反向引物各0.4 μl(10 μmol /L),模板DNA 1.0 μl,Mix 18.2 μl。PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃,10 min,在Gene Amp梯度PCR仪进行扩增。(3)毒力基因检测:引物名称、序列及产物见表 1[6]。采用20 μl扩增体系,包括super Mix 18.2 μl,引物各0.4 μl(10 pmol),模板DNA 1.0 μl;PCR扩增条件:95 ℃ 5 min;95 ℃ 30 s,56 ℃ 30 s,72 ℃ 40 s,30个循环;72 ℃ 5 min。
(4) 多位点可变数目串联重复序列分析(MLVA):PCR引物名称、序列参见文献[7]。试验方案、PCR扩增及检测、结果分析参见文献[8]。获得预期条带的扩增产物进行微卫星扫描(STR),并与公布的布鲁氏菌MLVA分型标准等位基因比较,将扩增片段转换为串联重复数(U),从而获得每个菌株的MLVA-16特征值。将流行病学背景信息和MLVA特征值一并录入Excel软件保存为文本文件(制表符分隔)备用。将湖南地区分离的2株菌与全球布鲁氏菌MLVAbank(包括来自50多个国家的5 611株布鲁氏菌)(http://microbesgenotyping.i2bc.paris-saclay.fr/Databases/view/907)的菌株MLVA特征值进行比较,并将遗传相似性≥95%的菌株下载进行聚类分析,追溯感染来源。
4.统计学分析:采用Excel 2016软件对数据进行统计学分析和绘图,采用AcrGIS 10.5软件绘制疫情分布图。
结果1.湖南省人间布病流行特征分析:
(1) 疫情概况:2003-2010年湖南省无人间布病病例。2010-2018年分别报告病例数为9、3、21、20、50、94、166、181和184例,共计728例。无死亡病例。年均发病率为0.12/10万。2010、2011年该地区人间布病较少,2012年后该地区人间布病的发病率呈逐年上升趋势,特别是从2015年开始发病率有明显升高的趋势。2018年的发病率(0.28/10万)约是2010年的(0.01/10万)28倍。见图 1。

|
| 图 1 2010-2018年湖南省人间布病发病情况 |
(2) 发病时间分布:病例报告排列居前的月份为5月(20.05%,146/728)、6月(12.64%,92/728)、7月(12.64%,92/728)、9月(9.62%,70/728)、8月(9.07%,66/728)和3月(9.07%,66/728)。11月发病数最少(2.61%,19/728)。5-7月为发病高峰期,报告病例占45.33%。
(3) 人群分布:职业分布以农民最多(59.07%,430/728),其次为商业服务人员(7.42%,54/728)和其他人员(6.87%,50/728);餐饮食品业从业人员、牧民、离退人员及家务待业人员分别为23、25、28和29例,占比分别为3.16%、3.43%、3.85%和3.98%,其余有幼托儿童、散居儿童、干部职员、教师和工人等职业,但病例较少。
(4) 年龄分布:0~83岁年龄组均有分布,其中50~岁组(162例,22.25%)和45~岁组(117例,16.01%)发病数居前,45~54岁年龄组病例最多为279例,占38.32%。男性534例,占73.35%;女性194例,占26.65%。男女性别比为2.75:1。见图 2。
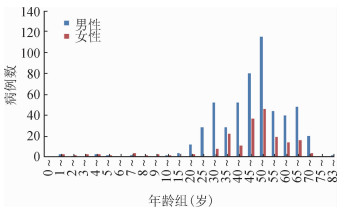
|
| 图 2 2010-2018年湖南省人间布病患者年龄分布 |
(5) 地区分布特征:郴州市和永州市发病率(/10万)居前,分别为2.50和1.90。2010年该地区的人间布病病例仅分布于芙蓉区、衡东县、宁乡县、桃源县、桃江县5个县(市、区),其中桃江县(5例)的发病率(/10万)最高,为0.56,其余地区均为1例,发病率(/10万)分别为0.26、0.13、0.07和0.10。2018年疫情扩散到69个县(市、区),发病率(/10万)较高的县(市、区)分别为苏仙区(2.96)、洪江市(2.30)、新宁县(1.70)、韶山市(1.67)、永顺县(1.30)、自治县(1.30)、冷水滩区(1.25)、桃源县(1.23)。见图 3。

|
| 图 3 2010、2018年湖南省人间布病地区分布 |
2.常规鉴定:待测菌株的CO2需要和H2S产生实验结果均阴性;血清凝集实验均阳性,A因子血清凝集均阳性,M因子血清凝集阴性;染料抑菌实验均为阳性;菌株可被噬菌体BK2裂解,104 Tb和WB噬菌体未见明显裂解(表 2)。
3. UTS-PCR鉴定:牛、羊种标准参考菌株获得预期结果,扩增条带分别为牛种布鲁氏菌99 bp,羊种84 bp,阴性对照未见扩增。2株待测菌获得了预期84 bp的特异性扩增产物。
4.毒力基因检测:电泳检测显示2株菌的6个毒力基因全部获得预期扩增。Ure、ManA、PerA、Omp19、wpbW和WbkA的扩增产物分别为2 100、271、716、550、639和931 bp,阴性对照未见扩增。见图 4。
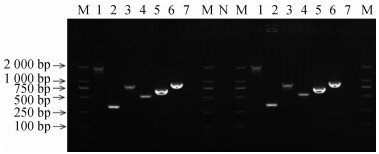
|
| 注:M:Marker(DL2000);1~6分别为Ure、ManA、PerA、Omp19、wpbW和WbkA;7:阴性对照;N:无样品 图 4 布鲁氏菌毒力基因检测 |
5. MLVA-16聚类分析:2株临床分离布鲁氏菌的16个位点的串联重复数完全相同,依次为1-5-3-13-2-2-3-2-4-41-8-4-4-3-5-5(图 5)。随后将2株菌的16个位点的特征值输入国际布鲁氏菌MLVAbank数据库进行同源性检索,发现有12株布鲁氏菌与试验菌株的遗传相似性≥95%,菌株分别来自内蒙古(9株)、山西(1)、青海(1)和天津(1)4个省份。14株菌的Panel1和MLVA-11基因型分别为42和116。临床分离的2株布鲁氏菌与内蒙古来自骆驼和绵羊的羊种布鲁氏菌具有完全相同的MLVA-16基因型。见图 5。
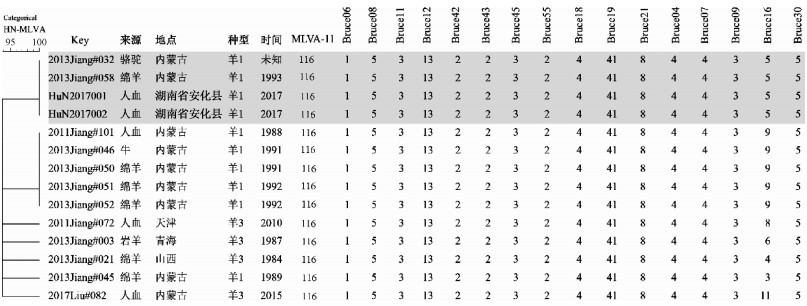
|
| 图 5 布鲁氏菌MLVA聚类分析 |
2010-2018年湖南省人间布病的年均发病率为0.12/10万,与福建省2011-2016年的发病率(0.14/10万)相当[9]。2013年之前该地区人间布病的发病率低于2013年全国布病发病率(3.21/10万)。2016年发病率略低于南方地区均值(0.27/10万)[10],但2018年的发病率约为2010年的28倍,提示湖南省人间布病发病率呈明显的快速上升趋势。发病主要集中在5-7月,呈现明显的夏季多发,这与李锡太等[11]的研究结果相符。在职业分布中农民感染者最多,与布病的感染特点吻合,与染疫动物及其污染物密切接触的人群多发[12]。在0~83岁年龄组均有分布,其中45~54岁组病例最多。年龄分布特征与我国其他布病流行区布病患者的年龄分布一致[13]。因布鲁氏菌感染无性别、年龄、种族、时间等差异,布鲁氏菌对人群和绝大多数动物包括海洋动物均有感染性,仅与接触感染动物相关。故本研究未对年龄、职业等进行相关的差异性统计分析。2010年湖南省仅5个县(市、区)有人间布病病例,发病地区较为集中且发病率较低。2018年69个县(市、区)报告了病例,其中苏仙区的发病率最高,与我国人畜间布病逐渐由北方畜牧业省份向南方地区蔓延的流行模式相符[13-14]。应进一步强化检测防控,防止由传染源的输入导致人间布病流行。
布鲁氏菌的分离是可疑患者确诊的“金标准”[15],也是开展溯源调查的分子基础。本研究从湖南省安化县的一起家庭布病疫情的2名患者(母亲和早产儿)的血液样本中分离获得了2株布鲁氏菌,经鉴定菌株均为羊种1型布鲁氏菌。虽然羊种1型布鲁氏菌是我国的优势流行菌种[16],但因菌株数量有限尚不能断定湖南省人间布病由羊种布鲁氏菌引起。2株布鲁氏菌均有6个相关的毒力基因,而这些基因编码的蛋白对布鲁氏菌的胞内存活具有重要生物学意义[17],表明该菌株为强毒株,也是导致孕妇早产的主要原因。分离菌株的Panel 1和MLVA-11基因型分别为42和116,该类基因型的羊种布鲁氏菌在我国北方布病流行地区广泛存在,也是导致我国人畜间布病严重流行的优势基因型[8, 18]。湖南省安化县分离的2株布鲁氏菌具有一致的MLVA-16基因型,表明2例患者由相同的传染源引起,提示患儿通过母婴传播而感染。此外,2株菌与从内蒙古地区骆驼和绵羊分离的羊种布鲁氏菌具有完全相同的MLVA-16基因型,提示传染源来自内蒙古,表明该起家庭布病疫情为输入性的聚集流行。目前,由传染源的输入导致南方地区家庭布病的聚集性疫情已有报道。江苏某地因接触了引入感染的羊而导致了家庭布病聚集性暴发[19]。建议在南方地区开展相应的布鲁氏菌溯源调查,揭示感染来源和传播模式,为制定有针对性的防控策略提供参考。
利益冲突 所有作者均声明不存在利益冲突
| [1] |
Kamal IH, Al Gashgari B, Moselhy SS, et al. Two-stage PCR assay for detection of human brucellosis in endemic areas[J]. BMC Infect Dis, 2013, 13: 145. DOI:10.1186/1471-2334-13-145 |
| [2] |
Shi YJ, Gao H, Pappas G, et al. Clinical features of 2041 human brucellosis cases in China[J]. PLoS One, 2018, 13(11): e0205500. DOI:10.1371/journal.pone.0205500 |
| [3] |
Khan MZ, Zahoor M. An overview of brucellosis in Cattle and humans, and its serological and molecular diagnosis in control strategies[J]. Trop Med Infect Dis, 2018, 3(2): 65. DOI:10.3390/tropicalmed3020065 |
| [4] |
Al Dahouk S, Tomaso H, Nöckler K, et al. Laboratory-based diagnosis of brucellosis-a review of the literature. PartⅠ:Techniques for direct detection and identification of Brucella spp.[J]. Clin Lab, 2003, 49(9/10): 487-505. |
| [5] |
Alamian S, Esmaelizad M, Zahraei T, et al. A Novel PCR Assay for Detecting Brucella abortus and Brucella melitensis[J]. Osong Public Health Res Perspect, 2017, 8(1): 65-70. DOI:10.24171/j.phrp.2017.8.1.09 |
| [6] |
Mirnejad R, Jazi FM, Mostafaei S, et al. Molecular investigation of virulence factors of Brucella melitensis and Brucella abortus strains isolated from clinical and non-clinical samples[J]. Microb Pathog, 2017, 109: 8-14. DOI:10.1016/j.micpath.2017.05.019 |
| [7] |
Al Dahouk S, Le Flèche P, Nöckler K, et al. Evaluation of Brucella MLVA typing for human brucellosis[J]. J Microbiol Methods, 2007, 69(1): 137-145. DOI:10.1016/j.mimet.2006.12.015 |
| [8] |
Liu ZG, Di DD, Wang M, et al. MLVA Genotyping Characteristics of Human Brucella melitensis Isolated from Ulanqab of Inner Mongolia, China[J]. Front Microbiol, 2017, 8: 6. DOI:10.3389/fmicb.2017.00006 |
| [9] |
祝寒松, 王灵岚, 林代华, 等. 福建省2011-2016年人间布鲁氏菌病流行病学分析和时空聚集探测[J]. 中华流行病学杂志, 2017, 38(9): 1212-1217. Zhu HS, Wang LL, Lin DH, et al. Analysis on epidemiology and spatial-temporal clustering of human brucellosis in Fujian province, 2011-2016[J]. Chin J Epidemiol, 2017, 38(9): 1212-1217. DOI:10.3760/cma.j.issn.0254-6450.2017.09.014 |
| [10] |
施玉静, 赖圣杰, 陈秋兰, 等. 我国南北方2015-2016年人间布鲁氏菌病流行特征分析[J]. 中华流行病学杂志, 2017, 38(4): 435-440. Shi YJ, Lai SJ, Chen QL, et al. Analysis on the epidemiological features of human brucellosis in northern and southern areas of China, 2015-2016[J]. Chin J Epidemiol, 2017, 38(4): 435-440. DOI:10.3760/cma.j.issn.0254-6450.2017.04.005 |
| [11] |
李锡太, 陈艳伟, 何战英, 等. 北京市2004-2015年布鲁氏菌病时间分布特征分析[J]. 实用预防医学, 2017, 24(2): 185-187. Li XT, Chen YW, He ZY, et al. Seasonality characteristics of brucellosis in Beijing, 2004-2015[J]. Pract Pre Med, 2017, 24(2): 185-187. DOI:10.3969/j.issn.1006-3110.2017.02.015 |
| [12] |
周艳华, 左顺武, 姚颖波, 等. 玉溪市职业人群布鲁菌病调查[J]. 中华劳动卫生职业病杂志, 2015, 33(12): 913-914. Zhou YH, Zuo SW, Yao YB, et al. An investigation of brucellosis in occupational population in Yuxi, China[J]. Chin J Ind Hyg Occup Dis, 2015, 33(12): 913-914. DOI:10.3760/cma.j.issn.1001-9391.2015.12.009 |
| [13] |
Lai SJ, Zhou H, Xiong WY, et al. Changing epidemiology of human brucellosis, China, 1955-2014[J]. Emerg Infect Dis, 2017, 23(2): 184-194. DOI:10.3201/eid2302.151710 |
| [14] |
Kong WL. Brucellosis infection increasing in Southern China[J]. Eur J Intern Med, 2018, 51: e16-18. DOI:10.1016/j.ejim.2018.03.004 |
| [15] |
Bharathan B, Backhouse L, Rawat D, et al. An unusual case of seronegative, 16S PCR positive Brucella infection[J]. JMM Case Rep, 2016, 3(5): e005050. DOI:10.1099/jmmcr.0.005050 |
| [16] |
Jiang H, Fan MG, Chen JD, et al. MLVA genotyping of Chinese human Brucella melitensis biovar 1, 2 and 3 isolates[J]. BMC Microbiol, 2011, 11: 256. DOI:10.1186/1471-2180-11-256 |
| [17] |
Delrue RM, Lestrate P, Tibor A, et al. Brucella pathogenesis, genes identified from random large-scale screens[J]. FEMS Microbiol Lett, 2004, 231(1): 1-12. DOI:10.1016/s0378-1097(03)00963-7 |
| [18] |
Tian GZ, Cui BY, Piao DR, et al. Multi-locus variable-number tandem repeat analysis of Chinese Brucella strains isolated from 1953 to 2013[J]. Infect Dis Poverty, 2017, 6: 89. DOI:10.1186/s40249-017-0296-0 |
| [19] |
Tan ZM, Huang Y, Liu GY, et al. A familial cluster of human brucellosis attributable to contact with imported infected goats in Shuyang, Jiangsu province, China, 2013[J]. Am J Trop Med Hyg, 2015, 93(4): 757-760. DOI:10.4269/ajtmh.15-0149 |
 2019, Vol. 40
2019, Vol. 40




