文章信息
- 金鹏飞, 李靖欣, 朱凤才.
- Jin Pengfei, Li Jingxin, Zhu Fengcai.
- 评估疫苗群体保护的研究进展
- Progress in assessment of vaccine on herd protection
- 中华流行病学杂志, 2018, 39(6): 862-866
- Chinese Journal of Epidemiology, 2018, 39(6): 862-866
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.06.032
-
文章历史
收稿日期: 2017-05-18
在传统随机对照疫苗临床试验中,试验人群被随机分配至试验组和安慰剂组,经过一定疾病监测期后分析比较两组间的疾病发病率,得到的保护效力为疫苗的直接保护效应。当接种率达到一定水平时,疫苗接种除直接保护接种人群还会产生群体保护间接保护未接种的易感人群。因此,疫苗的群体保护效应具有十分重要的公共卫生意义[1-3]。
随着新型疫苗上市后的推广接种,其群体保护研究越来越受到关注。新型疫苗的价格通常高于传统疫苗很多,例如预防轮状病毒[4-5]、肺炎球菌、HPV[6-7]、肠道病毒71型(EV71)[8]等病原体的疫苗。此外,一些新型疫苗在低收入水平人群中仅提供中等水平的保护效力,如口服霍乱疫苗和轮状病毒疫苗等新一代疫苗[9-10]。如果新型疫苗具有良好的群体保护,将会提高疫苗的经济学价值,从而有助于在公共卫生决策中被优先考虑。近年来,国外关于疫苗群体保护的研究日益增多,但国内还未见相关的文献报道。本文综述了国外关于疫苗群体保护的相关研究,旨在对评价疫苗群体保护的研究设计及方法进行阐述,为我国在该领域的相关研究提供参考。
一、群体保护及其评价疫苗群体效应包括群体保护(herd protection)和群体免疫(herd immunity),群体保护和群体免疫常常被交替应用,但两者概念和意义均存在一定的差异。群体保护:人群中一定水平的疫苗接种率可降低易感人群(免疫失败和未接种人群)的暴露机会和强度以及病原体的传播能力,使易感人群获得间接保护,减毒活疫苗和灭活疫苗均可产生群体保护;群体免疫:减毒活疫苗的病毒/细菌株自接种者排出体外形成二次传播,感染易感人群使其产生间接保护,主要为减毒活疫苗,如脊髓灰质炎和轮状病毒减毒活疫苗[11-12]。
群体保护的评价指标包括间接效应(indirect effect)、总效应(total effect)和整体效应(overall effect),当疫苗接种率达一定水平时,未接种人群因群体保护而获得疫苗的间接保护,即间接效应;接种人群同时获得疫苗的直接和间接保护,即总效应;总人群(包括接种人群和未接种人群)获得的疫苗保护,即整体效应[13-14]。群体保护的计算公式:

在疫苗上市后的观察性研究中,对照群组为观察人群接种前水平,疫苗群组为同一观察人群接种后不同水平;在群随机对照临床试验中,因考虑伦理学要求,对照群组常接种与预防目标疾病无关的对照疫苗。
二、评价群体保护的研究设计1.观察性研究设计(Observational study design):评价疫苗群体保护的传统研究设计常在疫苗上市推广后或公共卫生项目中得以应用实施,基于前瞻性人群的疾病监测以及疫苗接种率水平,观察疫苗接种前后目标人群的发病率变化。观察性研究在肺炎球菌结合疫苗[15-16]、Hib结合疫苗[17]、脑膜炎球菌结合疫苗[18]、百日咳疫苗[19]以及轮状病毒疫苗[20-22]的群体保护评价中被广泛应用,以肺炎球菌结合疫苗和轮状病毒疫苗为例,分别介绍两种评价群体保护的方法。
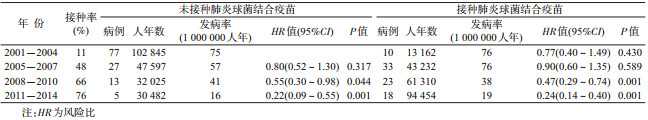
(1)肺炎球菌结合疫苗的群体保护研究:2001年6月,肺炎球菌结合疫苗相继在西班牙获得批准接种,肺炎球菌所致侵袭性疾病(Invasive pneumococcal disease,IPD)监测工作组在Navarra省实施了一项人群队列研究以评价肺炎球菌结合疫苗的群体保护水平[16]。2001年1月至2014年12月期间,工作组共随访120 980名5岁以下儿童及婴幼儿发生IPD的情况,共206人发生了IPD。根据5岁以下儿童及婴幼儿肺炎球菌结合疫苗的接种率水平,将随访时间分成4个阶段:①2001-2004年7价肺炎球菌结合疫苗的接种率较低,作为疫苗接种前的基线数据;② 2005-2007年7价肺炎球菌结合疫苗的接种率逐年上升期;③2008-2010年7价肺炎球菌结合疫苗高接种率期;④ 2011-2014年13价肺炎球菌结合疫苗高接种率期。研究组分别计算2005-2007/2008-2010/2011-2014年未接种和接种肺炎球菌结合疫苗人群的IPD发病率相对于2001-2004年未接种人群的风险比(hazard ratios,HR),以评估肺炎球菌结合疫苗的间接保护和总保护水平。结果显示随着肺炎球菌结合疫苗接种率的升高,肺炎球菌结合疫苗预防所有血清型IPD的间接保护效应和总效应均呈增加趋势,当疫苗接种率达76%时,间接保护效应达到78%,总效应达到76%,疫苗对接种人群和未接种人群的保护效应相接近(表 1)。
(2)轮状病毒减毒活疫苗的群体保护研究:当无法获知每个观察对象的接种水平时,疫苗所预防疾病实际发病率下降的百分比大于预期下降的百分比,则为疫苗间接保护提供有力的证据。实际发病率下降的百分比(%)(observed reduction)=(接种前发病率-接种后发病率)/接种前发病率;预期发病率下降的百分比(%)(expected reduction)=Ⅲ期临床试验的疫苗效力×疫苗接种率,为疫苗的直接保护;间接保护效应=实际发病率下降的百分比-预期发病率下降的百分比[22]。
2006年美国免疫策略咨询委员会(Advisory Committee on Immunization Practices,ACIP)相继推荐4价重组疫苗和单价减毒疫苗用于婴幼儿轮状病毒感染所致腹泻疾病的预防。随后,美国CDC建立多中心、以人群为基础的轮状病毒主动监测系统,监测轮状病毒疫苗上市前后3岁以下儿童和婴幼儿轮状病毒所致疾病发生情况[20]。2006-2009年监测系统中共261名3岁以下儿童和婴幼儿因轮状病毒所致的重症急性肠胃炎(severe acute gastroenteritis,SAG)住院,各年住院率分别为22.5/10 000、21.6/10 000、2.4/10 000和10.1/10 000,2006-2009年轮状病毒疫苗接种率分别约为0%、10%、42%和67%。基于疫苗接种率以及Ⅲ期临床试验中观察的疫苗效力,2008年预测轮状病毒所致SAG住院率下降49%,而实际轮状病毒所致SAG住院率相对于2006年基线水平下降89%,轮状病毒疫苗的间接保护效应为40%。
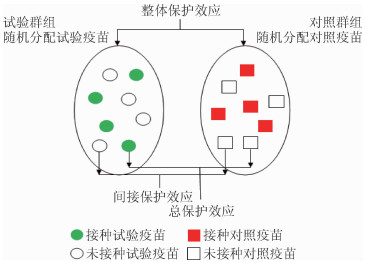
2.群随机临床试验设计(Cluster-randomized clinical trial design):群随机临床试验是评价疫苗群体保护最理想的研究设计,严格的群随机疫苗临床试验分为两层随机,包括群随机和个体随机。首先,将选择好的群组随机分配至试验组和对照组,考虑到伦理学问题,对照组通常分配与试验疫苗预防疾病无关的其他疫苗;然后,各群组内受种者被随机分配接种试验用疫苗和不接种疫苗(图 1)。
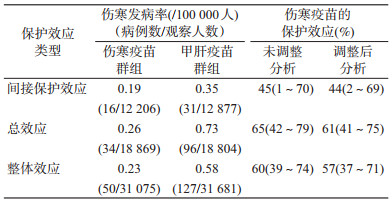
(1)伤寒Vi疫苗的群体保护研究:2004年,Sur等[23]在印度Kolkata地区开展了一项2岁以上人群中伤寒Vi疫苗群随机Ⅳ期临床研究,以评价Vi多糖结合疫苗免后2年预防伤寒的群体保护。将根据人口普查资料以及地理分布分成的80个群组,随机分配至试验组和对照组。试验组人群接种Vi多糖结合疫苗,对照组人群接种灭活甲型肝炎疫苗,但试验组和对照组内疫苗的接种未进行随机化分配。试验组共31 075人,接种Vi多糖结合疫苗18 869人(接种率为61%);对照组共31 681人,接种灭活甲型肝炎疫苗18 804人(接种率为60%)。根据上述群体保护的评价方法,研究结果显示在2岁以上人群中伤寒Vi疫苗预防伤寒的间接效应、总效应和整体效应分别为45%、65%和60%(表 2)。
(2)口服轮状病毒减毒活疫苗群体保护效应:2008年,GAVI在Bangladesh农村地区6~20周岁儿童中实施了一项群随机、开放性对照临床研究评价口服轮状减毒活疫苗的群体保护效应,为该疫苗纳入国家的免疫规划提供科学的依据[24]。该研究是首个评价轮状病毒群体效应的群随机对照临床试验,共142个乡村按1 : 1比例随机分配至试验群组和对照群组,试验群组口服轮状病毒减毒活疫苗和免疫规划脊髓灰质炎减毒活疫苗,对照群组仅口服脊髓灰质炎减毒活疫苗。接种后近2年的急性轮状病毒腹泻疾病的监测结果显示,试验群组和对照群组儿童急性轮状病毒腹泻发病率分别为2.8/100人年和4.1/100人年,疫苗的整体效应为20.9%(95%CI:11.3%~43.1%);试验群组73.7%儿童接种口服轮状病毒减毒活疫苗,急性轮状病毒腹泻发病率为2.28/100人年,疫苗的总效应为38.8%(95%CI:20.6%~52.7%)。研究中未观察到疫苗的间接保护效应,可能与病例监测的时间较短、疫苗接种率低以及随机群组间的交互影响相关。
3.小群组研究设计(The minicommunity design):以地理分布或社区为分配单位的群随机对照临床研究所需的人力、物力、经济资源较多,实施的难度较大,从而影响了群随机对照临床研究实施的可行性。对于一些聚集性传播的疾病,如百日咳[25]、肺炎球菌感染[26]、流感等[27],以家庭或学校小群为随机单位的群随机对照临床研究日益增多。分析比较接种者家庭成员和未接种者家庭成员的疾病发生情况,以评价疫苗的间接保护。
(1)肺炎球菌结合疫苗的群体保护研究(以家庭为群组研究单位):1997-2000年O’Brien等[28]实施了首个肺炎球菌结合疫苗上市前的群随机对照Ⅲ期疫苗临床试验,以评价疫苗在6周龄至24月龄的婴幼儿中的总效应和间接保护效应。按试验社区划分的38个群组,被随机分配至试验群组(7价肺炎球菌结合疫苗)和对照群组(脑膜炎奈瑟球菌结合疫苗)。试验中独立的统计人员按1 : 1比例随机将6种标签(B、F、H、M、T、U)分配给试验疫苗和对照疫苗,其他研究人员对于标签的分配均处于盲态。在临床试验揭盲之后,研究组分析比较试验和对照组接种者家庭成员携带肺炎球菌的概率,以评价疫苗的间接保护效应[26]。最终,试验群组542个家庭(<18岁儿童1 030人,≥18岁成年人1 018人)和对照群组385个家庭(<18岁儿童665人,≥18岁成年人711人)被纳入分析。研究结果显示<5岁儿童和≥18岁成年人中肺炎球菌结合疫苗针对疫苗血清型肺炎球菌携带的间接保护效应均为43%;在携带有疫苗血清型肺炎球菌接种者的家庭中,试验群组家庭中成年人携带率低于对照群组家庭中成年人的携带率。该研究证实肺炎球菌结合疫苗可降低未接种人群的暴露风险以及肺炎球菌的传播能力,从而产生一定的间接保护效应。
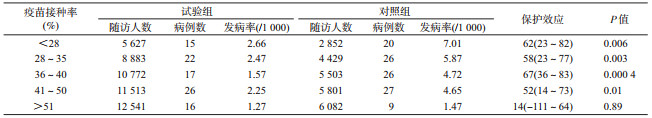
(2)口服霍乱疫苗的群体保护研究(以家族为群组研究单位):1985年,Clemens等[10, 29]在孟加拉国Matlab地区开展了一项评价灭活口服霍乱疫苗保护效力的个体随机、双盲对照疫苗临床试验,124 035名符合入组标准的2~15岁儿童及≥15岁的女性被随机分配至疫苗组(口服霍乱疫苗)或对照组(大肠埃希菌疫苗)。结果显示疫苗组接种后1年内预防霍乱的直接保护效力仅为50%左右。由于口服霍乱疫苗中等水平的直接保护效力,该疫苗在霍乱流行区并不十分受欢迎,故有必要评价口服霍乱疫苗的间接保护效应。由于受入组时受试者拒绝以及排除率的影响,在地理位置上疫苗的覆盖率可能呈非随机分布。故Ali等[30]重新分析Matlab临床试验资料,以地理位置相对独立的Bari(按父系家族形成的聚居区)作为分析单位,按疫苗覆盖率不同进行分层分析。分析的结果显示随着口服霍乱疫苗覆盖率的升高,对照组人群霍乱发病率随之下降(P<0.000 1),证实口服霍乱疫苗可以提供群体保护(表 3)。
4.关于不同研究设计的考虑:人群观察性研究是评价疫苗群体保护最为传统、也是应用最广泛的研究设计,因为该研究设计实施相对容易。但需要获得观察对象的接种水平(或疫苗接种率)和疫苗所预防疾病发病率的数据,同时,建立高质量的监测体系才能确保疫苗接种水平(或疫苗接种率)和疾病发病率的准确性。疫苗群体保护能降低目标人群的暴露风险和强度,使得目标人群首次感染或发病的年龄出现延迟,还可间接保护非目标人群免于疾病的发生;此外,群体保护可以通过免疫屏障形成选择压力,从而改变病原体的流行株或基因型,如肺炎链球菌最为常见[14, 31-32]。故在人群观察性研究中,可评价目标人群首次感染或发病年龄的改变、非目标人群发病率的降低以及流行株或基因型的改变,证实疫苗群体保护。观察性研究中人群发病率的改变会受到疾病流行特征或者其他与疫苗接种无关因素的影响,特别是周期性流行或者不同基因型交替流行时,可能会低估或高估疫苗的群体保护水平[14],故在实施观察性研究时需考虑混杂因素对群体保护评价的影响。
群随机对照疫苗临床试验是评价疫苗群体保护最理想的研究设计。在群随机对照临床试验中,群的选择十分重要。需要考虑以下几点[12]:①群内病原体应具有一定的传播能力,同时要减少疫苗组群和对照组群间的交互影响,群之间的传播将会低估疫苗的间接保护效应。②群内的研究人群应该相对稳定,尽量减少群内人群的迁入迁出以及群间人群的迁移。③应有足够用于随机分组的群数,确保试验和对照群组间基线水平均衡以及满足统计效能的需要。由于以地理分布或社区为群组的群随机对照临床试验所需的人力、物力较大,故国外大群组随机对照临床试验研究相对较少。对于一些聚集性传播的疾病,如百日咳、肺炎球菌感染、流感等[25-27],以家庭或学校为随机分配单位的小群对照临床试验日益增多。相比较以大群为随机单位的临床试验,小群组对照临床试验更加经济可行[33]。此外,小群组对照临床试验可以在个体随机对照临床的基础上进行拓展实施,提高了研究设计的效率[10, 29];且在研究人群数量一定的情况下,小群组对照临床研究的效能要高于大群组随机对照临床研究。
三、总结疫苗群体保护效应对于疫苗公共卫生决策和疾病流行特征具有十分重要的意义,相比于欧美国家,我国在该领域的研究较少。随着新型疫苗不断获批上市,我国应建立相应的疾病监测系统,以评价疫苗上市后对人群发病率以及疾病流行特征的影响;同时,应探索设计、实施群随机对照临床试验,为我国疫苗免疫策略提供科学的依据。在制定评价疫苗群体效应的研究设计时,需考虑不同研究设计的特点以及实施的可行性。此外,目标人群、疫苗覆盖率、流行强度以及传播动力学等因素均会影响疫苗群体保护的评价,故在群体保护外推方面,均要综合考虑以上因素的影响。
利益冲突: 无
| [1] | Luyten J, Beutels P. The social value of vaccination programs:beyond cost-effectiveness[J]. Health Aff, 2016, 35(2): 212–218. DOI:10.1377/hlthaff.2015.1088 |
| [2] | Fox JP, Elveback L, Scott W, et al. Herd immunity:basic concept and relevance to public health immunization practices[J]. Am J Epidemiol, 1971, 94(3): 179–189. DOI:10.1093/oxfordjournals.aje.a121310 |
| [3] | Holubar M, Stavroulakis MC, Maldonado Y, et al. Impact of vaccine herd-protection effects in cost-effectiveness analyses of childhood vaccinations. A quantitative comparative analysis[J]. PLoS One, 2017, 12(3): e0172414. DOI:10.1371/journal.pone.0172414 |
| [4] | Vesikari T, Matson DO, Dennehy P, et al. Safety and efficacy of a pentavalent human-bovine (WC3) reassortant rotavirus vaccine[J]. N Engl J Med, 2006, 354(1): 23–33. DOI:10.1056/NEJMoa052664 |
| [5] | Ruiz-Palacios GM, Pérez-Schael I, Velázquez FR, et al. Safety and efficacy of an attenuated vaccine against severe rotavirus gastroenteritis[J]. N Engl J Med, 2006, 354(1): 11–22. DOI:10.1056/NEJMoa052434 |
| [6] | Paavonen J, Jenkins D, Bosch FX, et al. Efficacy of a prophylactic adjuvanted bivalent L1 virus-like-particle vaccine against infection with human:papillomavirus types 16 and 18 in young women:an interim analysis of a phase Ⅲ double-blind, randomised controlled trial[J]. Lancet, 2007, 369(9580): 2161–2170. DOI:10.1016/S0140-6736(07)60946-5 |
| [7] | Joura EA, Leodolter S, Hernandez-Avila M, et al. Efficacy of a quadrivalent prophylactic human papillomavirus (types 6, 11, 16, and 18) L1 virus-like-particle vaccine against high-grade vulval and vaginal lesions:a combined analysis of three randomised clinical trials[J]. Lancet, 2007, 369(9574): 1693–1702. DOI:10.1016/S0140-6736(07)60777-6 |
| [8] | Zhu FC, Meng FY, Li JX, et al. Efficacy, safety, and immunology of an inactivated alum-adjuvant enterovirus 71 vaccine in children in China:a multicentre, randomised, double-blind, placebo-controlled, phase 3 trial[J]. Lancet, 2013, 381(9882): 2024–2032. DOI:10.1016/S0140-6736(13)61049-1 |
| [9] | Madhi SA, Cunliffe NA, Steele D, et al. Effect of human rotavirus vaccine on severe diarrhea in African infants[J]. New Engl J Med, 2010, 362(4): 289–298. DOI:10.1056/NEJMoa0904797 |
| [10] | Clemens JD, Sack DA, Harris JR, et al. Field trial of oral cholera vaccines in Bangladesh:results from three-year follow-up[J]. Lancet, 1990, 335(8684): 270–273. DOI:10.1016/0140-6736(90)90080-O |
| [11] | Paul Y. Herd immunity and herd protection[J]. Vaccine, 2004, 22(3/4): 301–302. DOI:10.1016/j.vaccine.2003.07.016 |
| [12] | Clemens J, Shin S, Ali M. New approaches to the assessment of vaccine herd protection in clinical trials[J]. Lancet Infect Dis, 2011, 11(6): 482–487. DOI:10.1016/S1473-3099(10)70318-2 |
| [13] | Halloran ME, Struchiner CJ, Longini IM Jr. Study designs for evaluating different efficacy and effectiveness aspects of vaccines[J]. Am J Epidemiol, 1997, 146(10): 789–803. DOI:10.1093/oxfordjournals.aje.a009196 |
| [14] | Halloran ME, Longini Jr IM, Struchiner CJ.Design and analysis of vaccine studies[M]. New York: Springer, 2009. |
| [15] | Hennessy TW, Singleton RJ, Bulkow LR, et al. Impact of heptavalent pneumococcal conjugate vaccine on invasive disease, antimicrobial resistance and colonization in Alaska Natives:progress towards elimination of a health disparity[J]. Vaccine, 2005, 23(48/49): 5464–5473. DOI:10.1016/j.vaccine.2005.08.100 |
| [16] | Guevara M, Barricarte A, Torroba L, et al. Direct, indirect and total effects of 13-valent pneumococcal conjugate vaccination on invasive pneumococcal disease in children in Navarra, Spain, 2001 to 2014:cohort and case-control study[J]. Euro Surveill, 2016, 21(14). DOI:10.2807/1560-7917.ES.2016.21.14.30186 |
| [17] | Adegbola RA, Secka O, Lahai G, et al. Elimination of Haemophilus influenzae type b (Hib) disease from The Gambia after the introduction of routine immunisation with a Hib conjugate vaccine:a prospective study[J]. Lancet, 2005, 366(9480): 144–150. DOI:10.1016/S0140-6736(05)66788-8 |
| [18] | Ramsay ME, Andrews NJ, Trotter CL, et al. Herd immunity from meningococcal serogroup C conjugate vaccination in England:database analysis[J]. BMJ, 2003, 326(7385): 365–366. DOI:10.1136/bmj.326.7385.365 |
| [19] | Préziosi MP, Halloran ME. Effects of pertussis vaccination on transmission:vaccine efficacy for infectiousness[J]. Vaccine, 2003, 21(17/18): 1853–1861. DOI:10.1016/S0264-410X(03)00007-0 |
| [20] | Payne DC, Staat MA, Edwards KM, et al. Direct and indirect effects of rotavirus vaccination upon childhood hospitalizations in 3 US Counties, 2006-2009[J]. Clin Infect Dis, 2011, 53(3): 245–253. DOI:10.1093/cid/cir307 |
| [21] | Clarke MF, Davidson GP, Gold MS, et al. Direct and indirect impact on rotavirus positive and all-cause gastroenteritis hospitalisations in South Australian children following the introduction of rotavirus vaccination[J]. Vaccine, 2011, 29(29/30): 4663–4667. DOI:10.1016/j.vaccine.2011.04.109 |
| [22] | Pollard SL, Malpica-Llanos T, Friberg IK, et al. Estimating the herd immunity effect of rotavirus vaccine[J]. Vaccine, 2015, 33(32): 3795–3800. DOI:10.1016/j.vaccine.2015.06.064 |
| [23] | Sur D, Ochiai RL, Bhattacharya SK, et al. A cluster-randomized effectiveness trial of Vi typhoid vaccine in India[J]. N Engl J Med, 2009, 361(4): 335–344. DOI:10.1056/NEJMoa0807521 |
| [24] | Zaman K, Sack DA, Neuzil KM, et al. Effectiveness of a live oral human rotavirus vaccine after programmatic introduction in Bangladesh:a cluster-randomized trial[J]. PLoS Med, 2017, 14(4): e1002282. DOI:10.1371/journal.pmed.1002282 |
| [25] | Trollfors B, Taranger J, Lagergård T, et al. Immunization of children with pertussis toxoid decreases spread of pertussis within the family[J]. Pediatr Infect Dis J, 1998, 17(3): 196–199. DOI:10.1097/00006454-199803000-00005 |
| [26] | Millar EV, Watt JP, Bronsdon MA, et al. Indirect effect of 7-valent pneumococcal conjugate vaccine on pneumococcal colonization among unvaccinated household members[J]. Clin Infect Dis, 2008, 47(8): 989–996. DOI:10.1086/591966 |
| [27] | Esposito S, Marchisio P, Cavagna R, et al. Effectiveness of influenza vaccination of children with recurrent respiratory tract infections in reducing respiratory-related morbidity within the households[J]. Vaccine, 2003, 21(23): 3162–3168. DOI:10.1016/S0264-410X(03)00253-6 |
| [28] | O'Brien KL, Moulton LH, Reid R, et al. Efficacy and safety of seven-valent conjugate pneumococcal vaccine in American Indian children:group randomised trial[J]. Lancet, 2003, 362(9381): 355–361. DOI:10.1016/S0140-6736(03)14022-6 |
| [29] | Clemens JD, Harris JR, Sack DA, et al. Field trial of oral cholera vaccines in Bangladesh:results of one year of follow-up[J]. J Infect Dis, 1988, 158(1): 60–69. DOI:10.1093/infdis/158.1.60 |
| [30] | Ali M, Emch M, Von Seidlein L, et al. Herd immunity conferred by killed oral cholera vaccines in Bangladesh:a reanalysis[J]. Lancet, 2005, 366(9479): 44–49. DOI:10.1016/S0140-6736(05)66550-6 |
| [31] | Carnalla-Barajas MN, Soto-Noguerón A, Sánchez-Alemán MA, et al. Changing trends in serotypes of S. pneumoniae isolates causing invasive and non-invasive diseases in unvaccinated population in Mexico (2000-2014)[J]. Int J Infect Dis, 2017, 58: 1–7. DOI:10.1016/j.ijid.2017.02.005 |
| [32] | Préziosi MP, Yam A, Wassilak SGF, et al. Epidemiology of pertussis in a West African community before and after introduction of a widespread vaccination program[J]. Am J Epidemiol, 2002, 155(10): 891–896. DOI:10.1093/aje/155.10.891 |
| [33] | Halloran ME. The minicommunity design to assess indirect effects of vaccination[J]. Epidemiol Methods, 2012, 1(1): 83–105. DOI:10.1515/2161-962X.1008 |
 2018, Vol. 39
2018, Vol. 39