文章信息
- 温莹, 何柳, 翟屹, 吴静, 陈玉宇, 王辉, 宗庆庆, 梁晓峰.
- Wen Ying, He Liu, Zhai Yi, Wu Jing, Chen Yuyu, Wang Hui, Zong Qingqing, Liang Xiaofeng.
- 流行性感冒病毒裂解疫苗和23价肺炎球菌多糖疫苗改善老年人慢性阻塞性肺疾病的社区干预试验
- Effect of influenza and 23-valent pneumococcal polysaccharide vaccinations on elderly with chronic obstructive pulmonary diseases: a community-based intervention study
- 中华流行病学杂志, 2018, 39(6): 792-798
- Chinese Journal of Epidemiology, 2018, 39(6): 792-798
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2018.06.019
-
文章历史
收稿日期: 2017-10-30
2. 100871 北京大学光华管理学院应用经济系;
3. 200433 上海财经大学公共经济与管理学院;
4. 102206 北京, 中国疾病预防控制中心
2. Department of Applied Economics, Guanghua School of Management, Peking University, Beijing 100871, China;
3. School of Public Economics and Administration, Shanghai University of Finance and Economics, Shanghai 200433, China;
4. Chinese Center for Disease Control and Prevention, Beijing 102206, China
COPD是以不完全可逆、进行性呼吸道气流受限为特点的慢性呼吸道疾病,其病程包括稳定期和急性加重期,其中急性加重影响整体疾病的严重情况,而呼吸道感染是造成急性加重的最主要原因[1]。有研究认为,流行性感冒病毒裂解疫苗(流感疫苗)和23价肺炎球菌多糖疫苗(肺炎疫苗)是预防COPD急性加重的有效手段,对COPD患者的症状减轻及生活质量改善起到重要作用[2];越来越多的学者认为疫苗接种可成为预防控制慢性病的一项重要措施[3]。但目前我国尚缺乏基于大规模人群的干预对照研究来佐证疫苗接种对COPD的防控效果。本研究通过实施社区干预实验,评价肺炎疫苗和流感疫苗对改善老年COPD患者症状的效果,为我国人群COPD防控策略优化提供证据。
对象与方法1.资料来源:在重庆市和宁波市各选取3个国家级慢性非传染性疾病综合防控示范区(慢病示范区)作为研究现场,通过各示范区现有COPD患者登记电子数据记录,由重庆市和宁波市CDC工作人员调取各自示范区所有COPD患者名单,作为本研究的患者来源。
2.研究对象:
(1)纳入标准:①年龄60~75岁;②COPD稳定病例:入选时患者咳嗽、咳痰和气短等症状稳定或症状轻微,无针对呼吸道症状的用药改变[1]。
(2)排除标准:①除COPD外,合并其他呼吸系统疾病;②COPD急性加重期:入选前4周内出现呼吸道症状超过日常变异范围的持续恶化,并需改变药物治疗方案,咳嗽、咳痰、气短和(或)喘息加重,痰量增多,脓性或黏液脓性痰,或伴有发热等炎症明显加重的表现;③近5年内接种过23价肺炎球菌多糖疫苗或肺炎结合疫苗;④对流感疫苗或肺炎疫苗成分过敏,无法接种者;⑤正在接受激素治疗的患者;⑥疑似或确诊肺炎球菌感染者[4]。本研究通过北京大学医学部伦理委员会批准,研究对象完成知情同意。
3.研究方法:按照社区干预试验设计,实施时间为2013年11月至2014年10月。从重庆市、宁波市的各3个慢病示范区内,按照整群抽样各抽取4个社区,将各社区中符合入组条件的COPD患者按照组别接受不同干预措施。干预组按照3种干预措施,分为流感疫苗接种组、肺炎疫苗接种组、流感疫苗与肺炎疫苗联合接种组;对照组社区不接种任何疫苗。流感疫苗采用英国葛兰素史克公司生产的流行性感冒病毒裂解疫苗福禄立适,肺炎疫苗采用法国赛诺菲巴斯德公司生产的23价肺炎球菌多糖疫苗优博23。流感疫苗剂型为0.5 ml/支,肺炎疫苗为0.5 ml/支。对研究对象进行上肢肌肉注射,流感疫苗与肺炎疫苗联合接种则是不同上肢同时接种。
4.研究内容:收集各社区内COPD患者登记电子数据记录、人口学特征信息。疫苗接种时及接种1年后,由CDC工作人员进入社区,对所有研究对象进行两次COPD患者自我评估测试(COPD assessment test,CAT)。CAT问卷含8个问题,涉及咳嗽、咳痰、胸闷、睡眠、精力、情绪6项主观指标,以及运动耐力、日常运动影响2项耐受力评价指标。患者对每个项目做出评分(0~5分),总分为0~40分,按症状严重程度分为4类:0~10分判为“轻微影响”;11~20分判为“中等影响”;21~30分判为“严重影响”;31~40分判为“非常严重影响”[5]。
5.统计学分析:采用SAS 9.4软件分析。招募研究对象时未进行严格匹配,为减少混杂因素影响,采用倾向评分配比(propensity score matching,PSM)对4个组匹配。使用logistic回归模型,以分组为应变量,年龄、性别、婚姻状况、户籍、文化程度、CAT评分等因素为协同变量,卡钳值=0.02,配比度为1 : 1,计算倾向性评分(propensity score,PS值)及倾向评分权重,匹配评分相近的患者。计量资料使用M、IQR描述,采用Kruskal-Wallis检验进行组间比较,两两比较采用Bonferroni法。计数资料采用χ2检验,COPD患者接种疫苗前后CAT评分差值进行秩和检验,对4组COPD患者干预后CAT评分进行基于秩的2×2析因分析,流感疫苗、肺炎疫苗作为每个因素,均存在是否接种的两个水平,计算离均差平方和(Sum of square,SS)、均方(Mean square,MS)。检验水准α=0.05,双侧检验。
结果1.基线特征:
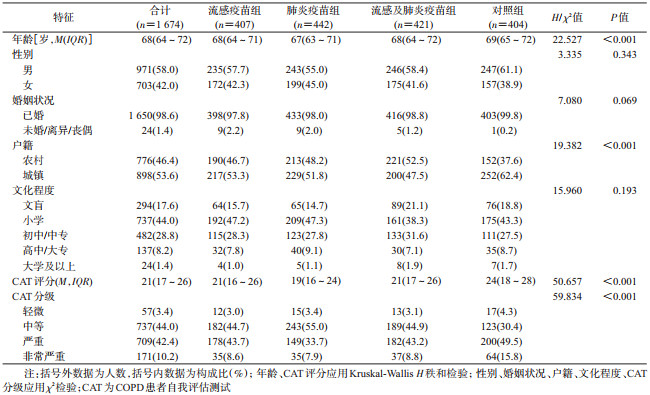
(1)人口学特征及CAT情况:共纳入1 674名60~75岁COPD患者,年龄(67.9±4.45)岁,M=68(IQR:64~72)岁,4组患者年龄差异有统计学意义,其中肺炎疫苗组与对照组年龄差异有统计学意义(H=4.774 1,P<0.001),其余各组两两比较年龄差异无统计学意义。男性占58.0%(971/1 674),98.6%(1 650/1 673)的研究对象已婚,性别和婚姻状况在4组间差异无统计学意义。城镇人口占53.6%(898/1 674),多于农村人口,4组患者的户籍构成比差异有统计学意义(χ2=19.382,P<0.001),两两比较肺炎疫苗组和对照组、流感及肺炎疫苗组和对照组户籍构成比差异有统计学意义。小学文化程度者占44.0%(737/1 674),4组研究对象文化程度差异无统计学意义。
1 674例研究对象CAT评分为(21.54±6.67)分,M=21(IQR:17~26)分,为非正态分布(W=0.986 3,P<0.01)。秩和检验4组的基线CAT评分(H=50.656,P<0.001)及分级(χ2=59.834,P<0.001)差异均有统计学意义。两两比较结果显示,流感疫苗组与肺炎疫苗组(H=3.057,P=0.014)、流感疫苗组与对照组(H=4.049,P<0.001)、肺炎疫苗组与流感及肺炎疫苗组(H=2.837,P=0.027)、肺炎疫苗组与对照组(H=7.182,P<0.001)、流感及肺炎疫苗组与对照组(H=4.324,P<0.001)CAT评分差异均有统计学意义,仅流感疫苗组与流感及肺炎疫苗组CAT评分差异无统计学意义(H=0.241 2,P=1.000)。“严重”及“非常严重”级研究对象占比超过50.0%(52.6%,880/1 674),“轻微”级占比最小,仅为3.4%(57/16 74)。见表 1。
(2)PSM后研究对象人口学特征及CAT情况:PSM后共纳入1 244例患者,占总研究对象的74.31%(1 244/1 674),每组311人。研究对象年龄(68.5±4.78)岁,M=69(IQR:65~72)岁;男性占58.4%(726/1 244);已婚者占99.4%(1 237/1 244);初中及以下文化程度者占88.5%(1 101/1 244);年龄(H=4.393,P=0.222)、性别(χ2=2.580,P=0.461)、婚姻状况(Fisher确切概率P=0.664)及文化程度(χ2=13.172,P=0.375)在4组间差异无统计学意义。农村户籍占53.6%(898/1 674),多于城镇户籍,4组患者的户籍构成差异有统计学意义(χ2=10.952,P=0.012)。
1 244例研究对象基线CAT评分为(21.36±6.64)分,M=21(IQR:17~26)分。经秩和检验,4组的基线CAT评分差异有统计学意义(H=14.306,P=0.003)。CAT评分两两比较结果显示,仅肺炎疫苗组与流感及肺炎疫苗组差异有统计学意义(H=3.644,P=0.002),流感疫苗组与肺炎疫苗组(H=1.081,P=1.000)、流感疫苗组与流感及肺炎疫苗组(H=2.563,P=0.063)、流感疫苗组与对照组(H=0.040,P=1.000)、肺炎疫苗组与对照组(H=1.041,P=1.000)、流感及肺炎疫苗组与对照组(H=2.603,P=0.056)间CAT评分差异均无统计学意义。“严重”和“非常严重”级研究对象占54.9%(682/1 244),“轻微”最少,仅占3.6%(45/1 244)。见表 2。
PSM后,仅流感疫苗组和对照组的户籍构成差异有统计学意义,仅肺炎疫苗组与流感及肺炎疫苗组的CAT评分差异有统计学意义,其他特征在各干预组与对照组间差异均无统计学意义,较匹配前COPD患者情况更加均衡可比。
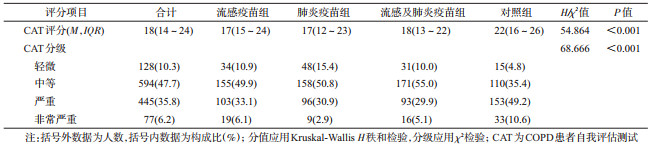
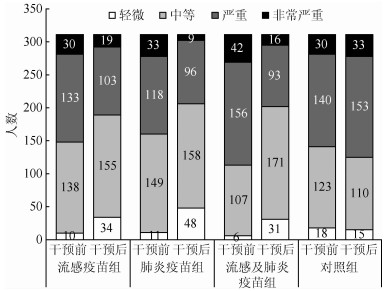
2.疫苗接种1年后CAT评分:疫苗接种1年后,1 244例研究对象CAT评分M=18(IQR:14~24)分,4组CAT评分差异有统计学意义(H=54.864,P<0.001)。两两比较结果显示,流感疫苗组与对照组(H=4.772,P<0.001)、肺炎疫苗组与对照组(H=6.940,P<0.001)、流感及肺炎疫苗组与对照组(H=6.039,P<0.001)间CAT评分差异有统计学意义,流感疫苗组与肺炎疫苗组(H=2.167,P=0.183)、流感疫苗组与流感及肺炎疫苗组(H=1.267,P=1.000)、肺炎疫苗组与流感及肺炎疫苗组(H=0.900,P=1.000)CAT评分差异均无统计学意义。研究对象中CAT分级“轻微”者占10.3%(128/1 244),较基线增加1.84倍(83/45),“严重”和“非常严重”者占42.0%(522/1 244),较基线减少23.5%(160/682)。各组CAT评分结果见表 3,疫苗接种前后各组CAT分级变化情况见图 1。
|
| 图 1 流行性感冒病毒裂解疫苗和23价肺炎球菌多糖疫苗接种前后研究对象CAT评分分级变化情况 |
3.疫苗接种后CAT评分及各项分值改变情况:流感疫苗组(t=-6.531,P<0.001)、肺炎疫苗组(H=-9 623,P<0.001)、流感及肺炎疫苗组(t=-10.803,P<0.001)平均CAT评分及各项分值在干预后均降低,差异有统计学意义。对照组CAT评分在干预前后变化差异无统计学意义(H=1 167,P=0.403),但咳嗽、气喘、外出、睡眠、精力5项指标变化差异有统计学意义,咳嗽、气喘2项指标症状缓解,外出、睡眠、精力3项指标症状加重。4组干预前后CAT评分及各项分值变化情况。见表 4。
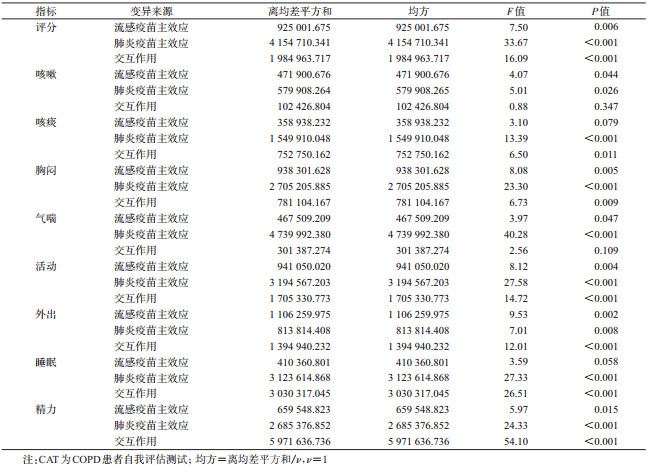
4.流感疫苗与肺炎疫苗接种对COPD患者症状影响分析:除咳痰(F=3.10,P=0.079)及睡眠(F=3.59,P=0.058)外,流感疫苗主效应对COPD患者整体症状、以及咳嗽、胸闷、气喘、活动、外出、精力6项指标均有改善作用。肺炎疫苗主效应对整体症状及全部8项单独指标均有改善作用。流感疫苗与肺炎疫苗联合接种所产生的协同效应对整体症状及咳痰、胸闷、活动、外出、睡眠、精力6项指标的改变也具有统计学意义,仅对咳嗽(F=0.88,P=0.347)和气喘(F=2.56,P=0.109)2项指标的改善无交互作用。流感疫苗与肺炎疫苗接种对COPD患者CAT评分及各项分值影响析因。见表 5。
慢阻肺评估包括综合症状评估、肺功能评估及急性加重风险评估,对指导COPD患者管理十分重要[1],症状评估是第一步[2]。2013年我国修订的COPD诊治指南[1]建议任选改良版英国医学研究委员会呼吸问卷(breathlessness measurement using the modified British Medical Reseach Council,mMRC)或CAT评分作为症状评估方法;mMRC仅评价呼吸困难严重程度,但COPD除累及肺脏外,还会引起心血管疾病、骨质疏松、抑郁等全身症状,故本研究通过收集CAT评分来全面评估COPD患者的症状。本次研究发现流感疫苗接种、肺炎疫苗接种及同时接种2种疫苗对≥60岁COPD患者的整体症状及咳嗽、咳痰、胸闷、气喘、活动、外出、睡眠、精力等具体指标都有所改善,此外同时接种2种疫苗对COPD整体症状及咳痰、胸闷、活动、外出、睡眠、精力这些方面的改变也具有协同作用。研究结果还显示,疫苗接种后CAT分级“严重”及“非常严重”的比例均有所下降,“轻微”及“中等”人数增多,对照组“轻微”及“中等”人数减少,提示流感疫苗和肺炎疫苗对COPD患者的症状改善作用。国外已有研究证实,流感疫苗和肺炎疫苗接种可减少COPD患者感染流感病毒及肺炎球菌,有效控制症状,减少急性加重[6]。有研究指出,肺炎疫苗可以显著降低COPD患者急性加重风险,减少咳嗽、痰量、呼吸困难等症状(OR=0.60,95%CI:0.39~0.93)[7]。另外一项系统综述发现,COPD患者接种流感疫苗可以减少流感相关的急性呼吸系统疾病,其COPD急性加重风险仅为安慰剂组患者的20%,重度、中度和轻度气流阻塞患者中,其风险仅分别为安慰剂组的10%、50%、20%[8]。Garrastazu等[9]回顾性队列研究发现,流感疫苗接种1年内,COPD患者急性加重风险明显低于未接种人群(OR=0.46,95%CI:0.16~0.65)。本研究的3个疫苗接种组COPD患者的咳嗽、咳痰、呼吸状况(胸闷、气喘)指标评分均在接种1年后下降(P<0.001),提示此类症状有所改善,与既往国外研究结论相似。
既往研究发现,流感疫苗对于COPD临床症状改善不如肺炎疫苗明显[10]。本研究在60~75岁的COPD患者中也发现了类似的结果,通过析因分析,流感疫苗对咳痰和睡眠症状的作用主效应无统计学意义,而肺炎疫苗对所有症状的主效应均有统计学意义,提示肺炎疫苗较流感疫苗症状改善作用可能更明显。我国流感流行高峰为当年11月至次年2月,推荐在高峰期前1~2月(即当年9-11月)接种[11],本研究于2013年11月完成疫苗接种,2014年10月收集CAT评分,恰处于1个接种周期内,包括2013年冬季、2014年春季、秋季多个高发区,2014年9、10月可能已出现新的流行株,流感疫苗无法完全发挥保护作用,是造成本研究中流感疫苗的改善效果低于肺炎疫苗的可能原因,需在今后的研究中谨慎确定评价流感疫苗效果的观察期限,减少因流感病毒流行株变化而影响疫苗作用的偏倚。
对于老年COPD患者接种肺炎疫苗或流感疫苗的时机,也是国内外研究者关注的问题。既往研究显示[8],COPD患者接种肺炎疫苗对社区获得性感染的时间并无影响,但肺炎球菌肺炎的发病率显著低于未接种者,且肺炎疫苗对COPD患者的保护作用与年龄有关,在年龄<65岁人群中有效性更好。此外,患慢性基础性疾病的患者较同龄健康成年人感染流感病毒后,严重疾病或死亡的风险更高,其流感相关住院率和超额死亡率明显高于未患病者[12]。本研究于流感高发期进行疫苗接种后,在60~75岁COPD患者中均发现了流感疫苗和肺炎疫苗良好的症状改善作用,提示≥65岁老年COPD患者中,仍可通过疫苗接种预防感染,延缓疾病进展,可对其进行长期观察,进一步探索其疾病症状的发展程度。
CAT评分简单易行,广泛应用于评估COPD患者的健康状况,但本研究仅以CAT评分这一主观症状评价指标为主,缺乏客观评价COPD改善程度的指标;此外,样本通过整群抽样获得、以社区为单位进行分组,尽管便于操作,但干预组与对照组间的基线特征均衡性不理想,故采取了倾向性评分配比的方法,对4组人群的基线特征进行匹配,增强了组间基线特征的均衡性。本研究缺乏症状改善的客观指标结果,但仍按照患者的人口学特征和症状情况进行配比,从患者主观症状角度得到了疫苗对于COPD症状改善积极作用的试验证据,证实通过流感疫苗接种或肺炎疫苗接种,可以有效缓解COPD的临床症状,改善患者生活质量。
综上所述,在流感流行高峰前,对老年COPD患者给予流感疫苗和肺炎疫苗接种,可有效改善患者呼吸道、精神等方面自觉症状,提高活动耐受力,降低病情严重程度。疫苗可作为COPD患者管理的一种有效措施,可在今后研究中收集肺功能检测指标、胸部影像学诊断、急性加重发生情况等数据,进一步研究证实其长期有效性。
利益冲突: 无
| [1] |
中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版)[J]. 中华结核和呼吸杂志, 2013, 36(4): 255–264.
Chronic obstructive pulmonary disease group of Chinese Thoracic Society, Chinese Medical Association. Guidelines for diagnosis and treatment of chronic obstructive pulmonary diseases(edition 2013)[J]. Chin J Tuberc Respir Dis, 2013, 36(4): 255–264. DOI:10.3760/cma.j.issn.1001-0939.2013.04.007 |
| [2] | Global Initiative for Chronic Obstructive Lung Disease (GOLD). Global strategy for the diagnosis, management and prevention of chronic obstructive pulmonary disease[EB/OL]. (2016-11-05)[2017-09-30]. http://goldcopd.org/gold-2017-global-strategy-diagnosis-management-prevention-copd/. |
| [3] |
赵文华, 杨维中. 疫苗或可成为慢性病防控的重要手段[J]. 中华预防医学杂志, 2015, 49(8): 675–676.
Zhao WH, Yang WZ. Vaccine might be an important means of chronic disease prevention and control[J]. Chin J Prev Med, 2015, 49(8): 675–676. DOI:10.3760/cma.j.issn.0253-9624.2015.08.002 |
| [4] | World Health Organization. Pneumococcal vaccines, WHO position paper[EB/OL]. (2012-04-06)[2017-09-30]. http://www.who.int/wer/2012/wer8714.pdf?ua=1. |
| [5] | GlaxoSmithKline group of companies. COPD assessment test, healthcare professional user guide: expert guidance on frequently asked questions[EB/OL]. (2016-12-02)] [2017-09-30]. http://www.catestonline.org/images/UserGuides/CAT_HCP%20User%20Guide.pdf. |
| [6] | Wedzicha JA, Mackay AJ, Singh R, et al. COPD exacerbations:impact and prevention[J]. Breathe, 2013, 9(6): 434–440. DOI:10.1183/20734735.002913 |
| [7] | Walters JA, Tang JNQ, Poole P, et al. Pneumococcal vaccines for preventing pneumonia in chronic obstructive pulmonary disease[J]. Cochrane Database Syst Rev(1): CD001390. DOI:10.1002/14651858.CD001390.pub4 |
| [8] | Sehatzadeh S. Influenza and pneumococcal vaccinations for patients with chronic obstructive pulmonary disease (COPD):an evidence-based review[J]. Ont Health Technol Assess Ser, 2012, 12(3): 1–64. |
| [9] | Garrastazu R, García-Rivero JL, Ruiz M, et al. Prevalence of influenza vaccination in chronic obstructive pulmonary disease patients and impact on the risk of severe exacerbations[J]. Arch Bronconeumol, 2016, 52(2): 88–95. DOI:10.1016/j.arbr.2015.09.022 |
| [10] | Schembri S, Morant S, Winter JH, et al. Influenza but not pneumococcal vaccination protects against all-cause mortality in patients with COPD[J]. Thorax, 2009, 64(7): 567–572. DOI:10.1136/thx.2008.106286 |
| [11] |
卫生部办公厅. 中国流行性感冒疫苗预防接种指导意见(试行)[EB/OL]. (2003-08-28)[2017-09-30]. http://www.moh.gov.cn/mohbgt/pw10303/200804/18615.shtml.
General office of the Ministry of Health, Guidelines on the prevention of influenza vaccination in China (trial)[EB/OL]. (2003-08-28)[2017-09-30]. http://www.moh.gov.cn/mohbgt/pw10303/200804/18615.shtml. |
| [12] |
冯录召, 杨鹏, 张涛, 等. 中国季节性流感疫苗应用技术指南(2014-2015)[J]. 中华流行病学杂志, 2014, 35(12): 1295–1319.
Feng LZ, Yang P, Zhang T, et al. Technical guidelines for the application of seasonal influenza vaccine in China (2014-2015)[J]. Chin J Epidemiol, 2014, 35(12): 1295–1319. DOI:10.3760/cma.j.issn.0254-6450.2014.12.001 |
 2018, Vol. 39
2018, Vol. 39