文章信息
- 张岭, 金聪, 江震, 唐涛, 蒋岩, 潘品良.
- Zhang Ling, Jin Cong, Jiang Zhen, Tang Tao, Jiang Yan, Pan Pinliang.
- 2013-2015年全国HIV-1病毒载量检测能力验证方法的比较
- Comparison of commercial HIV-1 viral load tests by using proficiency test results in China, 2013-2015
- 中华流行病学杂志, 2017, 38(9): 1231-1235
- Chinese journal of Epidemiology, 2017, 38(9): 1231-1235
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.018
-
文章历史
收稿日期: 2017-01-19
2. 102206 北京, 中国疾病预防控制中心性病艾滋病预防控制中心干预室
2. Division of Prevention and Intervention, National Center for AIDS/STD Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 102206, China
HIV-1病毒载量检测是艾滋病防控工作中一项重要任务,主要用于抗病毒治疗监测,包括治疗时机判定、治疗效果评估、耐药预警;还可用于HIV感染的补充诊断和血液筛查。为了保证全国HIV-1病毒载量的检测质量,中国CDC性病艾滋病预防控制中心参比实验室从2005年开始组织全国HIV-1病毒载量能力验证(Viral quality ability-proficiency testing,VQA-PT)工作。国内不同实验室采用上述检测方法的试剂版本相对固定。因此,本研究利用2013-2015年VQA-PT考核结果,对这5种方法的定量值进行横向比较。
材料与方法1.样本:参照《HIV-1病毒载量测定及质量保证指南》(2013版)要求,每年组织2次全国HIV-1病毒载量能力验证考核,每次包括5个样本。2013-2015年不同实验室应用参比实验室统一制备运输相同的考核盘,在规定时间内统一反馈结果,由参比实验室进行统计学分析。
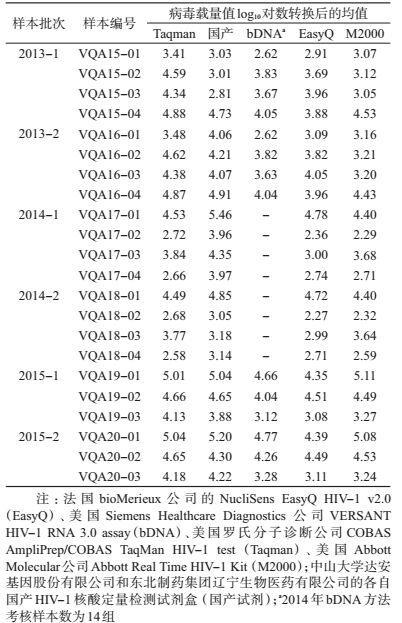
2.检测程序:国内使用的HIV-1病毒载量测定试剂盒:基于核酸序列依赖性扩增(NASBA)和分子信标技术的法国bioMerieux公司的NucliSens EasyQ HIV-1 v2.0(EasyQ);基于分支DNA信号放大技术的美国Siemens Healthcare Diagnostics公司的VERSANT HIV-1 RNA 3.0 assay(bDNA);基于TaqMan探针技术的美国罗氏分子诊断公司的COBAS AmpliPrep/COBAS TaqMan HIV-1 test(Taqman)、基于实时荧光定量PCR扩增技术的美国Abbott Molecular公司的Abbott Real Time HIV-1 Kit(M2000)以及基于实时荧光探针技术的中山大学达安基因股份有限公司和东北制药集团辽宁生物医药有限公司的HIV-1核酸定量检测试剂盒。由于2种国产试剂的样本处理方法及核酸检测原理相同,所以结果统计按照同一类方法分析。
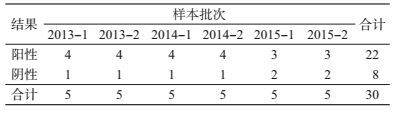
3.统计学分析:将测得病毒载量值(拷贝/ml)进行log10对数转换,获得病毒载量值对数值。按照方法与样本进行分类,计算均值。由于多中心的工作模式,该均值可作为该方法检测该样本的真实结果。共计发放样本30个,阴性样本8个,阳性样本22个,利用22个阳性样本数据绘制Bland-Altman散点图与回归分析,计算相关性系数。
结果1.参加考核的实验室数量:2013-2015年,全国参加VQA-PT的实验室逐年增多(表 1)。使用EasyQ、bDNA和国产试剂的实验室数量相对稳定,2015年使用Taqman与M2000的实验室数量增加。
2.考核盘样本组成:2013-2015年,每年组织2次能力验证,每次所用的考核盘由5个样本组成,其中至少1个阴性样本。见表 2。
3.不同方法测定病毒载量结果:参加考核的实验室收到考核样本后采用本实验室的检测方法完成检测,结果按要求上报到参比实验室。结果汇总后首先将病毒载量值进行log10对数转换,然后按照不同方法归类,计算各自均值(表 3)。由于本研究主要评价各方法定量值的相关性,表 2中阴性样本未列入统计分析中。另外,2014年bDNA考核样本与其他方法的考核样本不同,所以bDNA方法与其他方法进行相关性分析时有效数据为14组,其他的相关性分析有效数据为22组。
4. Bland-Altman散点图及相关性分析:对于5种检测方法,以Taqman方法为参照,以Taqman结果减去其他某种方法结果的差值为纵坐标,以Taqman结果与该方法结果的均值为横坐标,分别绘制Bland-Altman散点图(图 1)。设定一致性界限为2种方法检测结果差值的x±1.96s,可见EasyQ、bDNA与Taqman比较,所有检测结果都在一致性区间内,说明两种方法与Taqman之间的一致性良好。国产试剂和M2000分别有91%(20/22)和95%(21/22)的结果在一致性区间内,说明两者与Taqman比较也具有较好的一致性。Bland-Altman分析中,2013年M2000方法有一个样本超出1.96s,国产试剂出现两个样本超出1.96s,两种方法分别由3个实验室和6个实验室参加室间质评,数据量偏少,对结果真实性可能造成影响。

|
| 注:纵坐标为Taqman结果对数值减去对比试剂检测结果对数值,横坐标为Taqman结果对数值与对比试剂检测结果对数值的均值;横坐标、纵坐标单位为病毒载量值的log10对数转换后的结果;法国bioMerieux公司的NucliSens EasyQ HIV-1 v2.0(EasyQ)、美国Siemens Healthcare Diagnostics公司VERSANT HIV-1 RNA 3.0 assay(bDNA)、美国罗氏分子诊断公司COBAS AmpliPrep/COBAS TaqMan HIV-1 test(Taqman)、美国Abbott Molecular公司Abbott RealTime HIV-1 Kit(M2000);中山大学达安基因股份有限公司和东北制药集团辽宁生物医药有限公司的各自国产HIV-1核酸定量检测试剂盒(国产试剂) 图 1 bDNA、EasyQ、国产试剂、M2000与Taqman结果比较的Bland-Altman分布 |
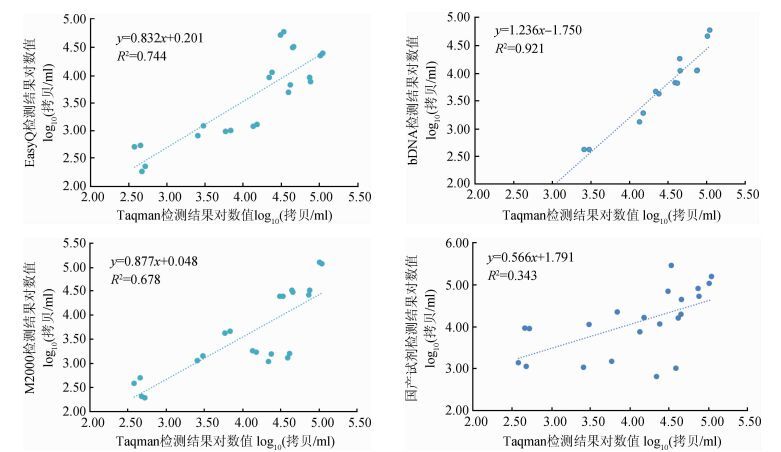
5.线性回归分析:在Bland-Altman分析的基础上,各种病毒载量检测方法的结果分别与Taqman检测结果进行线性回归分析,计算线性回归方程、相关系数和P值。见表 4。通过线性回归分析的曲线图见图 2。
|
| 图 2 不同检测方法与Taqman之间的线性回归曲线 |
1997年我国艾滋病实验室开始引进HIV-1病毒载量检测技术,2004年开始国家针对治疗艾滋病患者提供每年一次的免费病毒载量检测,此后我国开展该项检测工作的实验室日益增多,截至2015年底,全国已经有155个实验室具备HIV-1病毒载量检测能力,覆盖CDC、医院、军队等系统,每年检测量已达35万人份以上。2016年6月WHO新颁布的抗病毒药物应用指导原则[1]推荐所有HIV感染者发现就参加抗病毒治疗。作为用药监测的重要手段,需要检测病毒载量作为治疗效果的监测,病毒载量值越高其HIV传播流行能力越强。所以病毒载量检测不仅具有生物学意义,还具有流行病学意义[2]。
统一不同方法的检测结果对流行病学研究与疾病防控用药监测具有重要意义。我国目前病毒载量检测在结果间比较存在着两个问题。① 检测方法多样,目前存在有不同版本的多种病毒载量检测试剂。不同试剂/系统的检测原理差异导致不同实验结果;② 国内病毒载量检测实验室已发展到155家,分布在全国,实验室配套设施、人员操作熟练程度、重点人群及相应的流行毒株、运输温度等因素会影响检测结果,使检测结果带有各自实验室特征。上述两个特征影响其流行病学分析,在群体病毒载量分析中不同方法的结果不能直接汇总或比较。因此,获得兼顾实验室特征的方法学间定值换算关系具有重要意义。
2014年Sollis等[3]对37项相关研究涉及的方法包括Amplicor Monitor HIV-1,Cobas TaqMan v2.0,Abbott RealTime HIV-1,Versant HIV-1 RNA bDNA 3.0,Versant HIV-1 RNA kPCR 1.0,ExaVir Load v3,NucliSens EasyQ v2.0,但这些研究的结果仅限于比较不同方法间定值的大小,未涉及方法之间结果的换算。2015年Ndiaye等[4]利用81个样本对EasyQ、Taqman、M2000与GENERIC HIV CHARGE VIRALE 4套系统进行了比较,发现两两方法之间有很好的一致性,相关系数均在0.9以上。该研究虽然获得了不同方法检测的换算方式,但所有结果是在特定实验室内一次完成的。本实验室2014年曾进行病毒载量方法学对比研究,获得了Taqman和EasyQ之间的一致性和相关性[5],与Ndiaye的研究一样,结果来自单一的实验室。目前的文献报道还没有多家实验室参与的涉及到方法学之间定值换算关系的比较研究。
本研究在进行统计分析时将多家考核合格实验室的PT考核结果取平均值,实际上是一种多中心的研究方式[6],多中心研究的结果具有广泛的代表性,为国际上制备标准品常用的研究方法[7],例如WHO的HIV-1基因型国际参考品制备项目就是16个国家28个实验室联合完成的[8]。本次研究中EasyQ、Taqman、bDNA每一平均值均基于超过20个实验室的结果。从统计学角度讲,本次研究的结果涵盖可能影响国内病毒载量检测的所有因素,取平均值可以减少不同实验室造成的的随机误差,使检测结果更加接近样本真值,根据样本真值得到的换算关系更具有说服力。在进行病毒载量流行病学分析时,所有结果均出自本研究所涵盖的实验室,本研究得到的换算关系更具有现实意义。
在此基础上Bland-Altman分析结果显示各方法间相关性良好。进而通过线性回归分析得到不同方法间的换算关系。以EasyQ和Taqman之间关系为例,之前研究[6]得到的回归方程为y=0.855x+1.22(R2=0.817),本文得到的结果为y=0.832x+0.201(R2=0.744),相比较方程的斜率相似,截距偏小,说明在真实条件下二者在数值上接近。从回归曲线的位置可以看出,EasyQ、M2000和bDNA结果均小于Taqman结果,其中M2000的结果与Taqman最接近。因为EasyQ基于NASBA加分子信标技术,bDNA基于分支DNA杂交技术,M2000和Taqman均基于荧光定量PCR技术,所以上述结果反映出检测原理对最终结果的影响,与文献报道的相一致[9]。另外,国产试剂呈现出低病毒载量样本检测结果偏低,高病毒载量样本偏高,可能有两个原因:① 国产试剂实验室数量少,计算的均值对统计会有一定影响,这与一致性分析的结果相类似,国产试剂与Taqman的相关系数较小(0.586)也能证明这一问题;② 国产试剂在低载量和高载量样本在PCR扩增效率不能保持恒定,还需要进一步的优化。统计结果显示,不同方法的线性回归分析P值均<0.01,说明各种方法检测结果与Taqman之间的差异可以用线性方程进行换算,在全国范围内统计HIV-1病毒载量,可以将不同方法获得的结果利用上述公式都转化成Taqman结果,作参考比较。
总之,本研究得到的不同方法学间的换算关系不仅具有生物学意义,更具有流行病学意义,是各种检测方法在国内应用情况的真实体现,可作为病毒载量流行病学分析的依据。值得注意的是,本研究仅得到2013-2015年间的换算关系,不同方法之间结果的换算关系不是固定的,会随着病毒载量应用的深入,不同方法学设备或试剂的升级换代而发生变化。
志谢: 所有参与全国HIV-1病毒载量能力验证的实验室负责人及检测技术人员利益冲突: 无
| [1] | W HO.Consolidated Guidelines on the Use of Antiretroviral Drugs for Treating and Preventing HIV Infection. Recommendations for A Public Health Approach[M]. 2nd ed. Geneva: World Health Organization, 2016. |
| [2] | Edelman EJ, Tate JP, Fiellin DA, et al. Impact of defined clinical population and missing data on temporal trends in HIV viral load estimation within a health care system[J]. HIV Med, 2015, 16(6): 346–354. DOI:10.1111/hiv.12219 |
| [3] | Sollis KA, Smit PW, Fiscus S, et al. Systematic review of the performance of HIV viral load technologies on plasma samples[J]. PLoS One, 2014, 9(2): e85869. DOI:10.1371/journal.pone.0085869 |
| [4] | Ndiaye O, Diop-Ndiaye H, Ouedraogo AS, et al. Comparison of four commercial viral load techniques in an area of non-B HIV-1 subtypes circulation[J]. J Virol Methods, 2015, 222: 122–131. DOI:10.1016/j.jviromet.2015.06.002 |
| [5] |
李繁, 蒋岩, 屈然, 等.
两种HIV-1核酸定量检测试剂盒v2.0的对比研究[J]. 中国艾滋病性病, 2014, 20(3): 146–148, 153.
Li F, Jiang Y, Qu R, et al. Comparison of the two assays for HIV-1 viral load quantitation[J]. Chin J AIDS/STD, 2014, 20(3): 146–148, 153. DOI:10.13419/j.cnki.aids.2014.03.001 |
| [6] | Pagliusi SR, Dillner J, Pawlita M, et al. Chapter 23:international Standard reagents for harmonization of HPV serology and DNA assays-an update[J]. Vaccine, 2006, 24(Suppl 3): S193–200. DOI:10.1016/j.vaccine.2006.06.016 |
| [7] | World Health Organization. Recommendations for the preparation, characterization and establishment of international and other biological reference standards(revised 2004)[R]. WHO Technical Report Series, No.932, Geneva:WHO, 2006. |
| [8] | Holmes HC, Davis CL, Heath AB, et al. Report of an international collaborative study to evaluate a who HIV-1 RNA genotype reference panel[R]. Geneva:Expert Committee on Biological Standardization, 2003. |
| [9] | Scott LE, Noble LD, Moloi J, et al. Evaluation of the Abbott M2000 RealTime human immunodeficiency virus type 1(HIV-1) assay for HIV load monitoring in South Africa compared to the Roche Cobas AmpliPrep-Cobas Amplicor, Roche Cobas AmpliPrep-Cobas TaqMan HIV-1, and BioMerieux NucliSENS EasyQ HIV-1 assays[J]. J Clin Microbiol, 2009, 47(7): 2209–2217. DOI:10.1128/JCM.01761-08 |
 2017, Vol. 38
2017, Vol. 38