文章信息
- 张丽, 张卫, 吕静静, 张继娟, 刘甲野, 颜丙玉, 冯艺, 梁晓峰, 崔富强, 王富珍, 张国民, 徐爱强.
- Zhang Li, Zhang Wei, Lyu Jingjing, Zhang Jijuan, Liu Jiaye, Yan Bingyu, Feng Yi, Liang Xiaofeng, Cui Fuqiang, Wang Fuzhen, Zhang Guomin, Xu Aiqiang.
- 5μg和10μg重组乙型肝炎疫苗初次免疫正常应答和高应答新生儿5年抗体持久性比较
- Comparison of antibody persistence after primary immunization with 5 μg and 10 μg recombinant hepatitis B vaccine among newborns with normal and high response:a five-year following-up
- 中华流行病学杂志, 2017, 38(9): 1156-1160
- Chinese journal of Epidemiology, 2017, 38(9): 1156-1160
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.09.002
-
文章历史
收稿日期: 2017-01-16
2. 100013 北京市疾病预防控制中心免疫预防管理所;
3. 250117 济南, 山东省肿瘤医院药剂科;
4. 100050 北京, 中国疾病预防控制中心免疫规划中心
2. Department of Planned Immunization Programme, Beijing Center for Disease Control and Prevention, Beijing 100013, China;
3. Pharmacy Department of Shandong Tumor Hospital, Ji'nan 250117, China;
4. Department of Immunization Programme, Chinese Center for Disease Control and Prevention, Beijing 100050, China
新生儿接种乙型肝炎(乙肝)疫苗(HepB)可有效降低儿童HBV的流行[1]。我国既往新生儿HepB接种剂量多为5 μg,近年来提高到10 μg。有研究显示,新生儿接种10 μg HepB可获得更高的抗体阳转率和抗体水平[2],且符合成本效益[3],但在HBV流行的低收入国家为降低接种成本仍推荐使用低剂量HepB[4]。为评价HepB不同接种剂量的免疫持久性,本研究基于既往建立的新生儿5 μg HepB和10 μg HepB初次免疫(初免)观察队列,于接种后第5年进行随访观察,现将结果报告如下。
对象与方法1.研究对象:2009年分别在山东省随机选取4个市10个县(市、区)和北京市全部18个区(县),选取按照“0-1-6”月龄免疫程序完成3剂次HepB初免的7~12月龄婴儿,其中山东省婴儿接种5 μg重组啤酒酵母乙肝疫苗(HepB-SC),北京市婴儿接种10 μg重组汉逊酵母乙肝疫苗(HepB-HP)。于第3剂次后1~6个月(T0)采集静脉血2 ml,其中经检测抗-HBs≥100 mIU/ml即初次免疫后正常和高应答者[5],作为初选对象。于2014年(初次免疫后5年,T1)随访上述初选对象,经调查未进行HepB加强免疫者作为本次研究对象。本研究经山东省CDC预防医学伦理委员会和北京市CDC伦理委员会批准,所有研究对象监护人均签署知情同意书。
2.研究方法:由经过培训的调查人员使用统一调查问卷,通过询问研究对象监护人获得婴儿出生日期、性别、出生体重、是否早产、父母HBsAg等信息;免疫史通过查阅儿童预防接种证获得,并通过问询家长或监护人进一步核实;初次免疫后抗体水平通过查阅既往研究记录获得。所有研究对象于T1时采集静脉血2 ml,采集的血标本委托有资质的第三方医学检验公司,采用化学发光微粒子免疫分析法(美国雅培ARCHITECT-i2000免疫发光检测仪及试剂)检测抗-HBs。
3.相关定义:低出生体重指出生体重<2 500 g;早产指28~37孕周分娩;正常应答指免疫后100 mIU/ml≤抗-HBs<1 000 mIU/ml,高应答为免疫后抗-HBs≥1 000 mIU/ml[5];抗-HBs阳性率指调查对象中抗-HBs≥10 mIU/ml者所占的比例。
4.统计学分析:采用EpiData 3.1软件进行数据双录入和比对,不符者对照原始调查表进行核对和修订。采用Stata 11.2软件进行统计分析。抗-HBs阳性率组间比较采用χ2检验或Fisher’s精确概率法;抗-HBs浓度经对数转换后,组间比较采用单因素方差分析。抗体阳性率的影响因素采用多因素logistic回归分析,抗体水平的影响因素采用对数转换后的多因素线性回归分析。研究结果判定,P值取双侧概率,检验水准α=0.05。
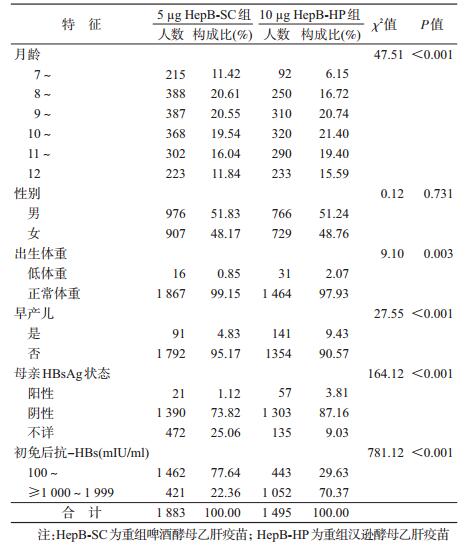
结果1.基本情况:共4 143名新生儿使用5 μg HepB-SC进行初免,3 347人(80.79%)T0时出现正常或高应答,T1时共随访到2 578人,随访率为77.02%,其中1 883人(73.04%)未进行加强免疫者为5 μg HepB组。共4 519名新生儿使用10 μg HepB-HP初免,4 408人(97.54%)T0时出现正常或高应答,T1时共随访到1 679人,均未进行加强免疫者,随访率为38.09%,为10 μg HepB组。两组性别构成差异无统计学意义(χ2=0.12,P=0.731),但其采血月龄、出生体重、早产儿、母亲HBsAg状态、初免后抗-HBs水平差异均有统计学意义(P<0.01)。见表 1。
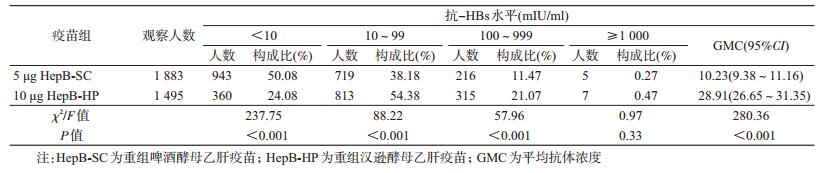
2.抗体持久性比较:T1时5 μg HepB-SC组和10 μg HepB-HP组抗体阳性率分别为49.92% (940/1 883) 和75.92%(1 135/1 495),差异有统计学意义(χ2=237.75,P<0.001)。5 μg HepB-SC组新生儿T1时抗-HBs(mIU/ml)<10、10~99、100~999和≥1 000者所占比例分别为50.08%、38.18%、11.47%和0.27%;10 μg HepB-HP组T1时上述各相应抗体水平所占比例分别为24.08%、54.38%、21.07%和0.47%;两组T1抗体水平分布的差异有统计学意义(χ2=244.06,P<0.001)。T1时5 μg HepB-SC组和10 μg HepB-HP组抗-HBs的平均抗体浓度(GMC)分别为10.23(95%CI:9.38~11.16) mIU/ml和28.91(95%CI:26.65~31.35) mIU/ml,差异有统计学意义(F=280.36,P<0.001)。两组分别有943人和360人T1抗-HBs<10 mIU/ml,其抗体水平的构成差异有统计学意义(χ2=39.75,P<0.001),见表 3。
3.抗体持久性相关因素分析:多因素分析显示,初免采血月龄、初免HepB剂量和初免抗体水平与T1时抗-HBs阳性率显著相关(P<0.05),性别、低出生体重、早产和母亲HBsAg阳性与T1时抗-HBs阳性率无关(P>0.05),见表 4;初免采血月龄、初免HepB剂量、初免抗体水平和早产与T1时抗-HBs水平显著相关(P<0.05),而性别、低出生体重、早产和母亲HBsAg阳性与T1时抗-HBs水平无关(P>0.05),见表 5。
HepB接种对于乙肝控制的作用已得到公认,但不同剂量HepB的免疫效果研究结果差异较大。本研究组先期通过大样本、多中心研究证实了新生儿接种10 μg HepB-HP较5 μg HepB-SC可获得更高的抗体阳转率和抗体水平[2],本次对两种疫苗接种后的抗体持久性进行5年随访。结果显示,10 μg HepB初免新生儿5年随访时抗-HBs水平显著高于5 μg HepB初免新生儿,前者随访抗体水平降至保护线(10 mIU/ml)以下者所占比例仅为后者的一半,说明新生儿接种10 μg HepB 5年抗体持久性优于接种5 μg HepB;采用多因素分析方法排除了早产、出生体重、母亲HBsAg状态等因素的影响,进一步证实了以上结论。
新生儿接种HepB后抗-HBs会逐渐衰减至保护水平之下,如果机体免疫细胞存在对HBV的免疫记忆,则一旦感染HBV,机体可快速产生抗-HBs,及时中和病毒,即出现免疫回忆反应。既往研究显示,抗-HBs阴转者中,残留抗体水平越高,机体免疫细胞存在免疫记忆的可能性越大[6-8]。本研究未对免疫记忆进行观察,无法对两组观察对象免疫记忆情况进行直接比较;但5 μg HepB组残留抗体水平低于10 μg HepB组,推测其存在免疫记忆者所占的比例亦低于10 μg HepB组。
本研究有局限性。一是来自两个地区的两组研究对象未做到随机分组,导致随访对象采血月龄、出生体重、早产等特征在两组分布不均匀;二是两组接种的疫苗来自两个不同的表达体系,故两种疫苗抗体持久性的差异无法完全归结于疫苗剂量的差别。此外,由于北京市人口流动性大,其研究对象随访率<40%。但研究中通过多因素方法排除了两组人口学特征差异的影响,且目前尚无证据显示不同表达体系的疫苗会影响免疫效果,故本文结果仍可信。
总之,本研究结果证实新生儿使用10 μg HepB初免,其抗体持久性优于接种5 μg HepB。
志谢: 感谢北京市各县(区)及山东省章丘市、寿光市、烟台市和威海市CDC相关人员在数据收集过程中的大力帮助利益冲突: 无
| [1] | Liang XF, Bi SL, Yang WZ, et al. Epidemiological serosurvey of hepatitis B in China-declining HBV prevalence due to hepatitis B vaccination[J]. Vaccine, 2009, 27(47): 6550–6557. DOI:10.1016/j.vaccine.2009.08.048 |
| [2] |
张丽, 张卫, 翟祥军, 等.
新生儿5μg和10μg重组酵母乙型肝炎疫苗初免后抗体免疫应答比较[J]. 中华流行病学杂志, 2012, 33(3): 305–308.
Zhang L, Zhang W, Zhai XJ, et al. Comparison on the antibody response after primary immunization of 5μg and 10μg hepatitis B vaccine made by recombinant DNA techniques, among newborns[J]. Chin J Epidemiol, 2012, 33(3): 305–308. DOI:10.3760/cma.j.issn.0254-6450.2012.03.013 |
| [3] | Yin J, Ji ZH, Liang PF, et al. The doses of 10μg should replace the doses of 5μg in newborn hepatitis B vaccination in China:a cost-effectiveness analysis[J]. Vaccine, 2015, 33(31): 3731–3738. DOI:10.1016/j.vaccine.2015.05.082 |
| [4] | Kim SY, Salomon JA, Goldie SJ. Economic evaluation of hepatitis B vaccination in low-income countries:using cost-effectiveness affordability curves[J]. Bull World Health Organ, 2007, 85(11): 833–842. DOI:10.2471/BLT.06.038893 |
| [5] | Isolani AP, Sversuti CS, Sell AM, et al. Protection against hepatitis B by the Butang recombinant vaccine in newborn children in South Brazil[J]. Mem Inst Oswaldo Cruz, 2006, 101(5): 551–553. DOI:10.1590/S0074-02762006000500012 |
| [6] |
张丽, 颜丙玉, 刘甲野, 等.
乙型肝炎疫苗初次免疫正常应答和高应答婴儿初次免疫5年后免疫记忆持久性随访观察[J]. 中华流行病学杂志, 2015, 36(12): 1372–1376.
Zhang L, Yan BY, Liu JY, et al. Persistence of immune memory to hepatitis B vaccine among infants with normal or high antibody response to primary vaccination:a five-year following-up study[J]. Chin J Epidemiol, 2015, 36(12): 1372–1376. DOI:10.3760/cma.j.issn.0254-6450.2015.12.011 |
| [7] | Yao J, Shan H, Chen YD, et al. The one year effects of three doses of hepatitis B vaccine as a booster in anti-HBs-negative children 11-15 years after primary immunization; China, 2009-2011[J]. Hum Vaccin Immunother, 2015, 11(5): 1114–1119. DOI:10.4161/21645515.2014.987001 |
| [8] | Chiara F, Bartolucci GB, Cattai M. Hepatitis B vaccination of adolescents:significance of non-protective antibodies[J]. Vaccine, 2013, 32(1): 62–68. DOI:10.1016/j.vaccine.2013.10.074 |
 2017, Vol. 38
2017, Vol. 38