文章信息
- 王雪枝, 陈杏, 李雨晴, 肖彤洋, 蒋毅, 李马超, 刘海灿, 万康林.
- Wang Xuezhi, Chen Xing, Li Yuqing, Xiao Tongyang, Jiang Yi, Li Machao, Liu Haican, Wan Kanglin.
- 结核分枝杆菌抗原Rv0585c人T细胞抗原表位鉴定及其免疫原性评价
- Identification and evaluation of T cell epitopes of Rv0585c from Mycobacterium tuberculosis
- 中华流行病学杂志, 2017, 38(5): 665-669
- Chinese Journal of Epidemiology, 2017, 38(5): 665-669
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.05.022
-
文章历史
收稿日期: 2016-10-01
2. 421001 衡阳, 南华大学公共卫生学院
2. School of Public Health, University of South China, Hengyang 421001, China
结核分枝杆菌的清除主要依赖T淋巴细胞和巨噬细胞之间的相互作用[1]。T细胞表位是被宿主T细胞特异性抗原受体(TCR)特异性识别的抗原部分,是宿主与病原菌相互作用的作用位点,对T细胞表位的研究对了解结核分枝杆菌的致病机制以及研发免疫诊断试剂、有效的治疗药物、疫苗非常重要。本研究利用比较基因组学筛选出结核分枝杆菌H37Rv和BCG共有的保守膜蛋白Rv0585c(主要参与细胞壁的加工处理)[2],然后对Rv0585c的人T细胞表位进行预测,并通过人群免疫学检测和动物免疫学试验对T细胞表位及其免疫原性进行分析。
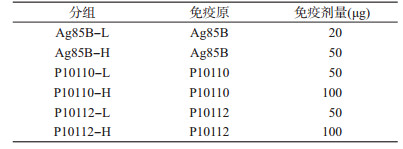
材料与方法1.多肽的合成:用生物信息学软件TE-predict和IEDB在线T细胞表位预测软件对Rv0585c抗原进行人T细胞抗原表位预测,选择表位聚集区9条表位多肽(表 1),由生工生物工程(上海)股份有限公司合成。其中用于动物免疫实验的多肽是通过多肽半胱氨酸的巯基与血蓝蛋白(keyhole limpet hemocyanin,KLH)上的伯胺共价偶联。
2.人群样本筛选:结核病患者筛选标准定为经过痰培养或痰涂片,或临床验证过的结核病患者,符合中华人民共和国卫生行业标准《肺结核诊断标准(WS 288-2008)》。肺部其他疾病患者筛选标准定为经细菌学试验鉴定或临床诊断排除结核病的肺部疾病患者。本研究通过中国CDC传染病预防控制所伦理审查委员会及动物伦理审查委员会批准,所有参与者均签署知情认同书。被试人群包括结核病患者、肺部其他疾病患者和健康志愿者。
3.固相酶联免疫斑点技术(ELISpot):根据结核分枝杆菌效应T细胞检测试剂盒T-SPOT.TB(北京金豪制药股份有限公司),用肝素锂抗凝真空采血管采集10 ml新鲜外周静脉血,用Ficoll淋巴细胞分离液分离外周血淋巴细胞(peripheral blood mononuclear cells,PBMC),用AIM-V无血清培养基(Gibco,USA)将细胞稀释成2.5×106/ml的细胞悬液。将PBMC细胞悬液加入到预先包被IFN-γ抗体的96孔微孔反应板中,100 μl/孔,来自同一个志愿者PBMCs分别加入9条多肽(终浓度为20 μg/ml),每条多肽100 μl,平行加入100 μl终浓度为15 μg/ml的植物血凝素PHA作为阳性对照孔,加入100 μl无菌PBS作为阴性对照孔,然后加入试剂盒中抗原肽100 μl作为检测孔。将抗原与PBMCs细胞置于37 ℃、5% CO2的培养箱中培养20 h。次日,按照试剂盒说明对细胞上清中IFN-γ的水平进行检测。结果判定:当空白对照孔斑点数为0~5,且检测孔斑点数-空白对照孔斑点数≥6判定为阳性;当空白对照孔斑点数为6~10,检测孔斑点数≥(2×空白对照孔斑点数)时,判定为阳性。
4.动物免疫试验:为了验证筛选出的T细胞表位的免疫原性,选择其中人T细胞免疫反应强度较强的2条多肽P10110和P10112以及Ag85B蛋白免疫BALB/c小鼠。随机将48只6周龄的雌性BALB/c小鼠(SPF级,购自武汉生物制品研究所动物中心)分为8组,每组6只。多肽P10110、P10112及Ag85B蛋白和KLH(阴性对照)利用佐剂[100 μl DDA(2.5 mg/ml)DDA及50 μl polyⅠ:C(0.5 mg/ml)(Sigma)]乳化后用于小鼠免疫,见表 2。空白对照组仅皮下免疫200 μl PBS。所有小鼠均皮下免疫3次,每次间隔2周。末次免疫4周后处死小鼠,取出小鼠脾脏,用RPMI-1640培养基(20%胎牛血清,1%双抗)将脾细胞稀释成2×106/ml,将细胞悬液加到24孔细胞培养板中,500 μl/孔,PBS组和KLH组小鼠的脾细胞分别加入相同体积的Ag85B(5 μg/ml)、P10110(5 μg/ml)、P10112(5 μg/ml)进行刺激,Ag85B-L和Ag85B-H组小鼠的脾细胞用500 μl Ag85B(5 μg/ml)进行刺激,P10110-L和P10110-H组的小鼠脾细胞用500 μl P10110(5 μg/ml)进行刺激,P10112-L和P10112-H组的小鼠脾细胞用500 μl P10112(5 μg/ml)进行刺激。每条多肽刺激设置双孔。每组小鼠皮细胞刺激均设阴性对照(加入500 μl PBS)和阳性对照(加入500 μl 5 μg/ml的PHA)。37 ℃、5% CO2的培养箱中培养72 h后,用细胞因子检测试剂盒(美国BD公司)检测细胞上清中的抗原特异性的细胞因子IFN-γ、IL-2、IL-4、IL-10的水平。
5.统计学分析:ELISpot试验结果用阳性率和特异度表示,动物实验中细胞因子水平用x± s表示,最后利用SPSS 21软件进行数据处理,采用独立样本t检验,P<0.05为差异有统计学意义。
结果1.一般情况:共采集全血样本153份,其中结核病患者样本50例、肺部其他疾病患者43例、健康志愿者60例。全部样本中,5例健康志愿者样本的检测结果不符合质量控制标准而被剔除,最终纳入统计的样本为148例。
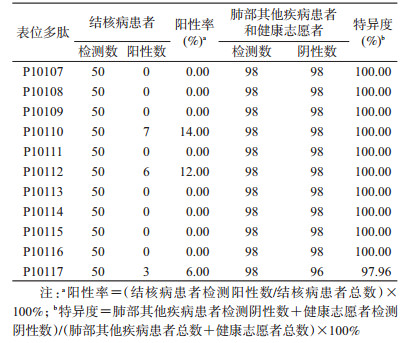
2. ELISpot:利用多肽刺激志愿者PBMC进行ELISpot试验,人群筛选试验结果显示,结核病患者对其中3条多肽能产生不同程度的阳性T细胞免疫应答,P10110、P10112和P10117,用于肺结核检测的阳性率分别为14.00%、12.00%和6.00%,特异度分别为100.00%、100.00%和97.96%。根据单条结核T细胞表位多肽检测阳性即为阳性的原则,3条多肽联合用于肺结核检测的阳性率为22.00%(11/50),特异度为97.96%(95/98),见表 3。肺部其他疾病患者和健康志愿者对此9条多肽的T细胞免疫反应均为阴性,因此提示P10110、P10112、P10117为结核分枝杆菌人T细胞抗原表位。
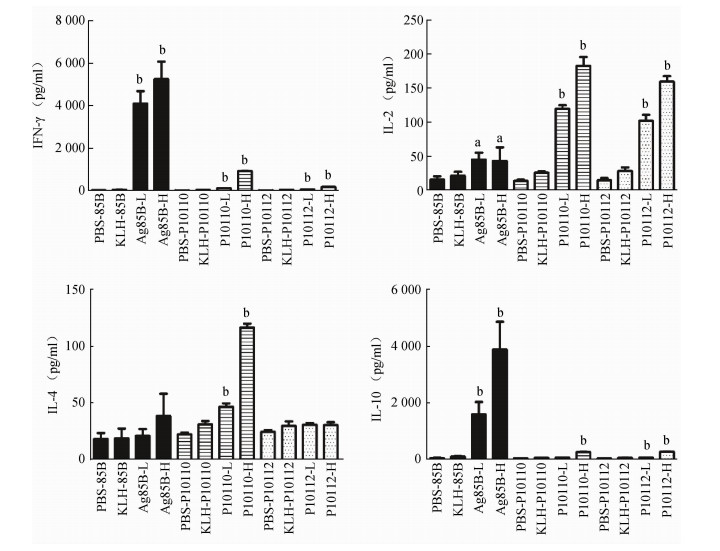
3.细胞因子水平检测:末次免疫4周后,采集每组6只小鼠的脾细胞,以特异性抗原Ag85B、P10110多肽、P10112多肽进行刺激,检测产生的细胞因子IFN-γ、IL-2、IL-4、IL-10。P10110和P10112均能刺激机体产生的IFN-γ、IL-2、IL-4和IL-10(图 1),且高剂量组产生的细胞因子的水平均高于低剂量组。与阳性对照Ag85B抗原相比,P10110和P10112高、低剂量组产生的IFN-γ、IL-10的水平低于Ag85B高、低剂量组,差异有统计学意义(P<0.001)。但P10110和P10112高、低剂量组产生的IL-2的水平高于Ag85B高、低剂量组,差异有统计学意义(P<0.001)。
|
| 注:横坐标各组以“免疫组-刺激原”命名,aP<0.05,bP<0.001 图 1 不同剂量P10110和P10112免疫小鼠分泌IFN-γ、IL-2、IL-4、IL-10的水平 |
结核病的流行给全球公共卫生带来巨大挑战,而结核疫苗能有效预防和控制结核病的流行[3]。BCG疫苗虽然被广泛使用,但其保护性只能维持10~15年[4-5]。新型亚单位疫苗有潜力替代BCG疫苗或用于加强免疫增强BCG引起的免疫应答[6-9]。结核候选抗原的缺少仍是结核亚单位疫苗研究的最大阻碍,因此寻找新的免疫优势抗原或抗原表位是新型结核疫苗研发的关键。
在本研究中,从Rv0585c蛋白中鉴定的3个人T细胞表位在人群中的反应强度不同且反应强度较低,推测可能与检测阴性的T细胞表位多肽只是该抗原T细胞表位的一部分或单条多肽结构单一,不足以引起足够的T细胞免疫反应有关。3个T细胞表位联合应用,检测的阳性率较单个表位的阳性率有所升高,因此,多条多肽联合使用,能够提高T细胞反应强度,在人群结核病监测中使用,可更好地监测人群中结核病的流行情况。
机体对结核分枝杆菌的免疫应答主要是CD4+T淋巴细胞和CD8+T淋巴细胞介导的细胞免疫应答。其中CD4+T细胞可以分为Th1和Th2细胞,而前者分泌的IFN-γ、IL-2、IL-12、TNF-α中的IFN-γ能够激活巨噬细胞、释放效应分子活性氮介质、活性氮介质和促进溶酶体成熟等杀菌物质清除细胞内结核分枝杆菌[10-11],Th2细胞能分泌IL-4、IL-5和IL-10等细胞因子,辅助B细胞激活、增殖调节体液免疫[11]。本研究中的P10110表位能诱导BALB/c小鼠产生高浓度的IFN-γ、IL-2、IL-4和IL-10,而P10112表位则能刺激产生较高浓度的IFN-γ、IL-2和IL-10,证实2条T细胞表位均能刺激机体产生较强的细胞免疫应答和体液免疫应答。但100 μg P10110和100 μg P10112产生的IFN-γ和IL-10水平均明显低于50 μg Ag85B,产生的IL-2和IL-4明显高于Ag85B,显示单一多肽,即使提高免疫浓度,免疫效果仍然不如其全蛋白抗原。
综上所述,本研究利用ELISpot试验从预测的Rv0585c抗原表位多肽中首次鉴定出3条人T细胞表位,这些表位可以用作刺激物,用于结核病的检测。通过用T细胞表位免疫BALB/c小鼠,证实了P10110和P10112两条T细胞表位具有较强的免疫原性,能诱导机体产生高水平的细胞因子,因此这两个T细胞表位具有潜在的可能性用于结核亚单位疫苗。若将Rv0585c或其T细胞表位用作新型结核亚单位疫苗的制备,仍需对其免疫保护力进一步验证。
利益冲突: 无
| [1] | van Crevel R, Ottenhoff THM, van der Meer JWM.Innate immunity to Mycobacterium tuberculosis[M]. New York: Springer, 2003: 241–247. |
| [2] | de Souza GA, Leversen NA, Målen H, et al. Bacterial proteins with cleaved or uncleaved signal peptides of the general secretory pathway[J]. J Proteomics, 2011, 75(2): 502–510. DOI:10.1016/j.jprot.2011.08.016 |
| [3] | Lönnroth K, Raviglione M. Global epidemiology of tuberculosis:prospects for control[J]. Semin Respir Crit Care Med, 2008, 29(5): 481–491. DOI:10.1055/s-0028-1085700 |
| [4] | Andersen P, Doherty TM. The success and failure of BCG-implications for a novel tuberculosis vaccine[J]. Nat Rev Microbiol, 2005, 3(8): 656–662. DOI:10.1038/nrmicro1211 |
| [5] | Mangtani P, Abubakar I, Ariti C, et al. Protection by BCG vaccine against tuberculosis:a systematic review of randomized controlled trials[J]. Clin Infect Dis, 2014, 58(4): 470–480. DOI:10.1093/cid/cit790 |
| [6] | Bertholet S, Ireton GC, Kahn M, et al. Identification of human T cell antigens for the development of vaccines against Mycobacterium tuberculosis[J]. J Immunol, 2008, 181(11): 7948–7957. DOI:10.4049/jimmunol.181.11.7948 |
| [7] | Bertholet S, Ireton GC, Ordway DJ, et al. A defined tuberculosis vaccine candidate boosts BCG and protects against multidrug-resistant Mycobacterium tuberculosis[J]. Sci Transl Med, 2010, 2(53): 53ra74. DOI:10.1126/scitranslmed.3001094 |
| [8] | Ottenhoff THM, Doherty TM, van Dissel JT, et al. First in humans:a new molecularly defined vaccine shows excellent safety and strong induction of long-lived Mycobacterium tuberculosis-specific Th1-cell like responses[J]. Hum Vaccin, 2010, 6(12): 1007–1015. DOI:10.4161/hv.6.12.13143 |
| [9] | van Dissel JT, Soonawala D, Joosten SA, et al. Ag85B-ESAT-6 adjuvanted with IC31® promotes strong and long-lived Mycobacterium tuberculosis specific T cell responses in volunteers with previous BCG vaccination or tuberculosis infection[J]. Vaccine, 2011, 29(11): 2100–2109. DOI:10.1016/j.vaccine.2010.12.135 |
| [10] | Flynn JA, Chan J. Immunology of tuberculosis[J]. Annu Rev Immunol, 2001, 19(1): 93–129. DOI:10.1146/annurev.immunol.19.1.93 |
| [11] | Matucci A, Maggi E, Vultaggio A. Cellular and humoral immune responses during tuberculosis infection:useful knowledge in the era of biological agents[J]. J Rheumatol Suppl, 2014, 91: 17–23. DOI:10.3899/jrheum.140098 |
 2017, Vol. 38
2017, Vol. 38