文章信息
- 廖征, 冯小武, 刘学恩, 周义生, 文海蓉, 彭时辉, 张艳霞, 许波, 庄辉, 陈海婴.
- Liao Zheng, Feng Xiaowu, Liu Xueen, Zhou Yisheng, Wen Hairong, Peng Shihui, Zhang Yanxia, Xu Bo, Zhuang Hui, Chen Haiying.
- 甲型肝炎灭活疫苗在大学生中加强免疫的效果研究
- Immune response to one booster dose of inactivated hepatitis A vaccine in college students
- 中华流行病学杂志, 2017, 38(5): 625-628
- Chinese Journal of Epidemiology, 2017, 38(5): 625-628
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2017.05.013
-
文章历史
收稿日期: 2016-11-21
2. 100083 北京大学医学部基础医学院病原生物学系
2. Department of Microbiology and Parasitology, School of Basic Medical Sciences, Peking University Health Science Center, Beijing 100083, China
甲型肝炎(甲肝)是由甲肝病毒(HAV)引起的急性传染病,是世界性的公共卫生问题。甲肝流行与地区的经济发展、生活习惯、卫生条件密切相关,全球不同地区流行率在15%~100%之间。我国于2007年将甲肝疫苗纳入国家扩大免疫规划,甲肝得到了进一步控制。2007-2011年,全国累计报告甲肝247 838例,年平均发病率3.74/10万[1]。但是,由于实施甲肝疫苗计划免疫,以及卫生状况好转,出现甲肝发病高峰向20~40岁组成年人后移现象[2-4]。尽管成年人甲肝的临床表现与儿童相似,但症状更为严重,肝功能损害程度也明显高于儿童[5]。因此,随着甲肝流行模式的改变,可能会出现成年人甲肝感染率上升、临床病例增加、重症肝炎增多的态势。大学生和入伍军人是特殊群体,既往调查显示大学新生的甲肝抗体阳性率为15.68%[6],入伍新兵为37.85%[7],较低的抗体水平加上聚集生活、流动性大等特点,易成为甲肝暴发流行的高危人群。
本研究是对国产甲肝灭活疫苗(孩尔来福®)与国产冻干甲肝减毒活疫苗(H2减毒株)免疫后3年的16~25岁高校大学生,进行甲肝灭活疫苗1针加强免疫效果和安全性研究,为制订特殊人群甲肝疫苗免疫策略提供依据。
对象与方法1.研究设计及受试者选择:2008年在南昌市的16~25岁大学生群体中开展甲肝灭活疫苗和冻干甲肝减毒活疫苗的随机双盲临床试验[8],研究中将受试者随机分为3组。A组接种1剂500 U/剂甲肝灭活疫苗;B组接种1剂6.50 lgCCID50/剂甲肝减毒活疫苗;C组接种2剂(0,6月程序)500 U/剂甲肝灭活疫苗。受试者在免疫前、免疫后1.5、7、12、24、36个月采血,进行抗-HAV定量检测,评价甲肝疫苗的免疫原性和免疫持久性。本研究于2011年选择上述研究中基础免疫前甲肝抗体阴性、完成1针基础免疫(甲肝灭活疫苗或减毒活疫苗)、完成3年随访、身体健康,经知情同意自愿参加本研究的大学生作为受试者。排除标准:① 接种疫苗前发热者,腋下体温>37.0 ℃;② 各种慢性疾病,如病毒性肝炎、结核病、血液病、神经系统疾病等;③ 各种急性疾病或慢性疾病急性发作;④ 过去6个月内接受过免疫抑制剂治疗、细胞毒性药物治疗、吸入皮质类固醇治疗(不包括过敏性鼻炎的皮质类固醇喷雾治疗、急性非并发皮炎的表面皮质类固醇治疗);⑤ 接种疫苗前3个月内接受过血液制品;⑥ 接种疫苗前30 d内接受过其他研究药物或疫苗;⑦ 接种疫苗前30 d内接受过减毒活疫苗;⑧ 接种疫苗前14 d内接受过亚单位或灭活疫苗;⑨ 女性妊娠试验阳性者;⑩ 根据研究者判断,由于各种医疗、心理、社会条件、职业因素或其他条件,有悖于试验方案,或影响受试者签署知情同意。符合要求的研究对象共133人,其中70人接种过甲肝灭活疫苗,63人接种过减毒活疫苗。最终入组80人,其中42人接种过甲肝灭活疫苗,38人接种过减毒活疫苗,全部受试者接种1针500 U/剂灭活疫苗。接种后进行30 min即时反应观察以及24、48、72 h的随访观察。两组受试者均在加强免疫后1个月进行采血。所有样本采用微粒子酶免法进行甲肝抗体(抗-HAV)检测。
2.伦理学审查:本研究设计符合药物临床试验质量管理规范(GCP),并遵守赫尔辛基宣言。研究方案已通过北京大学生物医学伦理委员会(IRB/IEC)审查和批准,所有受试者在参与研究前均签署书面知情同意书。
3.试验疫苗:甲肝灭活疫苗(孩尔来福®),成年人剂型(500 U/每支1.0 ml)用于16岁以上人群。成分包括HAV抗原、氢氧化铝、磷酸氢二钠、磷酸二氢钠、氯化钠和注射用水。由北京科兴生物制品有限公司生产,批号为201010021,有效期至2014年4月12日,经中国食品药品检定研究院(NIFDC)批签发检定合格。接种途径为上臂外侧三角肌肌内注射。
4.甲肝抗体检测方法及评价标准:由北京大学医学部病原生物系进行抗-HAV定量检测。采用Abbott公司生产的HAVAB2.0®甲肝抗体检测试剂(微粒子酶免疫法)在AXSYM®操作系统下进行抗-HAV定量检测。抗-HAV滴度≥20 mIU/ml为抗体阳性。系统检测域值为5~100 mIU/ml,<5 mIU/ml按照2.5 mIU/ml计算;样本滴度超过100 mIU/ml,采用专用稀释液稀释后进行复测,稀释后结果>20 000 mIU/ml,按照20 000 mIU/ml计算。
5.安全性评价:接种后受试者在接种点观察30 min,以保证受试者安全并记录出现的任何即时反应。接种后的第0~3天内,记录主动监测的注射部位(局部)反应(触痛、红斑、肿胀、硬结、瘙痒)和全身反应(发热、皮疹、头痛、头晕、乏力、肌肉疼痛、关节痛、恶心、呕吐、腹泻、腹痛)的发生时间、持续天数、严重程度。严重程度按照《预防用疫苗临床试验不良反应分级标准指导原则》(2005年10月14日颁布)进行分级。
6.统计学分析:凡接受加强免疫者均纳入安全性分析集,完成加强免疫前、后采血者纳入免疫原性分析集。本研究中抗-HAV滴度用几何平均浓度(GMC)及其95%CI来表示。将抗体滴度进行对数转换,组内接种前后比较用配对t检验;组间进行方差齐性检验,方差不齐时选用校正t检验。抗体阳性率分析的组间比较采用χ2检验或Fisher精确概率法。此外,对免疫原性分析集中获得全部采血数据的受试者描述3年甲肝抗体阳性率和GMC动态变化。采用SPSS 15.0软件分析数据,统计检验用双侧检验,给出检验统计量及其对应的P值,用Fisher精确概率法时直接计算出P值,以P<0.05为差异有统计学意义。
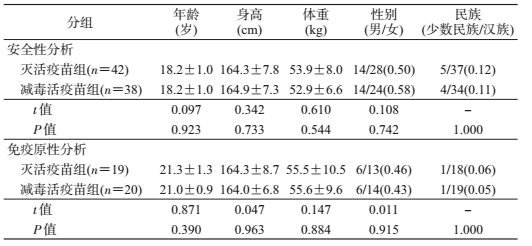
结果1.基本情况:研究对象共80人,年龄为19~25岁,男性28例,女性52例,男女性别比例为1 : 1.86,有71例为汉族,9例为少数民族。39人完成免疫后采血,进行加强免疫后抗体分析,其中灭活疫苗组19人,减毒活疫苗组20人。各组基线数据均符合方案要求,各组间受试者的基线数据均衡,具有良好的可比性(表 1)。
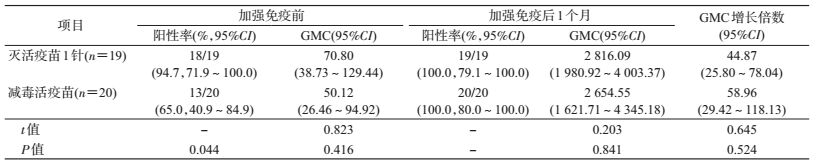
2.甲肝灭活疫苗加强免疫效果:符合免疫原性分析集的受试者共39例,其中灭活疫苗1针组19人、减毒活疫苗组20人。两试验组加强免疫前GMC分别为70.80 mIU/ml、50.12 mIU/ml,差异无统计学意义(t=0.823,P=0.416);阳性率分别为94.7%、65.0%,差异有统计学意义(P=0.044)。加强免疫1针灭活疫苗后,抗体阳性率均为100.0%,灭活疫苗组和减毒活疫苗组GMC分别为2 816.09 mIU/ml、2 654.55 mIU/ml,差异无统计学意义(t=0.203,P=0.841),两组GMC增长倍数分别为44.87、58.96(表 2)。
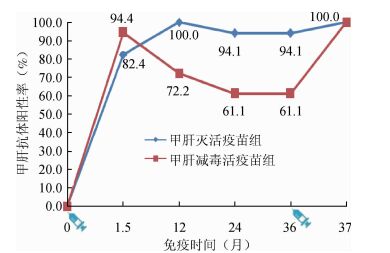
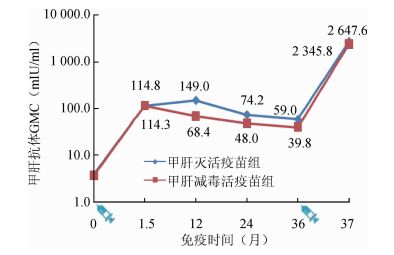
3.间隔3年加强免疫后甲肝抗体动态变化:免疫原性分析集的39名受试者中有35名受试者完成了基础免疫后1.5个月至3年的免疫持久性观察,其中1针甲肝灭活疫苗免后1.5个月至3年,抗体阳性率由最高100%降至94.1%,GMC由114.8 mIU/ml降至59.0 mIU/ml。1针甲肝减毒活疫苗免后1.5个月至3年,抗体阳性率由94.4%降至61.1%,GMC由114.3 mIU/ml降至39.8 mIU/ml。加强免疫1针甲肝灭活疫苗后甲肝抗体阳性和抗体滴度均有显著升高(图 1、2)。
|
| 图 1 间隔3年加强免疫后甲肝抗体阳性率动态变化 |
|
| 图 2 间隔3年加强免疫后甲肝抗体GMC动态变化 |
4.加强免疫的安全性:80例受试者接受了1针甲肝灭活疫苗加强免疫,未观察到不良反应/事件的发生,表明甲肝灭活疫苗用于加强免疫,具有良好的安全性。
讨论大中专院校学生集体居住、集体餐饮,一旦出现甲肝传染源,容易发生暴发[9]。因此,有必要在大中专院校学生中开展甲肝疫苗接种。我国目前的甲肝疫苗免疫策略是:减毒活疫苗在18月龄接种1剂,或灭活疫苗在18月龄和2岁各接种1剂,尚无成年人相关的免疫策略。本研究对成年人接种甲肝疫苗3年后进行加强免疫的效果观察。结果显示,部分大中专院校学生在接种甲肝疫苗3年后已失去了甲肝抗体的有效保护,尤其是接种1针减毒活疫苗者,抗体阳性率水平已下降至65.0%,而完成1针灭活疫苗接种3年后受试者的阳性率维持在94.1%,显著高于减毒疫苗组,这与Liu等[10]的研究结果一致。该结果提示:① 对于甲肝减毒活疫苗需要开展更多研究,获得更多关于其免疫持久性的证据,为是否加强接种提供更多依据;② 目前世界上大多数国家推荐的甲肝灭活疫苗接种程序为两剂次,间隔6~12个月,但本研究提示1剂次甲肝灭活疫苗亦可考虑作为常规策略运用,这与阿根廷国家甲肝免疫策略的实践证据一致[11]。研究发现进行甲肝灭活疫苗加强免疫后1个月,灭活疫苗1针组和减毒活疫苗组抗体阳性率均为100.0%,GMC显著上升分别至2 816.09 mIU/ml和2 654.55 mIU/ml,两者加强免疫效果相近,说明对已完成1针灭活疫苗或减毒活疫苗接种的人群进行1针灭活疫苗的接种均能产生理想的效果,受试者免疫回忆反应明显。
本研究有一定局限性:① 本次研究对象选择大学生作为成年人代表人群,存在一定选择偏倚,但考虑到机体对疫苗的免疫反应受年龄的影响大于职业的影响,研究结论对同年龄段的其他成年人应该也有一定参考价值,如入伍军人、流动就业人员、企事业单位新招收职工等;② 受失访影响,最终纳入分析的样本量较小,研究结果外推要谨慎,但研究结论可为下一步大样本研究提供线索。
综上所述,在已接种1剂甲肝疫苗的成年人中有加强接种的必要性,采用灭活甲肝疫苗进行加强接种能够显著增强免疫效果。
利益冲突: 无
| [1] |
徐也晴, 崔富强, 张国民, 等.
中国2007-2011年甲型和戊型病毒性肝炎以及细菌性痢疾流行病学特征分析[J]. 中国疫苗和免疫, 2013, 19(6): 501–505.
Xu YQ, Cui FQ, Zhang GM, et al. Epidemiological characteristic analysis of hepatitis A, hepatitis E, bacillary dysentery in China, 2007-2011[J]. Chin J Vacc Immun, 2013, 19(6): 501–505. |
| [2] | Nelson KE. Global changes in the epidemiology of hepatitis A virus infections[J]. Clin Infect Dis, 2006, 42(8): 1151–1152. DOI:10.1086/501014 |
| [3] |
秦京宁, 高秀媛, 高波, 等.
北京市成年人群甲型肝炎病毒血清抗体流行率调查[J]. 中国卫生检验杂志, 2011, 21(7): 1775–1776.
Qin JN, Gao XY, Gao B, et al. A seroprevalence of anti-HAV IgG in the adults of Beijing city[J]. Chin J Health Lab Technol, 2011, 21(7): 1775–1776. |
| [4] |
吴小东, 李文凡, 杨生义, 等.
2008年广州市20岁以上正常人群甲型肝炎抗体流行率调查[J]. 热带医学杂志, 2010, 10(5): 551–552.
Wu XD, Li WF, Yang SY, et al. The prevalent rate of anti-HAV IgG in normal adults over 20 year old in Guangzhou in 2008[J]. J Trop Med, 2010, 10(5): 551–552. |
| [5] |
张栋华.
儿童甲型肝炎与成人甲型肝炎临床特征对比分析[J]. 中国社区医生, 2014, 30(23): 74–76.
Zhang DH. Comparative analysis of clinical features of children with hepatitis A and adult with hepatitis A[J]. Chin Comm Doct, 2014, 30(23): 74–76. DOI:10.3969/j.issn.1007-614x.2014.23.47 |
| [6] |
张龙杰.
西南师大新生甲肝抗体调查及甲肝疫苗免疫效果观察[J]. 中国学校卫生, 1997, 18(1): 8–9.
Zhang LJ. Anti-HAV level and effect of hepatitis A vaccine in first-year students of Southwest China Normal University[J]. Chin J School Health, 1997, 18(1): 8–9. |
| [7] |
俞苏蒙, 叶小波, 高彦军, 等.
入伍新兵人群甲型病毒性肝炎血清抗体水平监测[J]. 疾病监测, 2008, 23(9): 549–550.
Yu SM, Ye XB, Gao YJ, et al. Surveillance of hepatitis A serum antibody levels in recruits[J]. Dis Surv, 2008, 23(9): 549–550. DOI:10.3784/j.issn.1003-9961.2008.09.008 |
| [8] |
廖征, 刘学恩, 王旭, 等.
甲型肝炎灭活疫苗和减毒活疫苗在青壮年人群中的免疫原性和安全性研究[J]. 中国病毒病杂志, 2012, 2(4): 310–314.
Liao Z, Liu XE, Wang X, et al. Immunogenicity and safety of inactivated and live attenuated hepatitis A vaccines in Chinese young adults[J]. Chin J Viral Dis, 2012, 2(4): 310–314. DOI:10.16505/j.2095-0136.2012.04.004 |
| [9] |
吴景文, 熊志伟, 徐丹, 等.
一起高校内甲型肝炎暴发的流行病学调查分析[J]. 现代预防医学, 2009, 36(3): 410–412.
Wu JW, Xiong ZW, Xu D, et al. Epidemiological investigation and analysis of a outbreak of hepatitis A in one college[J]. Mod Prev Med, 2009, 36(3): 410–412. |
| [10] | Liu XE, Chen HY, Liao Z, et al. Comparison of immunogenicity between inactivated and live attenuated hepatitis A vaccines among young adults:a 3-year follow-up study[J]. J Infect Diseases, 2015, 212(8): 1232–1236. DOI:10.1093/infdis/jiv213 |
| [11] | Vizzotti C, Gonzalez J, Rearte A, et al. Single-dose universal hepatitis A immunization in argentina:low viral circulation and high persistence of protective antibodies up to 4 years[J]. J Pediatric Infect Dis Soc, 2015, 4(4): e62–67. DOI:10.1093/jpids/piu068 |
 2017, Vol. 38
2017, Vol. 38