文章信息
- 张芳, 王素萍, 史晓红, 王雪飞, 高怡, 郭健, 张临瑞, 王婷, 温海秀, 许喜喜, 杨志清, 王斌, 汪波, 丰淑英 .
- Zhang Fang, Wang Suping, Shi Xiaohong, Wang Xuefei, Gao Yi, Guo Jian, Zhang Linrui, Wang Ting, Wen Haixiu, Xu Xixi, Yang Zhiqing, Wang Bin, Wang Bo, Feng Shuying .
- 新生儿HBV血清标志物及免疫状态与乙型肝炎疫苗无/弱应答的关系
- Relationship between the mode of HBV marker and immune status in neonates and non-/hypo-response to hepatitis B vaccine
- 中华流行病学杂志, 2016, 37(8): 1074-1079
- CHINESE JOURNAL OF EPIDEMIOLOGY, 2016, 37(8): 1074-1079
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.08.004
-
文章历史
收稿日期: 2016-03-21
2. 030001 太原市第三人民医院妇产科
2. Obstetrics and Gynaecology Department, Third People Hospital of Taiyuan City, Taiyuan 030001, China
新生儿接种乙型肝炎(乙肝)疫苗是阻断HBV母婴传播最有效的方法[1],但最近的文献报道显示,国内HBsAg阳性孕产妇的12月龄婴儿乙肝疫苗无/弱应答率仍高达27.4%~30.2%[2-3]。HBV血清标志物与HBV感染密切相关[4-5],且新生儿自身的免疫功能受HBV感染的调节[6-7],推测新生儿HBV血清学模式可能会影响其免疫状态,进而影响乙肝疫苗免疫效果。本研究旨在了解HBsAg阳性孕产妇的新生儿HBV血清学模式与乙肝疫苗无/弱应答的关系;进而从新生儿外周血Toll样受体3(TLR3)及相关免疫细胞和Th1/Th2型细胞因子方面探讨新生儿HBV血清学模式及其免疫状态对乙肝疫苗无/弱应答的影响。
对象与方法1. 研究对象:2011年7月至2013年7月太原市第三人民医院妇产科HBsAg阳性孕产妇及其足月分娩的新生儿386对,收集孕产妇及新生儿流行病学资料。采集孕产妇孕期肘静脉血及新生儿出生后24 h内主、被动免疫前股静脉抗凝和非抗凝血各3 ml。按照我国0-1-6月免疫接种程序对新生儿进行乙肝疫苗接种和出生24 h内注射200 IU乙肝高效价免疫球蛋白。随访至12月龄(婴儿,227例),收集流行病学资料,并采集其股静脉抗凝和非抗凝血各3 ml。所有血液样本置于-80 ℃冰箱保存。本研究经山西医科大学伦理委员会批准,所有孕产妇均签署知情同意书。
2. HBV血清标志物检测:化学发光免疫试验(CLIA)检测孕产妇、新生儿及婴儿的HBsAg、抗-HBs、HBeAg、抗-HBe、抗-HBc。婴儿乙肝疫苗免疫应答判定标准:抗-HBs<100 mIU/ml为无/弱应答;抗-HBs≥100 mIU/ml为强应答[8-9]。HBV血清标志物(HBVM)试剂盒购于德国罗氏诊断有限公司。
3. 外周血TLR3蛋白和免疫细胞的检测:分离外周血单个核细胞(PBMC),采用流式细胞术(FCM)检测新生儿及婴儿的PBMC TLR3蛋白表达量及外周血树突状细胞(DCs)、CD4+ T 淋巴细胞、CD8+ T淋巴细胞、CD19+ B淋巴细胞和FoxP3+(CD4+ CD25+)调节性T淋巴细胞数量。检测TLR3蛋白用的羊抗鼠IgG-FITC和TLR3鼠抗人抗体购于美国Santa Cruz公司;检测免疫细胞所用的单克隆抗体均购于美国eBioscience公司。使用Cell Quest软件进行结果分析。从外周血中检测的细胞数量是指相对数量,用百分数(%)表示。
4. 外周血细胞因子的检测:采用ELISA检测新生儿及婴儿的血清白介素(IL)-12p40(IL-12p40)、IL-6、IL-10、IL-2、IL-4和干扰素-γ(IFN-γ)水平。IL-12p40、IL-6、IL-10、IL-2、IL-4和IFN-γ的检出限分别为15、23.3、11、50、14.5和20 pg/ml。标准曲线的决定系数:R2>0.997。细胞因子检测试剂盒购于生工生物工程(上海)股份有限公司。
5. 统计学方法:采用SPSS 20.0软件进行统计学分析。定量资料组间的比较采用方差分析或秩和检验;用“x±s”表达服从正态分布的资料,用“M值 (QR)”表达呈偏态分布的资料。定性资料组间的比较采用 χ2检验。OR值及其95%CI的计算采用logistic回归分析。不服从正态分布变量的相关性分析采用Spearman秩相关分析。P<0.05为差异有统计学意义。
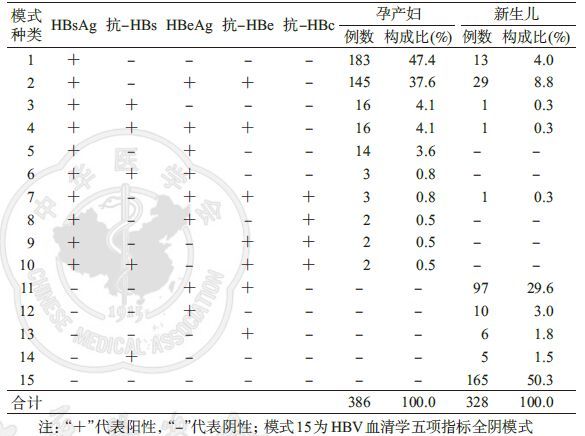
结 果1. HBsAg阳性孕产妇及其新生儿HBV血清学模式:386对HBsAg阳性孕产妇及其新生儿HBV 血清学模式共15种,见表 1。其中,HBsAg阳性孕产妇HBV血清学模式有10种,为表 1所列第1~10种;新生儿HBV血清学模式也有10种,为表 1所列第1、2、3、4、7、11~15种。
(1)HBsAg阳性孕产妇及其新生儿HBV血清学模式种类:386例HBsAg阳性孕产妇的10种HBV血清学模式中以模式1多见,占孕产妇总数的47.4%(183/386),模式2次之,占37.6%(145/386),为HBsAg阳性孕产妇的2种主要模式,共328例。其余模式占孕产妇总数的比例均较低,其中模式8(大三阳)和模式9(小三阳)这2种传统模式各占0.5%(2/386)。328例新生儿的10种HBV血清学模式中以模式15最多见,占新生儿总数的50.3%(165/328);其次为模式11、模式2和模式1,分别占新生儿总数的29.6%(97/328)、8.8%(29/328)和4.0%(13/328),其他模式所占比例均较少。见表 1。
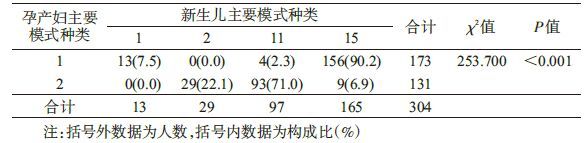
(2)HBsAg阳性孕产妇及其新生儿HBV血清学模式种类的关系:HBsAg阳性孕产妇2种主要模式下其新生儿4种主要模式所占比例的差异具有统计学意义(P<0.001)。HBsAg阳性孕产妇模式1下其新生儿以模式15多见,占该模式下新生儿总数的90.2%(156/173);HBsAg阳性孕产妇模式2下其新生儿以模式11多见,占该模式下新生儿总数的71.0%(93/131)。见表 2。
2. 新生儿4种主要HBV血清学模式与婴儿乙肝疫苗免疫应答的关系:
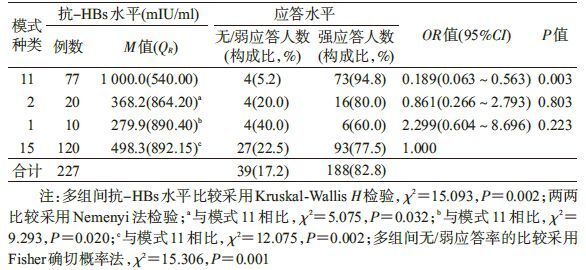
(1)新生儿4种主要HBV血清学模式下婴儿抗体水平的比较:4种主要模式(即模式11、2、1、15)的新生儿共304例,共随访到婴儿227例,随访婴儿与未随访婴儿在孕周、身长和体重等方面差异无统计学意义(P>0.05)。新生儿4种模式下婴儿抗体水平的差异有统计学意义(P<0.001),且模式11婴儿抗体水平均高于其他3种模式。见表 3。
(2)新生儿4种主要HBV血清学模式与婴儿乙肝疫苗无/弱应答的关系:227例婴儿乙肝疫苗无/弱应答率为17.2%(39/227),强应答率为82.8%(188/227)。新生儿各模式无/弱应答率的差异具有统计学意义(P<0.001),且无/弱应答率由低到高依次为模式11(5.2%)<模式2(20.0%)<模式15(22.5%)<模式1(40.0%)。同时新生儿模式11发生乙肝疫苗无/弱应答的风险比模式15下降了81.1%(OR=0.189,95%CI:0.063~0.563,P=0.003)。见表 3。
3. 新生儿4种主要HBV血清学模式下新生儿及婴儿PBMC TLR3蛋白表达量以及相关免疫细胞数量和Th1/Th2型细胞因子水平的比较: (1)PBMC TLR3蛋白表达量的比较:共测得149例新生儿PBMC TLR3蛋白表达量,169例婴儿PBMC TLR3蛋白表达量。新生儿孕周、身长和体重在测定者和未测定者之间及各模式下的差异无统计学意义(P>0.05),各模式下新生儿及婴儿PBMC TLR3蛋白表达量的差异均无统计学意义(P>0.05)。
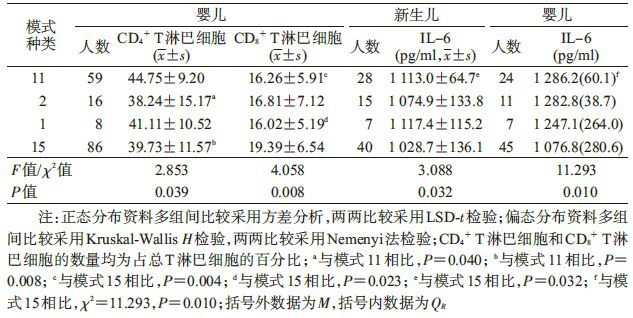
(2)外周血免疫细胞数量的比较:共测得140例新生儿和169例婴儿外周血CD4+ T淋巴细胞、CD8+ T淋巴细胞、FoxP3+(CD4+ CD25+)调节性T淋巴细胞、CD19+ B淋巴细胞以及DCs的数量。新生儿孕周、身长和体重在测定者和未测定者之间及各模式下的差异无统计学意义(P>0.05)。新生儿外周血各免疫细胞数量在各血清学模式下的差异均无统计学意义;婴儿CD4+ T淋巴细胞、CD8+ T淋巴细胞数量在各模式下的差异均有统计学意义(P<0.05),其他细胞数量差异均无统计学意义。两两比较可知,模式2和模式15下婴儿CD4+ T淋巴细胞数量低于模式11(P<0.05);模式11和模式1下婴儿CD8+ T淋巴细胞数量低于模式15(P<0.05)。见表 4。
(3)Th1/Th2型细胞因子水平的比较:共测得90例新生儿和87例婴儿外周血Th1/Th2型细胞因子IL-12p40、IL-4、IL-6、IL-10、IL-2及IFN-γ水平。新生儿孕周,身长和体重在测定者和未测定者之间及各模式下的差异无统计学意义(P>0.05)。新生儿及婴儿IL-6水平在各模式下的差异均具有统计学意义(P<0.05),两两比较可知,模式11下新生儿及婴儿IL-6水平均高于模式15(P<0.05)。见表 4。新生儿及婴儿IL-12p40、IL-4、IL-10、IL-2及IFN-γ水平在各模式下的差异均无统计学意义(P>0.05)。
4. 婴儿CD4+ T淋巴细胞、CD8+ T淋巴细胞数量和新生儿及婴儿外周血IL-6水平与婴儿抗-HBs水平的相关性分析:婴儿CD4+ T淋巴细胞与抗-HBs水平不存在相关关系(r=0.136,P=0.063);婴儿CD8+ T淋巴细胞与抗-HBs水平不存在相关关系(r=-0.138,P=0.060)。新生儿IL-6水平与抗-HBs水平呈正相关(r=0.679,P<0.001);婴儿IL-6水平与抗-HBs呈正相关(r= 0.746,P<0.001)。
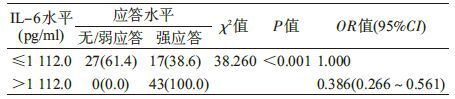
5. 新生儿IL-6水平分级与婴儿乙肝疫苗免疫应答的关系:新生儿IL-6水平按M分为IL-6水平≤1 112.0 pg/ml组和IL-6水平>1 112.0 pg/ml组,87例婴儿中34.5%(30/87)为乙肝疫苗无/弱应答者,65.5%(57/87)为强应答者。IL-6水平>1 112.0 pg/ml组无/弱应答发生率为0.0%,低于IL-6水平≤1 112.0 pg/ml组的65.2%(P<0.001)。且IL-6水平>1 112.0 pg/ml的新生儿发生乙肝疫苗无/弱应答的风险比IL-6水平≤1 112.0 pg/ml新生儿下降了61.4%(OR=0.386,95%CI:0.266~0.561,P<0.001)。见表 5。
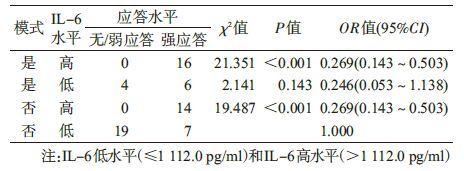
6. 综合分析新生儿“HBeAg+抗-HBe+”模式和IL-6水平对婴儿乙肝疫苗无/弱应答的影响:新生儿IL-6水平按M分为IL-6低水平(≤1 112.0 pg/ml)和IL-6高水平(>1 112.0 pg/ml)。以新生儿模式11(“HBeAg+抗-HBe+”是与否)分层,显示乙肝疫苗无/弱应答率呈现IL-6高水平者低于IL-6低水平者(OR=0.269,95%CI:0.143~0.503,P<0.001);以IL-6水平(高、低)分层,显示“HBeAg+抗-HBe+”模式与乙肝疫苗无/弱应答无关(OR=0.246,95%CI:0.053~1.138,P=0.143)。见表 6。
HBV血清学模式复杂多样,且HBsAg阳性孕产妇HBV血清学模式与新生儿HBV血清学模式存在一定关联。2007年王健等[4]研究显示孕产妇HBV血清学模式以“小三阳”模式多见,占孕产妇感染总数的36.0%(95/264);其次为“HBsAg+”模式和“大三阳”模式。而本研究结果显示,HBsAg阳性孕产妇HBV血清学模式以“HBsAg+”模式多见,占孕产妇总数的47.4%;而传染性较强的“大三阳”和“小三阳”模式均较少见。这可能与HBsAg阳性孕产妇抗病毒治疗有关,提示孕产妇阻断HBV母婴传播的意识有所提高。由于抗-HBe检出多数是在HBeAg转阴后,通常HBeAg和抗-HBe同时检出较少见,而本研究显示HBsAg阳性孕产妇的新生儿“HBeAg+抗-HBe+”模式所占比例较大,且HBsAg阳性孕产妇“HBsAg+HBeAg+抗-HBe+”模式下其新生儿HBV血清学模式以“HBeAg+抗-HBe+”模式多见。这可能是由于孕产妇HBeAg和抗-HBe通过胎盘传递给新生儿,也可能是由于机体自身的免疫作用使其HBV感染向康复方向发展。
本研究中227例HBsAg阳性孕产妇婴儿乙肝疫苗无/弱应答率为17.2%,高于我国一般人群乙肝疫苗无/弱应答率。这可能是由于这些婴儿在生命早期长期处于孕产妇HBV感染的生物环境因素中,使其自身免疫功能不同于一般人群所致。同时,本研究HBsAg阳性孕产妇的婴儿乙肝疫苗无/弱应答率低于国内其他相关研究的27.4%~30.2%[2-3],这可能与所选研究对象自身免疫功能的差异等诸多原因造成的。HBV血清学模式能反映HBV感染状况,也能反映机体对入侵的HBV产生免疫应答的能力[4-5, 10];且新生儿HBV感染会影响新生儿的免疫功能[7],故推测具有不同HBV血清学模式的新生儿对乙肝疫苗的免疫应答效果不同。本研究也显示,不同HBV血清学模式的新生儿对乙肝疫苗的免疫应答反应不同,且新生儿“HBeAg+抗-HBe+”模式下乙肝疫苗无/弱应答发生率最低。提示新生儿HBeAg和抗-HBe阳性可能会通过影响新生儿免疫功能来提高乙肝疫苗免疫应答能力。
TLR3作为连接机体天然免疫和获得性免疫的纽带,能特异性识别HBV复制的中间产物,随后TLR3信号通路被活化,进而促进其下游效应T淋巴细胞以及IL-6、IL-8、IL-12和IFN-γ等细胞因子表达增多,从而发挥免疫调节的作用[11-14]。虽然本研究新生儿4种主要HBV血清学模式下新生儿及婴儿PBMC TLR3蛋白表达量差异无统计学意义,但是TLR3信号通路相关的婴儿CD4+ T淋巴细胞和CD8+ T淋巴细胞及新生儿、婴儿的IL-6水平差异有统计学意义。由于CD4+ T淋巴细胞和CD8+ T淋巴细胞是主要抗HBV感染的免疫细胞[15-16],推测不同HBV血清学模式的婴儿其清除病毒的能力可能不同。但本研究未显示婴儿CD4+ T淋巴细胞及CD8+ T淋巴细胞数量与抗-HBs水平存在相关性。本研究显示“HBeAg+抗-HBe+”模式下新生儿IL-6水平高于“HBVM-”模式,提示新生儿HBeAg和抗-HBe阳性可促进IL-6的产生。进一步研究显示新生儿及婴儿的IL-6水平与抗-HBs呈正相关,即随着IL-6水平的升高,婴儿抗-HBs水平随之升高;且血清IL-6水平>1 112.0 pg/ml的新生儿发生乙肝疫苗无/弱应答的风险比IL-6水平≤1 112.0 pg/ml新生儿下降了61.4%。提示乙肝疫苗接种者体内IL-6高水平可能与强应答的发生有关,与孔令斌等[17]的研究一致。由于Th2型细胞因子IL-6是机体免疫调节网络中的一个关键因子,其可活化B淋巴细胞,并调节B淋巴细胞的增殖、分化,从而影响机体的免疫功能[18]。提示IL-6可能是通过促进B淋巴细胞的成熟来增加抗-HBs水平的产生。综合分析显示,新生儿“HBeAg+抗-HBe+”模式与婴儿乙肝疫苗无/弱应答无直接关系,推测 “HBeAg+抗-HBe+”模式下婴儿乙肝疫苗无/弱应答率低是由于该模式能够促进IL-6分泌而起作用的。
综上所述,HBsAg阳性孕产妇HBV血清学模式与其新生儿HBV血清学模式存在关联;IL-6高水平者的乙肝疫苗无/弱应答发生率较低,且新生儿HBeAg和抗-HBe阳性可能通过促进IL-6分泌来增强婴儿乙肝疫苗免疫应答。因此,IL-6可能作为乙肝疫苗佐剂来降低这一特殊人群的乙肝疫苗无/弱应答发生率。由于本研究HBsAg阳性孕产妇新生儿的例数较少,难以全面反映这一特殊人群的真实情况,希望能增大样本量进一步深入地探讨。
| [1] | 王富珍, 郑徽, 张国民, 等. 8个省(自治区)乙型肝炎病毒表面抗原阳性产妇筛查及新生儿免疫预防措施的调查[J]. 中国疫苗和免疫 , 2014, 20 (6) : 523–528 Wang FZ, Zheng H, Zhang GM, et al. Survey on hepatitis B virus surface antigen screening among pregnant women and prevention measuers for newborns in 8 provines or autonomous region,China[J]. Chin J Vaccines Immun , 2014, 20 (6) : 523–528 |
| [2] | 王静, 冯玉岭, 刘明晖, 等. HBsAg阳性母亲所生婴儿联合免疫后乙型肝炎表面抗体的动态变化[J]. 中华肝脏病杂志 , 2013, 21 (8) : 580–583 DOI:10.3760/cma.j.issn.1007-3418.2013.08.005 Wang J, Feng YL, Liu MH, et al. Combined immunoprophylaxis induces changes in anti-hepatitis B surface protein titer in infants born to mothers with positivity for hepatitis B surface antigen[J]. Chin J Hepatol , 2013, 21 (8) : 580–583 DOI:10.3760/cma.j.issn.1007-3418.2013.08.005 |
| [3] | 唐洁, 许联红, 陈洁, 等. 新生儿免疫预防乙型肝炎病毒母婴传播的效果及传播易患因素分析[J]. 中国妇幼保健 , 2014, 29 (21) : 3427–3430 DOI:10.7620/zgfybj.j.issn.1001-4411.2014.21.24 Tang J, Xu LH, Chen J, et al. Effect of neonatal immunoprophylaxis in mother-to-fetus transmission of HBV and analysis on risk factors for transmission[J]. Matern Child Health Care China , 2014, 29 (21) : 3427–3430 DOI:10.7620/zgfybj.j.issn.1001-4411.2014.21.24 |
| [4] | 王健, 孙琳, 侯稳. 孕妇HBV感染模式与宫内感染关系的临床研究[J]. 中国计划生育学杂志 , 2007, 15 (4) : 223–226 DOI:10.3969/j.issn.1004-8189.2007.04.015 Wang J, Sun L, Hou W. Relationship of the modes of hepatitis B virus marker in pregnant women with intrauterine infection[J]. Chin J Fam Plan , 2007, 15 (4) : 223–226 DOI:10.3969/j.issn.1004-8189.2007.04.015 |
| [5] | 苑妹, 王青. 不同乙肝五项模式乙型肝炎患者血清HBV-DNA检验结果及其意义[J]. 医学检验与临床 , 2008, 19 (5) : 62–63 DOI:10.3969/j.issn.1673-5013.2008.05.025 Yuan M, Wang Q. Serum HBV-DNA detection results and signifcant in different five items of HBV model patients[J]. Med Lab Sci Clin , 2008, 19 (5) : 62–63 DOI:10.3969/j.issn.1673-5013.2008.05.025 |
| [6] | Goenka A, Kollmann TR. Development of immunity in early life[J]. J Infect , 2015, 71 (Suppl 1) : S112–120 DOI:10.1016/j.jinf.2015.04.027 |
| [7] | Hong M, Sandalova E, Low D, et al. Trained immunity in newborn infants of HBV-infected mothers[J]. Nat Commun , 2015, 6 : 6588 DOI:10.1038/ncomms7588 |
| [8] | Bracciale L, Fabbiani M, Sansoni A, et al. Impact of hepatitis B vaccination in children born to HBsAg-positive mothers:a 20-year retrospective study[J]. Infection , 2009, 37 (4) : 340–343 DOI:10.1007/s15010-008-8252-3 |
| [9] | Zou HB, Chen Y, Duan ZP, et al. Protective effect of hepatitis B vaccine combined with two-dose hepatitis B immunoglobulin on infants born to HBsAg-positive mothers[J]. PLoS One , 2011, 6 (10) : e26748 DOI:10.1371/journal.pone.0026748 |
| [10] | 李文郎, 刘卫东, 吴爱成, 等. 不同HBV感染模式产妇血清及乳汁HBV-DNA检测结果分析[J]. 国际检验医学杂志 , 2013, 34 (4) : 400–401 DOI:10.3969/j.issn.1673-4130.2013.04.007 Li WL, Liu WD, Wu AC, et al. HBV-DNA level analysis in serum and breast milk of puerpera with different HBV infection modes[J]. Int J Lab Med , 2013, 34 (4) : 400–401 DOI:10.3969/j.issn.1673-4130.2013.04.007 |
| [11] | Karimi-Googheri M, Arababadi MK. TLR3 plays significant roles against hepatitis B virus[J]. Mol Biol Rep , 2014, 41 (5) : 3279–3286 DOI:10.1007/s11033-014-3190-x |
| [12] | Rong YH, Song HH, You SL, et al. Association of Toll-like receptor 3 polymorphisms with chronic hepatitis B and hepatitis B-related acute-on-chronic liver failure[J]. Inflammation , 2013, 36 (2) : 413–418 DOI:10.1007/s10753-012-9560-4 |
| [13] | Isogawa M, Robek MD, Furuichi Y, et al. Toll-like receptor signaling inhibits hepatitis B virus replication in vivo[J]. J Virol , 2005, 79 (11) : 7269–7272 DOI:10.1128/JVI.79.11.7269-7272.2005 |
| [14] | Zhang SY, Herman M, Ciancanelli MJ, et al. TLR3 immunity to infection in mice and humans[J]. Curr Opin Immunol , 2013, 25 (1) : 19–33 DOI:10.1016/j.coi.2012.11.001 |
| [15] | Dinney CM, Zhao LD, Conrad CD, et al. Regulation of HBV-specific CD8+ T cell-mediated inflammation is diversified in different clinical presentations of HBV infection[J]. J Microbiol , 2015, 53 (10) : 718–724 DOI:10.1007/s12275-015-5314-y |
| [16] | TrehanPati N, Geffers R, Sukriti, et al. Gene expression signatures of peripheral CD4+ T cells clearly discriminate between patients with acute and chronic hepatitis B infection[J]. Hepatology , 2009, 49 (3) : 781–790 DOI:10.1002/hep.22696 |
| [17] | 孔令斌, 安锐, 林立, 等. 乙肝疫苗接种后无弱应答者发生的分子生物学机制[J]. 济宁医学院学报 , 2007, 30 (1) : 13–16 DOI:10.3969/j.issn.1000-9760.2007.01.003 Kong LB, An R, Lin L, et al. Study on Molecular Biology Mechanism of Non-and-Hyporesponder After Hepatitis B Vaccination[J]. J Jining Med Coll , 2007, 30 (1) : 13–16 DOI:10.3969/j.issn.1000-9760.2007.01.003 |
| [18] | Hösel M, Quasdorff M, Wiegmann K, et al. Not interferon,but interleukin-6 controls early gene expression in hepatitis B virus infection[J]. Hepatology , 2009, 50 (6) : 1773–1782 DOI:10.1002/hep.23226 |
 2016, Vol. 37
2016, Vol. 37