文章信息
- 何文刚, 赵骏, 黄守杰, 吴婷.
- He Wengang, Zhao Jun, Huang Shoujie, Wu Ting.
- 重组人乳头瘤病毒疫苗临床评价研究进展
- Research progress regarding the clinical evaluation on recombinant human papillomavirus vaccines
- 中华流行病学杂志, 2016, 37(6): 904-908
- Chinese Journal of Epidemiology, 2016, 37(6): 904-908
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2016.06.033
-
文章历史
- 投稿日期:2015-10-26
HPV能引起人体黏膜和皮肤鳞状上皮增殖,据其嗜组织性可分为黏膜类和皮肤类,又据与恶性肿瘤尤其是宫颈癌的相关性,前者又被分为高危型和低危型。国际癌症研究院(IARC)将HPV16、18、31、33、35、39、45、51、52、56、58和59共12个型别定为1级致癌物(确定致癌),68型为2A级致癌物(很可能致癌),这13个型别均属于高危型HPV[1],与99%以上宫颈癌、90%肛门癌、40%外阴癌或阴道癌、40%阴茎癌、12%口咽癌及部分其他黏膜部位恶性肿瘤密切相关[2]。其中约70%的宫颈癌是由HPV16、18型感染所致[3],另外5型(31、33、45、52、58)可导致约90%的宫颈癌[4]。而低危型如HPV6、11等型别感染可导致超过90%的尖锐湿疣[5]。
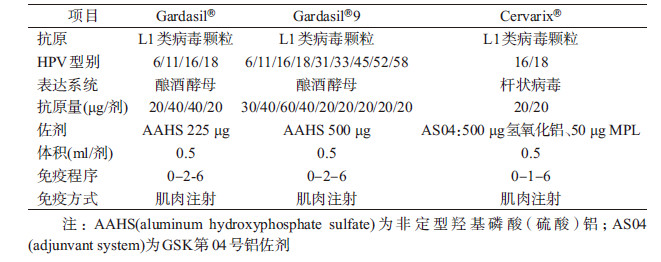
目前全球已有3种HPV疫苗上市销售,均为重组L1类病毒颗粒(virus-like particle)基因工程疫苗,分别是默沙东公司(Merck)的Gardasil®四价疫苗、Gardasil®9九价疫苗和葛兰素史克公司(GSK)的Cervarix®二价疫苗(表 1)。其中由默沙东公司于2006年研发的Gardasil®四价疫苗(HPV6/11/16/18型)首次被批准用于预防宫颈癌、宫颈癌癌前病变和生殖器疣,其第二代Gardasil®9九价疫苗(HPV6/11/16/18/31/33/45/52/58型)也于2014年获得批准上市,该疫苗增加了引起约20%宫颈癌的其他5种高危型别,使得其可预防约90%的宫颈癌[6]。葛兰素史克公司研发的Cervarix®二价疫苗(HPV16/18型)于2007年上市,可用于预防宫颈癌及其癌前病变,但不能预防尖锐湿疣。Cervarix®采用了全新的佐剂AS04,该佐剂与传统铝佐剂的最大不同在于其含有Toll样受体4(TLR-4)激动剂3-去酰基脂质A(MPL),可刺激产生大量IP-10,对单核细胞、NK细胞产生化学吸附作用,同时MPL能促进CD4+ T淋巴细胞分泌IFN-γ,具有很强的佐剂效应[7]。
1. HPV疫苗的有效性:
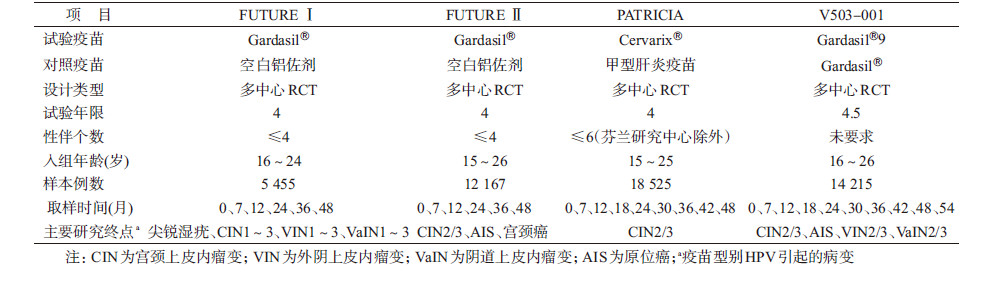
(1)15~26岁女性人群:HPV疫苗的有效性数据主要来自Ⅲ期临床试验,包括对相应型别HPV持续性感染及其相关疾病的保护效果。有效性分析主要在符合方案集(per-protocol set,PPS)中进行。Gardasil®、Cervarix®、Gardasil®9疫苗的Ⅲ期临床试验均采用随机双盲对照设计,选取有性行为的年轻女性为受试对象,但在临床终点选择、受试对象入选与排除标准、种群异质性以及具体实施细节等方面均有所不同(表 2),因此直接比较不同临床试验的观察结果时需慎重。
Gardasil®两项Ⅲ期临床试验中,FUTURE Ⅰ以疫苗相关型别HPV感染所致外生殖器、阴道、宫颈等部位疾病为病例终点。共入组5 455名女性,在随访48个月内,PPS中疫苗组未出现终点病例,而对照组有60例[8]。FUTURE Ⅱ则以HPV16/18感染所致宫颈高度病变包括CIN2/3、原位腺癌(AIS)、宫颈癌为病例终点。共入组12 167名女性,在随访期限内,PPS中疫苗组出现1例CIN3,而对照组终点病例数为42[9]。综合FUTURE Ⅰ、FUTURE Ⅱ结果,PPS中Gardasil®对尖锐湿疣、外阴或阴道上皮内瘤变2级及以上(VIN2+/VaIN2+)、CIN2、CIN3、AIS保护效果分别为100%(95%CI:94%~100%)、100%(95%CI:88%~100%)、100%(95%CI:95%~100%)、97%(95%CI:88%~100%)、100%(95%CI:31%~100%)。意向性治疗(intention to treat,ITT)集由于纳入了在基线状态已感染疫苗型别HPV的女性,且部分研究对象未能全程接种,导致在ITT数据集保护效果有不同程度下降,Gardasil®对尖锐湿疣、VIN2+/VaIN2+、CIN2、CIN3、AIS保护效果分别为80%(95%CI:73%~85%)、79%(95%CI:55%~91%)、55%(95%CI:41%~66%)、45%(95%CI:30%~57%)、60%(95%CI:0~87%)[10]。
Cervarix®Ⅲ期临床试验(PATRICIA)以HPV16、18感染所致CIN2+为主要终点,HPV16、18持续性感染为次要终点。PATRICIA共入组18 525名女性,随访期内PPS中疫苗对CIN2+的保护效果为98.1%(95%CI:88.4%~100.0%)、对CIN3+保护效果为100.0%(95%CI:36.49%~100.0%)、对≥6个月持续性感染保护效果为94.3%(95%CI:91.5%~96.3%)、对≥12个月持续性感染保护效果为91.4%(95%CI:86.1%~95.0%)。在ITT集中,Cervarix®对CIN2+、CIN3+保护效果分别为60.7%(95%CI:49.6%~69.5%)、45.7%(95%CI:22.9%~62.2%)[11]。
Gardasil®9Ⅲ期临床试验(V503-001)以疫苗相关型别HPV感染所致宫颈、外阴、阴道部位高度病变为主要病例终点,疫苗相关型别HPV持续性感染为次要终点。V503-001共入组14 215人,出于伦理考虑选择Gardasil®作为对照疫苗。Gardasil®9是通过与Gardasil®进行免疫原性的非劣效性[其统计学定义为抗体几何平均滴度(GMT)比值的95%CI下限大于事先规定界值,在Gardasil®9Ⅲ期临床试验中界值为0.67,在下文其他研究中非劣效性比较界值为0.5]比较,判断对HPV6、11、16、18型致相关病变的保护性。在接种完3针次疫苗后1个月,Gardasil®9与Gardasil®诱导的HPV6、11、16、18抗体滴度比值分别为1.02(95%CI:0.99~1.06)、0.80(95%CI:0.77~0.83)、0.99(95%CI:0.96~1.03)、1.19(95%CI:1.14~1.23)[6]。Gardasil®9对新增5型HPV的保护效果主要通过比较PPS中疫苗组与对照组出现的由该5种亚型引起的宫颈、外阴、阴道部位高度病变发病率的差异来判定。在随访48个月内PPS中疫苗对HPV31、33、45、52、58感染相关的主要终点保护效果高达96.7%(95%CI:80.9%~99.8%),≥6个月持续性感染保护效果为96.0%(95%CI:94.4%~97.2%)[6]。
目前数据显示Gardasil®对疫苗相关型别HPV感染及引起的宫颈病变的保护期至少为6年[12],而Cervarix®至少为9.4年[13]。
(2)24~45岁女性人群:虽然初次性生活后5~10年是HPV感染的高峰期,但>25岁女性仍存在较大的感染风险[14],有研究发现相对年轻女性,年长女性HPV持续性感染的清除时间更长[15, 16]。Muñoz等[17]的一项对24~45岁女性人群随访2.2年的临床试验显示,Gardasil®对HPV16、18持续性感染或疾病保护效果,在PPS(n=3 251)中达到83.1%(95%CI:50.6%~95.8%),在ITT集(n=3 769)中为30.9%(95%CI:11.1%~46.5%),验证了Gardasil®对疫苗相关型别HPV持续性感染或宫颈及外生殖器病变具有保护作用;随访4年内PPS中疫苗保护效果达到88.7%(95%CI:78.1%~94.8%)[18]。再对PPS疫苗组中684名研究对象进行2年随访,在第4~6年内未出现与疫苗型别HPV感染相关的CIN或外生殖器病变[12]。26~45岁女性接种3针次Cervarix®后1个月HPV16、18抗体均阳转,GMT虽低于15~25岁女性,但仍数倍于自然感染水平[19]。大多数成年女性仅感染过一种疫苗相关型别HPV,接种疫苗后仍可通过预防其他疫苗型别HPV感染而受益[9]。
(3)9~15岁女性人群的保护性(桥接试验):初次性生活后的5年是HPV感染的高风险期[20],因此对尚未开始性生活的少女进行预防接种的成本效益最高。从伦理考虑,不宜对未成年女性进行妇科检查,因此采用桥接试验设计,通过比较疫苗在未成年女性中的免疫原性是否非劣效于15~25岁成年女性以验证未成年女性接种疫苗的有效性。
426名9~15岁未成年女性接种3针次Gardasil®后,与16~23岁女性相比7个月时HPV6、11、16、18的GMT比值分别为1.67(95%CI:1.46~1.91)、1.73(95%CI:1.50~2.00)、1.84(95%CI:1.54~2.20)、2.02(95%CI:1.71~2.39)[21]。10~14岁女性接种3针次Cervarix®后,产生的抗体滴度为15~25岁女性的2.1~2.5倍[22]。
接种2针免疫程序不仅能降低接种费用,且能提高依从性,扩大免疫覆盖率。在Romanowski等[23]的一项研究中,对9~14岁基线时抗体阴性女性按“0-6”程序接种Cervarix®,7个月时HPV16、18的IgG抗体滴度与15~25岁女性按“0-1-6”标准免疫程序相比,GMT比值分别为1.08(95%CI:0.78~1.47)、1.30(95%CI:0.99~1.69)。在48个月时,GMT比值分别为0.93(95%CI:0.68~1.28)、0.90(95%CI:0.63~1.28);在60个月时,GMT比值分别为1.13(95%CI:0.82~1.54)、1.06(95%CI:0.74~1.51)[23]。提示9~14岁女性接种2针后的免疫原性非劣效于15~25岁女性接种3针后的免疫原性。2013年12月欧洲药品管理局(EMA)正式批准Cervarix®在9~14岁女性人群中按“0-6”免疫程序接种。
Merck随后开展了9~13岁女性接种2针次Gardasil®疫苗的免疫原性和安全性研究。该人群按“0-6”程序接种后在7个月时HPV16、18抗体滴度与16~26岁女性按“0-2-6”标准免疫程序相比,GMT比值分别为2.09(95%CI:1.61~2.71)、1.83(95%CI:1.46~2.29)。在随访的36个月内,除24个月时9~13岁女性HPV18的GMT值劣效于16~26岁女性外,其余时间点HPV16/18 的GMT值均非劣效[24]。2014年2月欧洲人用药品委员会(CHMP)批准9~13岁女性按“0-6”或“0-1-6”程序接种Gardasil®。
(4)有效减少CIN2+患者手术后复发:CIN患者术后10~20年内,肿瘤复发风险是普通人群的3~12倍[25]。利普刀治疗是CIN2+患者常用的一种保守性的诊断和治疗方法[26],术后残留率和复发率为5%~30%[27, 28]。Kang等[29]的一项前瞻性研究将利普刀治疗后的737名CIN2/3病例分为两组,一组接种Gardasil®(n=360),一组不干预(n=377),进行为期2年随访。期间疫苗组、对照组分别有2.5%、8.5%观察对象出现HPV16/18感染相关的复发性疾病,复发率降低了71%(χ2=6.878,P=0.008)。在另一项对FUTURE Ⅰ、FUTURE Ⅱ基线时存在病变受试者(n=1 350)进行的回顾性分析中发现,在术后的受试者中,疫苗组与对照组相比,疫苗相关型别所致疾病发生率降低79%(95%CI:49%~93%),任一型别所致CIN2+发生率降低65%(95%CI:20%~86%)[30]。
(5)对HPV其他型别的交叉保护:除16、18型外,其余11种高危型HPV引起了约30%的宫颈癌[31]。在Ⅲ期临床试验中Gardasil®和Cervarix®也显示对其他高危型别HPV感染及其所致疾病有一定预防作用。在PATRICIA中,Cervarix®对HPV31、33、45、51持续性感染保护效果分别为77.1%(95%CI:67.2%~84.4%)、43.1%(95%CI:19.3%~60.2%)、79.0%(95%CI:61.3%~89.4%)、25.5%(95%CI:12.0%~37.0%)[32]。Gardasil®在FUTURE Ⅱ中,显示出只对HPV31持续性感染有交叉保护作用,为46.2%(95%CI:15.3%~66.4%)。两疫苗交叉保护差异可能与疫苗诱导产生的抗体滴度不同有关[33]。Gardasil®和Cervarix®交叉保护期限并未明确,但接种Cervarix®后的3年内,对HPV31、45一过性感染的保护效果接近100%[11],第3~6年间保护效果分别降至59.8%(95%CI:20.5%~80.7%)、77.7%(95%CI:39.3%~93.4%)[34]。
(6)成年女性人群接种<3针次的有效保护作用:简化免疫程序始终是疫苗研究的方向之一。Kreimer等[35]新近开展的PATICA及另一项大规模Ⅲ期临床试验表明,成年人群接种2针次乃至1针次HPV疫苗的保护效果[36]。基线HPV16/18 DNA阴性女性接种一针次Cervarix®后,对HPV16/18一过性感染保护效果为85.7%(95%CI:70.7%~93.7%),并不低于2针次(76.0%,95%CI:62.0%~85.3%)、3针次(77.0%,95%CI:74.7%~79.1%)保护效果。以≥6个月持续性HPV16/18感染为分析指标,也能得出相同结论[1~3针次保护效果分别为100.0%(95%CI:41.1%~100.0%)、83.7%(95%CI:53.7%~97.5%)、92.6%(95%CI:89.2%~95.1%)]。1针次Cervarix®对HPV31/33/45不具备交叉保护作用,而间隔期限为6个月的2针次Cervarix®的交叉保护作用并不低于3针次。该项研究为简化成年人免疫程序提供了新思路[37],但由于该研究中不同针次组受试者未经过随机分配,且1针次组样本量较小,致使该项研究结果并不能从根本上改变当前官方推荐的成年人群免疫程序。
2. HPV疫苗的安全性:Gardasil®与Cervarix®均具有良好的安全性。常见的局部不良反应为接种部位疼痛、肿胀及全身不良反应(发热、恶心等)。疫苗组与对照组不良反应的发生情况相似,大部分不良反应症状轻微,持续时间短暂,无需医疗干预即可痊愈。疫苗上市后监测显示常见的不良反应为接种部位疼痛及头晕、头痛,且发生率并不高于其他种类疫苗,但其中头晕和静脉栓塞略高于既往水平,是否与疫苗接种有关还有待研究[38, 39]。2014年WHO全球疫苗咨询委员会(GACVS)系统审阅有关HPV疫苗安全性数据,特别是自身免疫性疾病(如多发性硬化症)、吉兰-巴雷综合征(GBS)、痉挛、中风、静脉栓塞、过敏等,再次确认了HPV疫苗的安全性[40]。GACVS特别审查了日本报告的24例接种后出现慢性全身疼痛者,认为尚不能确认其与疫苗接种的相关性[41]。国际妇产科联盟(FIGO)审查了现有数据后,也支持HPV疫苗在适用人群中持续使用[42]。
育龄期女性接种HPV疫苗后的安全性一直备受关注。Panagiotou等[43]在Cervarix®的一项Ⅲ期临床试验基础上,随访疫苗组(n=3 727)和对照组(n=3 739),同时观察2 836名普通人群(未接种Cervarix®或为对照接种甲型肝炎疫苗)在随访期内是否妊娠及妊娠结局。结果显示与非HPV疫苗组相比,疫苗组妇女在接种后90 d内怀孕流产的RR=1.02(95%CI:0.78~1.34)。对妊娠年龄、接种年龄等混杂因素标化后,各组的差异无统计学意义。Baril等[44]在英国一项队列研究中,将接种前30 d或接种后45 d内怀孕者归为暴露组(n=207),将接种后4~12个月内怀孕者归为非暴露组(n=632),分析发现暴露组与非暴露组自然流产发生率分别为11.6%(24/207)和9.0%(57/632)。研究期限内共出生557名新生儿,两组新生儿的阿普加评分、出生缺陷率的差异均无统计学意义。暴露组妊娠年龄低于非暴露组,对年龄进行标化后,自然流产率风险比为HR=1.11(95%CI:0.64~1.91)。GACVS亦审查了HPV疫苗免疫后妊娠数据,认为可能无影响[40]。
3. 展望:目前全球已有179个国家应用HPV疫苗[45]。WHO、欧洲疾病预防控制中心(ECDC)、美国疾病控制预防中心免疫咨询委员会(ACIP)均建议将未成年女性HPV疫苗接种纳入国家免疫规划[46]。已有80余个国家采纳此建议[47]。鉴于HPV疫苗在未发生性行为女性中保护效果最好,且在小年龄人群中能产生更高抗体滴度,2014年发布的WHO立场性文件中建议:HPV疫苗接种主要目标人群为9~13岁未成年女性,次要目标人群为>13岁未成年和年轻成年女性。推荐<15岁女性按“0-6”免疫程序,≥15岁女性则按标准免疫程序接种3针次疫苗。在不占用主要目标人群HPV疫苗接种资源、不影响正常宫颈筛查计划、接种疫苗后成本效益比高的前提下,鼓励次要目标人群接种[48]。
HPV疫苗接种社会效益与接种率密切相关。澳大利亚、南非、卢旺达、尼泊尔、丹麦等国家3针次HPV疫苗接种率高达70%~99%,西班牙、苏格兰等国家和地区2针次接种率达到88%~90%,但大多数国家低于50%[49]。HPV疫苗高接种率国家已受益明显,如丹麦2006年对女性开展HPV疫苗接种后,2007-2010年女性人群尖锐湿疣发病率每年降低3.1%。2009年后20~29岁女性人群尖锐湿疣发生率每年降低13.1%~14.7%,而男性发病率却呈持续上升趋势[49]。有文献报道以学校为基础的常规免疫计划是提高HPV疫苗接种覆盖率、降低成本费用最有效方式[50]。除此之外,提高家长及少女对HPV疫苗认知度也是可行方法之一。
利益冲突 无| [1] Combes JD,Guan P,Franceschi S,et al. Judging the carcinogenicity of rare human papillomavirus types[J]. Int J Cancer,2015,136(3):740-742. DOI:10.1002/ijc.29019. |
| [2] Parkin DM,Bray F. Chapter 2:the burden of HPV-related cancers[J]. Vaccine,2006,24 Suppl 3:S3/11-25. DOI:10.1016/j.vaccine.2006.05.111. |
| [3] Muñoz N,Bosch FX,De Sanjosé S,et al. Epidemiologic classification of human papillomavirus types associated with cervical cancer[J]. N Engl J Med,2003,348(6):518-527. DOI:10.1056/NEJMoa021641. |
| [4] Serrano B,Alemany L,Tous S,et al. Potential impact of a nine-valent vaccine in human papillomavirus related cervical disease[J]. Infect Agents Cancer,2012,7(1):38. DOI:10.1186/1750-9378-7-38. |
| [5] Godinez JM,Nicolas-Parraga S,Pimenoff VN,et al. Phylogenetically related,clinically different:human papillomaviruses 6 and 11 variants distribution in genital warts and in laryngeal papillomatosis[J]. Clin Microbiol Infect,2014,20(6):406-413. DOI:10.1111/1469-0691.12420. |
| [6] Joura EA,Giuliano AR,Iversen OE,et al. A 9-valent HPV vaccine against infection and intraepithelial neoplasia in women[J]. N Engl J Med,2015,372(8):711-723. DOI:10.1056/NEJMoa1405044. |
| [7] Garçon N,Wettendorff M,van Mechelen M. Role of AS04 in human papillomavirus vaccine:mode of action and clinical profile[J]. Expert Opin Biol Ther,2011,11(5):667-677. DOI:10.1517/14712598.2011.573624. |
| [8] Garland SM,Hernandez-Avila M,Wheeler CM,et al. Quadrivalent vaccine against human papillomavirus to prevent anogenital diseases[J]. N Engl J Med,2007,356(19):1928-1943. DOI:10.1056/NEJMoa061760. |
| [9] The FUTUREⅡStudy Group. Quadrivalent vaccine against human papillomavirus to prevent high-grade cervical lesions[J]. N Engl J Med,2007,356(19):1915-1927. DOI:10.1056/NEJMoa061741. |
| [10] Schiller JT,Castellsagué X,Garland SM. A review of clinical trials of human papillomavirus prophylactic vaccines[J]. Vaccine,2012,30 Suppl 5:F123-138. DOI:10.1016/j.vaccine.2012.04.108. |
| [11] Paavonen J,Naud P,Salmerón J,et al. Efficacy of human papillomavirus(HPV)-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by oncogenic HPV types(PATRICIA):final analysis of a double-blind,randomised study in young women[J]. Lancet,2009,374(9686):301-314. DOI:10.1016/s0140-6736(09)61248-4. |
| [12] Luna J,Plata M,Gonzalez M,et al. Long-term follow-up observation of the safety,immunogenicity,and effectiveness of Gardasil in adult women[J]. PLoS One,2013,8(12):e83431. DOI:10.1371/journal.pone.0083431. |
| [13] Naud PS,Roteli-Martins CM,de Carvalho NS,et al. Sustained efficacy,immunogenicity,and safety of the HPV-16/18 AS04-adjuvanted vaccine:final analysis of a long-term follow-up study up to 9.4 years post-vaccination[J]. Hum Vacc Immunotherap,2014,10(8):2147-2162. DOI:10.4161/hv.29532. |
| [14] Collins S,Mazloomzadeh S,Winter H,et al. High incidence of cervical human papillomavirus infection in women during their first sexual relationship[J]. BJOG,2002,109(1):96-98. DOI:10.1111/j.1471-0528.2002.01053.x. |
| [15] Castle PE,Schiffman M,Herrero R,et al. A prospective study of age trends in cervical human papillomavirus acquisition and persistence in Guanacaste,Costa Rica[J]. J Infect Dis,2005,191(11):1808-1816. DOI:10.1086/428779. |
| [16] Hsing AW,Schiffman M,Zhang T,et al. Persistence of type-specific human papillomavirus infection among cytologically normal women[J]. J Infect Dis,1994,170(2):498. DOI:10.1093/infdis/170.2.498. |
| [17] Muñoz N,Manalastas R Jr,Pitisuttithum P,et al. Safety,immunogenicity,and efficacy of quadrivalent human papillomavirus(types 6,11,16,18) recombinant vaccine in women aged 24-45 years:a randomised,double-blind trial[J]. Lancet,2009,373(9679):1949-1957. DOI:10.1016/s0140-6736(09)60691-7. |
| [18] Castellsagué X,Muñoz N,Pitisuttithum P,et al. End-of-study safety,immunogenicity,and efficacy of quadrivalent HPV(types 6,11,16,18) recombinant vaccine in adult women 24-45 years of age[J]. Br J Cancer,2011,105(1):28-37. DOI:10.1038/bjc.2011.185. |
| [19] Schwarz TF. An AS04-containing human papillomavirus(HPV) 16/18 vaccine for prevention of cervical cancer is immunogenic and well-tolerated in women 15-55 years old[J]. J Clin Oncol,2006,24(18 Suppl):1008. |
| [20] Qiao YL,Franceschi S,Belinson JL,et al. HPV Prevalence in Chinese women:A population-based multiple center survey in Mainland China//Abstract Book of the 24th International Papillomavirus Conference and Clinical Workshop[C]. Beijing,China:[s.n.],2007. |
| [21] Block SL,Nolan T,Sattler C,et al. Comparison of the immunogenicity and reactogenicity of a prophylactic quadrivalent human papillomavirus(types 6,11,16,and 18) L1 virus-like particle vaccine in male and female adolescents and young adult women[J]. Pediatrics,2006,118(5):2135-2145. DOI:10.1542/peds.2006-0461. |
| [22] Romanowski B,Schwarz TF,Ferguson LM,et al. Immunogenicity and safety of the HPV-16/18 AS04-adjuvanted vaccine administered as a 2-dose schedule compared with the licensed 3-dose schedule:results from a randomized study[J]. Hum Vacc,2011,7(12):1374-1386. DOI:10.4161/hv.7.12.18322. |
| [23] Romanowski B,Schwarz TF,Ferguson L,et al. Sustained immunogenicity of the HPV-16/18 AS04-adjuvanted vaccine administered as a two-dose schedule in adolescent girls:five-year clinical data and modeling predictions from a randomized study[J]. Hum Vacc Immunotherap,2016,12(1):20-29. DOI:10.1080/21645515.2015.1065363. |
| [24] Dobson SRM,Mcneil S,Dionne M,et al. Immunogenicity of 2 doses of HPV vaccine in younger adolescents vs 3 doses in young women:a randomized clinical trial[J]. JAMA,2013,309(17):1793-1802. DOI:10.1001/jama.2013.1625. |
| [25] Edgren G,Sparén P. Risk of anogenital cancer after diagnosis of cervical intraepithelial neoplasia:a prospective population-based study[J]. Lancet Oncol,2007,8(4):311-316. DOI:10.1016/s1470-2045(07)70043-8. |
| [26] Hillemanns P,Kimmig R,Dannecker C,et al. LEEP versus cold knife conization for treatment of cervical intraepithelial neoplasias[J]. Zentralbl Gynakol,2000,122(1):35-42. |
| [27] Nuovo J,Melnikow J,Willan AR,et al. Treatment outcomes for squamous intraepithelial lesions[J]. Int J Gynaecol Obstet,2000,68(1):25-33. DOI:10.1016/S0020-7292(99)00162-9. |
| [28] Holowaty P,Miller AB,Rohan T,et al. Natural history of dysplasia of the uterine cervix[J]. J Natl Cancer Inst,1999,91(3):252-258. DOI:10.1093/jnci/91.3.252. |
| [29] Kang WD,Choi HS,Kim SM. Is vaccination with quadrivalent HPV vaccine after loop electrosurgical excision procedure effective in preventing recurrence in patients with high-grade cervical intraepithelial neoplasia(CIN2-3)?[J]. Gynecol Oncol,2013,130(2):264-268. DOI:10.1016/j.ygyno.2013.04.050. |
| [30] Joura EA,Garland SM,Paavonen J,et al. Effect of the human papillomavirus(HPV) quadrivalent vaccine in a subgroup of women with cervical and vulvar disease:retrospective pooled analysis of trial data[J]. BMJ,2012,344:e1401. DOI:10.1136/bmj.e1401. |
| [31] de Sanjose S,Quint WGV,Alemany L,et al. Human papillomavirus genotype attribution in invasive cervical cancer:a retrospective cross-sectional worldwide study[J]. Lancet Oncol,2010,11(11):1048-1056. DOI:10.1016/s1470-2045(10)70230-8. |
| [32] Wheeler CM,Castellsagué X,Garland SM,et al. Cross-protective efficacy of HPV-16/18 AS04-adjuvanted vaccine against cervical infection and precancer caused by non-vaccine oncogenic HPV types:4-year end-of-study analysis of the randomised,double-blind PATRICIA trial[J]. Lancet Oncol,2012,13(1):100-110. DOI:10.1016/s1470-2045(11)70287-x. |
| [33] Herrero R,González P,Markowitz LE. Present status of human papillomavirus vaccine development and implementation[J]. Lancet Oncol,2015,16(5):e206-216. DOI:10.1016/s1470-2045(14)70481-4. |
| [34] Romanowski B,de Borba PC,Naud PS,et al. Sustained efficacy and immunogenicity of the human papillomavirus(HPV)-16/18 AS04-adjuvanted vaccine:analysis of a randomised placebo-controlled trial up to 6.4 years[J]. Lancet,2009,374(9706):1975-1985. DOI:10.1016/s0140-6736(09)61567-1. |
| [35] Kreimer AR,Struyf F,Del Rosario-Raymundo MR,et al. Efficacy of fewer than three doses of an HPV-16/18 AS04-adjuvanted vaccine:combined analysis of data from the Costa Rica Vaccine and PATRICIA trials[J]. Lancet Oncol,2015,16(7):775-786. DOI:10.1016/s1470-2045(15)00047-9. |
| [36] Herrero R,Wacholder S,Rodríguez AC,et al. Prevention of persistent human papillomavirus infection by an HPV16/18 vaccine:a community-based randomized clinical trial in Guanacaste,Costa Rica[J]. Cancer Discov,2011,1(5):408-419. DOI:10.1158/2159-8290.cd-11-0131. |
| [37] Brotherton JML. Could one dose of bivalent HPV vaccine prevent cervical cancer?[J]. Lancet Oncol,2015,16(7):739-740. DOI:10.1016/s1470-2045(15)00046-7. |
| [38] Angelo MG,Zima J,Tavares Da Silva F,et al. Post-licensure safety surveillance for human papillomavirus-16/18-AS04-adjuvanted vaccine:more than 4 years of experience[J]. Pharmacoepidemiol Drug Safety,2014,23(5):456-465. DOI:10.1002/pds.3593. |
| [39] Slade BA,Leidel L,Vellozzi C,et al. Postlicensure safety surveillance for quadrivalent human papillomavirus recombinant vaccine[J]. JAMA,2009,302(7):750-757. DOI:10.1001/jama.2009.1201. |
| [40] World Health Organisation. Weekly epidemiological record:relevé épidémiologique hebdomadaire[M]. Geneve:World Health Organization,2014. |
| [41] Hanley SJB,Yoshioka E,Ito Y,et al. HPV vaccination crisis in Japan[J]. Lancet,2015,385(9987):2571. DOI:10.1016/s0140-6736(15)61152-7. |
| [42] Scheller NM,Svanström H,Pasternak B,et al. Quadrivalent HPV vaccination and risk of multiple sclerosis and other demyelinating diseases of the central nervous system[J]. JAMA,2015,313(1):54-61. DOI:10.1001/jama.2014.16946. |
| [43] Panagiotou OA,Befano BL,Gonzalez P,et al. Effect of bivalent human papillomavirus vaccination on pregnancy outcomes:long term observational follow-up in the Costa Rica HPV Vaccine Trial[J]. BMJ,2015,351:h4358. DOI:10.1136/bmj.h4358. |
| [44] Baril L,Rosillon D,Willame C,et al. Risk of spontaneous abortion and other pregnancy outcomes in 15-25 year old women exposed to human papillomavirus-16/18 AS04-adjuvanted vaccine in the United Kingdom[J]. Vaccine,2015,33(48):6884-6891. DOI:10.1016/j.vaccine.2015.07.024. |
| [45] Jit M,Brisson M,Portnoy A,et al. Cost-effectiveness of female human papillomavirus vaccination in 179 countries:a PRIME modelling study[J]. Lancet Glob Health,2014,2(7):e406-414. DOI:10.1016/s2214-109x(14)70237-2. |
| [46] European Cervical Cancer Association. HPV vaccination across Europe[EB/OL].[2015-08-13] http://www.ecca.info/fileadmin/user_upload/HPV_Vaccination/ECCA_HPV_Vaccination_April_2009.pdf.. |
| [47] Wigle J,Fontenot HB,Zimet GD. Global delivery of human papillomavirus vaccines[J]. Pediatr Clin North Am,2016,63(1):81-95. DOI:10.1016/j.pcl.2015.08.004. |
| [48] World Health Organisation. Human papillomavirus vaccines:WHO position paper,October 2014-Recommendations[J]. Vaccine,2015,33(36):4383-4384. DOI:10.1016/j.vaccine.2014. 12.002. |
| [49] Donovan B,Franklin N,Guy R,et al. Quadrivalent human papillomavirus vaccination and trends in genital warts in Australia:analysis of national sentinel surveillance data[J]. Lancet Infect Dis,2011,11(1):39-44. DOI:10.1016/S1473-3099(10)70225-5. |
| [50] Pomfret TC,Gagnon JMJr,Gilchrist AT. Quadrivalent human papillomavirus(HPV) vaccine:a review of safety,efficacy,and pharmacoeconomics[J]. J Clin Pharm Therap,2011,36(1):1-9. DOI:10.1111/j.1365-2710.2009.01150.x. |
 2016, Vol. 37
2016, Vol. 37