文章信息
- 王静, 李瑞岐, 欧阳能勇, 郑灵燕, 区颂邦, 王文军. 2015.
- Wang Jing, Li Ruiqi, Ouyang Nengyong, Zheng Lingyan, Ou Songbang, Wang Wenjun. 2015.
- 玻璃化冷冻胚胎和新鲜胚胎移植的临床结局比较
- Comparison of clinical outcomes of vitrified-thawed embryo transfer and fresh embryos transfer
- 中华流行病学杂志, 2015, 36(2): 176-180
- Chinese Journal of Epidemiology, 2015, 36(2): 176-180
- http://dx.doi.org/10.3760/cma.j.issn.0254-6450.2015.02.017
-
文章历史
- 投稿日期:2014-08-25
胚胎的冷冻保存是辅助生育技术(assisted reproductive technology,ART)的重大进步,尤其是玻璃化冷冻技术,大大提高了解冻时胚胎的存活率,已被越来越多的生殖中心接受和运用。玻璃化冷冻技术不仅能避免胚胎浪费,减少患者反复多次促排卵和取卵的痛苦,降低治疗费用[1],且对不适宜进行新鲜胚胎移植者,是重要的治疗方案。但经过玻璃化冷冻并解冻后移植的胚胎与新鲜的胚胎相比,在临床助孕结局方面仍存在争议,且关于玻璃化冷冻胚胎安全性的文献报道较少,为此本研究回顾性分析了2013年1月至2014年3月在中山大学孙逸仙纪念医院进行体外受精-胚胎移植(IVF-ET)及其衍生技术助孕的患者共870个周期的临床资料,比较冷冻胚胎移植(FET)和新鲜胚胎移植(NET)在临床妊娠率、流产率、胎儿出生体重等方面的临床结局。 对象与方法
1. 研究对象:回顾性分析2013年1月至2014年3月在中山大学孙逸仙纪念医院因不孕症接受助孕治疗的患者临床资料。纳入标准为①因女方输卵管和/或盆腔因素不孕和/或男方因素不育而接受IVF或单精子卵细胞浆内显微注射(ICSI)助孕者;②采取黄体期长方案促排卵者。排除标准①患有子宫内膜异位症、子宫肌瘤、子宫腺肌症(子宫腺肌瘤)、卵巢肿瘤、卵巢功能不良、多囊卵巢综合症(PCOS)、高泌乳素血症、甲状腺疾病、肾上腺疾病、糖尿病、HBV携带者、染色体异常者;②女方生殖道畸形或宫腔镜检查显示宫腔畸形;③处于供精和/或供卵周期者。入组患者行NET后,若未妊娠、流产、生化妊娠,再行FET者(并为第一次冷冻复苏周期)归为FET组,仅NET(无论是否成功妊娠)且未行FET者为NET组;再将FET组分为妊娠和未妊娠2个亚组(不包括FET组中9个生化妊娠周期),进一步分析比较两亚组移植第3天胚胎(D3)和移植囊胚对FET周期临床结局的影响。采用二分类logistic回归模型筛选影响妊娠结局的因素。
2. 研究方法:
(1)促排卵方案:采用黄体中期长方案超促排卵,于前一月经周期的黄体中期给予长效达菲林(GnRHa)1.25~1.87 mg(法国博福-益普生公司)进行垂体降调节。当血E2(雌激素)<50 ng/L、LH(促黄体激素)<5 IU/L、FSH(促卵泡激素)<5 IU/L及阴道B超检测子宫内膜厚度<5 mm,表明达到降调节标准[2]。此14 d后给予促性腺激素(Gn)促卵泡发育。根据患者年龄、基础FSH(bFSH)、BMI及窦卵泡数决定Gn的剂量,给予重组人促卵泡激素(果纳芬,德国默克雪兰诺公司)150~300 IU/d。当B超监测患者有3个卵泡直径≥16 mm或2个卵泡直径≥17 mm或1个卵泡直径≥18 mm,当晚注射人绒毛膜促性腺激素(HCG)4 000~10 000 IU(中国珠海丽珠医药有限公司)。注射后34~36 h经阴道B超引导下穿刺取卵。同时男方取精(精液标本均经过密度梯度法处理[3]),根据洗涤后精液浓度和活动率决定受精方式,采取传统的IVF受精方式或ICSI方式。
(2)胚胎或囊胚评分和移植:取卵后进行授精和胚胎培养[4],根据文献标准进行胚胎评分[5],于受精后(17±1)h观察原核评估受精情况,受精后(44±1)h和(68±1)h观察胚胎卵裂以及发育情况。优质胚胎为无多原核现象;D2胚胎卵裂球数目为4~5个,卵裂球大小相对均匀,细胞碎片<5%卵裂球面积;D3胚胎卵裂球数目7~9个,卵裂球大小相对均匀形状规则,细胞质均一,细胞碎片<10%卵裂球面积。采用Gardner等[6]方法对囊胚进行评分,将D5晚期且滋养层细胞和内细胞团细胞质量均达到A级和/或B级的囊胚,即评分为3AA、3AB、3BA、3BB、4AA、4AB、4BA、4BB的囊胚视为优质囊胚。当患者年龄<35岁且为第一个治疗周期时其移植胚胎数目不超过2个,其他患者不超过3个,剩余可利用的胚胎采用玻璃化冷冻方法行冷冻保存[7],解冻后细胞存活数≥50%为可移植胚胎。
(3)黄体支持:取卵后肌肉注射黄体酮40~60 mg/d(中国浙江仙琚制药股份有限公司) ,每天用药至胚胎移植后14 d。胚胎移植后第14天查血清β-HCG,若妊娠则继续用黄体酮至妊娠第12周。移植胚胎后14 d血β-HCG升高(>25 U/L),阴道B超检查未见孕囊形成者视为生化妊娠[8];移植术后第35天B超检查,宫内有妊娠囊及胎芽可见胎心搏动则诊断为临床妊娠。流产定义为妊娠不满28周,胎儿体重<1 000 g而终止妊娠者,包括早晚期流产、异位妊娠。
(4)FET组内膜准备:所有行FET者均为月经周期内分泌正常且采用自然周期内膜准备方案者:B超监测排卵后第3天解冻移植卵裂期第3天胚胎(D3),排卵后第5天解冻移植第5~6天的囊胚。
3. 统计学分析:采用SPSS 17.0软件进行统计分析。当样本为定量资料(女性年龄、BMI、不孕年限、bFSH、bLH、bE2、HCG日E2水平、HCG日子宫内膜厚度、Gn总量、Gn总天数、卵子总数、成熟卵子数、正常受精数、正常卵裂数、正常受精率、正常卵裂率、优质胚胎数、胎儿出生体重),采用t检验,以x±s表示;当样本为定性资料(种植率、临床妊娠率、流产率、生化妊娠率),用Chi-square分析,结果以百分位数表示,其中临床妊娠率和流产率为主要观察分析指标。将所有纳入的患者进行二分类logistic回归分析(纳入指标为是否行FET、女方年龄、不孕年限、BMI、bFSH、bLH、bE2、HCG日内膜厚度、获卵数、正常受精数、正常卵裂数、优质胚胎数)。以P<0.05为差异有统计学意义。 结 果
1. 两组患者临床特征比较:两组患者平均年龄(31.78±4.47)岁,平均BMI(21.18±2.64)kg/m2。年龄、BMI、基础内分泌、HCG日子宫内膜厚度、Gn用量、Gn总天数的差异均无统计学意义,具有可比性。但FET组中女方输卵管或/和盆腔因素不孕的比例高于NET组(89.71% vs. 80.14%,P=0.003),差异有统计学意义(表 1)。870个周期包括175个冷冻胚胎移植周期(FET组),解冻胚胎574个,存活541个,复苏率为94.25%;695个新鲜胚胎移植周期(NET组)IVF周期577个,ICSI周期118个。
2. 两组患者实验室指标和临床结局比较:FET组在获卵数(13.49±5.59 vs. 11.26±5.36,P<0.001)、成熟卵子数(11.98±4.88 vs. 9.66±4.85,P<0.001)、正常受精数(9.39±4.36 vs. 7.31±4.07,P<0.001)、正常卵裂数(9.14±4.22 vs. 7.17±4.03,P<0.001)和优质胚胎数(2.53±2.62 vs. 1.96±2.20,P=0.003)方面明显高于NET组,但前者的种植率、临床妊娠率均明显低于后者(26.27% vs. 31.98%,P=0.01;47.43% vs. 65.18%,P<0.001),差异均有统计学意义。其余指标两组间的差异均无统计学意义(表 2)。
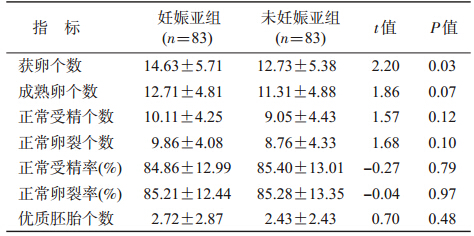
3. 亚组间一般资料和促排卵情况比较:分析FET组的妊娠亚组(83个周期)和未妊娠亚组(83个周期)发现,前者的女方年龄明显小于后者(30.69±3.37 vs. 32.00±5.09,P=0.03),但获卵数却多于后者(14.63±5.71 vs. 12.73±5.38,P=0.03),差异均有统计学意义。而HCG日E2水平(P=0.13)、成熟卵子数(P=0.07)、正常受精数(P=0.12)、正常卵裂数(P=0.10)虽然均高/多于后者,但差异无统计学意义(表 3、4)。
4. 移植D3胚胎和囊胚对FET组临床结局的影响:移植D3胚胎和移植囊胚相比,种植率明显升高(35.14% vs. 18.10%,P=0.001),FET、NET两组在临床妊娠率(52.10% vs. 37.50%,P=0.07)和流产率(8.06% vs. 4.76%,P=0.61)方面,差异均无统计学意义(表 5)。
5. 影响妊娠结局因素的二分类logistic回归分析:对二分类logistic回归模型的变量进行赋值[采用Forward Stepwise法,是否行FET冷冻胚胎移植(否=0,是=1);未妊娠=0,妊娠=1]。结果显示是否行FET(OR=0.052,95% CI:0.031~0.089,P<0.001)、女方年龄(OR=0.920,95% CI:0.886~0.955,P<0.001)、BMI(OR=0.922,95% CI:0.866~0.982,P=0.011)、优质胚胎数(OR=1.210,95% CI:1.119~1.309,P<0.001)为影响妊娠结局的因素(表 6)。
本研究采用二分类logistic回归分析显示,是否行FET、女方年龄、BMI是影响妊娠结局的危险因素。女方年龄、BMI的增加均可降低临床妊娠率,而FET组的临床妊娠发生率是NET组的0.052倍;优质胚胎数为保护因素,即优质胚胎数与妊娠率在一定程度上呈正比关系。有研究认为在辅助生育技术中,胚胎冷冻保存和解冻情况、女方年龄均可影响FET的成功率[9]。Edgar等[10]发现冷冻胚胎周期的种植能力比新鲜胚胎周期低约30%,临床妊娠率低于NET周期[11-12}。本研究同样显示FET组的种植率为26.27%,临床妊娠率为47.73%,均明显低于NET组的31.98%和65.18%,这可能与本研究中FET组纳入的输卵管或/和盆腔因素不孕者比例明显高于NET组有关(89.71% vs. 80.14%,P=0.003)。有研究表明,输卵管因素不孕患者的比例高达30%[13],输卵管炎和盆腔炎是输卵管性不孕的最常见原因[14]。此外,FET组的平均获卵数为(13.49±5.59)个、卵子成熟率为(88.64±12.14)%,均明显多/高于NET组(11.26个±5.36个,86.15%±14.04%),有研究表明获卵数为8~12 个临床妊娠率最为理想[15],获卵数超过一定的数量,卵子的发育潜能可能会受到影响,且FET组中卵子成熟率高达(88.64±12.14)%,可能存在卵子过度成熟甚至老化的现象,从而降低临床妊娠率。
Takahashi等[16]发现行FET者妊娠后,胎儿出生孕周、出生体重均与行NET后妊娠者的差异无统计学意义。本研究显示,FET组和NET组在流产率(P=0.63)、生化妊娠率(P=0.17)和胎儿出生体重(P=0.33)方面的差异均无统计学意义,表明玻璃化冷冻方法虽然在一定程度上会引起卵裂球损伤,影响胚胎质量,降低临床妊娠率,但对于胚胎干细胞而言,只要有后续的发育机会,其发育过程并不会受到影响,因此玻璃化冷冻并不增加流产和生化妊娠的风险,且不会影响出生胎儿的体重,说明对于因各种因素导致不孕,行NET而妊娠失败的患者或不适合行NET的患者,FET是相对安全的选择方案。
本研究将FET患者进一步分成亚组分析发现,妊娠亚组女方年龄为(30.69±3.37)岁,明显低于未妊娠亚组的(32.00±5.09)岁,表明女性年龄与卵巢反应和子宫容受性降低有关[17],患者年龄的增加可导致冷冻胚胎妊娠率下降[18],是影响FET成功率的重要因素之一[19]。另外,在FET周期,D3胚胎组的临床妊娠率和种植率均高于囊胚组,这可能与D3胚胎组有较多的优质胚胎而囊胚组存在较多的非优质囊胚有关。本研究D3胚胎组的流产率为8.06%,同样高于囊胚组的4.76%,可能是因为在囊胚培养的过程中,淘汰了发育潜能较低和/或存在染色体异常的胚胎,降低了胚胎的非整倍体率,因此囊胚组的流产率低于D3胚胎组[20]。
综上所述,曾经行NET未成功妊娠者,FET可降低种植率和临床妊娠率,但不增加患者妊娠后的流产率,未影响胎儿出生体重。对于符合冷冻条件的胚胎或囊胚,建议行玻璃化冷冻并挑选评分较高或质量较好的胚胎,以提高患者的临床结局。
| [1] Song ML,Xu X,Hu R,et al. Analysis on the influential factors on the pregnancy outcome of frozen embryo transfer[J]. Shandong Med J,2013,53(7):4-7. (in Chinese) 宋梦玲,徐仙,胡蓉,等. 冻融胚胎移植妊娠结局影响因素的分析[J]. 山东医药,2013,53(7):4-7. |
| [2] Chen H, Wang W, Mo Y,et al. Women with high telomerase activity in luteinised granulosa cells have a higher pregnancy rate during in vitro fertilisation treatment[J]. J Assist Reprod Genet,2011,28(9):797-807. |
| [3] Lam PM,Suen SH, Lao TT,et al. Hepatitis B infection and outcomes of in vitro fertilization and embryo transfer treatment[J]. Fertil Steril,2010,93(2):480-485. |
| [4] Zhang NF,Chen JH, Wang WJ, et al. Quantitative clinical standard of embryo selection[J]. J Sun Yat-sen Univ:Med Sci,2012,33(1):131-135. (in Chinese) 张宁锋,陈静华,王文军,等. 移植胚胎选择的量化指标[J]. 中山大学学报:医学科学版,2012,33(1):131-135. |
| [5] Alpha Scientists in Reproductive Medicine and ESHRE Special Interest Group of Embryology. The istanbul consensus workshop on embryo assessment:proceedings of an expert meeting[J]. Hum Reprod,2011,26(6):1270-1283. |
| [6] Gardner DK,Lane M,Stevens J,et al. Blastocyst score affects implantation and pregnancy outcome:towards a single blastocyst transfer[J]. Fertil Steril,2000,73(6):1155-1158. |
| [7] Huang LL,Wang WJ, Li RQ,et al. Research on the effect of vitrification with different carriers for human ovarian tissue[J]. Chin Med Herald,2012,9(35):8-10,13. (in Chinese) 黄丽丽,王文军,李瑞岐,等.采用不同载体的玻璃化冷冻对人卵巢组织冻存效果的比较研究[J].中国医药导报,2012,9(35):8-10,13. |
| [8] Troncoso C, Bosch E,Rubio C,et al. The origin of biochemical pregnancies:lessons learned from preimplantation genetic diagnosis[J]. Fertil Steril,2003,79(2):449-450. |
| [9] Selman HA,El-Danasouri I. Pregnancies derived from vitrified human zygotes[J]. Fertil Steril,2002,77(2):422-423. |
| [10] Edgar DH, Bourne H, Jericho H, et al. The developmental potential of cryopreserved human embryos[J]. Mol Cell Endocrinol,2000,169(1/2):69-72. |
| [11] Guerif F, Bidault R,Cadoret V,et al. Parameters guiding selection of best embryos for transfer after cryopreservation:a reappraisal[J]. Hum Reprod,2002,17(5):1321-1326. |
| [12] Ghobara T,Vandekerckhove P. Cycle regimens for frozen-thawed embryo transfer[J]. Cochrane Database Syst Rev,2008(1):D3414. |
| [13] Papaioannou S,Bourdrez P,Varma R,et al. Tubal evaluation in the investigation of subfertility:a structured comparison of tests[J]. BJOG,2004,111(12):1313-1321. |
| [14] Chen QL,Zeng PH,Pei L,et al. The pregnancy outcome in patients with hydrosalpingx in IVF-ET[J]. J Chongqing Med Univ,2007,32(7):697-698,738. (in Chinese) 陈巧莉,曾品鸿,裴莉,等.输卵管积液对体外受精-胚胎移植助孕妊娠结局的影响[J]. 重庆医科大学学报,2007,32(7):697- 698,738. |
| [15] Sun H, Feng Y,Chen ZJ. Effect of egg number and egg maturation on IVF-ET[J]. Reprod Contracep,2000,20(3):184- 186. (in Chinese) 孙海,冯云,陈子江.取卵数目与卵子成熟对IVF-ET的影响[J]. 生殖与避孕,2000,20(3):184-186. |
| [16] Takahashi K, Mukaida T,Goto T, et al. Perinatal outcome of blastocyst transfer with vitrification using cryoloop:a 4-year follow-up study[J]. Fertil Steril,2005,84(1):88-92. |
| [17] Lahav-Baratz S,Koifman M,Shiloh H,et al. Analyzing factors affecting the success rate of frozen-thawed embryos[J]. J Assist Reprod Genet,2003,20(11):444-448. |
| [18] Wang JX,Yap YY, Matthews CD. Frozen-thawed embryo transfer:influence of clinical factors on implantation rate and risk of multiple conception[J]. Hum Reprod,2001,16(11):2316- 2319. |
| [19] Lim AS,Ho AT,Tsakok MF. Chromosomes of oocytes failing in- vitro fertilization[J]. Hum Reprod,1995,10(10):2570-2575. |
| [20] Papanikolaou EG,Camus M,Fatemi HM,et al. Early pregnancy loss is significantly higher after day 3 single embryo transfer than after day 5 single blastocyst transfer in GnRH antagonist stimulated IVF cycles[J]. Reprod Biomed Online,2006,12(1):60-65. |
 2015, Vol. 36
2015, Vol. 36