文章信息
- 黄海龙, 朱鹏, 杨浩
- HUANG Hai-long, ZHU Peng, YANG Hao
- LAMP-LFD技术及其在生物快检方面应用
- LAMP-LFD Technology and Its Application in Rapid Detection of Biological
- 中国生物工程杂志, 2015, 35(12): 89-95
- China Biotechnology, 2015, 35(12): 89-95
- http://dx.doi.org/10.13523/j.cb.20151214
-
文章历史
- 收稿日期: 2015-07-08
- 修回日期: 2015-07-23
2. 宁波博奥生物工程有限公司 宁波 315211;
3. 中国人民解放军后勤工程学院 重庆 401331
2. Ningbo Boao Biological Engineering Co., Ltd. Ningbo 315211, China;
3. Dept of Oil Application & Management Engineering, LEU, Chongqing 401311, China
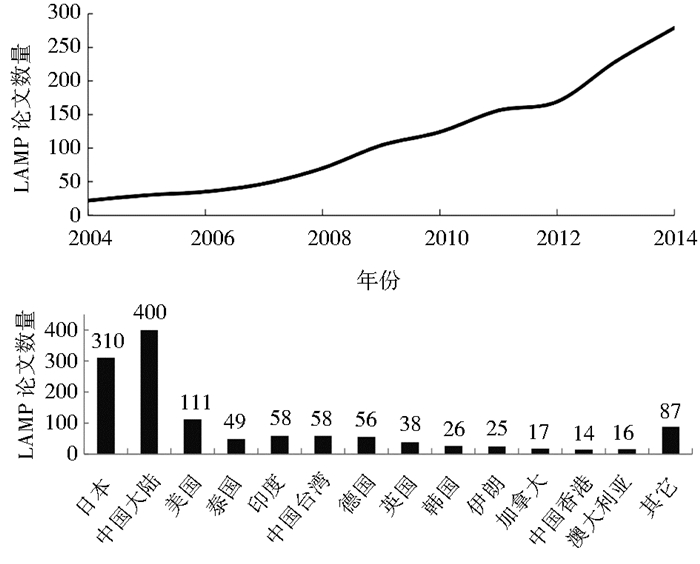
近年来,由病毒、细菌、病原菌、真菌及转基因生物等带来的生物危害对社会经济及人类健康产生了严重的影响,令国内外各界研究者都十分关注。目前,用于生物危害的检测方法主要有免疫学检测方法ELISA[1](Enzyme linked immunosorbent assay)和分子生物学检测方法(PCR)等,但由于ELISA方法对样品和实验操作环境要求高,并且传统的PCR方法需要价格昂贵的仪器设备,需要具备经验丰富的操作人员,因此传统检测方法不能满足在生物快速检测方面的应用。为了克服传统检测方法的不足,研究人员通过各种手段及方法研究更好的检测技术。在2000年,日本学者Notomi等[2]建立了一种新式的横温核酸扩增方法:环介导横温扩增法(LAMP)。该方法仅需要简单的水浴锅或者加热器,在横温扩增环境条件下(60 ℃~65 ℃)高效率(30~60 min)地扩增目标DNA,对操作者分子生物学技术要求也不高,而且在灵敏度、特异性等方面能媲美甚至优于PCR技术[3]。在扩增反应阶段受到非靶基因序列DNA的影响比PCR要小[4]。因此LAMP技术受到研究者的高度关注,全球LAMP论文发表成倍增长,本人通过NCBI整理了近10年LAMP论文发表量及其在各个国家的分布。(图 1)
|
| 图 1 近十年各国LAMP论文发表量及其在各个国家分布图 Fig. 1 The LAMP articles presented and its distribution in recent ten years |
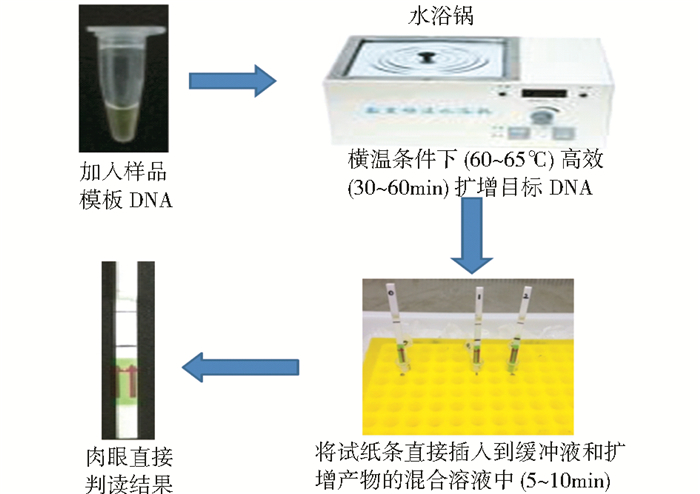
虽然LAMP技术已被各个检测领域所应用,但该技术在结果呈现方面仍然表现出不足和缺陷。目前用来判定LAMP扩增结果的方法主要有四种:(1)以扩增产生的副产物焦磷酸镁白色沉淀为依据观察白色沉淀;(2)反应体系中加入染料观察扩增结果是否产生相应颜色来判定是否有目的片段扩增;(3)通过恒温扩增微流控芯片实时观察反应结果[5];(4)运用实时浊度仪监测反应结果[6]。但前面两种判定方式都会因结果颜色不明显而造成肉眼观察不便捷及误判等缺陷,而后两种则需要购置昂贵的分析仪器。因此,迫切需要找到一种廉价并能用肉眼便捷、准确观察结果的检测方法。随着环介导横温扩增和横向流动试纸条技术各自的不断发展,近年来一些科研工作者为弥补LAMP法在结果呈现上的缺陷,尝试将环介导横温扩增技术与核酸横向流动试纸条检测技术相结合(LAMP-LFD)以实现LAMP现场检测方便、可视化。整个实验操作过程见图 2,操作者不依赖任何专门的仪器设备,只需将LAMP的扩增产物和试纸条浸入缓冲液即可实现目标产物的特异性检测,整个操作过程简便、安全、结果可视化。LAMP-LFD技术一经问世,便得到众多科研工作者的青睐。该技术方法能使经济效益和社会效益显著提高,在生物快速检测方面的应用极具推广前景。
|
| 图 2 LAMP-LFD操作流程示意图 Fig. 2 The flow chart of LAMP-LFD operations |
环介导横温扩增(LAMP)通过设计出的特异性引物和Bst DNA聚合酶(置换和结合功能),在横温环境条件下,一边合成模板DNA互补链,一边通过BstDNA聚合酶置换掉DNA单链。被置换下的单链DNA则因两端均存在着自我互补的碱基序列,从而发生碱基互补配对,形成类似于哑铃状结构的DNA链。LAMP扩增反应以该哑铃状的DNA链为起始结构,进入再循环和延伸扩增步骤,目标序列大量产生,最终形成的扩增目标产物是具有多环的花椰菜形状的茎环结构的DNA片段,数量级可达到109水平。
LFD技术的基础是Sano等[7]在1992年建立的检测微量抗原的高灵敏度技术。该技术结合了严格的碱基互补配对原则、抗原抗体反应的高特异性和聚合酶链反应的高灵敏性,并融合了免疫层析技术和分子生物学手段。LFD横向流动试纸条检测下限为5 pg DNA(德国原装Dipstick for PCR-Products产品介绍书)。LFD试纸条整个检测过程大约需持续5~15分钟,生物素标记核酸产物与FITC(异硫氰酸荧光素)标记的特异性探针相互杂交。随后直接吸取少量的杂交产物滴加到LFD试纸条上或者将试纸条垂直地放入混有杂交产物的检测缓冲液中,由于层析膜作用使免疫复合产物通过试纸条扩散,当免疫复合物扩散到试纸条的检测线时,由生物素标记的核酸扩增产物会被试纸条上的生物素配体所捕获,从而形成能用肉眼观察的具有颜色的检测线。在层析膜的作用下未被生物素配体所捕获的免疫复合物继续扩散,扩散到质控线的免疫复合物会被特异性抗体所捕获,最终在试纸条上形成具有颜色的质控线。
1.2 LAMP-LFD技术的优势现阶段,LAMP-LFD技术已用于各个生物检测领域中,并具有高灵敏度、高特异性、快速、方便、成本低和产物易检等优势(表 1)。
| LAMP-LFD | PCR | qPCR | |
| 反应条件 | 61℃~65℃恒温 | 40℃~95℃温度循环 | 40℃~95℃温度循环 |
| 反应时间 | 30~60 分钟左右 | 90~120 分钟左右 | 90~120 分钟左右 |
| 最少检测量 | 10拷贝 | 100拷贝 | 10~100拷贝 |
| 特异性 | 特高 | 较高 | 较高 |
| 检测速度 | 快 | 慢 | 慢 |
| 设备要求 | 低 | 高 | 高 |
| 检测方式 | 试纸条 | 电泳 | 仪器检测 |
| 结果判读难易度 | 容易 | 繁琐 | 繁琐 |
LAMP-LFD技术能在DNA模板浓度很低的条件下进行扩增,受外界环境及样品纯度影响较小[12],但PCR灵敏度易受测定样品中干扰物质的影响,过多的有机物质和无机物质会导致灵敏度降低。LAMP-LFD技术一般检测下限要比PCR低10倍的拷贝数,对低浓度病毒样品的检测比PCR效果要好[13]。
1.2.2 特异性较强针对特异性靶基因序列设计的4种引物和一条特异性探针,可以严格地识别靶序列,在扩增过程中,只有由生物素标记的引物扩增产生的产物才能与试纸条中的生物素配体相结合,从而形成能用肉眼辨别的具有颜色的检测线[14]。
1.2.3 速度较快LAMP-LFD技术方法不需要像PCR反应通过不同温度来进行核酸扩增,且没有温度循环变化带来的时间损失,整个扩增反应过程只需要30~60分钟,即可将几个拷贝的靶基因扩增到109水平。对于多样品检测需求来说,LAMP-LFD技术从横温扩增到试纸条检测的整个过程都要比PCR技术效率高,完全能满足多样品的快速检测要求。通过改进内外引物浓度比例使LAMP反应体系得以优化从而加快扩增反应环节的速率,提高检测速度[15],最后LFD试纸条的检测结果直接通过肉眼观察,大大提高了检测效率。
1.2.4 设备简单,成本低LAMP-LFD技术整个操作过程简便、安全,对操作人员的分子生物学技术要求也不高,在样品现场诊断检测中具有其他技术无法替代的优势,具有很好的推广前景。LAMP-LFD检测技术由于使用设备的简单化、实验操作的方便化、实验的特异性高和灵敏度高等优点,该技术在水产疾病检测应用方面已有较好的推广 [16, 17]。
1.2.5 产物易检杨小娟等[18]通过加入荧光染料SYBR Green I,在紫外灯下肉眼对扩增产物进行判别,反应结果若为绿色,则表明为阳性结果,若反应溶液保持SYBR Green I的橘黄色不变,则表明为阴性结果。但通过加入荧光染料法容易产生以下误区:(1)由于SYBR Green I结合到双链DNA的小沟部分,反应前加入荧光染料则会抑制LAMP反应;(2)SYBR Green I染料不能特异性地指示LAMP扩增产物。通过LAMP-LFD技术,操作者只需将环介导等温扩增技术的扩增产物和试纸条浸入缓冲液即可实现目标产物的检测。使扩增产物现场检测可视化,检测结果明显直观,通过肉眼即可辨认[19]。
2 LAMP-LFD技术在生物快速检测方面应用 2.1 在病毒快检领域的应用LAMP-LFD技术因其高灵敏度、高特异性、操作方便、速度快和检测成本低等特点而倍受研究者的青睐,该技术已日益广泛地应用在各种病毒领域的快速检测。
Kiatpathomchai等[9]在研究对虾桃粒病毒(TSV)时,通过RT-LAMP-LFD 快速扩增和特异性检测出了TSV 病毒,其中阴性对照组,IHNV、MBV、PmDNV、WSSV、YHV、TSV、MrNV、GAV 等病毒均未被检出,呈阴性检测结果。Kiatpathomchai等通过LAMP-LFD检测技术对虾桃粒病毒(TSV)进行快速检测研究时,还比较了RT-LAMP-凝胶电泳检测与RT-LAMP-LFD检测的灵敏度,原始模板进行了10-3~10-8系列的梯度稀释(原始模板浓度为100ng/μl),发现RT-LAMP-凝胶电泳检测体系,能检测到的灵敏度为10-5稀释浓度,而RT-LAMP-LFD检测体系能检测出的灵敏度为10-7稀释浓度,LAMP-LFD的检测灵敏度比凝胶电泳高出100倍。
在研究虾传染性肌坏死病毒(IMNV)时,Puthawibool等[20]通过RT-LAMP-LFD与RT-LAMP-凝胶电泳两种检测方法的比较,使用RT-LAMP-LFD比RT-LAMP-凝胶电泳检测时间至少减少了30分钟,而且使用LAMP-LFD检测技术,直接肉眼观察结果,无需接触EB染料等有毒物质。Jaroenram等[21]通过利用LAMP-LFD检测技术和RT-LAMP-LFD 检测技术对虾病毒WSSV等病毒进行快速检测实验,整个实验过程,从核酸提取阶段到病毒检测结果,整个实验过程时间只需要大约70分钟。设计了病毒特异性探针,并标记了FITC探针特异性地与LAMP、RT-LAMP扩增产物杂交结合,在LFD检测线上富集从而使病毒被特异性地检测出来。在LAMP-LFD技术研究对虾白斑综合症病毒(WSSV)实验中,LAMP-LFD特异性地检测了WSSV,对阴性对照和其他病毒呈阴性结果。
Nimitphak等[22]通过LAMP与LFD相结合的检测技术对虾细小病毒(PmDNV)进行研究发现:虽然巢式PCR 比RT-LAMP-凝胶电泳检测灵敏度高10 倍,但是RT-LAMP-LFD极大地提高了检测灵敏度,比巢式PCR检测灵敏度高出10倍,比凝胶电泳检测高出了100 倍。同时检测时间明显减少,整个实验过程也无需高端精密的大型仪器。他们认为LAMP-LFD检测技术不但具有高灵敏度,而且也是一种安全、快速的检测方法。Ding等[23]利用对传染性脾肾坏死病毒(ISKNV)快速检测方法的研究,将普通PCR-凝胶电泳、LAMP-凝胶电泳、LAMP-LFD检测方法进行灵敏度比较,初始模板的浓度为108 copies/μl,实验做了108~100系列的梯度稀释,结果发现LAMP-凝胶电泳检测灵敏度(102 copies/μl浓度)是普通PCR-凝胶电泳检测的灵敏度(104 copies/μl)浓度的100倍,而LAMP-LFD的检测灵敏度最高(101 copies/μl浓度)是普通PCR-凝胶电泳检测的灵敏度(104 copies/μl)浓度的1000倍。
Yiyue等[24]利用了LAMP扩增技术与LFD相结合的检测技术快速扩增和特异性检测了H7N9禽流感病毒,临床特异性高达100%,最低检出10个拷贝的合成RNA模板量,并通过与荧光RT-PCR方法进行比较,LAMP-LFD技术检测灵敏度远好于荧光RT-PCR。Sun等[25]比较了LAMP-LFD、LAMP、PCR等方法检测犬瘟热病毒的灵敏度,发现LAMP-LFD和LAMP一样,都为10-1 TCID50/ml,远远高于PCR的102 TCID50/ml。
通过研究者对病毒快速检测方法优点的归纳,我们可以知道LAMP-LFD检测方法用于诊断病毒不仅具有速度快、特异性强、灵敏度高的优势特点,还具有检测设备便宜,实验操作简便等优点,因而在水产动物病毒快速检测和陆地动物疫病快速检测领域中的应用具有潜在的价值。
2.2 在细菌快检领域的应用王瑞娜等[26]利用环介导等温扩增技术与横向流动试纸条相结合的方法,针对海豚链球菌中的促旋酶B亚单位(gyrase subunit B,gyrB)基因设计出6条引物,进行了由生物素标记的LAMP扩增反应,产物经FITC标记的探针杂交,在LFD上能特异性地检出海豚链球菌。排除核酸提取过程所用时间,从LAMP核酸扩增反应开始到免疫复合物滴加到试纸条上最终形成肉眼可观察的有色条带的整个过程,大概只需要40分钟。这个检测过程时间比常规PCR检测过程所需的时间缩短大约2小时。
Prompamorn等[27]利用环介导等温扩增技术与横向流动试纸条相结合的方法能够准确特异性检测出28株副溶血性弧菌,不能够检测出24株非副溶血性弧菌和35株非弧菌。从实验开始阶段到LFD显色检出结果,整个检测过程大约只需90分钟。研究者利用LAMP-LFD技术在副溶血性弧菌纯培养物实验中检测灵敏度为120 CFU/ml。环介导等温扩增技术与横向流动试纸条相结合的方法在未经过富集的虾样品中检测副溶血性弧菌限度为1.8×103 CFU/g是传统PCR方法检出度的10倍。
Yongkiettrakul等[28]在自己研究中发现通过LAMP-LFD技术快速检测疟原虫基因组中的PV和Pf两个基因,将普通PCR方法和LAMP-LFD检测方法进行灵敏度比较,结果显示利用LAMP-LFD技术检测灵敏度是传统PCR检测方法灵敏度的10倍。因此,LAMP-LFD检测方法在检测疟原虫方面具有较高的灵敏度、实验方法简便等特点,有可能发展成为快速检测疟原虫的有效方法之一。
2.3 在转基因产品快检领域的应用转基因大豆是第一个占主导地位的转基因农作物。抗农达耐药性大豆(RRS)是孟山都公司的出品的转基因大豆,占据全球市场的75%。全球大概有1亿公顷种植的转基因大豆,是许多大豆饲料和食品的主要原料。Wang等[11]通过利用环介导等温扩增技术与横向流动试纸条相结合的方法以抗农达耐药性大豆(RRS)的G35S基因为靶序列设计LAMP-LFD特异性引物和探针,扩增产物经试纸条显色反应特异性检出。通过该方法整个检测过程大约只需50分钟,最低检测限为2.4拷贝,其灵敏度远远好于传统检测方法。LAMP-LFD检测方法对于检测转基因样品不仅具有高效的特异性和极高的灵敏度等优势特点,而且该方法从经济成本和对仪器设备的要求方面来讲也具有极好的优势,摆脱了传统检测方法需要昂贵的仪器设备和试剂耗材等不利因素。通过使用最新的DNA 快速提取技术然后结合该检测技术使得快速现场检测转基因样品变得更方便。
2.4 在真菌快检领域的应用树脂枝孢霉(Amorphotheca resina)是一种能在喷气燃料中生长的主要污染菌,在喷气燃料污染案例中有93%的都是由该菌引起。当前,针对检测飞机油箱中的微生物,国际航空运输协会(The International Air Transport Association,IATA)推荐使用4种检测方法,但是针对树脂枝孢霉的检测却并不常见。和倩倩等人,(该文章已被工业微生物杂志接收)通过利用LAMP-LFD技术方法,以树脂枝孢霉的18S rRNA基因为靶基因序列,设计出一套特异性引物和探针,实验通过与PCR方法的比较进行了特异性和灵敏度实验,并且还运用LAMP-LFD技术方法进行野外样品检测实验。结果显示,LAMP-LFD方法用于检测树脂枝孢霉不但具有高特异性和高灵敏度,还具有非常好的野外样品检测能力,能快速检测出喷气燃料中的树脂枝孢霉,且结果可用肉眼直接观察。LAMP-LFD技术作为一种全新的检测技术有望将来在真菌快检领域中被广泛用于实地现场检测。
3 展 望近年来,随着LAMP-LFD技术的稳步发展,许多科研工作者将其用于生物快速检测方面的研究,LAMP-LFD技术不仅克服了传统PCR检测技术需要不同温度梯度的条件要求,还具有特异性高、灵敏度高、反应时间短、安全、操作简单、结果可视化、费用低等优点,但LAMP-LFD技术在理论和实际应用方面仍然存一些不足,如LAMP-LFD技术对引物特异性的要求更高,设计也更复杂,不仅需要2条外引物,2条内引物和一条FITC标记的特异性探针,还需要将一条外引物进行生物素标记[27]。引物设计环节由于引物设计的特殊要求性使得实验者不得不通过大量工作对引物进行筛选、优化。由于LAMP引物针对的靶基因序列长度一般不能长于500bp,因此不适于长链扩增及检测。此外,LAMP-LFD技术虽然是通过两种技术巧妙结合而产生的一种新技术方法,但该新技术并未解决实验过程中开盖检测的难题,产物在开盖检测的过程中会分散到实验环境中,形成气溶胶,残留在实验仪器设备上等,从而造成检测过程中的污染,导致假阳性结果。因此该技术并未真正广泛推广到各个生物检测领域。宁波大学和宁波博奥生物工程有限公司联合开发的Echk系列产品将LAMP扩增和LFD试纸条检测技术通过密闭实验系统装置﹙专利号:201410059786.4、201420076690.4﹚进行完美的结合,将核酸扩增与结果检测合二为一,减少了操作步骤,初步实现了LAMP-LFD集成自动化。在彻底消除基因扩增产物污染问题的同时,也实现现场多重多靶点的高通量快速检测,除了通过上述装置的研发来解决实验假阳性问题,本人近期还通过LAMP-LFD技术在微小卡罗藻快速检测的研究实验中发现由FITC标记的探针可以提前加入扩增反应实验,不需经扩增完毕再进行杂交实验,但该实验机制目前尚不明确,还需经过后期大量的实验对其进行阐述,如果后期大量实验工作能对该机制进行阐明,那么LAMP-LFD技术的操作时间将会大大缩短。综上所述,我相信通过对LAMP-LFD技术存在的问题和缺陷的不断改进和完善,LAMP-LFD技术在生物快速检测方面的应用将得到更广泛的推广和普及,也将会更好地服务于其它各个研究领域。
| [1] | Carmichael W W, An J. Using an enzyme linked immunosorbent assay (ELISA) and a protein phosphatase inhibition assay (PPIA) for the detection of microcystins and nodularins. Natural Toxins, 1999, 7(6):377-385. |
| [2] | Notomi T, Okayama H, Masubuchi H, et al. Loop-mediated isothermal amplification of DNA. Nucleic Acids Research, 2000, 28(12):e63. |
| [3] | Tomita N, Mori Y, Kanda H, et al. Loop-mediated isothermal amplification (LAMP) of gene sequences and simple visual detection of products.Nat Protoc, 2008, 3(5):877-882. |
| [4] | Yang X J, Wu Q P, Zhang J M, et al. Loop-mediated isothermal amplification method for detection of nucleic acids and its application in food safety inspection. Microbiol China, 2010, 37(8):1227-1233. |
| [5] | Guoliang Huang,Qin Huang,fM to aM nucleic acid amplification for molecular diagnostics in a non-stick-coated metal microfluidic bioreactor.Scientific Reports, 2014,4(7344):1-9. |
| [6] | Peng Zhu,Bai-Feng Zhang,Jing-Hua Wu, et al.Sensitive and rapid detection of microcystin synthetase E Gene (mcyE) by loop-mediated isothermal amplification:A new assay for detecting the potential microcystin-producing Microcystis in the aquatic ecosystem.Harmful Algae, 37(2014):8-16. |
| [7] | Sano T, Smith C L, Canter C R,et al. Immuno-PCR:very sensitive antigen detection by means of specific an tibody-DNA conjugates.Science, 1992, 258:120-122. |
| [8] | 张柏烽,朱鹏,严小军,等.一种快速检测微囊藻毒素mcyG基因的新技术-环介导恒温扩增.生态学报,2015,9:1-13.Zhang B F, Zhu P, Yan X J, et al. A novel assay for rapid detection of microcystin mcyG gene:loop-mediated isothermal amplification.Acta Ecologica Sinica, 2015,9:1-13. |
| [9] | Kiatpathomchai W, et al. Shrimp Taura syndrome virus detection by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 2008,153:214-217. |
| [10] | Piepenburg O, et al. DNA detection using recombination proteins.PloS Biology, 2006,4(7):e204. |
| [11] | Wang X, Teng D, Guan Q, et al. Detection of roundup ready soybean by loop-mediated isothermal amplification combined with a lateral-flow dipstick. Food Control, 2013, 29(1):213-220. |
| [12] | Khunthong S, Jaroenram W, Arunrut N, et al. Rapid and sensitive detection of shrimp yellow head virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Journal of Virological Methods, 2013, 188(1):51-56. |
| [13] | Yu-Ling Sun, Chon-Ho Yen, Ching-Fu Tu, et al. Visual detection of canine parvovirus based on loop-mediated isothermal amplification combined with enzyme-linked immunosorbent assay and with lateral flow dipstick. The Journal of Veterinary Medical Science, 2014, 76(4):509. |
| [14] | Kaewphinit T, Arunrut N, Kiatpathomchai W, et al. Detection of Mycobacterium tuberculosis by using loop-mediated isothermal amplification combined with a lateral flow dipstick in clinical samples. BioMed Research International, 2013, (2013). |
| [15] | Aryana E, Makvandia M, Farajzadeha A, et al. A novel and more sensitive loop-mediated isothermal amplification assay targeting IS6110 for detection of Mycobacterium tuberculosis complex. Microbiol Res, 2010, 165(3):211-220. |
| [16] | Nimitphak T, Meemetta W, Arunrut N,et al.Rapid and sensitive detection of Penaeusmonodon nucleopolyhedro virus (PemoNPV) by loop-mediated isothermal amplification combined with a lateral-flowdipstick. Mol CellProbes, 2010, 24(1):1-5. |
| [17] | Thongkao K, Longyant S, Silprasit K, et al. Rapid and sensitive detection of Vibrio harveyi by loop-mediated isothermal amplification combined with lateral flow dipstick targeted to vhhP2 gene. Aquaculture Research, 2013:1-10. |
| [18] | 杨小鹃,吴清平,张菊梅,等.环介导等温扩增核酸技术及其在食品安全检测领域的应用.微生物学通报, 2010, 37(8):1227-1233. Yang X J,Wu Q P,Zhang J M,et al.Loop-mediated isothermal amplification method for detection of nucleic acids and its application in food safety inspection. Microbiology China,2010, 37(8):1227-1233. |
| [19] | 王耀焕,王瑞娜,周前进,等.环介导等温扩增联合横向流动试纸条快速检测创伤弧菌检测方法的建立.生物技术通报, 2014,6:81-87. Wang Y H,Wang R N,Zhou Q J,et al.Rapid detection of Vibrio vulnificus by loop-mediated isothermal amplification combined with lateral flow dipstick assay.Biotechnology Bulletin, 2014,6:81-87. |
| [20] | Puthawibool T, Senapin S, Kiatpathomchai W, et al.Detection of shrimp infectious myonecrosis virus by reverse transcription loop-mediated isothermal amplification combined with a lateral flow dipstick. J Virol Methods, 2009,156:27-31. |
| [21] | Jaroenram W, Kiatpathomchai W, Flegel T W, et al. Rapid and sensitive detection of white spot syndrome virus by loop-mediated isothermal amplification combined with a lateral flow dipstick.Mol Cell Probes, 2009, 23:65-70. |
| [22] | Nimitphak T, Kiatpathomchai W, Flegel T W, et al. Shrimp hepatopancreatic parvovirus detection by combining loop-mediated isothermal amplification with a lateral flow dipstick. J Virol Methods, 154(1-2):56-60. |
| [23] | Ding W C, Chen J, Shi Y H, et al. Rapid and sensitive detection of infectious spleen and kidney necrosis virus by loop-mediated isothermal amplification combined with a lateral flow dipstick. Archives of Virology, 2010, 155(3):385-389. |
| [24] | Yiyue Ge,Bin Wu,Xian Qi,et al. Rapid and sensitive detection of novel Avian-Origin Influenza A (H7N9) Virus by Reverse Transcription Loop-Mediated Isothermal Amplification Combined with a Lateral-Flow Device.PLoS One, 2013,8:8. |
| [25] | Sun Y L, Yen C H, Tu C F,et al..Visual detection of canine parvovirus based on loop-mediated isothermalamplification combined with enzyme-linked immunosorbent assay and with lateral flow dipstick. J Vet Med Sci, 2014,176(4):509-516. |
| [26] | 王瑞娜,周前进,陈炯,等.环介导等温扩增联合横向流动试纸条可视化检测海豚链球菌方法的建立.农业生物技术学报,2014, 22(12):1584-1594. Wang R N,Zhou Q J,Chen J, et al.Visual detection of Streptococcus iniae based on Loop-mediated Isothermal Amplification combined with a Lateral Flow Dipstick. Journal of Agricultural Biotechnology,2014, 22(12):1584-1594. |
| [27] | Prompamorn P, Sithigorngul P, Rukpratanporn S, et al. The development of loop-mediated isothermal amplification combined with lateral flow dipstick for detection of Vibrio parahaemolyticus. Letters in Applied Microbiology, 2011, 52(4):344-351. |
| [28] | Yongkiettrakul S, Jaroenram W, Arunrut N, et al. Application of loop-mediated isothermal amplification assay combined with lateral flow dipstick for detection of Plasmodium falciparum and Plasmodium vivax. Parasitology International, 2014, 63(6):777-784. |
 2015, Vol. 35
2015, Vol. 35