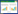文章信息
- 胡宗福, 朱宏吉
- HU Zong-fu, ZHU Hong-ji
- 解磷酵母Pichia farinose FL7用于镍污染土壤植物提取的研究
- Application of Phosphate Solubilizing Yeast Pichia farinose FL7 in Phytoextraction of Nickel Contaminated Soil
- 中国生物工程杂志, 2015, 35(11): 36-45
- China Biotechnology, 2015, 35(11): 36-45
- http://dx.doi.org/10.13523/j.cb.20151106
-
文章历史
- 收稿日期: 2015-04-13
- 修回日期: 2015-06-18
工业活动日益加剧,土壤重金属污染正成为一个深受全球关注的热门环境问题。由于重金属不能够发生降解,土壤一旦被重金属污染,其可以持续存在于土壤中。镍是生物体必需的微量营养元素之一,但当生物体内积累过量的镍时,会导致细胞结构及生理过程发生改变[1]。土壤中的镍主要来自成土母质,正常土壤中镍的含量为5~500mg/kg,大部分低于50mg/kg [2]。土壤中镍的主要污染来源是金属电镀、化石燃料燃烧、镍金属冶炼等,分别通过工业废水、废气、固体污染物的形式排入环境中。据估计,全球每年释放到环境中的重金属镍超过3.8×106t,给环境造成不可忽视的影响[3]。降低土壤中重金属镍污染是一件亟须解决的难点和热点问题。
到目前为止,研究者们已提出了多种方法来修复土壤重金属污染,其中包括传统的物理分离、化学修复技术,以及新颖的微生物修复、植物提取技术。物理分离主要以挖掘填埋方式为主,把污染问题从高危害区转移到低危害区,不可避免存在占用土地、渗漏、污染周边环境等负面影响,并不是一个永久措施,目前已很少使用。化学修复技术主要包括土壤淋洗、化学固化、电动修复、化学改良等,化学方法需要使用强烈的理化试剂,往往会破坏土壤微生物多样性。相比较而言,植物提取和微生物修复在成本优势、人类和环境安全方面优于物理和化学方法,因此逐渐受到人们重视[4]。
植物提取是20世纪90年代初发展起来的生物修复技术,因其高效性、低成本、易操作及环保性等优势具有巨大的应用前景,成为学术界研究的热点[5]。植物提取是利用超累积植物对重金属的超量吸收,在植物的可收获部分富集重金属,在生长一定时期后,收获超累积植物后进行焚烧以回收重金属,从而将其从土壤中清除。因此,植物提取技术能够逐渐降低土壤重金属,尤其是有效态重金属的含量。然而,植物提取技术本身也存在着缺陷,一方面大多数超累积植物生长缓慢,另一方面土壤中重金属的生物可利用度低,这两方面的原因致使植物提取技术修复重金属污染的效率较低[6]。虽然已有研究表明,向土壤中施加乙二胺四乙酸(EDTA)、二乙基三胺五乙酸(DTPA)、乙二醇双(2-氨基乙基醚)四乙酸(EDGA)、氨基三乙酸(NTA)等化学螯合剂能够提高植物修复过程中重金属的生物可利用度[7, 8],但是,这些化学物质对土壤肥力或土壤结构有不容忽视的负面影响。
重金属污染的另一种修复方法是磷酸盐原位修复,目前已经广泛研究的磷酸盐包括如磷酸二铵[(NH4)2HPO4]等可溶性磷酸盐,以及如磷酸钙[Ca3(PO4)2]、羟基磷酸钙[Ca5(OH)(PO4)3]等的不溶性磷酸盐[9, 10, 11]。但磷酸盐原位修复技术在实际应用中受到限制,水溶性磷酸盐会因为磷淋失造成水体污染,不溶性磷酸盐修复效率较低。此外,原位修复后重金属仍然滞留在土壤中,不利于土壤资源的进一步利用。近年来研究者提出了一种利用具有生长促进功能的解磷微生物进行重金属修复的新技术,解磷微生物通过产生有机酸,将土壤中如Ca3(PO4)2、磷酸铁(FePO4)、磷酸铝(AlPO4)等难溶性磷酸盐中的磷素以可溶PO3-4的形式释放出来[12, 13, 14]。解磷微生物修复重金属污染的研究结果主要包括两个方面。一是利用微生物产生的功能性物质将重金属固定从而降低其流动性。例如,Park等[15]的研究表明,具有解磷活性的阴沟肠杆菌(Enterobacter cloacae)能够溶解土壤中的磷酸岩并形成磷酸铅复合物从而降低土壤中铅(Pb)的流动性。但这仅能降低重金属的流动性,仍然不能将污染重金属从土壤中彻底清除。二是采用解磷微生物能够溶解重金属磷酸盐,从而增加重金属的生物利用度。例如,Jeong等[16]的研究表明,将巨大芽孢杆菌(Bacillus megaterium)用于镉(Cd)污染土壤,能够增加Cd的流动性并有效提高生物有效性,植物提取率增加了2倍。
在本实验室的前期研究中,Zhu等[17]从农业废弃物中筛选得到一株具有解磷活性的毕赤酵母Pichia farinose FL7,通过对其解磷机制的研究发现,P. farinose FL7通过产生柠檬酸、琥珀酸等有机酸表现出解磷活性,此外P. farinose FL7还有植物生长促进作用。我们对P. farinose FL7解磷活性的进一步研究结果表明,P. farinose FL7对FePO4、AlPO4、磷酸镍[Ni3(PO4)2]也表现出溶解能力,因此将P. farinose FL7分别用于硝酸镍[Ni(NO3)2]、Ni3(PO4)2污染土壤的植物提取。本研究的假设是解磷酵母P. farinose FL7对Ca3(PO4)2、FePO4、AlPO4的溶解活性使其能够将土壤中的Ni2+固定形成Ni3(PO4)2难溶物,同时其对Ni3(PO4)2的溶解活性又能够将部分固定的Ni3(PO4)2难溶物溶解,这种固定-溶解双重功能可提高镍(Ni)的生物可利用度,从而加快Ni2+或Ni3(PO4)2污染土壤中Ni的清除速率。
1 材料与方法 1.1 实验菌株本实验所用的功能微生物是从农业废弃物堆肥中筛选得到的具有解磷活性的酵母菌P. farinose FL7 (CMGCC No. 4008)。解磷酵母P. farinose FL7在YEPD液体培养基(蛋白胨20.0g,葡萄糖20.0g,酵母粉10.0g,蒸馏水1 000ml,pH 6.0,1×105Pa灭菌20min)中于30℃、150r/min扩增至对数期,备用。P. farinose FL7培养过程的菌落数(YEPD平板)和发酵液pH变化如表 1所示。
| 培养时间(h) | |||||||
| 0 | 12 | 24 | 48 | 72 | 96 | 108 | |
| 菌落数(×108) | 0.00±0.00 | 0.06±0.01 | 0.27±0.02 | 3.34±0.07 | 4.25±0.06 | 4.12±0.04 | 4.02±0.05 |
| pH | 6.02±0.01 | 5.80±0.03 | 5.40±0.05 | 4.10±0.03 | 3.80±0.02 | 4.10±0.04 | 4.50±0.05 |
向250ml锥形瓶中添加100ml Pikovskaya基础液体培养基[葡萄糖10.0g,酵母粉0.5g,(NH4)2SO4 0.5g,NaCl 0.3g,KCl 0.3g,MgSO4·7H2O 0.3g,FeSO4·7H2O 0.03g,MnSO4·H2O 0.03g,蒸馏水1 000 ml,pH 7.0],1×105Pa灭菌20min。向250ml锥形瓶中分别添加0.5g Ca3(PO4)2、AlPO4 · 4H2O和FePO4,1×105Pa灭菌20min,备用。在超净台环境下,将经灭菌的Pikovskaya基础液体培养基倒入含灭菌Ca3(PO4)2、AlPO4 · 4H2O和FePO4的250ml锥形瓶中,摇匀,制备成测定培养基。
向上述测定培养基中接种1ml解磷酵母P. farinose FL7对数期培养物,于30℃培养108h,转速为150r/min。在培养过程的第0h、12h、24h、36h、48h、60h、72h、84h、96h、108h分别收集培养液,12 000r/min离心20min。①测定培养液pH;②加入Sevag试剂除蛋白质,0.22μm滤膜过滤,磷钼蓝法分析可溶性磷的含量[15]。
1.3 解磷酵母P. farinose FL7对Ni3(PO4)2的溶解能力测定在100ml Pikovskaya基础培养基中添加0.5g Ni3(PO4)2·8H2O,取1ml P. farinose FL7对数期的种子培养物接种到金属磷酸盐培养基中,30℃、150r/min培养72h,每12h取出样品,12 000r/min离心10min。①测定培养液pH;② 0.22μm膜过滤,磷钼蓝法测定可溶性磷的含量[18]。未接种P. farinose FL7的实验组作为对照。
1.4 解磷酵母P. farinose FL7的Ni(NO3)2耐受性将解磷菌P. farinose FL7接种于含有不同浓度Ni(NO3)2重金属离子(1mmol/L、3mmol/L、 5mmol/L、7mmol/L、8mmol/L、9mmol/L、10mmol/L、11mmol/L、13mmol/L、14mmol/L、15mmol/L)的YEPD液体培养基中,30℃、150r/min培养72h,利用分光光度计测定600nm处的菌体浓度。不添加Ni(NO3)2重金属离子(0mmol/L)的YEPD培养基组作为对照。
1.5 解磷酵母P. farinose FL7菌剂制备取1ml P. farinose FL7对数期的种子培养物接种到新鲜的YEPD液体培养基中,30℃、150r/min培养72h至对数期,收集培养液,7 000r/min离心收集菌体,用0.9%的生理盐水清洗3次,最终制成菌体密度为1.0×109的菌悬液。
1.6 预处理未污染土壤来自天津某田间(39°12.68′ N,116°89.72′ E),采集表层5~20cm的土壤,移除植物残体和石块后,混匀,过2mm筛。将供试土壤样品分成4份,为模拟重金属Ni污染土壤,向其中1份土壤人为添加含Ni浓度为160mg/L的Ni(NO3)2溶液(Ni的最终添加量为80mg/kg),1份添加Ni3(PO4)2·8H2O (等量递加法混合,Ni的最终添加量为80mg/kg),使用机械搅拌将添加重金属Ni的土壤充分混匀,另外2份土壤不添加任何物质。将印度芥菜(Brassica juncea)的种子播种于1份不添加任何物质的土壤中,出芽后生长28天(4周)作为供试植株。
在供试植株生长期间,上述添加Ni(NO3)2或Ni3(PO4)2·8H2O的土壤静置保存,即老化处理28天。老化处理后,无添加物、添加Ni(NO3)2、添加Ni3(PO4)2·8H2O土壤的主要理化性质如表 2所示。
| 理化性质 | 无添加物 | 添加Ni(NO3)2 | 添加Ni3(PO4)2·8H2O |
| pH | 7.51±0.05 | 7.42±0.04 | 7.48±0.05 |
| EC1∶5 (dS/m) | 0.822±0.09 | 0.85±0.11 | 0.821±0.06 |
| TOC (%) | 0.73±0.02 | 0.71±0.03 | 0.74±0.01 |
| 全氮N (mg/kg) | 1 060±25 | 1 039±17 | 1 045±11 |
| 有效磷P (mg/kg) | 30±2.7 | 27±1.9 | 35±3.1 |
| 速效钾K (mg/kg) | 510±21 | 495±17 | 502±9 |
| 有效态镍Ni (mg/kg/) | 0.048±0.04 | 78.29±1.21 | 0.78±0.12 |
| 无效态镍Ni (mg/kg) | 0.012±0.03 | 2.1±0.11 | 79.34±3.53 |
利用盆栽试验研究解磷酵母P. farinose FL7在印度芥菜修复Ni污染土壤中的应用效果。按照土壤预处理方式、微生物处理方式设计两单因素试验,其中土壤预处理方式包括无污染土壤(对照)、Ni(NO3)2污染土壤、Ni3(PO4)2·8H2O污染土壤3种,微生物处理方式包括添加P. farinose FL7菌悬液(10% V/m)、不添加P. farinose FL7菌悬液2种。
将“1.5”部分中预处理获得的无污染土壤、Ni(NO3)2污染土壤、Ni3(PO4)2·8H2O污染土壤分别置于干净的聚乙烯薄板上,按上述设计添加P. farinose FL7菌悬液并充分混合,取200g土壤至于陶制盆(上部直径9cm,底部直径7cm,深度10cm)中,浇水使土壤水分含量达到田间持水量。挑选湿重相近(变异系数CV<10%)的“1.5”部分中获得的印度芥菜供试植株,每盆栽种4株,四周用土壤压实,在温室条件下生长6周。盆栽试验采用自然光照,温度保持在10~26℃,相对湿度保持在60%~65%。盆栽试验期间定期加水以维持土壤含水量。为了减少温度和阴影位置对实验结果的影响,盆栽每隔2天随机更换位置。
在盆栽试验的第0天、14天、 28天、42天收集盆栽试验土壤样品,用修饰的Kelowna试剂提取溶液中的有效磷[19],12 000r/min离心10min,0.22μm膜过滤,磷钼蓝法测定可溶性磷的含量。42天(6周)后收集印度芥菜植株,用蒸馏水洗涤除去附着的土壤颗粒,在70℃的烘箱干燥24h,测量总生物量。收获植物时,从每个盆中采集土壤样品,并在室温下空气干燥。取盆栽试验第0天、42天的试验土壤样品测量pH。本盆栽试验有三次重复。
1.8 植物和土壤中的Ni含量分析按照Tessier连续提取法将盆栽试验前后土壤中的重金属Ni提取出来[20]。将盆栽试验获得的干燥植物样品磨成细粉,用HNO3-H2O2-蒸馏水(9∶1∶1,V/V/V)消化,提取重金属Ni,消化完成后,每组消化液用蒸馏水定容至25.0ml。采用原子吸收光谱仪[Thermo Scientific S系列(iCE 3000)]测定植物和土壤样品中的Ni含量,用硝酸溶解光谱纯金属镍制备标准工作溶液。
1.9 数据分析采用单因素方差分析和双因素方差分析对P. farinose FL7解磷过程中的可溶磷含量、P. farinose FL7耐受性相关的数据进行统计分析(P≤0.05水平认为是显著),通过post-hoc Tukey’s分析来评价不同磷源对解磷能力的影响。采用双向重复测量方差分析来测试培养时间、土壤处理方式及它们间的相互作用对盆栽试验过程中土壤有效P含量、土壤Ni含量、植株Ni含量的影响。数据分析采用SPSS 10.0版软件进行统计分析,所有结果表示为平均值和相应的标准误差。
2 结果与讨论 2.1 解磷酵母P. farinose FL7对Ca3(PO4)2、AlPO4、FePO4的溶解能力在土壤环境中,真菌类解磷微生物对Ca3(PO4)2、FePO4、AlPO4等难溶性磷酸盐的溶解是非常重要的磷元素营养循环过程,能够为植物和微生物的生长提供必要的可溶性磷酸盐以及微量元素。目前已经有大量关于真菌类解磷微生物解磷活性的研究,其中包括黑曲霉、青霉菌和正青霉属菌[21, 22, 23]。本实验室的前期研究表明,解磷酵母P. farinose FL7通过产生乙酸、苹果酸、乳酸、琥珀酸、乙二酸对磷酸钙具有很好的溶解能力[17],由于事实上土壤中的磷酸盐以FePO4、AlPO4和Ca3(PO4)2的形式同时存在[24],因此单纯以P. farinose FL7对Ca3(PO4)2的溶解能力不足以表征其解磷能力。本项研究中,我们通过Ca3(PO4)2、FePO4和AlPO4 三种不同的磷源,表征解磷酵母P. farinose FL7菌株的溶解能力。
如图 1所示,P. farinose FL7解磷过程的数据表明,在P. farinose FL7溶解Ca3(PO4)2、FePO4、AlPO4的过程中,随培养时间的延长,培养液的pH逐渐降低,而可溶P的含量逐渐升高,且在培养第96~108h时,各培养液中的可溶P含量可达到为(439.9±5.7)mg/L、(331.7±3.9)mg/L和(205.6±4.7)mg/L。由此表明,P. farinose FL7对Ca3(PO4)2和AlPO4的溶解能力很强,对FePO4的溶解能力有限。这与Qin等[25]的研究结论一致,即在单一磷源情况下,根际解磷菌的解磷能力按照Ca3(PO4)2>AlPO4>FePO4的顺序降低。该实验结果表明,P. farinose FL7的解磷能力与磷源的化学性质有关。
|
| 图 1 解磷酵母P. farinose FL7溶解磷酸钙、磷酸铝、磷酸铁过程中培养液pH和可溶磷含量变化 Fig. 1 Time-course variation of pH and soluble phosphate content during phosphate-solubilization process of P. farinose FL7 to calcium phosphate,aluminium phosphate,iron phosphate |
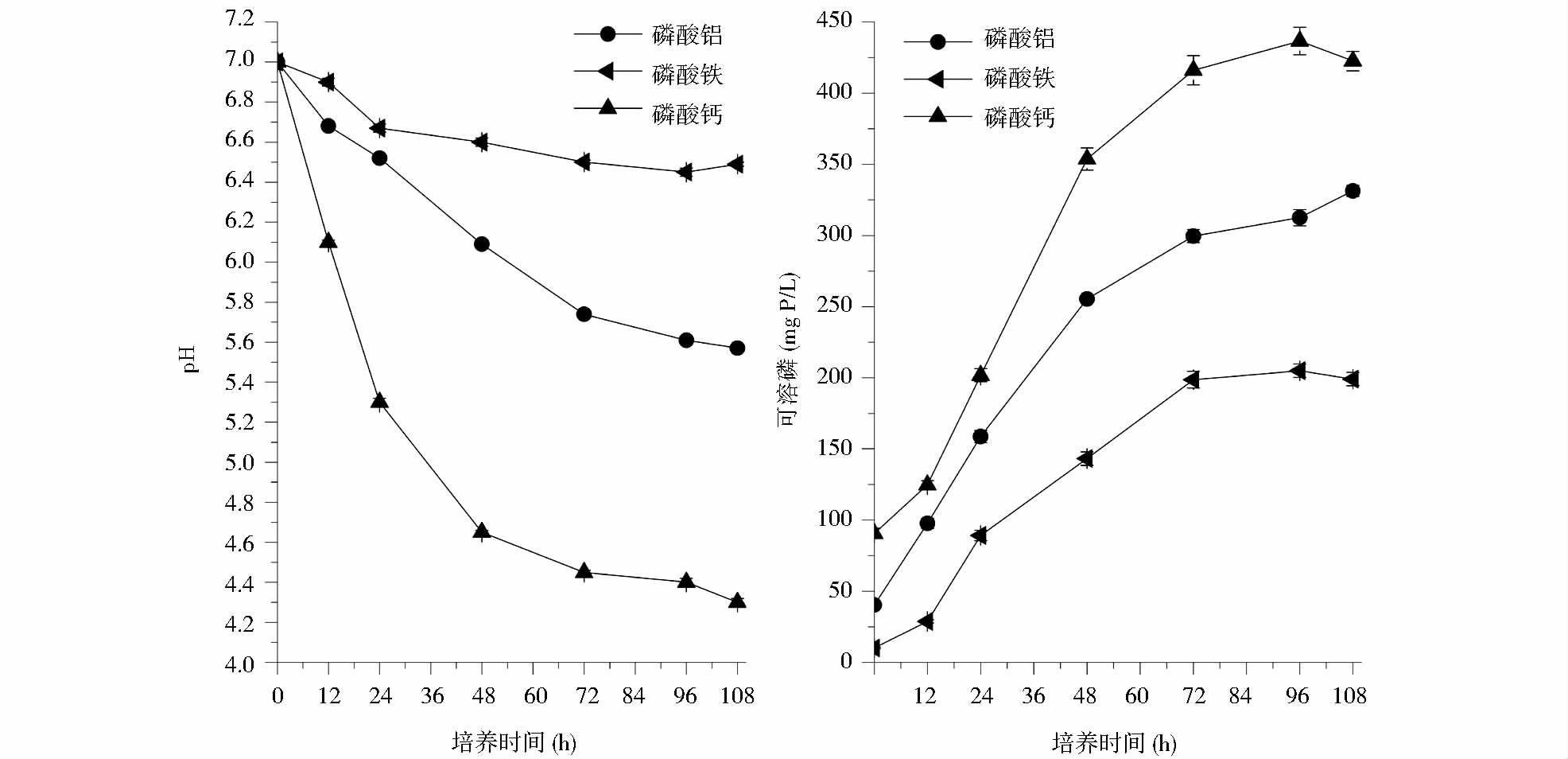
在本实验中,以Ni3(PO4)2·8H2O难溶性磷酸盐作为培养基中的唯一磷源,研究了P. farinose FL7对Ni3(PO4)2的溶解能力。在培养过程中,未接种P. farinose FL7组的培养液pH和可溶磷含量均未发生明显变化。接种P. farinose FL7的培养液pH在实验过程中显著降低,72h时pH降至4.10左右;可溶P含量第12~72h持续增加,在第72h时达到(182±11)mg/L,是未接种P. farinose FL7组培养基的12.4倍。由此表明,P. farinose FL7对Ni3(PO4)2具有很好的溶解能力(图 2)。
|
| 图 2 解磷酵母P. farinose FL7溶解Ni3(PO4)2·8H2O过程中pH和可溶磷含量的变化 Fig. 2 Time-course variation of pH and soluble phosphate content during phosphate-solubilization process of P. farinose FL7 to nickel phosphate |
一般而言,在重金属污染的土壤环境中生长的植物,其根际区域存在着大量的具有高浓度金属耐受性的根际微生物[26]。而且,在微生物修复重金属污染土壤的过程中,微生物的重金属耐受性是非常重要的。具有高金属耐受性的微生物能在重金属污染的环境中保持活力,从而增强其在重金属污染治理中的应用价值[16]。Ma等[27]的研究表明,具有Ni耐受性的根际微生物能够促进Alyssum serpyllifolium 和 Phleum phleoides的生长和对Ni的吸收。
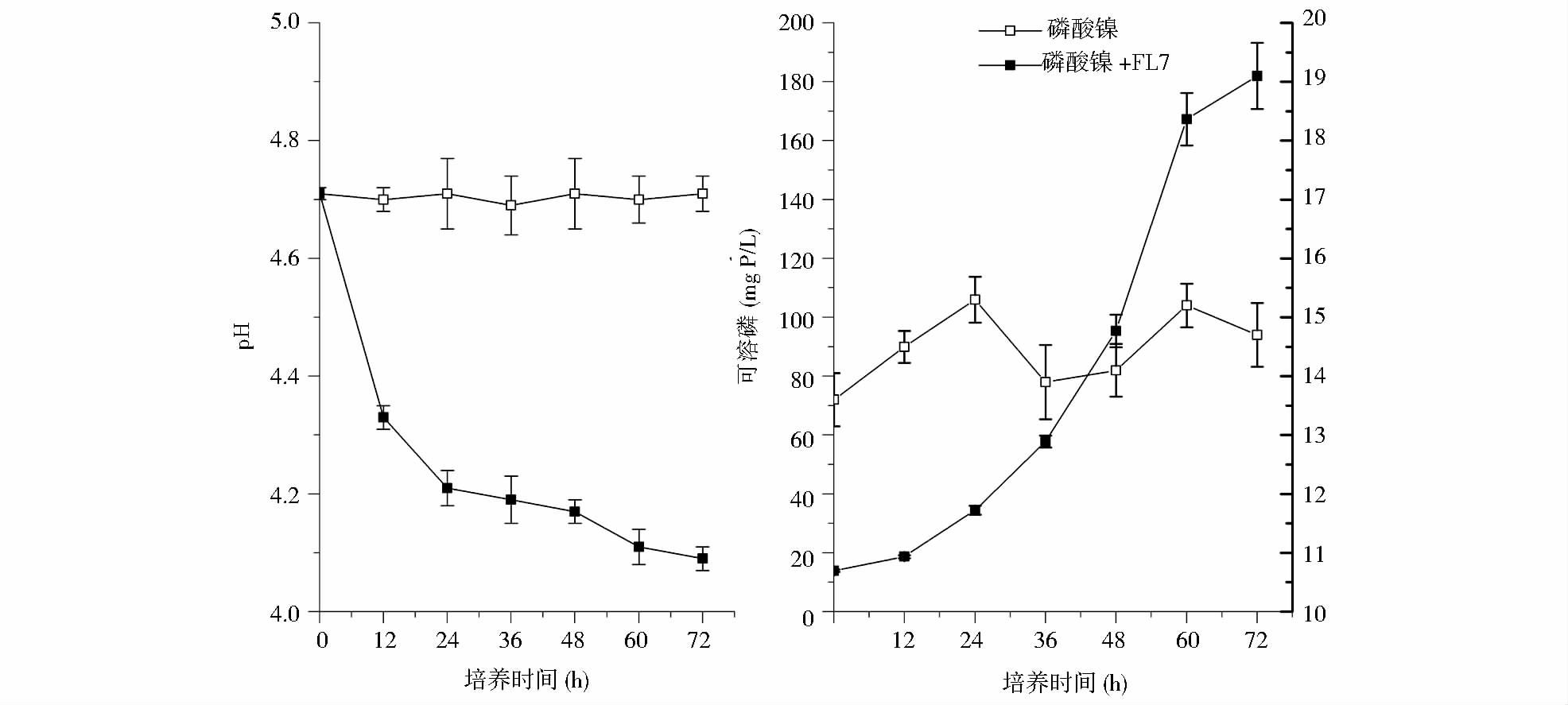
在YEPD液体培养实验中,对照组中解磷酵母P. farinose FL7的菌体浓度维持在1.68±0.07 (OD600mm),菌体浓度随培养基中Ni(NO3)2浓度的升高而平稳下降,当Ni(NO3)2浓度超过10mmol/L时,菌体浓度降至0.4以下,菌体生长受到明显抑制(图 3)。整体上P. farinose FL7表现出很好的Ni(NO3)2耐受性。
|
| 图 3 解磷酵母P. farinose FL7对Ni(NO3)2的耐受性 Fig. 3 Heavy metal tolerance of P. farinose FL7 to Ni(NO3)2 |
在利用植物提取技术治理重金属污染土壤的过程中,超累积植物的生物量是一个关键因素,植物提取技术的有效性就取决于植物生物量和重金属离子在植物中的积累量,已有研究表明接种根际促生菌能够显著促进超累积植物的生长和铜(Cu)、Ni等重金属离子的吸收[27, 28, 29]。
在本研究中,添加P. farinose FL7菌悬液的无污染土壤中印度芥菜的生物量达到最大,为(0.37±0.01)g (图 4),是不添加P. farinose FL7菌悬液的无污染土壤组的1.48倍,表明P. farinose FL7对印度芥菜具有明显的生长促进作用。此外,在不添加P. farinose FL7菌悬液的土壤处理方式中,重金属Ni以离子形式存在于土壤时,印度芥菜的生长受到影响,其生物量与不添加P. farinose FL7混悬液的无污染土壤相比明显降低;重金属Ni以难溶性Ni3(PO4)2的形式存在于土壤时,印度芥菜的生长几乎不受影响(图 4)。据Pulford等和Watson[30]报道,土壤中大量存在的重金属离子会干扰植物根系对Ca、Fe、Mg、P等营养元素的吸收和基本营养元素的代谢功能,导致植物生长发育迟缓。
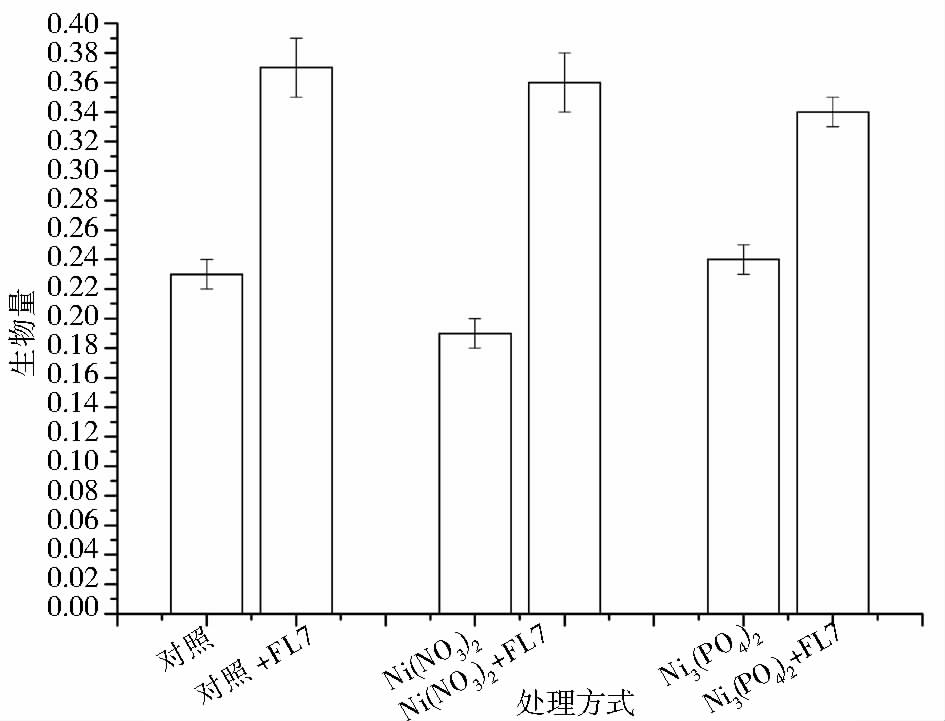
|
| 图 4 盆栽试验中不同处理方式下印度芥菜的生物量 Fig. 4 Biomass accumulation of B. juncea under different soil treatments during phytoextraction |
在盆栽试验中,我们还研究了添加P. farinose FL7对Ni+污染土壤和Ni3(PO4)2污染土壤中印度芥菜生长的影响。与不添加P. farinose FL7菌悬液的无污染土壤相比,在两种污染类型的土壤中P. farinose FL7均能够促进印度芥菜生物量的积累,且印度芥菜的生物量与添加P. farinose FL7的无污染土壤中的生物量积累相近(图 4)。这表明,通过添加P. farinose FL7可以改变根际微生物的活性,一方面能够改善超累积植物的生长,另一方面能够提高宿主植物对重金属毒性的抵抗力。Aboudrar等[31]的研究也表明,具有Ni耐受性的根际微生物能够提高超累积植物的重金属抗性。
2.4 解磷酵母P. farinose FL7对土壤中有效磷含量的影响不同处理方式下,盆栽试验前后土壤pH对比如表 3所示。与所有未添加P. farinose FL7的实验组相比,添加P. farinose FL7后,土壤pH明显降低,且Ni(NO3)2+FL7>Ni3(PO4)2+FL7>对照+FL7,由此进一步表明P. farinose FL7能够分泌有机酸导致土壤pH降低[17]。
| 土壤处理方式 | ||||||
| 对照 | 对照+FL7 | Ni(NO3)2 | Ni(NO3)2+FL7 | Ni3(PO4)2 | Ni3(PO4)2+FL7 | |
| 试验前 | 7.51±0.05 | 7.49±0.02 | 7.42±0.04 | 7.43±0.01 | 7.48±0.05 | 7.47±0.03 |
| 试验后 | 7.47±0.03 | 7.02±0.11 | 7.47±0.02 | 7.12±0.05 | 7.51±0.03 | 7.07±0.05 |
图 5所示不同处理方式下土壤有效P含量变化的数据表明,在盆栽试验条件下,解磷酵母P. farinose FL7也表现出很好的解磷能力。在所有实验组中,添加P. farinose FL7对照组(对照+FL7)的土壤有效P含量一直为最高,在盆栽试验结束时达到(397.4±8.7)mg/kg,是不添加P. farinose FL7对照组的6.87倍。但当向土壤中以Ni(NO3)2形式添加80mg/kg重金属Ni时,土壤有效P在试验过程中达到最低,在第42天时仅为(27.6±1.3)mg/kg,这可能是因为加入的Ni2+一方面与原土壤中的可溶P生成磷酸盐沉淀,另一方面抑制了土壤中自生解磷微生物的解磷活性。当向Ni(NO3)2污染土壤中加入P. farinose FL7菌剂后,土壤有效P含量从盆栽试验的第14天开始持续上升,在第42天达到(201.6±5.5)mg/kg,由此表明,加入的P. farinose FL7能够耐受Ni2+并表现出解磷能力。此外,与未添加P. farinose FL7的对照组相比,当向土壤中加入Ni3(PO4)2后,土壤可溶P含量出现小幅度下降,当Ni3(PO4)2污染土壤加入P. farinose FL7后,土壤有效P也出现大幅度增加。
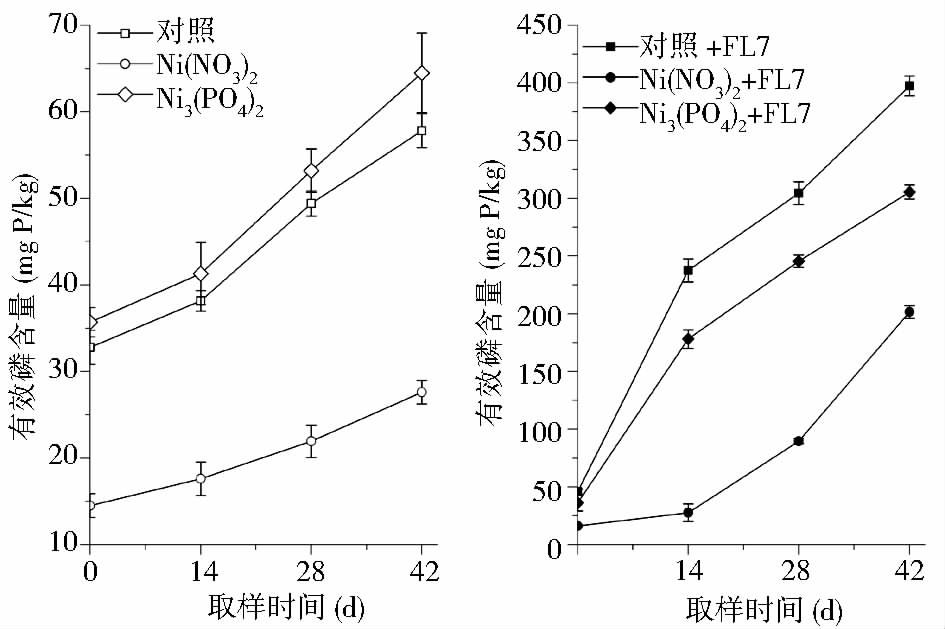
|
| 图 5 盆栽试验中不同处理方式下土壤有效磷含量的变化 Fig. 5 Time-course variation of available phosphate content in soil under different treatments during pot experiment |
在盆栽试验过程中,我们采用Tessier连续提取法研究了植物提取前后土壤中各形态Ni组分的变化(图 6)。Tessier连续提取法是根据各形态组分的生物可利用度,将土壤中的重金属分为NaOAc可交换态、碳酸盐吸附态、Fe-Mn氧化物吸附态及残留态[14]。本研究中,根据生物可利用度将可交换态、碳酸盐吸附态、Fe-Mn氧化物吸附态Ni的总和定义为有效态Ni,将残留态Ni定义为无效态Ni。
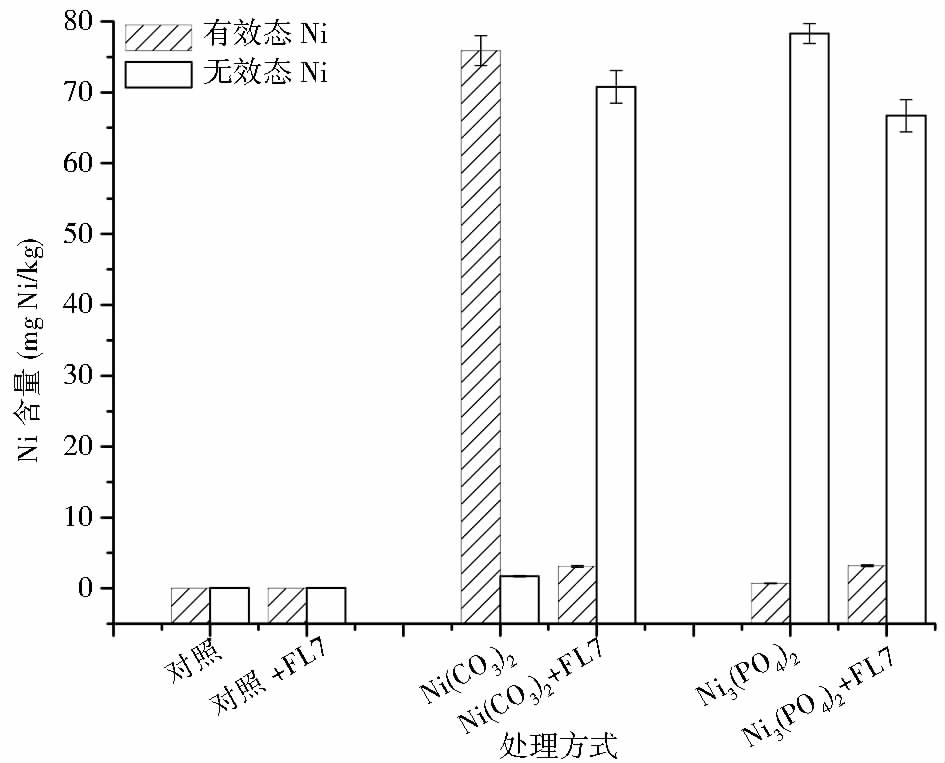
|
| 图 6 盆栽试验中不同处理方式下土壤有效态Ni、无效态Ni的含量 Fig. 6 Changes of bioavailable and biounavailable nickel content in soil under different treatments during pot experiment |
在盆栽试验前,未污染土壤中的Ni含量为(0.06±0.00)mg/kg,主要以无效态Ni的形式存在,占土壤总Ni含量的80%,有效态Ni仅占20%。无论添加P. farinose FL7菌悬液与否,在植物修复过程中,未污染土壤中的各形态Ni的含量变化不大。
当向土壤中以Ni(NO3)2的形式添加80mg/kg重金属Ni时,土壤中的Ni主要以有效态形式存在[(78.3±1.2)mg/kg,试验前],占全部Ni含量的98%。在试验过程中,不添加P. farinose FL7菌悬液的土壤中有效态Ni的含量在试验结束时降至(75.9±2.1)mg/kg,这一方面是因为超累积植物印度芥菜对重金属Ni的吸收,另一方面是因为添加到土壤中的金属离子随着时间的推移缓慢且持续地扩散到土壤颗粒内部;添加P. farinose FL7菌悬液的土壤中有效态Ni的含量在试验终点时降至(3.1±0.1)mg/kg,占土壤总Ni含量的4.2%,无效态Ni的含量为(70.8±2.3)mg/kg,占土壤总Ni含量的95.8%。这表明,添加解磷酵母P. farinose FL7能够显著降低Ni(NO3)2污染土壤中Ni+的流动性。这主要是因为解磷酵母P. farinose FL7能够从土壤中溶解Ca3(PO4)2、AlPO4、FePO4,释放PO3-4,从而将水溶性Ni+以金属磷酸盐的形式固定下来,形成无效态Ni。
当向土壤中以Ni3(PO4)2的形式添加80mg/kg重金属Ni时,土壤中的Ni主要以无效态形式存在[(79.3±3.5)mg/kg,试验前],占土壤总Ni含量的99%;有效态Ni的含量为(0.8±0.1)mg/kg。经P. farinose FL7菌悬液处理的Ni3(PO4)2污染土壤在盆栽试验结束时有效态Ni的含量达到(3.2±0.1)mg/kg,是未添加P. farinose FL7菌悬液土壤组的4.57倍;同时,无效态Ni的含量比未添加P. farinose FL7菌悬液土壤组减少了12.1mg/kg。这表明P. farinose FL7能够将部分以难溶性磷酸盐形式沉淀下来的重金属Ni重新溶解为有效态Ni,从而提高植物提取过程中Ni的流动性。
Tiwari等[32]的研究表明,微生物对重金属Ni的溶解或固定功能一般是特异性的,具有溶解功能微生物能够提高Ni的生物有效性,具有固定功能的微生物能够降低Ni的生物有效性。本研究表明,解磷酵母P. farinose FL7对重金属Ni具有固定-溶解双重功能:一方面P. farinose FL7对Ca3(PO4)2、AlPO4、FePO4的溶解能力使其能够将土壤中大量存在的重金属Ni2+以难溶物的形式固定下来;另一方面P. farinose FL7对Ni3(PO4)2的溶解功能能够将部分固定化的Ni溶解出来,形成可被植物吸收累积的部分。
2.6 解磷酵母P. farinose FL7对重金属Ni植物吸收的影响不同土壤处理方式下,印度芥菜对Ni的植物吸收量如图 7所示。在未污染土壤中,无论添加P. farinose FL7菌悬液与否,均没有在印度芥菜中检测到Ni的积累。当重金属Ni以Ni(NO3)2形式存在时,印度芥菜中重金属Ni含量为(326±10)mg/kg。向Ni(NO3)2污染土壤中添加P. farinose FL7菌悬液后,印度芥菜中重金属Ni的含量增加了50%。与Ni(NO3)2污染土壤相比,当土壤中的重金属以Ni3(PO4)2形式存在时,印度芥菜植物中Ni的含量降低了17%,这是重金属Ni的生物可利用度降低的缘故。当向Ni3(PO4)2污染土壤中添加解磷酵母P. farinose FL7菌悬液后,印度芥菜中Ni的积累量增加,并且与经P. farinose FL7菌悬液处理过Ni(NO3)2污染土壤中印度芥菜Ni的含量相当,为(481±11)mg/kg。可见,不论土壤中的重金属Ni以可溶性Ni(NO3)2形式存在,还是以不溶性Ni3(PO4)2形式存在,解磷酵母P. farinose FL7均能提高植物中重金属Ni的积累。
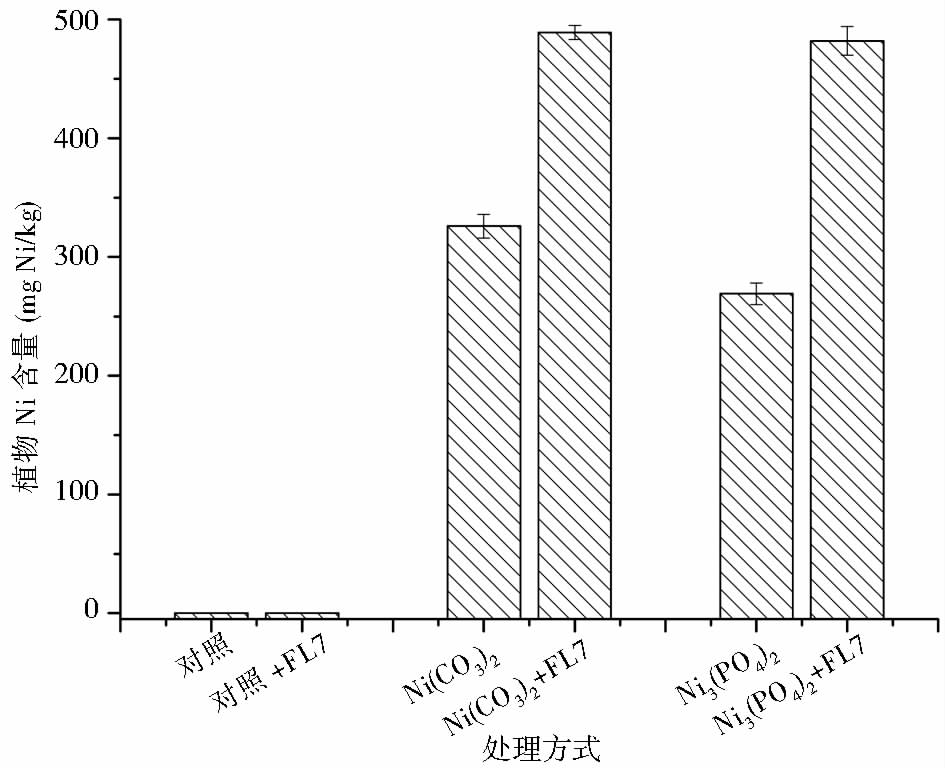
|
| 图 7 盆栽试验后,不同土壤处理方式下印度芥菜中Ni的含量 Fig. 7 Nickel accumulation in B. juncea under different soil treatments after pot experiment |
以生物量×植物含量计算每个盆栽中印度芥菜对重金属Ni的提取量,Ni(NO3)2污染土壤不经P. farinose FL7菌悬液处理组Ni的提取量为(61.9×10-3)mg,Ni(NO3)2污染土壤经过P. farinose FL7菌悬液处理组Ni为176.0×10-3mg,比前者增加了184%。Ni3(PO4)2污染土壤不经P. farinose FL7菌悬液处理组Ni的提取量为64.8×10-3mg,Ni3(PO4)2污染土壤经过P. farinose FL7菌悬液处理组Ni为163.5×10-3mg,也比前者增加了152%。这表明,用P. farinose FL7处理能够显著加快Ni(NO3)2或Ni3(PO4)2污染土壤中Ni的清除速率。
3 结 论本实验将对Ca3(PO4)2、AlPO4和FePO4具有较强溶解能力的酵母P. farinose FL7用于重金属Ni污染土壤的植物提取。研究表明,P. farinose FL7对Ni3(PO4)2具有一定溶解的能力,并对Ni(NO3)2具有较强的耐受性。盆栽试验中有效P和Ni生物有效性的数据表明,P. farinose FL7在Ni(NO3)2或Ni3(PO4)2污染土壤中均表现出解磷活性,并且能够将Ni(NO3)2污染土壤中存在的大部分Ni2+转化为无效态Ni,同时可将Ni3(PO4)2污染土壤中的无效态Ni溶解,由此说明P. farinose FL7对Ni具有固定-溶解的双重功能。盆栽试验还表明,解磷酵母P. farinose FL7还能促进超累积植物印度芥菜的生物量积累和对重金属Ni的吸收,可显著提高植物提取修复Ni污染土壤时的清除速率。
| [1] | 王瑞,于宗灵,关旸. 土壤镍污染植物修复的研究进展. 环境管理与科学,2013,38(8):111-114. Wang R,Yu Z L,Guan Y. Overview on phytoextraction of nickel contaminated soil. Environmental Science and Management, 2013, 38(8):111-114. |
| [2] | 张秀玲,宋光煜. 植物的镍素营养. 土壤肥料,2004,6:33-36. Zhang X L, Song G Y. The Nickel Nutrition of Plant. Soils and Fertilizers, 2004, (6):33-36. |
| [3] | 蔡信德,仇荣亮,陈桂珠. 镍污染对土壤微生物的生态效应. 生态科学, 2004,23(3):273-277. Cai X D, Qiu R L, Chen G Z. Review on ecological effects of microorganism in nickel polluted soil. Ecological Science, 2004, 23(3):273-277. |
| [4] | Kavamura V N, Esposito E. Biotechnological strategies applied to the decontamination of soils polluted with heavy metals. Biotechnology Advances, 2010, 28(1): 61-69. |
| [5] | Bhargava A, Carmona F F, Bhargava M, et al. Approaches for enhanced phytoextraction of heavy metals. Journal of Environmental Management, 2012, 105: 103-120. |
| [6] | Rajkumar M, Sandhya S, Prasad M N V, et al. Perspectives of plant-associated microbes in heavy metal phytoremediation. Biotechnology Advances, 2012, 30(6): 1562-1574. |
| [7] | Sun Y, Zhou Q, An J, et al. Chelator-enhanced phytoextraction of heavy metals from contaminated soil irrigated by industrial wastewater with the hyperaccumulator plant (Sedum alfredii Hance). Geoderma, 2009, 150(1-2): 106-112. |
| [8] | Kos B, Letan D. Chelator induced phytoextraction and in situ soil washing of Cu. Environmental Pollution, 2004, 132(2): 333-339. |
| [9] | Cao X, Wahbi A, Ma L, et al. Immobilization of Zn, Cu, and Pb in contaminated soils using phosphate rock and phosphoric acid. Journal of Hazardous Materials, 2009, 164(2): 555-564. |
| [10] | Park J H, Bolan N, Megharaj M, et al. Comparative value of phosphate sources on the immobilization of lead, and leaching of lead and phosphorus in lead contaminated soils. Science of the Total Environment, 2011, 409(4): 853-860. |
| [11] | He M, Shi H, Zhao X, et al. Immobilization of Pb and Cd in contaminated soil using nano-crystallite hydroxyapatite. Procedia Environmental Sciences, 2013, 18(18): 657-665. |
| [12] | Jeong S, Moon H S, Shin D, et al. Survival of introduced phosphate-solubilizing bacteria (PSB) and their impact on microbial community structure during the phytoextraction of Cd-contaminated soil. Journal of Hazardous Materials, 2013, 263(2): 441-449. |
| [13] | Park J H, Bolan N, Megharaj M, et al. Isolation of phosphate solubilizing bacteria and their potential for lead immobilization in soil. Journal of Hazardous Materials, 2011, 185(2): 829-836. |
| [14] | Park J H, Bolan N. Lead immobilization and bioavailability in microbial and root interface. Journal of Hazardous Materials, 2013, 261(13): 777-783. |
| [15] | Park J H, Bolan N, Megharaj M, et al. Concomitant rock phosphate dissolution and lead immobilization by phosphate solubilizing bacteria (Enterobacter sp.). Journal of Environmental Management, 2011, 92(4): 1115-1120. |
| [16] | Jeong S, Moon H S, Nam K, et al. Application of phosphate-solubilizing bacteria for enhancing bioavailability and phytoextraction of cadmium (Cd) from polluted soil. Chemosphere, 2012, 88(2): 204-210. |
| [17] | Zhu H J, Sun L F, Zhang Y F, et al. Conversion of spent mushroom substrate to biofertilizer using a stress-tolerant phosphate-solubilizing Pichia farinose FL7. Bioresource Technology, 2012, 111: 410-416. |
| [18] | Murphy J, Riley J P. A modified single solution method for the determination of phosphate in natural waters. Analytica Chimica Acta, 1962, 27: 31-36. |
| [19] | Qian P, Schoenaru J J, Karamanos R E. Simultaneous extraction of available phosphorus and potassium with a new soil test: a modification of Kelowna extraction. Communications in Soil Science and Plant Analysis, 1994, 25(5-6): 627-635. |
| [20] | Tessier A, Campbell P G C, Bisson M. Sequential extraction procedure for the speciation of particulate trace metals. Analytical Chemistry, 1979, 51(7): 844-851. |
| [21] | Achal V, Savant V V, Reddy M S. Phosphate solubilization by a wild type strain and UV-induced mutants of Aspergillus tubingensis. Soil Biology and Biochemistry, 2007, 39(2):695-699. |
| [22] | Reyes I, Baziramakenga R, Bernier L, et al. Solubilization of phosphate rocks and minerals by a wild-type strain and two UV-induced mutants of Penicillium rugulosum. Soil Biology and Biochemistry, 2001, 33(12-13):1741-1747. |
| [23] | Vyas P, Rahi P, Chauhan A, et al. Phosphate solubilization potential and stress tolerance of Eupenicillium parvum from tea soil. Mycological Research, 2007, 111(8):931-938. |
| [24] | Barroso C B, Nahas E. The status of soil phosphate fractions and the ability of fungi to dissolve hardly soluble phosphates. Applied Soil Ecology, 2005, 29(1):73-83. |
| [25] | Qin L, Jiang H, Tian J, et al. Rhizobia enhance acquisition of phosphorus from different sources by soybean plants. Plant and Soil, 2011, 349(1-2): 25-36. |
| [26] | Miransari M. Hyperaccumulators, arbuscular mycorrhizal fungi and stress of heavy metals. Biotechnology Advances, 2011, 29(6): 645-653. |
| [27] | Ma Y, Rajkumar M, Freitas H. Improvement of plant growth and nickel uptake by nickel resistant-plant-growth promoting bacteria. Journal of Hazardous Materials, 2009, 166(2-3): 1154-1161. |
| [28] | Ma Y, Rajkumar M, Freitas H. Inoculation of plant growth promoting bacterium Achromobacter xylosoxidans strain Ax10 for the improvement of copper phytoextraction by Brassica juncea. Journal of Environmental Management, 2009, 90(2): 831-837. |
| [29] | Ma Y, Rajkumar M, Freitas H. Isolation and characterization of Ni mobilizing PGPB from serpentine soils and their potential in promoting plant growth and Ni accumulation by Brassica spp.. Chemosphere, 2009, 75(6): 719-725. |
| [30] | Pulford I D, Watson C. Phytoremediation of heavy metal-contaminated land by trees-a review. Environment International, 2003, 29(4): 529-540. |
| [31] | Aboudrar W, Schwartz C, Morel J L, et al. Effect of nickel-resistant rhizosphere bacteria on the uptake of nickel by the hyperaccumulator Noccaea caerulescens under controlled conditions. Journal of Soils and Sediments, 2013, 13(3): 501-507. |
| [32] | Tiwari S, Kumari B, Singh S N. Microbe-induced changes in metal extractability from fly ash. Chemosphere, 2008, 71(7): 1284-1294. |
 2015, Vol. 35
2015, Vol. 35