2. 南京中医药大学 中药资源产业化与方剂创新药物国家地方联合工程研究中心, 南京 210023;
3. 江苏康缘药业股份有限公司, 连云港 222001;
4. 宁夏医科大学, 银川 750004
2. National and Local Collaborative Engineering Center of Chinese Medicinal Resources Industrialization and Formulae Innovative Medicine, Nanjing University of Chinese Medicine, Nanjing 210023, China;
3. Kanion Pharmaceutical Co., Ltd., Lianyungang 222001, China;
4. Ningxia Medical University, Yinchuan 750004, China
桃仁与山桃仁为2015年版《中华人民共和国药典》收载的桃仁药材的不同基原,分别来自蔷薇科(Rosaceae)植物桃Prunus persica(L.)Batsch与山桃Prunus davidiana(Carr.)Franch.的干燥成熟种子,具有活血祛瘀,润肠通便,止咳平喘等疗效[1]。桃仁作为常用中药材,其质量控制方法报道较多,主要仍集中于对苦杏仁苷[2]的研究,但油脂类成分也是桃仁重要的功效成分之一,研究较少。虽然现行版《中华人民共和国药典》将2种基原桃仁收载为同一药材,它们是以外观性状加以区别鉴定,主要依靠性状鉴别,两者差异较为明显,桃仁呈扁长卵形,较大;山桃仁呈类卵圆形,较小而肥厚。但关于它们之间化学成分差异的研究报道甚少。因此本文采用现代分析技术手段测定桃仁、山桃仁中脂肪酸类、氰苷类等多个有效成分,并结合化学计量学的方法,探究它们之间可能存在的化学成分差异,为桃仁和山桃仁的质量控制与临床用药提供参考。
1 仪器与材料 1.1 仪器ACQUITY UPLC系统(二元高压泵,自动进样器,柱温箱,二极管阵列检测器,Waters公司);SynaptTMQ-TOF质谱仪(Waters公司),配有Lock-spay接口,电喷雾离子源(ESI);MassLynxTM质谱工作站(Waters公司);PerkinElmer Clarus气相色谱仪串联AXION-iQT质谱检测器(PerkinElmer公司);NIST标准质谱图库(2011版,美国国家标准技术研究院),WILEY标准质谱图库(John Wiley &Sons公司);Sartorius BT125D电子分析天平(塞多利斯公司);Milli-Q超纯水制备仪;KQ-250E型超声波清洗器(昆山禾创超声仪器有限公司);AnkeGL-16 GII型离心机(上海安亭科学仪器厂)。
1.2 材料对照品苦杏仁苷(批号Z28A6L2815)购自上海源叶生物科技有限公司,野黑樱苷(批号99-18-3)购自南京春秋生物技术有限公司,纯度均大于95%;37种脂肪酸甲酯混合对照品(批号CDDE-GLC-NESTLE-37-25MG)购自上海源叶生物科技有限公司。甲醇、乙醚、正己烷、氢氧化钾、氯化钠、无水硫酸钠均为分析纯,购自南京化学试剂有限公司;14%三氟化硼甲醇溶液(批号BCBW1424)购自Sigma-Aldrich公司;甲酸、乙腈为色谱纯,购自MERCK公司;超纯水由Milli-Q纯水机制备。
22批桃仁样品,其详细信息见表 1。实验所用桃仁样品经南京中医药大学严辉副教授鉴定为蔷薇科(Rosaceae)植物桃Prunus persica(L.)Batsch及山桃Prunus davidiana(Carr.)Franch.的干燥成熟种子。
|
|
表 1 桃仁样品信息 Tab.1 Sample information of Persicae Semen |
取脂肪酸甲酯混合对照品适量,用正己烷溶制得混合对照品储备液(棕榈酸质量浓度为1 315 μg·mL-1,其他脂肪酸甲酯质量浓度均为657.5 μg·mL-1)。精密量取混合对照品储备液100 μL,置于5 mL量瓶中,加内标溶液50 μL,用正己烷定容至刻度,摇匀,即得混合对照品溶液。取水杨酸甲酯适量,用正己烷配成质量浓度为2.02 mg·mL-1的内标溶液。
2.1.2 油的提取取样品粉末(过2号筛)约5 g,精密称定,置于100 mL具塞锥形瓶中,精密加入乙醚50 mL,静置12 h,室温超声(40 kHz)45 min,滤过,并用乙醚洗涤残渣,收集滤液,用旋转蒸发仪回收溶剂,至恒量,得桃仁油。
2.1.3 供试品溶液的制备取桃仁油样品约0.1 g,精密称定,置于10 mL具塞刻度试管中,加入5%氢氧化钾甲醇溶液2 mL,摇匀,于60 ℃恒温水浴30 min,冷却至室温,加14%三氟化硼甲醇溶液2 mL,振摇,于60 ℃恒温水浴15 min,取出冷却至室温,精密加入正己烷2 mL,振摇萃取,加饱和氯化钠溶液2 mL,静置分层,取上清液即得甲酯化溶液。准确量取内标溶液10 μL,置于1 mL量瓶中,加入上述甲酯化溶液定容,混匀,0.22 μm微孔滤膜滤过,得供试品溶液1(用于测定十二烷酸、十四烷酸、十六碳烯酸、十七烷酸、二十烷酸);精密移取上述甲酯化溶液50 μL,置于10 mL量瓶中,用正己烷定容,得供试品甲酯化溶液稀释液,准确量取10 μL内标溶液置于1 mL量瓶中,用供试品甲酯化溶液稀释液定容,混匀,0.22 μm微孔滤膜滤过,得供试品溶液2(用于测定棕榈酸、亚油酸、油酸、硬脂酸)。
2.1.4 GC-MS检测条件采用Agilent HP-5 MS石英毛细管色谱柱(0.25 mm×30 mm,0.25 μm),程序升温(0~4 min,50 ℃;4~13 min,50→140 ℃;13~ 17 min,140 ℃;17~37 min,140→180 ℃;37~82 min,180→225 ℃;82~85 min,225 ℃;85~90.5 min,225→ 280 ℃;90.5~92.5 min,280 ℃),载气为氦气,分流比20:1,流速1 mL·min-1,进样口温度200 ℃,检测口温度250 ℃,进样量1 μL;电子轰击离子源(EI),离子源温度230 ℃,电子能量为70 eV,气相色谱-质谱接口温度为230 ℃,扫描范围为m/z 40~400。
在上述检测条件下进样1 μL进行GC-MS分析,所得混合对照品溶液及供试品溶液气相色谱-质谱总离子流色谱图见图 1。
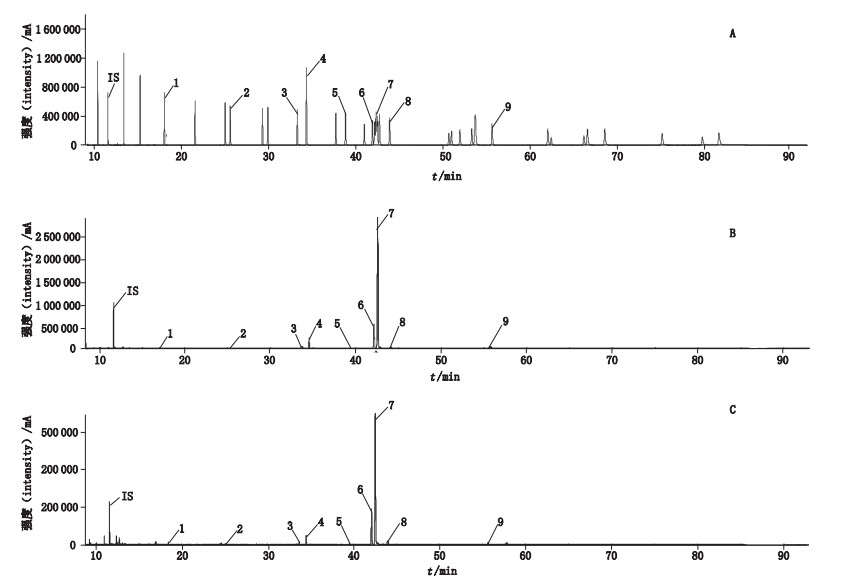
|
1.十二烷酸(dodecanoic acid)2.十四烷酸(myristic acid)3.十六碳烯酸(hexadecanoic acid)4.棕榈酸(palmitic acid)5.十七烷酸(heptadecanoic acid)6.亚油酸(linoleic acid)7.油酸(oleic acid)8.硬脂酸(stearic acid)9.二十烷酸(eicosanoid)IS.内参物(internal reference)A.混合对照品(mixed reference substances)B.桃仁(Prunus persica seeds)C.山桃仁(Prunus davidiana seeds) 图 1 不同品种桃仁脂肪酸类化学成分分析GC-MS总离子流图 Fig.1 GC-MS total ion chromatograms of fatty acids in Persicae Semen of different origin |
精密量取混合对照品储备液100 μL,置于5 mL量瓶中,加内标溶液50 μL,用正己烷定容至刻度,摇匀,按“2.1.4”检测条件连续进样6次,以对照品与内标物峰面积的比值计算各脂肪酸的RSD。结果十二烷酸、十四烷酸、十六碳烯酸、棕榈酸、十七烷酸、亚油酸、油酸、硬脂酸、二十烷酸的RSD分别为2.8%、2.4%、3.6%、2.4%、4.0%、3.3%、2.6%、2.4%、2.1%,表明本方法精密度良好。
2.1.6 重复性试验取桃仁油样品6份,每份约0.1 g,精密称定,按“2.1.4”项甲酯化处理,平行制备供试品溶液1、供试品溶液2各6份。按“2.1.4”色谱条件分别进样1 μL进行分析,测定各成分含量,计算RSD。结果十二烷酸、十四烷酸、十六碳烯酸、棕榈酸、十七烷酸、亚油酸、油酸、硬脂酸、二十烷酸的RSD分别为2.7%、3.3%、3.0%、2.3%、2.3%、2.2%、3.6%、3.6%、1.6%,表明本方法重现性良好。
2.1.7 稳定性试验取重复性试验所得供试品溶液1、供试品溶液2各1份,在室温下分别放置0、2、6、8、12 h后,按“2.1.4”检测条件分别进样1 μL进行分析,以对照品与内标峰面积的比值计算各脂肪酸的RSD。结果十二烷酸、十四烷酸、十六碳烯酸、棕榈酸、十七烷酸、亚油酸、油酸、硬脂酸、二十烷酸的RSD分别为2.1%、3.2%、2.7%、2.9%、2.6%、3.8%、3.4%、2.9%、3.4%,表明供试品溶液在室温下12 h内稳定性良好。
2.1.8 得油率以得油率作为指标进行评价[得油率=(油质量/样品质量)×100%];桃仁平均得油率(n=11)为(45.46±2.42)%,山桃仁平均得油率(n=11)为(51.83±0.98)%。利用SPSS 22.0数据处理软件进行t检验分析,P < 0.001,说明桃仁与山桃仁的得油率存在显著性差异,山桃仁的得油率显著高于桃仁。
2.1.9 脂肪酸的测定结果药材脂肪酸含量以其单位质量峰面积Ai /(As·W)代表,采用SPSS 22.0数据处理软件对此值进行t检验分析,结果见表 2。结果表明,桃仁、山桃仁药材中,十二烷酸、十四烷酸、十六碳烯酸、棕榈酸、十七烷酸、亚油酸、油酸、二十烷酸在两者间均具有显著性差异。其中,桃仁中十二烷酸、十四烷酸等饱和脂肪酸含量显著高于山桃仁;而油酸、棕榈酸等不饱和脂肪酸在山桃仁中的含量显著高于桃仁。此外,桃仁与山桃仁之间不饱和脂肪酸占比分别为89.01%、90.42%,虽然两者之间占比差异不大,但在含量上存在明显的差异。
|
|
表 2 脂肪酸类化学成分分析 |
分别精密称取苦杏仁苷、野黑樱苷的对照品适量,用甲醇配成质量浓度分别为21.5 mg·L-1、20.3 mg·L-1的混合对照品溶液。
2.2.2 供试品溶液的制备取样品粉末(过2号筛)约1 g,精密称定,置50 mL具塞锥形瓶中,精密加入70%甲醇20 mL,称定质量,静置12 h,超声处理(功率400 W,频率40 kHz)40 min,70%甲醇补足减失的量,摇匀,离心(12 000 r·min-1)10 min,取上清液,0.22 μm微孔滤膜滤过,取续滤液即得。
2.2.3 色谱-质谱条件采用Waters ACQUITY UPLC BEH C18(100 mm×2.1 mm,1.7 μm)色谱柱,柱温为35 ℃,流动相为乙腈(A)-0.1%甲酸水溶液(B),梯度洗脱(0~6 min,5%A→20%A;6~11 min,20%A→ 35%A;11~16 min,35%A→60%A;16~21 min,60%A→80%A;21~23 min,80%A→95%A),体积流量0.4 mL·min-1,进样量2 μL。采用电喷雾电离离子源(ESI),正负离子模式扫描,锥孔电压30 V,毛细管电压3.0 kV,脱溶剂气温度350 ℃,离子源温度120 ℃,脱溶剂气流量800 L·h-1,锥孔气流量50 L·h-1,碰撞能量6~40 eV,质量扫描范围m/z 100~1 000;数据采集方式和模式:Centroid。以亮氨酸-脑啡肽进行精质量实时校正,锁校质荷比分别为556.277 1(正离子模式)和554.261 5(负离子模式)。
在质谱正、负离子模式下检测,桃仁和山桃仁的基峰离子流色谱图(BPI图)见图 2、3。由于在正、负离子模式下,所鉴定差异性成分相同,故本文采用其中1种模式(负离子)进行分析。
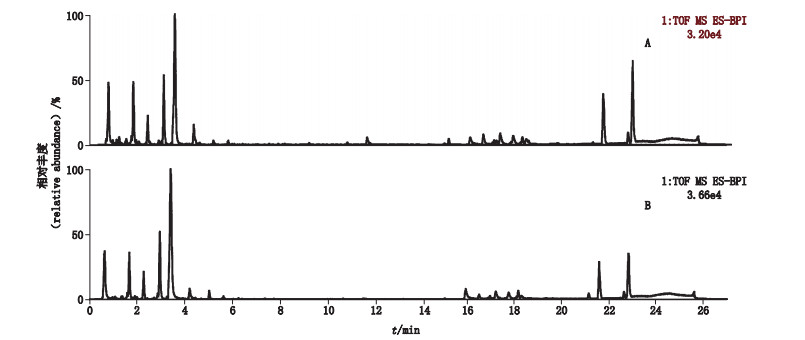
|
图 2 桃仁(A)和山桃仁(B)UPLC-Q-TOF/MS负离子模式下基峰离子流色谱图 Fig.2 Typical UPLC-Q-TOF/MS chromatograms of Prunus persica seeds(A)and Prunus davidiana seeds(B)in negative ion mode |
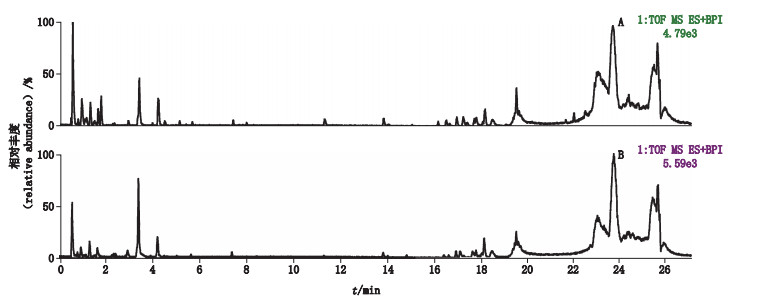
|
图 3 桃仁(A)和山桃仁(B)UPLC-Q-TOF/MS正离子模式下基峰离子流色谱图 Fig.3 Typical UPLC-Q-TOF/MS chromatograms of Prunus persica seeds(A)and Prunus davidiana seeds(B)in positive ion mode |
在质谱负离子模式下,将采集的原始样品质谱数据采用MarkerLynx XS软件进行峰提取、峰匹配、峰识别以及归一化等预处理,通过单位质量峰面积的值进行PCA和OPLS-DA等多元变量统计分析,结合S-Plot及变量权重重要性排序(variable importance in projection,VIP)值筛选出桃仁和山桃仁之间的差异性标志物。MarkerLynx XS软件的主要参数设置如下:保留时间范围为0~23 min;m/z 100~1 000;噪音消除水平为6.0;质量偏差为0.01;质量窗口为0.02。
2.2.5 UPLC-Q-TOF/MS差异标志物的筛选与鉴定采用PCA模式识别桃仁和山桃仁化学成分的差异,所得PCA得分图见图 4。由图 4可以看出,桃仁和山桃仁各自能较好的聚为一类,且在主成分t[1]轴上有明显的区分,表明桃仁和山桃仁之间化学成分差异显著。
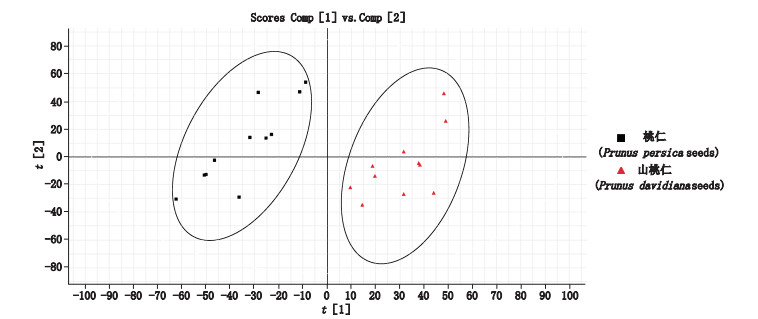
|
图 4 桃仁与山桃仁PCA得分图 Fig.4 PCA score plot of Prunus persica seeds and Prunus davidiana seeds |
PCA为无监督的分析方法,反映了数据的原始状态,不能忽略组内误差以及消除与研究目的无关的随机误差,PCA的分类结果往往还不够理想;而OPLS-DA作为一种有监督的模式分析方法是在PCA的基础上将与Y矩阵相关的X矩阵和与Y矩阵无关的X矩阵加以区分并滤除无关的X变量,从而更好地区分组间差异,增强模型的解释能力。因此,为便于后续寻找差异成分,本研究建立了桃仁与山桃仁的OPLS-DA模型,根据OPLS-DA分析得到的S-Plot图(图 5)并结合VIP值对差异性成分进行筛选,通过负离子一级和选择离子二级质谱扫描,并与文献报道相[3-8]比较,对照品保留时间行为及质谱数据比对,共筛选出12个差异性成分,鉴定了其中7个,分别为扁桃酸酰胺-β-龙胆二糖苷(C,tR 1.70 min,m/z 474.161 0)、扁桃酸-β-D-吡喃葡萄糖苷(D,tR 2.39 min,m/z 313.092 6)、苄基-β-龙胆二糖苷(E,tR 2.90 min,m/z 431.155 1)、苦杏仁苷(G,tR 3.46 min,m/z 456.150 2)、苦杏仁苷(H,tR 3.46 min,m/z 913.308 6)、野黑樱苷(I,tR 4.26 min,m/z 340.102 6)、Prupersin B(L,tR 9.14 min,m/z 417.118 4)。具体结果见表 3。
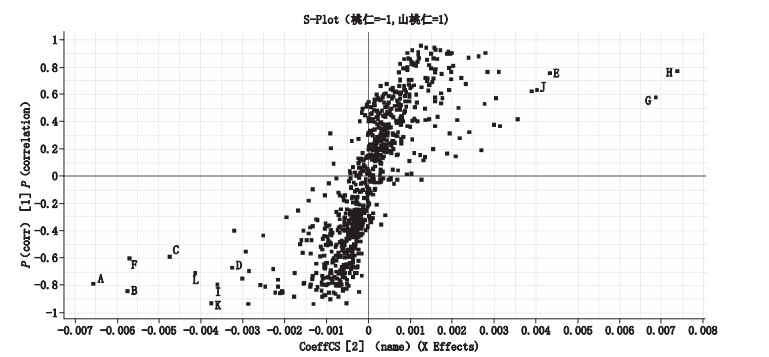
|
图 5 桃仁与山桃仁S-plot载荷图 Fig.5 S-plot of Prunus persica seeds and Prunus davidiana seeds |
|
|
表 3 桃仁与山桃仁差异性化学成分 Tab.3 Differential compounds in Prunus persica seeds and Prunus davidiana seeds |
为进一步明确上述鉴定成分在桃仁与山桃仁药材中的差异性,含量以单位质量峰面积(A/m)为代表,用SPSS 22.0数据处理软件对此值进行t检验分析,结果见表 4。结果表明,上述所鉴定成分均具有显著性的差异。桃仁药材中,扁桃酸酰胺-β-龙胆二糖苷、扁桃酸-β-D-吡喃葡萄糖苷、野黑樱苷、Prupersin B含量显著高于山桃仁;而苄基-β-龙胆二糖苷、苦杏仁苷在山桃仁药材中的含量显著高于桃仁。
|
|
表 4 差异性化学成分的相对含量差异 |
植物所含的油脂,主要包括游离脂肪酸及其甘油酯,且植物油脂中95%以上是脂肪酸甘油酯,油脂中脂肪酸的种类与相对含量是影响油脂的理化性质及生物活性的重要因素,甚至是区别不同来源油脂的主要判断指标。桃仁与山桃仁都是植物的成熟种子,富含油脂,它们的油脂类成分是其发挥药理活性的主要成分之一。作为2种植物成分的差异性研究,研究它们的油脂中脂肪酸的种类与相对含量差异是十分必要的。
本文采用一种公认的分析测试方法油脂皂化-衍生化的GC-MS分析测试方法进行研究,试图发现桃仁与山桃仁的油脂中脂肪酸的种类与相对含量的差异,虽然方法上没有创新,但其结果应该是可靠可信的。结果显示,它们的油脂中所含的脂肪酸类成分在种类上未发现不同,但在相对含量上存在一定的差异。
桃仁与山桃仁所含的化学成分基本相似,但有14个成分的相对含量存在显著差异。其中桃仁中十二烷酸等饱和脂肪酸及扁桃酸酰胺-β-龙胆二糖苷、扁桃酸-β-D-吡喃葡萄糖苷、野黑樱苷、Prupersin B含量显著高于山桃仁;而十六碳烯酸等不饱和脂肪酸及苄基-β-龙胆二糖苷、苦杏仁苷在山桃仁中的含量显著高于桃仁。它们都具有显著的生物活性,与桃仁的临床作用密切相关,如苦杏仁苷具有镇咳平喘、活血化瘀、抗肿瘤等作用,而其口服后在肠内转化为活性代谢物野黑樱苷而吸收[9];扁桃酸-β-D-吡喃葡萄糖苷、苄基-β-龙胆二糖苷、野黑樱苷尚具有抗肿瘤的作用[7];不饱和脂肪酸具有降血脂及防止血栓的形成,使血液的总胆固醇、低密度脂蛋白胆固醇下降,抗动脉粥样硬化的作用[10-13]。在桃仁药理活性研究的文献中[14-16],由于是同一药材的不同基原,基本上都没有明确研究对象是两者的哪一种。本文研究结果显示出两者在活性成分的相对含量上存在较为显著的差异,这些差异是否会引起药理活性的差异目前尚未见报道,有待进一步的研究。本文的研究结果可以给进行相关研究的学者提供一些参考。
此外,在市场上仍存在扁桃仁、苦杏仁等充当桃仁的混伪品,功效上有明显的区别,因此,建立桃仁及其伪品之间的鉴别方法还有待进一步研究。
| [1] |
中华人民共和国药典2015年版.一部[S].2015: 277 ChP 2015.Vol Ⅰ[S].2015: 277 |
| [2] |
叶晶晶. HPLC法测定不同产地桃仁中苦杏仁苷的含量[J]. 中华中医药学刊, 2011(1): 206. YE JJ. Determination of amygdal in Prunus persical (L.)Batsch produced in different areas by HPLC[J]. Chin Arch Tradit Chin Med, 2011(1): 206. |
| [3] |
云琦, 刘青旺, 马小华, 等. 新疆桃仁HPLC-UV指纹图谱研究及在地区分类中的应用[J]. 中国中药杂志, 2014, 39(5): 860. YUN Q, LIU QW, MA XH, et al. Quality assessment and classification of Persicae Semen based on HPLC-UV fingerprint[J]. China J Chin Mater Med, 2014, 39(5): 860. |
| [4] |
FUKUDA T, ITO H, MUKAINAKA T, et al. Anti-tumor promoting effect of glycosides from Prunus persica seeds[J]. Biol Pharm Bull, 2003, 26(2): 271. DOI:10.1248/bpb.26.271 |
| [5] |
ZHOU WJ, SONG JZ, FU WW, et al. Chemical comparison of two dosage forms of Hemp Seed Pills by UHPLC-Q-ToF-MS/MS and multivariate statistical techniques[J]. J Pharm Biomed Anal, 2013, 84(84C): 59. |
| [6] |
WANG JW, CHANG MH, LU CM, et al. Determination the active compounds of herbal preparation by UHPLC-MS/MS and its application on the preclinical pharmacokinetics of pure ephedrine, single herbal extract of Ephedra, and a multiple herbal preparation in rats[J]. J Chromatogr B, 2015, 1026(4): 152. |
| [7] |
尹权微, 李家春, 秦建平, 等. UPLC/Q-TOF-MS快速分析桂枝茯苓胶囊的入血成分[J]. 中国实验方剂学杂志, 2016, 22(21): 83. YIN QW, LI JC, QIN JP, et al. UPLC/Q-TOF-MS rapid analysis of components in plasma from Guizhi Fuling capsules[J]. Chin J Exp Tradit Med Form, 2016, 22(21): 83. |
| [8] |
陈晓燕.桃仁、桑叶化学成分及生物活性研究[D].北京: 北京协和医学院, 2014 CHEN XY.Studies on the Chemical Constituents and Bioactivities of the Seeds of Prunus davidiana and the Leaves of Morus alba[D].Beijing: Peking Union Med College, 2014 http://cdmd.cnki.com.cn/Article/CDMD-10023-1014345696.htm |
| [9] |
LIU L, DUAN JA, TANG Y, et al. Taoren-Honghua herb pair and its main components promoting blood circulation through influencing on hemorheology, plasma coagulation and platelet aggregation[J]. J Ethnopharmacol, 2012, 139(2): 381. DOI:10.1016/j.jep.2011.11.016 |
| [10] |
黄丽萍, 尹蓉, 张倩茹, 等. 桃仁中脂肪酸、氨基酸含量分析[J]. 农学学报, 2017, 7(11): 35. HUANG LP, YIN R, ZHANG QR, et al. Content of fatty acids and amino acids in peach kernel[J]. J Agric, 2017, 7(11): 35. DOI:10.11924/j.issn.1000-6850.casb16070076 |
| [11] |
YANG ZN, LUO SQ, YU ZW, et al. Quality evaluation of Semen Persicae(seed of Prunus persica L.Batsch)by gas chromatography-mass spectrometry[J]. Biochem Syst Ecol, 2011, 39(3): 183. DOI:10.1016/j.bse.2011.03.007 |
| [12] |
裴瑾, 颜永刚, 万德光, 等. 桃仁脂肪酸GC-MS指纹图谱研究[J]. 中国中药杂志, 2009, 34(18): 2360. PEI J, YAN YG, WAN DG, et al. GC-MS fingerprint analyses of fatty acids in peach seed[J]. China J Chin Mater Med, 2009, 34(18): 2360. DOI:10.3321/j.issn:1001-5302.2009.18.021 |
| [13] |
仲雪娜, 任小娜, 曾俊, 等. 新疆不同品种核桃及其油脂品质对比分析[J]. 中国油脂, 2018, 43(12): 130. ZHONG XN, REN XN, ZENG J, et al. Comparison of qualities of walnut and their oils from different varieties in xinjiang[J]. China Oil Fats, 2018, 43(12): 130. DOI:10.3969/j.issn.1003-7969.2018.12.030 |
| [14] |
赵永见, 牛凯, 唐德志, 等. 桃仁药理作用研究近况[J]. 辽宁中医杂志, 2015(4): 888. ZHAO YJ, NIU K, TANG DZ, et al. Research on pharmacological effects of peach kernel[J]. Liaoning J Tradit Chin Med, 2015(4): 888. |
| [15] |
王仁芳, 范令刚, 高文远, 等. 桃仁化学成分与药理活性研究进展[J]. 现代药物与临床, 2010, 25(6): 426. WANG RF, FAN LG, GAO WY, et al. Advances in research of chemical constituents and pharmacological activities of Persicae Semen[J]. Drugs Clin, 2010, 25(6): 426. |
| [16] |
许筱凰, 李婷, 王一涛, 等. 桃仁的研究进展[J]. 中草药, 2015, 46(17): 2649. XU XH, LI T, WANG YT, et al. Research progress in Persicae Semen[J]. Chin Tradit Herb Drugs, 2015, 46(17): 2649. DOI:10.7501/j.issn.0253-2670.2015.17.023 |
 2020, Vol. 40
2020, Vol. 40 
