生物药剂学分类系统(biopharmaceutics classification system,BCS)是根据药物的溶解性及渗透性对药物进行分类的科学体系,是预测药物体内外相关性的重要工具[1]。当前,越来越多的监管机构在药品研究和申报过程中都接受了BCS的概念,其中FDA、WHO和EMA发布的指导原则最具权威性[2-4]。我国在仿制药一致性评价中发布了关于豁免人体生物等效性(BE)试验的指导原则,要求在申请豁免或简化BE时提供生物药剂学分类信息,但由于分类标准和数据来源不同,常出现BCS分类结果不一致的情况[5-7],给实际应用造成混淆和困惑,因此进行BCS精准分类研究,是保障一致性评价工作顺利进行的关键。
左炔诺孕酮为消旋体炔诺孕酮中有生物活性的左旋体。左炔诺孕酮难溶于水,FDA和WHO报道其生物药剂学分类为BCS第1类,即高溶解性、高渗透性药物[2-3]。另有报道,在基于药物体内处置的生物药剂学分类(BDDCS)中,左炔诺孕酮为第4类,即低溶解性、弱代谢程度药物[8]。2种分类结果差异较大,故需进行溶解性、渗透性研究,明确左炔诺孕酮的药剂学分类。
左炔诺孕酮片为国家基本药物,是我国首批部署的仿制药质量和疗效一致性评价品种。左炔诺孕酮片作为紧急避孕药,用量约为1 mg,因此药品的有效性至关重要。目前针对左炔诺孕酮片体内外相关性的研究报道较少,且主要采用溶出手段来预测药物的体内吸收[9-11],易造成体外溶出曲线一致但体内生物等效性不一致的结果。故建立更为有效的制剂体外评价方法,对左炔诺孕酮片的肠渗透速率进行分析,是一致性评价中急需解决的技术难题。
本研究率先采用人工仿生膜技术,测定左炔诺孕酮的有效渗透性,并结合溶解度测定结果,对生物药剂学分类进行了准确的判定。本研究还建立了基于平行人工膜渗透性的体外评价方法,搭建了左炔诺孕酮片体外溶出-渗透模型,比较了参比制剂与受试制剂的溶出行为和渗透速率,为仿制药的一致性评价提供了有力的技术支撑。
1 仪器与试药µFluxTM型药物渗透性测定仪和Macro FluxTM型光纤药物溶出度与渗透速率测定系统(Pion Inc公司);SevenCompact型pH计与XA205型电子分析天平(Mettler Toledo公司);Milli-Q实验室超纯水系统(Merck Millipore公司)。
左炔诺孕酮对照品(含量99.8%),购自中国食品药品检定研究院;参比制剂:匈牙利吉瑞大药厂生产左炔诺孕酮片(规格1.5 mg);受试制剂:国内某企业生产左炔诺孕酮片(规格1.5 mg)。左炔诺孕酮原料药均为国内药厂生产[批号ZQ20120013的粒度d(0.9)为160.751,批号ZQ20130013的粒度d(0.9)为10.03]。胃肠道脂溶液、接收池漏槽条件缓冲液(acceptor sink conditioned buffer,ASB)、人工仿生渗透膜(聚偏氟乙烯,0.45 μm)均购自Pion Inc.公司,其他试剂均为分析纯。
本研究所用pH 1.2盐酸溶液、pH 4.5醋酸盐缓冲液和pH 6.8磷酸盐缓冲液,均参照《普通口服固体制剂溶出曲线测定与比较指导原则》中的附录配制,0.1 mol·L-1盐酸溶液参照《中华人民共和国药典》(简称《中国药典》)2015版四部(通则8006)中盐酸滴定液配制,并按0.05%和0.1%的比例加入十二烷基硫酸钠(sodium dodecyl sulfate,SDS)。
2 左炔诺孕酮溶解度的测定采用摇瓶法测定2种不同粒度的左炔诺孕酮原料药在6种介质中的溶解度。取左炔诺孕酮原料,置具塞锥形瓶中,分别加水、pH 1.2的盐酸溶液、pH 4.5的醋酸盐缓冲液、pH 6.8的磷酸盐缓冲液、0.05%SDS的0.1 mol·L-1盐酸溶液以及0.1%SDS的0.1 mol·L-1盐酸溶液50 mL,制成饱和溶液,每种介质平行配制3份,置37 ℃空气浴中振荡(150 r·min-1)24 h,取出,用Sartorius RC 0.45 µm滤膜滤过,采用高效液相色谱法测定[12],考察不同介质中左炔诺孕酮的溶解度,结果见表 1。左炔诺孕酮在水、pH 1.2的盐酸溶液、pH 4.5的醋酸盐缓冲液和pH 6.8的磷酸盐缓冲液中的溶解度差异不大,说明左炔诺孕酮的溶解度为非pH依赖,随着SDS的加入,溶解度迅速提高;同时,左炔诺孕酮的粒径大小对其溶解度没有较大的影响。
|
|
表 1 左炔诺孕酮溶解度 Tab.1 Levonorgestrel solubility |
本研究基于平行人工膜试验原理[13],测定左炔诺孕酮在被动转运中的有效渗透性,测定装置如图 1所示。该装置分为供体室和受体室,中间由人工仿生渗透膜隔开。由于人体空腹肠液的pH为6.5,血液的pH为7.4,因此,本研究中为了使渗透性的测定条件接近人体胃肠道环境,同时兼顾溶出曲线的测定,参照日本橙皮书和《普通口服固体制剂溶出曲线测定与比较指导原则》,选择pH 6.8的磷酸盐缓冲液作为实验介质。供体室代表胃肠道,加入pH 6.8磷酸盐缓冲液;受体室代表血液,加入pH 7.4的ASB缓冲液;中间的仿生膜代表胃肠道细胞膜,涂以胃肠道脂溶液。
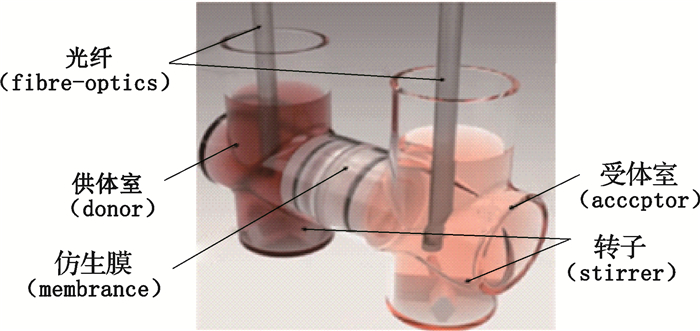
|
图 1 μ FLUXTM药物渗透性测定仪 Fig.1 The sketch of μ FLUXTM permeability tester |
取左炔诺孕酮对照品适量,精密称定,加二甲基亚砜溶解并稀释制成每1 mL中约含左炔诺孕酮2 mg的溶液,作为对照品储备液。精密量取对照品储备液适量,分别用pH 6.8磷酸盐缓冲液和ASB缓冲液(pH 7.4)稀释制成每1 ml中约含左炔诺孕酮0、1.5、3 µg和0、0.5、1 µg的溶液,作为标准曲线溶液,采用光纤探头在250~350 nm波长范围内分别测定,数据分析采用AuPROTM型软件(Pion Inc公司),二阶导数法校正后进行线性回归。
精密量取pH 6.8磷酸盐缓冲液和ASB缓冲液各20 mL,分别置于供体室和受体室中,两室间以面积为1.54 cm2仿生膜(20 μL胃肠道脂溶液浸润)隔离。取左炔诺孕酮对照品储备液30 μL,置供体室中,温度为37 ℃,搅拌速度为每分钟200转,采集时间4 h,采样间隔60 s,在250~350 nm紫外波长范围内,采用光纤探头分别测定药物浓度,按公式(1)计算药物的有效渗透性(Pe):
| $ {P_{{\rm{e}} = }}\left( {\frac{{{\rm{d}}C}}{{{\rm{d}}t}}} \right) \times V/\left( {A \times {C_t} \times 60} \right) $ | (1) |
式中Pe为有效渗透性(cm·s-1);Ct为供体室中药物的初始浓度(μg·mL-1);dC/dt为单位时间内受体室中药物浓度的变化速率(μg·mL-1·min-1);V为受体室缓冲液体积(mL);A为膜面积(cm2)。其中,根据受体室中测得的药物浓度,以时间对浓度进行线性回归,所得方程中的斜率即为单位时间内受体室中药物浓度的变化速率。
根据文献报道,美托洛尔在pH 6.5磷酸盐缓冲液和等渗条件下,在人体的近端空肠中单相测定的有效渗透性为1.34×10-4 cm·s-1[14]。本研究中,取酒石酸美托洛尔对照品,采用图 1所示装置测得在pH 6.8磷酸盐缓冲液中被动转运的有效渗透性为1.20×10-4 cm·s-1(n=3),与文献报道基本一致。由此可见,本研究中采用体外模型来模拟人体小肠环境测得的药物渗透性结果,接近人体小肠灌流实验测得的结果,且测定结果准确,可应用于药物的渗透性研究。
左炔诺孕酮在pH 6.8磷酸盐缓冲液中的渗透性测定结果如图 2所示。随着检测时间的增加,药物逐渐通过模拟的胃肠道细胞膜,由供体室转移到受体室中,根据受体室中测得的药物浓度,以时间对浓度进行线性回归,得到左炔诺孕酮的线性方程,线性相关系数均大于0.99,可用于有效渗透性的测定。将所测得数据带入公式(1)中,可计算出左炔诺孕酮的有效渗透性为5.92×10-4 cm·s-1(n=3),高于美托洛尔在相同条件下测得的有效渗透性数值,且3次测定结果的RSD值为8.0%,具有较好的重现性。
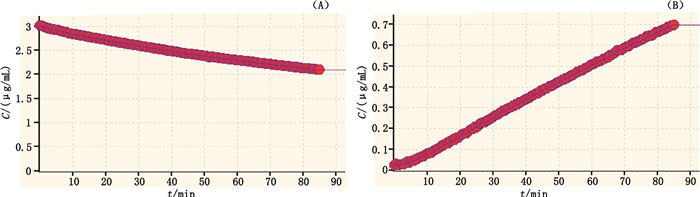
|
图 2 左炔诺孕酮在供体室(A)和受体室(B)中的浓度 Fig.2 Concentration of levonorgestrel in donor(A) and receptor(B) |
本研究采用Macro FluxTM装置[15],如图 3所示。取左炔诺孕酮片,照溶出度与释放度测定法(《中国药典》2015年版四部,通则0931第二法[16]),在溶出杯中以磷酸盐缓冲液(pH 6.8)1000 mL为溶出介质,转速为每分钟75转,依法操作;再精密量取ASB缓冲液(pH 7.4)12 mL,置于受体室中,微搅拌桨转速为每分钟450转;两隔室间以面积为3.88 cm2的仿生膜(50 μL胃肠道脂溶液浸润)隔离,采集时间240 min,采样间隔60 s。取左炔诺孕酮对照品适量,精密称定,加二甲基亚砜溶解并稀释制成每1 mL中约含左炔诺孕酮0.25 mg的溶液,作为对照品储备液。精密量取对照品储备液适量,分别用pH 6.8磷酸盐缓冲液和ASB缓冲液(pH 7.4)稀释制成每1 mL中约含左炔诺孕酮0~1.6 µg的溶液,作为标准曲线溶液,在250~350 nm波长范围内,采用光纤探头分别测定溶出杯和受体室中的吸收度,按公式(2)计算药物的人工膜渗透速率(J/Flux)[17]:
| $ J = \frac{{{\rm{d}}c}}{{{\rm{d}}t}} \times \frac{V}{A} $ | (2) |
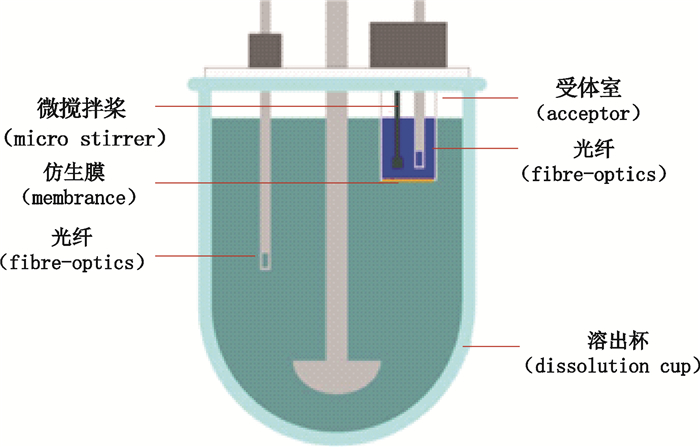
|
图 3 Macro FluxTM药物溶出度与渗透速率测试系统示意图 Fig.3 The sketch of Macro FluxTM f dissolution and flux tester |
式中J(Flux)为渗透速率,即药物在单位时间通过单位膜面积的量(μg·min-1·cm-2);其他同公式(1)。
在pH 6.8磷酸盐缓冲液中左炔诺孕酮片受试制剂与参比制剂溶出行为及渗透速率曲线如图 4所示。随着检测时间的增加药物在溶出杯中逐渐溶出,并通过模拟的胃肠道细胞膜由溶出杯转移到受体室中,根据受体室中测得的药物浓度,以时间对浓度进行线性回归,得到参比制剂和受试制剂的线性方程,线性相关系数均大于0.99,可用于制剂平行人工膜渗透速率的测定。将线性方程中的斜率带入公式(2),可计算出药物的渗透速率,其中受试制剂渗透速率测定结果的RSD值为2.7%(n=3)。

|
图 4 参比制剂与受试制剂溶出行为(A)及渗透速率(B)曲线 Fig.4 Dissolution behavior(A)and permeation rate(B)curve of reference preparation and test preparation |
由于受体室所用介质为模拟人体血液的缓冲液,含有表面活性剂,溶解能力高于正常溶剂,因此样品在受体室的浓度大于饱和溶解度。结果表明,受试制剂与参比制剂溶出曲线有较好的相似度,两者在240 min的溶出量分别为70%(仿制药)和71%(参比制剂)。截取60至240 min数据(见表 2),比较参比制剂与受试制剂的渗透速率,以及在240 min时受体室中测得的有效吸收的左炔诺孕酮药物总含量,两制剂基本一致,受试制剂的渗透速率和有效吸收的药物总含量分别为参比制剂的88.6%和97.8%。
|
|
表 2 左炔诺孕酮片人工膜渗透吸收结果 |
为了进一步比较受试制剂与参比制剂的差异,采用公式(3)及公式(4)分别计算了渗透速率以及240 min时受体室中左炔诺孕酮药物总含量的90%置信区间。
| $ 90\% 置信区间上限 = A + \left( {\frac{{C \times S}}{{\sqrt n }}} \right) $ | (3) |
| $ 90\% 置信区间下限 = A - \left( {\frac{{C \times S}}{{\sqrt n }}} \right) $ | (4) |
式中A为测量值的平均值;S为测量值的标准偏差;n为样本重复次数;C为换算系数,与重复次数具有相关性。本实验中n=3时,C=2.92。
由公式(3)及公式(4)计算可知,本研究中受试制剂渗透速率90%置信区间为0.057 2~0.062 8 μg·min-1·cm-2,240 min时受体室中有效吸收的左炔诺孕酮药物总含量90 %置信区间为54.10~59.72 μg。将受试制剂测定结果的90%置信区间数值与参比制剂测定结果的平均值相比可知,受试制剂渗透速率约为参比制剂的85%~93%,渗透吸收的药物总量约为参比制剂的93%~103%。
5 讨论 5.1 左炔诺孕酮的生物药剂学分类研究BCS和BDDCS是2个根据药物的溶解性、渗透性及代谢程度对药物进行分类的科学体系,是预测药物体内外相关性的重要工具。
BCS和BDDCS对高溶解度的定义均为:在37 ℃条件下,药物的最大使用剂量能完全溶解于规定pH范围内的≤250 mL的水溶性介质中[1, 18]。通过比较药物的最大给药剂量与溶解度的比值,可判断药物溶解性的高低。若比值≤250 mL,则为高溶解性药物;反之则为低溶解性药物。本研究中,左炔诺孕酮片规格为1.5 mg,单次口服剂量为1.5 mg,以此作为药物的最大给药剂量。根据测得的左炔诺孕酮的溶解度结果可知,其在pH 6.8中溶解度最低,为0.001 48 mg·mL-1,以此作为药物的溶解度。计算可知,左炔诺孕酮的最大给药剂量与溶解度的比值为1 013.5 mL,大于250 mL,为低溶解性药物。FDA和WHO在判定溶解性时,选择的最大给药剂量为0.75 mg,但根据本研究中溶解度测定结果计算,在0.75 mg下仍为低溶解性药物。
BCS对于高渗透性的定义为:在没有证据表明药物在胃肠道不稳定的情况下,制剂口服后吸收程度≥85%,即认为该药具有高渗透性[2-4]。FDA推荐了可以作为肠道原位灌流实验标准物的20种药物,其中高渗透性的标准物质为美托洛尔和酮洛芬[2],渗透性的高低可通过与同一方法测得的美托洛尔的数值进行比较,高于美托洛尔的为高渗透性药物,反之则为低渗透性药物。本研究中测得的左炔诺孕酮被动转运的有效渗透性为5.92×10-4 cm·s-1,高于同条件下测得的酒石酸美托洛尔被动转运的有效渗透性1.20×10-4 cm·s-1,因此左炔诺孕酮在被动转运中为高渗透性药物。
BDDCS用代谢程度代替渗透性,对于高代谢程度的定义为:单次口服给予最高剂量的药物后,从排泄物中检测到≥85%(FDA[2],EMA[4])或≥70%(Benet[18])的一相代谢产物和二相代谢产物,即认为该药物具有高代谢程度。由左炔诺孕酮的药代动力学研究结果可知,服药24 h后累积尿中左炔诺孕酮的排泄率为52%[8],说明左炔诺孕酮为弱代谢程度药物。
综上所述,左炔诺孕酮为低溶解性,高渗透性,弱代谢程度药物,应为BCS第2类和BDDCS第4类。
5.2 受试制剂的仿制药一致性评价左炔诺孕酮pKa为17.92,在各种pH条件下均以非解离形态存在,且溶解度为非pH依赖型,因此介质pH对其溶出和渗透情况无较大影响。本研究在原料药渗透性试验的基础上,以pH 6.5缓冲液为试验介质,比较了受试制剂和参比制剂在体外溶出行为和透膜渗透吸收上的差异,为仿制药的一致性评价提供参考。在制剂处方合理性方面,受试制剂溶出度与渗透速率均接近参比制剂,说明受试制剂处方较为合理。
5.3 人工膜渗透性技术在仿制药一致性评价中的应用在药物的BCS分类研究中,对渗透性的准确判定尤为关键。药物的渗透方式包括被动渗透、主动转运与旁路吸收等方式。其中,约95%的药物通过小肠上皮细胞被动转运机制渗透进入血液。尽管人体小肠灌流法是最直接的测量渗透性的方法,但由于人体试验操作复杂,成本高,因此到目前为止仅有Lennernas等[14]于2007年发表的29种药物的人体小肠渗透性数据可作为准确的判断依据。已有研究证实,平行人工膜渗透性(PAMPA)模型可以高效低耗的测定通过被动渗透机制吸收的药物的渗透性,其测定结果与人体小肠灌流法测定的渗透性结果呈正相关,相关系数为0.83[19]。此外,Avdeef等[20]通过比较PAMPA与Caco-2细胞模型,证明了PAMPA可一定程度上替代细胞模型。且由于细胞模型在与生理相关的介质中使用时,或在一些常用的辅料和表面活性剂存在时表现出的局限性,因此目前仅用于药物API渗透性的测定,无法用于制剂的体内外相关性评价。
我国的仿制药一致性评价工作中,要求受试制剂与参比制剂有相同的质量属性与临床疗效。采取有效手段对药物的体内外相关性(IVIVC)进行准确的评价,一直是一致性评价中的技术难题。传统的IVIVC是以溶出曲线是否一致来评价药品在体内是否等效,常规的药典溶出方法是一类密闭体系的溶出度方法,通过既定的实验参数仅能模拟胃肠道环境中的单一状态。结合多种溶出介质与转速条件使用该方法,虽然可以比较大多数药物制剂溶出行为间的差异,但因为药物在人体内溶出与吸收是一连续过程,单一的体外溶出实验往往与药物体内吸收的相关性不佳。由于口服固体制剂在人体肠道内的吸收与制剂的溶出行为及药物的渗透性有关,因此本研究中采用药物溶出度-渗透速率测定模型,将原位光纤检测和人工仿生膜相结合,可通过测定药物被动转运的渗透速率来模拟体内的吸收过程,实现药物溶出和吸收的同时监测,为仿制药的一致性评价提供技术支撑。
| [1] |
AMIDON GL, LENNERN H, SHAH VP, et al. A throretical basis for a biopharmaceutic drug classification:the correlation of in vitro drug product dissolution and in vivo bioavailability[J]. Pharm Res, 1995, 12(3): 413. |
| [2] |
FDA.Guidance for Industry: Waiver of In Vivo Bioavailability and Bioequivalence Studies for Immediate-Release Solid Oral Dosage Forms Based on a Biopharmaceutics Classification System Guidance for Industry[EB/OL].(2017-12-01)[2018-08-09].http://www.fda.gov/Drugs/Guidance Compliance Regulatory Information/Guidances/default.htm.
|
| [3] |
WHO.Technical Report Series No.937;Annex 7: Multisource (Generic) Pharmaceutical Products: Guidelineson Registration Requirements to Establish Interchangeability; Annex 8: Proposal to Waive In Vivo Bioequivalence Requirements for WHO Model List of Essential Medicines Immediate-release, Solid oral Dosage Forms[S].2006 https://www.who.int/medicines/areas/quality_safety/quality_assurance/ProposalWaiveVivoBioequivalenceRequirementsModelListEssentialMedicinesImmediateReleaseSolidOralDosageFormsTRS937Annex8.pdf?ua=1
|
| [4] |
EMA.Note for Guidance on the Investigation of Bioavailability and Bioequivalence CPMP/EWP/QWP/1401/98 Rev1, Appendix Ⅲ[S].2010
|
| [5] |
许鸣镝, 王琳, 王铁松, 等. 生物药剂学分类系统差异比较及应用探讨[J]. 中国药学杂志, 2016, 51(10): 777. XU MD, WANG L, WANG TS, et al. Comparison of different biopharmaceutics classification systems(BCS) and discussion of its application[J]. Chin Pharm J, 2016, 51(10): 777. |
| [6] |
RODRIGO C, CHANG C, JENNIFER BD, et al. Comparative analysis of biopharmaceutics classification system and biopharmaceutics drug disposition classification system:a cross-sectional survey with 500 bioequivalence studies[J]. J Pharm Sci, 2013, 102(9): 3136. |
| [7] |
王琳, 张喆, 胡琴, 等. 两种生物药剂学分类系统比较及应用探讨[J]. 中国药学杂志, 2018, 53(20): 38. WANG L, ZHANG Z, HU Q, et al. Comparison of two biopharmaceutics classification systems and discussion of their applications[J]. Chin Pharm J, 2018, 53(20): 38. |
| [8] |
BENET LZ, BROCCATELLI F, OPREA TI. BDDCS applied to over 900 drugs[J]. AAPS J, 2011, 13(4): 519. |
| [9] |
施捷, 车宝泉, 周立春, 等. 左炔诺孕酮片溶出度方法研究及制剂学评价[J]. 药物分析杂志, 2013, 33(4): 689. SHI J, CHE BQ, ZHOU LC, et al. Study on dissolution for levonorgestrel tablets and pharmaceutical evaluation[J]. Chin J Pharm Anal, 2013, 33(4): 689. |
| [10] |
金滨滨, 姜良银, 张敬富, 等. 高效液相色谱法测定左炔诺孕酮片的溶出度[J]. 北方药学, 2019, 16(1): 3. JIN BB, JIANG LY, ZHANG JF, et al. High efficiency liquid chromatography in detecting the dissolution rate of levonorgestrel tablets[J]. J North Pharm, 2019, 16(1): 3. |
| [11] |
孙秋, 商丽丽, 孙晶晶. 高效液相色谱法测定左炔诺孕酮片的溶出度[J]. 中国卫生产业, 2016(18): 117. SUN Q, SHANG LL, SUN JJ. High efficiency liquid chromatography in detecting the dissolution rate of levonorgestrel tablets[J]. China Health Ind, 2016(18): 117. |
| [12] |
中华人民共和国药典2015年版.Vol Ⅱ[S]. 2015: 152 ChP 2015.Vol Ⅱ[S].2015: 152 |
| [13] |
KANSY M, SENNER F, GUBERNATOR K. Physicochemical high throughput screening:parallel artificial membrane permeability assay in the description of passive absorption process[J]. J Med Chem, 1998, 41(7): 1007. |
| [14] |
LENNERNAS H. Intestinal permeability and its relevance for absorption and elimination[J]. Xenobiotica, 2007, 37(10-11): 1015. |
| [15] |
BORBáS E, NAGY ZK, NAGY B, et al. The effect of formulation additives on in vitro dissolution-absorption profile and in vivo bioavailability of telmisartan from brand and generic formulations[J]. Eur J Pharm, 2018, 114(3): 310. |
| [16] |
中华人民共和国药典2015年版.四部[S].2015: 121 ChP 2015.Vol Ⅳ[S].2015: 121 |
| [17] |
LIU H, SABUS C, GUY T, et al. In vitro, permeability of poorly aqueous soluble compounds using different solubilizers in the PAMPA assay with liquid chromatography/mass spectrometry detection[J]. Pharm Res, 2003, 20(11): 1820. |
| [18] |
WU C, BENET LZ. Predicting drug disposition via application of BCS:transport/absorption/elimination interplay and development of a biopharmaceutics drug disposition classification system[J]. Pharm Res, 2005, 22(1): 11. |
| [19] |
AVDEEF A, BENDELS S, DI L, et al. PAMPA-Critical factors for better predictions of absorption[J]. J Pharm Sci, 2007, 96(11): 2893. |
| [20] |
AVDEEF A, ARTURSSON P, NEUHOFF S, et al. Caco-2 permeability of weakly basic drugs predicted with the double-sink PAMPA pKa(flux) method[J]. Eur J Pharm, 2005, 24(4): 333. |
 2020, Vol. 40
2020, Vol. 40 
